Palabras clave
INTRODUCCIÓN
Todas las técnicas de revascularización percutánea generan, en mayor o menor medida, una rotura de la placa y una denudación del endotelio vascular, con la consiguiente exposición del material aterosclerótico y el tejido subendotelial al torrente sanguíneo. Ello activa tanto la adhesión y agregación plaquetaria como la cascada de coagulación. Ambos sistemas conducen a la generación de trombina (formación del trombo) y finalmente de fibrina (estabilización de éste), con las implicaciones que ello pueda conllevar en la luz coronaria. Por ello, desde el inicio de la intervención coronaria percutánea (ICP), con objeto de reducir las complicaciones agudas derivadas de la formación del trombo, se han ensayado múltiples estrategias, basadas principalmente en la administración de fármacos con actividad antiagregante y anticoagulante.
Inicialmente, para evaluar el éxito de la intervención, se tomaba como parámetro el flujo angiográfico obtenido y la estenosis residual en la luz coronaria. Sin embargo, pronto se observó que, con independencia del flujo coronario epicárdico, la reperfusión óptima y con implicaciones pronósticas, era aquélla que garantizaba también la reperfusión miocárdica y microvascular. La perfusión miocárdica adecuada se ve entorpecida por la disfunción microvascular que existe principalmente por la propia isquemia, el daño por reperfusión y la embolización distal de material trombótico y aterosclerótico durante el procedimiento. Se han ensayado diferentes estrategias para minimizar estos fenómenos que acontecen durante la ICP. Con independencia de los dispositivos de protección distal, los fármacos empleados con este propósito atañen principalmente al tratamiento del infarto agudo de miocardio con elevación del segmento ST, que es motivo de otro capítulo, por lo que no se detallarán aquí.
Finalmente, un tercer problema que preocupa al hemodinamista es la reestenosis de la arteria coronaria a medio y largo plazo. Además del control estricto de los factores de riesgo cardiovascular y los fármacos de prevención secundaria en la cardiopatía isquémica, los stents liberadores de fármacos se presentan como la alternativa principal para disminuir la incidencia de reestenosis. Desde el punto de vista farmacológico, recientemente han aparecido resultados prometedores con ciertos fármacos inmunodepresores, entendiendo el proceso de reestenosis como un proceso de inflamación generalizada.
En las siguientes líneas se detallan los principales fármacos coadyuvantes al tratamiento percutáneo. Se describen en detalle los fármacos con acción antitrombótica que son la base en el intervencionismo percutáneo y, posteriormente, se presentan de forma más sucinta los fármacos que recientemente han demostrado reducir la incidencia de reestenosis coronaria, que es el caso, básicamente, de la rapamicina oral.
FÁRMACOS ANTITROMBÓTICOS (I): FÁRMACOS ANTIPLAQUETARIOS
Ácido acetilsalicílico
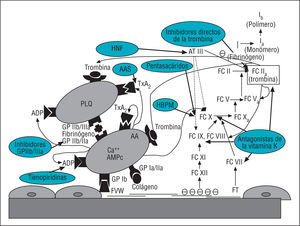
La aspirina o ácido acetilsalicílico (AAS) actúa bloqueando de forma irreversible la ciclooxigenasa plaquetaria, que sintetiza tromboxano A2 (TxA2) a partir del ácido araquidónico. La inhibición de la síntesis de TxA2, uno de los principales potenciadores de la agregación plaquetaria, causa el efecto antiagregante del AAS (fig. 1).
Fig. 1. Esquema simplificado de los sistemas de hemostasia primaria y secundaria y efectos de los principales fármacos antitrombóticos. AA: ácido araquidónico; AAS: ácido ace-tilsalicílico; AT III: antitrombina III; FC: factores de la coagulación; FVW: factor de Von Willebrand; GP: receptores plaquetarios de las glucoproteínas; HBPM: heparinas de bajo peso molecular; HNF: heparina no fraccionada; PLQ: plaqueta; TxA2: tromboxano A2.
Los estudios que establecen el beneficio del tratamiento con AAS en el contexto del intervencionismo percutáneo datan de finales de los años ochenta. En ellos se demuestra, respecto del placebo, una reducción de los eventos isquémicos agudos como la trombosis y el infarto agudo de miocardio (IAM) periprocedimiento1-3. El AAS de forma indefinida sigue siendo la indicación indiscutible en los pacientes con cardiopatía isquémica remitidos para cateterismo cardíaco, y se ha demostrado sobradamente su utilidad en la prevención secundaria (reducción de las tasas de muerte, reinfarto o accidente cerebrovascular [ACV]).
Por otra parte, se ha descrito recientemente el papel antiinflamatorio del AAS a dosis bajas (80 mg/día). Esta acción, independiente de su efecto antiagregante, contribuiría a explicar parte de los beneficios atribuidos al fármaco en los casos de cardiopatía isquémica y en concreto en el intervencionismo coronario. En general, se acepta que una dosis de AAS de 80-325 mg/día debe administrarse al menos en las 2 h previas al procedimiento4,5. Sin embargo, estas dosis son empíricas, sin que se haya establecido de forma definitiva una dosis mínima efectiva. Cuando el tratamiento con AAS se asocia a otros fármacos antitrombóticos (clopidogrel o acenocumarol principalmente), se aboga por dosis todavía inferiores (75-100 mg/día) desde la publicación de un subestudio del estudio CURE, en el que se demuestra mayor incidencia de hemorragias mayores en los grupos que recibieron dosis de AAS superiores a 100 mg/día (máxima incidencia en el grupo de AAS > 200 mg/día)6.
Tienopiridinas
Las tienopiridinas (ticlopidina y clopidogrel) actúan inhibiendo de forma irreversible el receptor plaquetario del adenosindifosfato (fig. 1), por lo que su efecto antiagregante es complementario al del AAS. Ello hace que, desde su aparición, estos fármacos se hayan estudiado la mayoría de las veces en asociación con el AAS, en un intento por conseguir un efecto antiplaquetario más potente, ya que con la introducción del stent intracoronario, las tasas de trombosis subaguda con monoantiagregación con AAS alcanzaban todavía el 3,5-8,6%.
Como ocurría con el AAS, además de su efecto antiplaquetario, las tienopiridinas, en concreto el clopidogrel, poseen un efecto antiinflamatorio porque suprimen ciertos marcadores de inflamación como el CD62 y el CD40L y atenúan la elevación de la proteína C reactiva que sigue al cateterismo coronario y posee valor pronóstico.
Ticlopidina
La ticlopidina asociada al AAS demostró su superioridad en varios estudios frente al AAS solo o la combinación de AAS y warfarina. En el estudio STARS, 1.653 pacientes de «relativo bajo riesgo trombótico» fueron aleatorizados a tratamiento con AAS solo (325 mg/día), a la asociación de AAS (325 mg/día) y ticlopidina (500 mg/día) o a la asociación de AAS (325 mg/día) y warfarina. El objetivo primario a los 30 días (el combinado de muerte, revascularización del vaso responsable, IAM o trombosis subaguda) fue del 3,6% para el grupo de pacientes tratados sólo con AAS, del 2,7% para el grupo de AAS y warfarina y del 0,5% para el grupo de AAS y ticlopidina (p < 0,001)7. Resultados similares se obtuvieron de los estudios ISAR y MATTIS, que evaluaban el beneficio de la ticlopidina en pacientes de mayor riesgo trombótico8,9.
Los efectos secundarios de la ticlopidina, frecuentes y en ocasiones de gravedad, la han relegado hoy día a casos anecdóticos. Se han descrito efectos gastrointestinales (20%), reacciones cutáneas (4,8-15%) y alteración de las pruebas hepáticas, aunque, sin duda alguna, sus efectos indeseables más temidos son la neutropenia grave (1% de los casos y generalmente reversible) y la púrpura trombótica trombocitopénica (< 1/1.000 y habitualmente fatal).
Clopidogrel
El clopidogrel es un fármaco de la familia de las tienopiridinas que apareció como alternativa a la ticlopidina en un intento de disminuir los efectos secundarios manteniendo una eficacia terapéutica similar. Los primeros estudios respondieron a este objetivo, como es el caso del estudio CLASSICS que, con más de 1.000 pacientes sometidos a cateterismo, en tratamiento con AAS y aleatorizados a ticlopidina (500 mg/día), clopidogrel (75 mg/día) o clopidogrel con dosis de carga previa (300 mg en bolo seguidos de 75 mg/día), demostró una reducción del objetivo primario (el compuesto de hemorragia mayor, neutropenia, trombocitopenia o suspensión del tratamiento) en los grupos de tratamiento con clopidogrel (el 4,6% para ambos grupos en conjunto respecto del 9,1% para el grupo de pacientes con ticlopidina, p < 0,005)10. No hubo diferencia en la tasa de muerte, IAM o necesidad de revascularización. Como el CLASSICS, otros estudios confirmaron la menor incidencia de efectos indeseables con clopidogrel, sin mostrar diferencias de eficacia entre los 2 fármacos11. Sin embargo, en un metaanálisis que incluyó a casi 14.000 pacientes, se demuestra una reducción de la mortalidad (el 0,48 frente al 1,09%, p = 0,003) y del conjunto de eventos isquémicos mayores (el 2,1 frente al 4%, p = 0,002) con el tratamiento con clopidogrel respecto del tratamiento con ticlopidina12, lo que establece definitivamente al clopidogrel como mejor tratamiento.
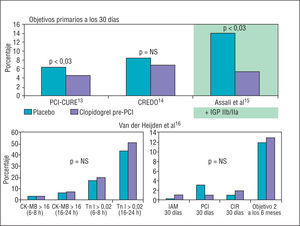
Dos estudios recientes establecen el beneficio del clopidogrel cuando se administra previamente al intervencionismo percutáneo (fig. 2). En el PCI-CURE, la administración de clopidogrel durante una media de 10 días antes de la ICP en los pacientes con síndrome coronario agudo (SCA) se relacionó con una reducción de los eventos mayores (muerte, IAM o revascularización urgente) periprocedimiento y a los 30 días (el 4,5 frente al 6,4% en el grupo placebo, p = 0,03)13. Por su parte, el estudio CREDO mostró una reducción (no significativa) del 38,6% del objetivo primario con la administración de clopidogrel un mínimo de 6 h antes del cateterismo electivo respecto del grupo que no recibió pretratamiento14,15, beneficio sobre todo obtenido a partir de los pacientes que recibieron el tratamiento más precozmente (más de 15 h antes del cateterismo). Datos recientes sobre los SCA estables establecen que el pretratamiento con clopidogrel no disminuye, en relación con el placebo, el daño miocárdico intraprocedimiento determinado por la elevación de los marcadores de necrosis (isoenzima MB de la creatincinasa y troponina I) ni mejora el perfil clínico de los pacientes a los 30 días y a los 6 meses16. Por lo tanto, el tratamiento con clopidogrel previo al cateterismo cardíaco todavía no tiene su indicación establecida.
Fig. 2. Resultados de algunos estudios que evalúan el beneficio del tratamiento con clopidogrel previo al intervencionismo percutáneo. CIR: cirugía de revascularización; CK-MB: isoenzima MB de la creatincinasa; IAM: infarto agudo de miocardio; IGP IIb/IIIa: inhibidores de la GP IIb/IIIa; PCI: tratamiento percutáneo; NS: no significativo. Objetivo 2: objetivo secundario; Tn: troponina.
En general, para el clopidogrel se ha recomendado una dosis de carga de 300 mg idealmente más de 6 h antes del cateterismo. Si el cateterismo se prevé antes de 6 h, puede administrarse una dosis de carga mayor (600 mg), aunque esta hipótesis debe confirmarse con estudios aleatorizados5. De forma paralela, para la ticlopidina, se ha recomendado iniciar el tratamiento un mínimo de 72 h antes para asegurar un buen nivel de acción antiplaquetaria en el momento del procedimiento. Estas estrategias, sin embargo, no son globalmente aceptadas en la práctica clínica, dado que el pretratamiento con doble antiagregación, además de su beneficio limitado, puede ser contraproducente en ciertas circunstancias, como es el caso de la necesidad de cirugía de revascularización urgente o la aparición de alguna complicación durante el intervencionismo percutáneo (perforación o disección coronaria). Por ello, la administración de la dosis de carga tras la implantación del stent sigue siendo hoy la alternativa preferida por muchos hemodinamistas.
Tras la revascularización percutánea con stent, el tratamiento clásico ha sido la doble antiagregación (AAS más tienopiridina) durante un mes, que es el período en que se acepta que tiene lugar la mayoría de las complicaciones trombóticas derivadas del procedimiento17. Para el clopidogrel, estudios recientes han demostrado el beneficio de la terapia a largo plazo tras el intervencionismo percutáneo. El estudio PCI-CURE obtuvo mejores resultados en la combinación de muerte, reinfarto o necesidad de revascularización en el grupo de tratamiento que recibió clopidogrel durante 9 meses respecto del que sólo lo recibió 1 mes postratamiento percutáneo (el 18,3 frente al 21,7%, p = 0,03)13. Asimismo, el tratamiento prolongado con clopidogrel no se asoció a un incremento de las hemorragias mayores, pero sí de las hemorragias menores (el 3,5 frente al 2,1%, p = 0,03)13. Por su parte, el estudio CREDO prolongó hasta 12 meses la administración de clopidogrel en pacientes sometidos a cateterismo electivo, y demostró una reducción del 26,9% de los eventos mayores (muerte, IAM, ACV) al año respecto de los pacientes que recibieron clopidogrel únicamente durante 1 mes poscateterismo (p = 0,02)14. Sin embargo, debe reseñarse que el grupo de pacientes que recibió tratamiento con clopidogrel durante 1 mes no recibió dosis de carga, a diferencia del grupo de tratamiento prolongado, lo cual pudo haber sesgado los resultados. Sobre la base de estos resultados, generalmente se recomienda mantener el tratamiento con doble antiagregación (AAS más clopidogrel) durante 9-12 meses tras el tratamiento percutáneo18, si bien algunos autores mantienen una actitud más conservadora alegando que la terapia prolongada no resulta coste-eficaz19. Recientemente, el implante de stents liberadores de fármacos que ejercen su acción inhibiendo la endotelización a nivel del stent produce, sin embargo, una denudación persistente de la pared vascular que puede prolongar una respuesta inflamatoria y trombótica que, por lo general, tiene lugar en el primer mes posprocedimiento. En el caso de los stents recubiertos, por tanto, se hace indispensable la doble antiagregación durante un período superior a 1 mes. Se han ensayado terapias de doble antiagregación de 2 meses y 3 meses en el caso de los stents recubiertos con sirolimus, y de 6 meses en el caso de los stents recubiertos con paclitaxel. Con ellas, se ha demostrado una reducción de los eventos mayores entre el 70-80% respecto del stent convencional con el mismo tratamiento antiagregante20,21.
Finalmente, debe recordarse que, además de su papel coadyuvante al AAS en el intervencionismo coronario, las tienopiridinas constituyen el tratamiento de elección en los pacientes con alergia o intolerancia al AAS. En ellos, la antiagregación, preferiblemente con clopidogrel, debe iniciarse idealmente 72 h antes del procedimiento si éste se realiza de forma electiva y posteriormente mantenerse de forma indefinida22.
Inhibidores de la glucoproteína IIb/IIIa
Los inhibidores de la glucoproteína (GP) IIb/IIIa actúan, como su nombre indica, bloqueando los receptores plaquetarios de la GP IIb/IIIa responsables de la agregación plaquetaria mediante puentes de fibrinógeno (fig. 1). A diferencia del AAS o las tienopiridinas, los inhibidores de la GP IIb/IIIa intervienen en la vía final común de la agregación plaquetaria, consiguiendo así un efecto antiplaquetario más potente.
Hasta la fecha, principalmente 3 fármacos se han ensayado en el contexto de la cardiopatía isquémica (abciximab, eptifibatida y tirofibán). En general, los resultados con los 3 fármacos han mostrado principalmente una reducción en las tasas de IAM, necesidad de revascularización urgente, o una mejoría en el flujo angiográfico obtenido de forma aguda, sin que pueda atribuírseles un papel directo en la inhibición de la reestenosis a medio y largo plazo5. Aunque en ninguno de los principales estudios se han obtenido beneficios significativos en la mortalidad, un metaanálisis reciente, que incluye 12 estudios con más de 20.000 pacientes, establece una reducción de la mortalidad a los 30 días en los pacientes tratados con inhibidores de la GP IIb/IIIa respecto del placebo (el 0,9 frente al 1,3%, odds ratio = 0,73, p = 0,024), con una estimación de 2,8 vidas salvadas a los 30 días por cada 1.000 pacientes tratados23.
En las siguientes líneas se describen los 3 fármacos principales, junto con sus resultados demostrados hasta el momento en las arterias coronarias nativas.
Abciximab
El abciximab (ReoPro®) es, de los 3, el fármaco que más firmemente ha demostrado su eficacia y el único que ha aportado beneficio en todos los contextos del paciente con cardiopatía isquémica, a saber, el IAM con elevación del segmento ST24,25, el SCA sin elevación del segmento ST de alto riesgo25, el SCA de bajo riesgo26 y el paciente estable sometido a cateterismo electivo, incluso cuando no se ha planeado una revascularización a priori27.
El abciximab es un anticuerpo monoclonal quimérico (ratón-humano) que inhibe selectivamente el receptor de la GP IIb/IIIa, generando un bloqueo plaquetario prolongado, sobre todo cuando se administra en infusión (hasta el 50% de inhibición plaquetaria 24 h después de suspender la infusión). Su origen inmunológico explica que inicialmente se le atribuyera la posibilidad de reacciones de hipersensibilidad con la administración repetida. Ello no fue confirmado por un registro de 500 pacientes con administración repetida de abciximab, en los que no se observó ningún caso de anafilaxia u otras manifestaciones alérgicas28. La presencia de anticuerpos antiquiméricos humanos tipo inmunoglobulina G (HACA), que ocurre aproximadamente en el 6% de los pacientes, no se relacionó con ninguna complicación ni mermó la efectividad del fármaco. Sí se observó, sin embargo, el aumento de las tasas de trombocitopenia severa, por lo que actualmente se recomienda la monitorización hematológica de los pacientes con HACA.
El primer estudio que demostró la eficacia del abciximab fue el estudio EPIC25, con más de 2.000 pacientes de alto riesgo aleatorizados a AAS más heparina a dosis fijas (10.000-12.000 U), a AAS más heparina fija más bolo de abciximab (0,25 mg/kg) o a AAS más heparina fija más bolo (0,25 mg/kg) más perfusión de abciximab (10 μg/min) durante 12 h. Se obtuvo una reducción del 35% en el objetivo primario (combinado de muerte, IAM no fatal, necesidad de revascularización percutánea o quirúrgica o fracaso del procedimiento) en los pacientes tratados con bolo más perfusión de abciximab frente al placebo (el 8,3 frente al 12,8%, p = 0,008), principalmente a expensas de mejores tasas de IAM no fatal (el 5,2 frente al 8,6%, p = 0,03) y sobre todo de necesidad de revascularización (el 0,8 frente al 4,5%, p < 0,001)25. No se observó beneficio con la administración única de bolo de abciximab sin perfusión. Cabe destacar, sin embargo, que las hemorragias fueron 2 veces más frecuentes (el 14 frente al 7%) en el grupo de abciximab respecto del placebo, lo que se ha atribuido al régimen de heparina a altas dosis y no ajustadas al peso utilizadas en el estudio.
Para los pacientes de bajo riesgo sometidos a angioplastia, el estudio EPILOG evaluó los resultados de 3 opciones de tratamiento: AAS más dosis estándar de heparina ajustada al peso (100 U/kg para conseguir un tiempo de coagulación activado [ACT] > 300 s) más placebo; AAS más la misma dosis de heparina más abciximab; y AAS más dosis reducida de heparina ajustada al peso (70 U/kg y ACT > 200 s) más abciximab. La incidencia de eventos clínicos mayores a los 30 días (muerte, IAM o revascularización urgente) fue menor en los grupos que recibieron abciximab: el 11,7% para el grupo placebo, el 5,4% para el grupo de abciximab más dosis estándar de heparina (p < 0,001) y el 5,2% para el grupo de abciximab más dosis reducida de heparina (p < 0,001)26. La incidencia de hemorragias graves fue similar en las 3 ramas de tratamiento.
El primer estudio que evaluó el beneficio del abciximab en pacientes sometidos a revascularización urgente o electiva con stent fue el EPISTENT. En él, 2.399 pacientes con enfermedad coronaria fueron aleatorizados a stent más placebo, angioplastia más abciximab o stent más abciximab, todos ellos con heparina no fraccionada (HNF) a dosis de 100 U/kg. Los resultados más favorables se obtuvieron en el grupo de pacientes asignados a stent más abciximab (el 5,3% de eventos clínicos mayores a los 30 días frente al 6,9% en el grupo de angioplastia más abciximab [p = 0,007] y el 10,8% en el grupo de stent más placebo [p < 0,001]). La evolución a largo plazo de estos pacientes siguió mostrando resultados favorables al abciximab, tanto a los 6 meses (menor tasa de revascularización, con beneficio máximo en los pacientes diabéticos) como al año de seguimiento (menor mortalidad respecto al grupo stent más placebo, el 1 frente al 2,4%, p = 0,03)29. No hubo diferencias en la tasa de hemorragias mayores en los 3 grupos29.
El beneficio a los 6 meses del tratamiento con abciximab en los pacientes con SCA sin elevación del segmento ST se ha evaluado por los seguimientos a largo plazo de los estudios EPIC30, EPILOG31 y EPISTENT32, que han demostrado, igual que para el IAM con elevación del segmento ST, una reducción de la necesidad de revascularización. Sin embargo, el papel del abciximab en la prevención de la reestenosis coronaria es controvertido, al igual que ocurre con los demás inhibidores de la GP IIb/IIIa. Se cree que estos resultados son consecuencia de la reducción de los eventos isquémicos agudos33,34.
Eptifibatida
La eptifibatida (Integrilin®) es un heptapéptido cíclico diseñado a semejanza de la barbourina (veneno de la serpiente Sisfrurus milarus barbouri), altamente específico y selectivo de los receptores de la GP IIb/IIIa. A diferencia del abciximab, no tiene afinidad por otros receptores de la integrina. Su principal ventaja respecto del primero es su acción más prolongada y su bajo coste.
El primer gran estudio realizado con eptifibatida fue el IMPACT-II en el contexto de la ICP, pero no demostró beneficios en el objetivo primario (muerte, IAM o necesidad de revascularización a los 30 días) frente al grupo placebo35. Ello se ha atribuido a las bajas dosis a las que se empleó el fármaco. De hecho, estudios posteriores con dosis superiores han demostrado su eficacia en los pacientes de menor riesgo que se someten a cateterismo cardíaco. El estudio PURSUIT incluyó a casi 11.000 pacientes con angina inestable, que se aleatorizó a placebo, eptifibatida a dosis bajas (bolo de 180 μg/kg seguido de una infusión a 1,3 μg/kg/min) o eptifibatida a dosis altas (bolo de 180 μg/kg seguido de infusión a 2 μg/kg/min). El grupo que recibió dosis altas del fármaco obtuvo cifras más bajas de muerte o infarto a los 30 días respecto del grupo placebo (el 14,2 frente al 15,7%, p = 0,042)36, diferencia ya presente desde las 96 h poscateterismo. Las tasas de hemorragias mayores (definidas por la escala TIMI) fueron más frecuentes en el grupo de eptifibatida (el 10,6 frente al 9,1%, p = 0,02). Los resultados más llamativos con eptifibatida, sin embargo, se obtuvieron con dosis aún mayores (bolo de 180 μg/kg seguido de infusión a 2 μg/kg/min más un nuevo bolo de 180 μg/kg a los 10 min del primero). Con esta pauta de tratamiento (junto con heparina a dosis bajas: 60 U/kg, AAS y clopidogrel), el estudio ESPRIT37, con poco más de 2.000 pacientes candidatos a cateterismo electivo, demostró una reducción del 37% de los eventos clínicos mayores a las 48 h (el 6,6 frente al 10,5% del grupo placebo, p = 0,0015), beneficio que se sostuvo a los 30 días e incluso al año de seguimiento, como ha demostrado un análisis reciente (el 8 frente al 12,4% en el grupo placebo para el combinado de muerte o infarto y el 17,5 frente al 22,1% para el combinado, de muerte, reinfarto o necesidad de revascularización a los 12 meses)38. La prevalencia de hemorragias mayores, aunque infrecuente, fue más acentuada en el grupo asignado a eptifibatida que en el grupo placebo (el 1,3 frente al 0,4%, p = 0,02). Sobre la base de estos resultados, el régimen de tratamiento utilizado en el estudio ESPRIT es el aceptado hoy en día para la eptifibatida.
Tirofibán
El tirofibán (Agrastat®) es un inhibidor no peptídico de la GP IIb/IIIa con acción dependiente de la dosis y alta especificidad. Como la eptifibatida, tiene mayor vida media y un coste 3 veces menor que el abciximab.
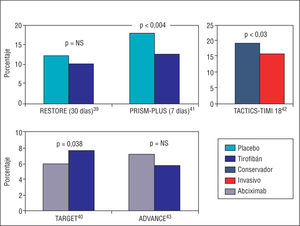
Los estudios iniciales con tirofibán en relación con la ICP no mostraron resultados tan positivos como con los otros inhibidores de la GP IIb/IIIa. En la figura 3 vienen representados los resultados de los principales estudios publicados con tirofibán. El estudio RESTORE fue el primero que evaluó la eficacia del tirofibán. Se aleatorizó a 2.139 pacientes a tratamiento con AAS más heparina más tirofibán (bolo de 10 μg/kg seguido de infusión a 0,15 μg/kg/min) o tratamiento con AAS más heparina más placebo. Aunque se observó un beneficio significativo con tirofibán a las 48 h del cateterismo y a los 7 días, el objetivo primario del estudio (el combinado de muerte, IAM, cirugía de revascularización o necesidad de nueva angioplastia a los 30 días) no demostró diferencias significativas entre las 2 opciones de tratamiento, si bien se observó una tendencia favorable en el grupo de tirofibán (el 10,3 frente al 12,2%, p = 0,16)39. Tampoco hubo diferencias significativas en el índice de hemorragias en ambos grupos. Por su parte, un estudio comparativo de las mismas dosis de tirofibán frente a abciximab mostró una superioridad del abciximab en la tasa de eventos clínicos mayores a los 30 días (el 6 frente al 7,6% en el combinado de muerte, infarto o necesidad de revascularización urgente, p = 0,038), aunque con menor incidencia de hemorragias en el grupo de tirofibán40. Esta superioridad fue consistente con independencia de la edad, el sexo, la presencia de diabetes o el tratamiento con clopidogrel. Las hemorragias mayores fueron similares en los dos grupos, aunque el grupo de tirofibán presentó menor incidencia de hemorragias menores40.
Fig. 3. Sarios realizados con tirofibán.
Estos resultados no han sido confirmados por otros estudios. El estudio PRISM-PLUS demostró, para pacientes con SCA de riesgo intermedio y alto, una reducción del compuesto de muerte, IAM o isquemia refractaria a los 7 días en el grupo de AAS más heparina más tirofibán respecto del grupo de AAS más heparina más placebo (el 12,9 frente al 17,9%, p = 0,004)41, beneficio sostenido a las 48 h, a los 30 días y a los 6 meses. En el subgrupo de pacientes sometidos a angioplastia, se objetivó además que el uso de tirofibán asociado al AAS y la heparina mejoraba los resultados angiográficos, reduciendo la cantidad de trombo intracoronario un 23% más que en el grupo tratado con placebo. Ello explica los resultados en este subgrupo de pacientes, en los que el tratamiento con tirofibán redujo un 32% el riesgo de muerte, IAM o angina refractaria y un 43% el riesgo de muerte o IAM. El estudio TACTICS-TIMI 18, por su parte, estableció, en los pacientes con SCA sin elevación del segmento ST y tratados con tirofibán, la superioridad de una estrategia invasiva temprana frente al tratamiento conservador. La incidencia de muerte, IAM o rehospitalización por angina refractaria a los 6 meses fue del 15,9% para el grupo de tirofibán más tratamiento invasivo frente al 19,4% para el grupo de tirofibán más tratamiento conservador (p = 0,025)42. El beneficio fue máximo en los pacientes de mayor riesgo definido por la escala TIMI Risk Score (TIMI 5-7).
Se cree que los resultados desalentadores de los estudios RESTORE y TARGET pueden deberse a la dosis de tirofibán empleada, que se considera insuficiente43. De hecho, existe un nuevo estudio con dosis más elevadas del fármaco que demuestra un incremento de su eficacia sin una mayor incidencia de hemorragias. En este estudio, el tirofibán se empleó a dosis de 25 μg/kg en bolos seguido de infusión a 0,15 μg/kg/min durante 18 h, y fue comparado frente al abciximab a dosis estándar. La incidencia de complicaciones isquémicas mayores fue del 5,8% en el grupo de tirofibán frente al 7,1% en el grupo de abciximab (p = 0,65), sin que existiesen diferencias en la tasa de hemorragias entre los 2 grupos44.
FÁRMACOS ANTITROMBÓTICOS (II): FÁRMACOS ANTICOAGULANTES
Heparina no fraccionada
La HNF está constituida por una mezcla de polímeros de glucosaminoglicanos con un peso molecular muy variable (5-30 kD). Su mayor actividad anticoagulante proviene de una única secuencia pentasacárida con gran afinidad por la antitrombina III (AT III). La unión del pentasacárido a la AT III condiciona un cambio estructural en esta última que potencia su actividad inhibidora sobre los factores de la coagulación IIa (trombina), IXa, Xa y XIa (fig. 1). De ellos, la trombina es el factor más sensible al efecto de la heparina, pero requiere una longitud mínima de la cadena sacárida (18 sacáridos) para que ésta pueda unirse simultáneamente a la AT III y la trombina y ejercer su efecto anticoagulante a este nivel. La gran variabilidad de la longitud de las cadenas sacáridas que conforman la heparina, junto con su diferente unión a las proteínas plasmáticas, explica la relativa impredecibilidad de su efecto anticoagulante.
A pesar de estos inconvenientes, la heparina sigue siendo el tratamiento anticoagulante estándar durante el procedimiento percutáneo, ya que su precio es inferior al de otros anticoagulantes y, sobre todo, se efecto es fácilmente reversible y monitorizable. La utilización de heparina durante el cateterismo coronario se inició de una forma relativamente empírica en un intento de evitar las complicaciones isquémicas agudas cardíacas y vasculares (formación de trombos en los puntos de acceso vascular o en las gu&iacu te;as y catéteres)45. Inicialmente se ensayaron dosis fijas para todos los pacientes de 10.000 U en bolo con un nuevo bolo posterior, dependiendo de la duración del procedimiento, lo cual demostró reducir la oclusión aguda del vaso y la incidencia de complicaciones isquémicas tempranas. Posteriormente, dada la frecuencia de las complicaciones hemorrágicas, se iniciaron regímenes de administración ajustados al peso con monitorización intraprocedimiento mediante la medición ACT, tomando como referencia los valores utilizados para la cirugía de revascularización coronaria (ACT > 300-400 s). Varios estudios demostraron inicialmente una reducción de las complicaciones isquémicas periprocedimiento con valores de ACT mayores, pero este beneficio se vio contrapuesto por una mayor tasa de hemorragias.
Actualmente el ACT sigue siendo el sistema de monitorización estándar durante el intervencionismo percutáneo, dado que los niveles de anticoagulación requeridos superan el rango de discriminación del tiempo de tromboplastina parcial activada. Existe controversia sobre los valores óptimos. Mientras que algunos estudios pequeños abogan por dosis bajas de heparina (bolo de 5.000 U) para los pacientes estables, con las que obtienen una incidencia de complicaciones isquémicas agudas similar a la de los pacientes tratados con dosis altas de heparina46,47, un metaanálisis reciente establece el beneficio máximo con valores elevados de ACT (350-375 s), siempre que no exista tratamiento concomitante con inhibidores de la GP IIb/IIIa48. En general, con los datos que se disponen en la actualidad, se recomienda, en ausencia de tratamiento con inhibidores de la GP IIb/IIIa, un bolo inicial de 70-100 U/kg con suplementos posteriores si son necesarios (bolo de 2.000-5.000 U) condicionados a conseguir un ACT 300-350 s (para el sistema Hemochrom) o de 250-300 s (para el sistema Hemotech)22. Cuando se asocia tratamiento con inhibidores de la GP IIb/IIIa, las dosis de heparina deben ser menores: bolo de 50-70 U/kg y ACT objetivo > 200 s.
La utilización sistemática de heparina tras el cateterismo no está indicada, ya que no ha demostrado beneficios en la incidencia de complicaciones isquémicas agudas ni en la tasa de reestenosis y, en cambio, se ha asociado a un mayor índice de hemorragias49.
Heparinas de bajo peso molecular
Las heparinas de bajo peso molecular (HBPM) provienen de la despolimerización química o enzimática de la HNF. La mayoría de las cadenas de las HBPM no disponen de la unidad pentasacárida de unión a la AT III, ni contienen los 18 sacáridos mínimos de unión a la trombina que posee la HNF, de modo la acción de las HBPM es fundamentalmente anti-Xa, en contraposición a la HNF, que tiene actividad anti-IIa y anti-Xa 1:1 (fig. 1). Las HBPM tienen ciertas ventajas respecto de la HNF, fundamentalmente por su efecto anticoagulante probablemente más potente, su respuesta más predecible que permite no monitorizar, su menor incidencia de trombocitopenia y la ausencia de efecto «hipercoagulante» de rebote. Para evaluar el grado de anticoagulación ejercido por las HBPM, puede determinarse en sangre los valores de actividad anti-Xa. Un estudio reciente sugiere que una actividad anti-Xa por debajo de 0,6 U/ml se asocia a una mayor incidencia de complicaciones isquémicas durante el intervencionismo coronario50, de forma que se considera que éste es el grado mínimo de anticoagulación exigido cuando se lleva a cabo un procedimiento percutáneo, aunque la determinación es compleja y no se realiza habitualmente.
Los estudios existentes con HBPM en el intervencionismo coronario atañen principalmente a la enoxaparina, aunque existen datos también con otros compuestos. El estudio REDUCE fue el primero en evaluar la efectividad de las HBPM durante los procedimientos de angioplastia sin stent; aleatorizó a 625 pacientes a reviparina (bolo de 7.000 U por vía intravenosa seguido de una infusión de 10.500 U en 24 h y posteriormente 3.500 U/12 h por vía subcutánea durante 28 días) o HNF (bolo de 10.000 U por vía intravenosa seguido de infusión de 24.000 U en 24 h) y se obtuvo una reducción del 52% en la incidencia de accidentes isquémicos en las primeras 24 h con la HBPM (p = 0,027). No hubo, sin embargo, diferencias entre los 2 grupos en cuanto al pronóstico a las 30 semanas51. Asimismo, las complicaciones hemorrágicas fueron similares en ambos grupos.
La enoxaparina es la HBPM que más firmemente ha demostrado su eficacia en el contexto del intervencionismo percutáneo, administrada tanto por vía intravenosa como subcutánea. En el estudio NICE-1, 828 pacientes recibieron 1 mg/kg de enoxaparina por vía intravenosa previo al procedimiento, obteniendo una incidencia de eventos isquémicos a los 30 días del 7,7%52, resultado similar e incluso más favorable al obtenido en un estudio previo de pacientes comparables tratados con HNF (estudio EPISTENT29, grupo placebo más stent). Dosis menores (0,5 mg/kg por vía intravenosa) han sido ensayadas para pacientes sometidos a cateterismo electivo, con buenos resultados, aunque en muestras con pocos pacientes53.
Asimismo, la enoxaparina también ha demostrado su eficacia asociada a inhibidores de la GP IIb/IIIa, en este caso administrada mayoritariamente a dosis de 0,75 mg/kg por vía intravenosa. La asociación de enoxaparina (0,75 mg/kg) y abciximab a dosis estándar demostró su seguridad y eficacia en el estudio NICE-452, en el que, con este tratamiento, se obtuvo un índice de complicaciones isquémicas similar al obtenido en otros estudios con abciximab más HNF27,29, con una incidencia de hemorragias del 0,2%. En asociación con eptifibatida, la enoxaparina ha sido evaluada frente a la HNF en un estudio con 261 pacientes sometidos a cateterismo urgente o electivo (estudio CRUISE)54. No se observaron diferencias significativas en los eventos clínicos entre el grupo de pacientes tratados con eptifibatida más enoxaparina y el grupo de eptifibatida más HNF (el 8,7 frente al 7,6%, p = NS), al igual que ocurrió con la tasa de complicaciones hemorrágicas, que fue similar en ambos grupos54.
La administración de HBPM por vía subcutánea en pacientes sometidos a cateterismo cardíaco también se ha demostrado eficaz y segura a partir de los datos extraídos de ciertos estudios pequeños. Collet et al55, de un análisis retrospectivo de los pacientes incluidos en el estudio ESSENCE en Francia, obtuvieron para los pacientes con angina inestable tratados con enoxaparina por vía subcutánea una tasa baja tanto de complicaciones cardíacas mayores a los 30 días (3%) como de hemorragias (0,8%). En la misma línea se obtuvieron los resultados del estudio NICE-3, con un índice de complicaciones isquémicas del 7,4% a los 30 días para una población de pacientes con SCA56. En cualquier caso, el tratamiento con enoxaparina por vía subcutánea en pacientes a quienes se indica un cateterismo cardíaco, se considera eficaz siempre que se administre como máximo en las 8 h previas al procedimiento, ya que es en este período en el que los valores de actividad anti-Xa se mantienen superiores a 0,6 U /ml (límite de dosis eficaz de las HBPM, como se ha comentado previamente). Cuando el cateterismo se lleva a cabo más allá de las 8 h, se acepta que debe administrarse un bolo adicional de 0,3 mg/kg por vía intravenosa de enoxaparina en el momento de realizar el procedimiento5.
Existen pocos datos de la dalteparina en el contexto de los procedimientos percutáneos. Un estudio pequeño concluye que, con la dosis de 60 U/kg por vía intravenosa en combinación con abciximab, se obtiene una tasa de eventos isquémicos aceptable al mes50. Por vía subcutánea, se acepta una dosis de 120 U/kg que debe suplementarse con un bolo de 40 U/kg por vía intravenosa cuando el período hasta el cateterismo excede de las 8 h50.
Antagonistas de la vitamina K
Los antagonistas de la vitamina K (más conocidos como anticoagulantes orales [ACO]) ejercen su acción inhibiendo la acción de la vitamina K, que es necesaria para la síntesis hepática de los factores de coagulación II, VII, IX y X (fig. 1).
El tratamiento con antagonistas de la vitamina K (warfarina y acenocumarol, los más empleados) se ha ensayado en el ámbito de la ICP con 2 objetivos principales: por una parte, reducir las complicaciones isquémicas agudas derivadas de la oclusión temprana del vaso y, por otra, disminuir la incidencia de reestenosis. En el primer aspecto, el tratamiento con ACO asociados al AAS no ha demostrado su superioridad frente al AAS solo, y en cualquier caso, ha obtenido resultados muy inferiores a la combinación de AAS más tienopiridina7. Para la prevención de la reestenosis coronaria postimplantación del stent, el tratamiento con ACO tampoco ha demostrado beneficio alguno, y además, se ha relacionado con un aumento de las complicaciones hemorrágicas, como se extrae de los 5 estudios principales que han analizado este aspecto5.
Por tanto, el tratamiento con ACO no está recomendado actualmente, e incluso está desaconsejado durante el intervencionismo coronario a no ser que haya otra indicación5.
Inhibidores directos de la trombina: hirudina y derivados
La hirudina es una proteína de 65 aminoácidos aislada de las glándulas salivales de la sanguijuela (Hirudo medicinalis) con capacidad para unirse a la trombina de forma directa e irreversible, inactivando su acción sobre la agregación plaquetaria, la cascada de la coagulación (factores V y VIII) y el fibrinógeno (fig. 1). La caracterización de la estructura de la hirudina ha permitido obtener formas recombinantes (bivalirudina) y agentes sintéticos (argotroban) que contienen la secuencia N-terminal causante de la neutralización de la trombina.
La hirudina y sus derivados aportan ciertas ventajas respecto de los anticoagulantes clásicos. A diferencia de la heparina, los hirulogs actúan no sólo sobre la trombina libre, sino también sobre la trombina que se encuentra en el interior del trombo, lo cual potencia su actividad anticoagulante. A diferencia de los anticoagulantes antagonistas de la vitamina K, su acción es rápida y su vida media, corta (25 min). Todos los compuestos tienen una curva dosis-respuesta predecible y no producen trombocitopenia mediada por anticuerpos.
Estas características han creado grandes expectativas con este tipo de fármacos. En el contexto del intervencionismo percutáneo, se han ensayado principalmente 3 compuestos: hirudina, bivalirudina (la más estudiada) y argatroban.
La hirudina fue evaluada frente a la HNF en un estudio con más de 1.000 pacientes con angina inestable sometidos a cateterismo cardíaco. Los pacientes fueron aleatorizados a 3 regímenes de tratamiento: HNF en bolo (10.000 U) más infusión durante 24 h; hirudina en bolo (40 mg) seguidos de infusión durante 24 h; e hirudina en bolo (40 mg) seguida de infusión durante 24 h más 40 mg/12 h por vía subcutánea durante 3 días. El tratamiento con hirudina demostró reducir en un 39% la tasa de complicaciones isquémicas posprocedimiento (el 11 frente al 7,9 frente al 5,6%, respectivamente, p = 0,02), pero el objetivo primario del estudio, la incidencia de reestenosis a los 7 meses, fue similar en los 3 grupos (el 67,3, el 63,5 y el 68%, respectivamente)57.
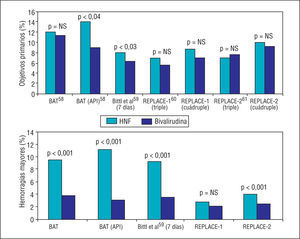
Por su parte, la bivalirudina ha sido ensayada en diversos estudios frente a la HNF, tanto de forma aislada como en asociación con los inhibidores de la GP IIb/IIIa. Hay que recalcar, sin embargo, que en todos ellos, las dosis utilizadas de HNF fueron muy elevadas, lo que incrementó considerablemente la incidencia de hemorragias y pudo sesgar los resultados (fig. 4). El estudio BAT aleatorizó a más de 4.000 pacientes con angina inestable a HNF (bolo de 175 mg/kg seguido de perfusión a 15 U/kg/h durante 18-24 h) o a tratamiento con bivalirudina (bolo de 1 mg/kg seguido de perfusión a 2,5 mg/kg/h durante 4 h y, posteriormente, de 0,2 mg/kg/h durante las siguientes 14-20 h). El grupo de bivalirudina no obtuvo diferencias en el objetivo primario (combinado de muerte, IAM, oclusión aguda del vaso o deterioro clínico de origen cardíaco durante el ingreso), pero sí se asoció a una menor incidencia de complicaciones hemorrágicas (el 3,8 frente al 9,8% en el grupo de HNF, p < 0,00158). En el subgrupo de angina postinfarto, sin embargo, el tratamiento con bivalirudina redujo la tasa de complicaciones isquémicas (el 9,1 frente al 14,2%, p = 0,04) y hemorrágicas (el 3 frente al 11,1%, p < 0,001)58, beneficio que no se sostuvo a los 6 meses. En un análisis posterior de los datos por intención de tratar, se ha observado un 22% de reducción del combinado de muerte, IAM o necesidad de revascularización a los 7 días con el tratamiento con bivalirudina, beneficio que en este caso sí se mantiene a los 90 y 180 días59.
Fig. 4. Principales estudios que comparan bivalirudina frente a heparina no fraccionada en el contexto del intervencionismo percutáneo. Se representan los resultados de los objetivos primarios y las complicaciones hemorrágicas. HNF: heparina no fraccionada.
Asociada a los inhibidores de la GP IIb/IIIa, la bivalirudina ha demostrado, en general, no ser inferior que la combinación de HNF más inhibidores de la GP IIb/IIIa, aunque con una menor tasa de hemorragias (que, como se ha comentado, algunos han relacionado con las altas dosis de heparina empleadas). Los estudios REPLACE-160 y REPLACE-261 son los que han estudiado de forma más extensa este aspecto. En ellos se aleatorizó de forma abierta a pacientes sometidos a cateterismo electivo o urgente a heparina en bolo (60-70 U/kg en el REPLACE-1 y 65 U/kg en el REPLACE-2) frente a bivalirudina en bolo más perfusión (0,75 mg/kg seguidos de 1,75 mg/kg/h). La utilización de inhibidores de la GP IIb/IIIa en el estudio REPLACE-1 fue a criterio del investigador (el 72% de los pacientes, similar en los 2 grupos), mientras que en el REPLACE-2 fue constante en el grupo de heparina y sólo provisional en el grupo de bivalirudina (el 7,2% de los pacientes). Como pudo observarse, ninguno de ellos demostró diferencias significativas entre los 2 grupos en los objetivos principales (combinado triple de muerte, IAM o necesidad de revascularización a los 30 días y combinado cuádruple de los anteriores más hemorragia mayor). La incidencia de hemorragias mayores evaluada de forma aislada fue, no obstante, inferior en los grupos que recibieron bivalirudina.
Las dosis aceptadas para la bivalirudina son las utilizadas en los estudios REPLACE-1 y REPLACE-2 (0,75 mg en bolo seguidos de infusión a 1,75 mg/kg/ h). En general, el tratamiento con bivalirudina se acepta como tratamiento anticoagulante durante el cateterismo cardíaco, preferiblemente sin asociación con inhibidores de la GP IIb/IIIa5, aunque su uso está poco establecido en la práctica clínica diaria. Asimismo, para los pacientes tratados con inhibidores de la GP IIb/IIIa con alto riesgo hemorrágico, la bivalirudina puede ser una buena alternativa a la heparina no fraccionada.
El argatroban no ha sido evaluado de forma rigurosa en el ámbito del intervencionismo percutáneo. Se ha utilizado exitosamente en pacientes con trombocitopenia inducida por heparina, por lo que ésta puede ser una indicación válida para este fármaco62.
Recientemente disponemos de un nuevo compuesto inhibidor directo de la trombina que, a diferencia de los previos, es de administración oral, el ximelagatran. Se metaboliza rápidamente a melagatran, su forma activa, de forma independiente del citocromo P450, de modo que posee pocas interacciones con otros fármacos. El ximelagatran se ha ensayado en el tratamiento de la trombosis venosa profunda y la tromboembolia pulmonar. En cardiopatía isquémica, ha demostrado, asociado al AAS, reducir la incidencia de eventos clínicos mayores a los 6 meses en los pacientes que han presentado IAM con o sin elevación del segmen to ST y que no se someten a cateterismo cardíaco (el 12,7 frente al 16,3% en el grupo de tratamiento con AAS solo, p = 0,03), sin aumentar las complicaciones hemorrágicas63. Sin embargo, todavía no hay datos acerca del papel del ximelagatran en el intervencionismo percutáneo.
Pentasacáridos
El fondaparinux es un pentasacárido de reciente introducción que inhibe de forma irreversible el factor X activado, y con mayor especificidad que la HNF o las HBPM (fig. 1). No interactúa con el factor plaquetario-4, por lo que no induce trombocitopenia. No necesita monitorización. Tiene una vida media de 15 h, por lo que permite la administración única diaria. Su efecto es reversible con el tratamiento con factor VIIa.
El fondaparinux ha demostrado su eficacia en la prevención y el tratamiento de trombosis tras la cirugía ortopédica o en el tratamiento de la tromboembolia pulmonar. En el IAM con elevación del segmento ST, el tratamiento con fondaparinux ha demostrado tener una eficacia similar a la HNF, e incluso con una tendencia a una menor reoclusión del vaso64. En el IAM sin elevación del segmento ST, el fondaparinux ha demostrado igual eficacia que la enoxaparina en la prevención de eventos cardíacos mayores (muerte, infarto, necesidad de revascularización) a los 9 días65. Incluso, a dosis de 2,5 mg/día, ha obtenido mejores resultados que la enoxaparina (el 27 frente al 35,7%, p < 0,05) en el mismo objetivo65. Sin embargo, en estos estudios no se sometió a los pacientes a cateterismo cardíaco, de forma que en el momento actual disponemos de pocos datos acerca de la utilidad del fondaparinux en el intervencionismo percutáneo.
FÁRMACOS DESTINADOS A REDUCIR LA INCIDENCIA DE REESTENOSIS
Rapamicina oral
A pesar de que la introducción del stent convencional permitió reducir la incidencia de reestenosis coronaria, ésta sigue siendo actualmente una limitación importante del tratamiento percutáneo. Recientemente la aparición de los stents liberadores de fármacos (principalmente de rapamicina y paclitaxel) ha permitido obtener resultados muy favorecedores en este contexto (hasta el 70-80% de reducción de reestenosis coronaria a los 6 meses)20,21.
La rapamicina (o sirolimus) es una lactona macrocíclica con potente actividad inmunosupresora utilizada para la prevención del rechazo agudo en el transplante renal. La demostración de su acción antiproliferativa y antimigratoria, básicamente en modelos experimentales66, ha despertado el interés por este fármaco en la enfermedad coronaria, tanto en la cardiopatía isquémica como en la vasculopatía del injerto del trasplante cardíaco. Los resultados descritos hasta la fecha con los stent liberadores de rapamicina local han sido muy positivos en la reducción de la reestenosis coronaria (el 5,9 frente al 42,3% de reestenosis binaria a los 8 meses en el grupo con stent convencional)20. Partiendo de estas cifras, recientemente han aparecido varios estudios en los que se ensaya el efecto de la rapamicina oral, con la hipótesis de que podría existir un beneficio similar al descrito para la rapamicina local con el tratamiento por vía sistémica. Los resultados obtenidos hasta la fecha son limitados y además contradictorios. Brara et al67 describieron los primeros resultados en 22 pacientes con alto riesgo de reestenosis coronaria (antecedentes de reestenosis previas o de tratamiento fallido con braquiterapia), a los que se administró 6 mg en bolo de rapamicina oral inmediatamente tras la revascularización percutánea, seguidos de 2 mg/día durante un mes. Se obtuvo una tasa de reestenosis del 86,7%, con una tasa de revascularización del vaso causante del 59,1% a los 6 meses. A ello debe añadirse, además, la gran incidencia de efectos adversos con el tratamiento, que obligó a suspenderlo en el 50% de los pacientes, principalmente por leucocitopenia e hipertrigliceridemia severas67. En la misma línea, otro estudio de 15 pacientes con lesión única y de bajo riesgo (diámetro medio de los vasos 3,4 mm), obtuvo una tasa de reestenosis a los 6 meses del 40% tras 1 mes de tratamiento con rapamicina oral68. Estos resultados, sin embargo, no han sido confirmados por posteriores estudios. El estudio OSIRIS aleatorizó a 300 pacientes a uno de los 3 brazos: placebo, tratamiento con rapamicina oral a dosis estándar (bolo de 8 mg seguido de 2 mg/día durante 7 días) o tratamiento con rapamicina a dosis altas (bolo de 24 mg seguido de 2 mg/día durante 7 días). El tratamiento con rapamicina se relacionó con una mejoría de la incidencia de reestenosis binaria (> 50%) a los 6 meses (el 22,1% en el grupo asignado a rapamicina a dosis altas, frente al 38,6% en el grupo de rapamicina a dosis estándar y el 42,2% en el grupo placebo, p = 0,005), con una tendencia no significativa a menor necesidad de revascularización69. Con el tratamiento durante 7 días, los efectos secundarios fueron menores (el 2,6% de los pacientes)69.
Tampoco hay consenso acerca de si el efecto de la rapamicina es dependiente de la dosis. Frente a los resultados expuestos del estudio OSIRIS, en el que el mayor beneficio se obtiene en el grupo con dosis altas de rapamicina, el estudio ORBIT describe tasas de reestenosis binaria similares en los pacientes tratados con 2 mg/día de rapamicina oral durante 1 mes respecto de los pacientes tratados con dosis de 5 mg/día (el 7,2 y el 6,9%, respectivamente, p = NS, valores inferiores a los descritos para reestenosis en grupos control sin rapamcina)70. Por su parte, un estudio piloto con 34 pacientes sí parece relacionar unos mejores resultados cuando las concentraciones alcanzadas del fármaco en sangre superan los 8 ng/ml71.
De todo ello se deduce que el tratamiento con rapamicina oral no ha demostrado hasta la fecha un beneficio claro y, sin duda, son necesarios más estudios para acabar de establecer su papel en la prevención de la reestenosis coronaria.
Otros fármacos
Se han ensayado otros fármacos con objeto de reducir la reestenosis coronaria, en general con pocos resultados.
Las estatinas se emplearon ya en la era de la angioplastia, pero no demostraron beneficios. Por el contrario, un estudio retrospectivo de 525 pacientes consecutivos, sometidos a revascularización percutánea con stent, demostró que el uso de estatinas se relacionaba con una menor tasa de reestenosis coronaria respecto del grupo control (el 25,4 frente al 38%, p < 0,005)72. Al parecer, la diferencia del beneficio de las estatinas con el stent respecto de la angioplastia simple podría explicarse por un proceso de reestenosis coronaria basado en una hiperplasia intimal más importante con el uso de stent, para lo cual el efecto antiinflamatorio y antitrombótico de las estatinas sería más útil. Estos resultados con estatinas, sin embargo, no se han confirmado en estudios posteriores, al menos en lesiones ostiales73, de forma que el papel de las estatinas exclusivamente en la prevención de la reestenosis coronaria no está establecido.
Finalmente, se disponen de algunos datos en el ámbito de la reestenosis coronaria con inhibidores de la enzima de conversión, en general con resultados poco llamativos. Los antagonistas del receptor de la angiotensina II, por el contrario, parecen tener un papel más importante en el proceso de la reestenosis, probablemente por un mayor efecto en la disminución de las citocinas circulantes y los factores de crecimiento, y en la reducción de la activación de los neutrófilos74. El estudio VAL-PREST, con 250 pacientes aleatorizados a tratamiento con 80 mg/día de valsartán o placebo, demostró una reducción de la tasa de reestenosis intra-stent (el 17 frente al 38%, p < 0,005) y de la necesidad de revascularización (el 12,1 frente al 28,7%, p < 0,005) a los 6 meses en el grupo asignado a valsartán respecto del placebo75. De todas formas, se trata de un estudio pequeño y se necesitan datos con poblaciones mayores para establecer definitivamente el beneficio de estos fármacos en la prevención de la reestenosis coronaria.
Sección patrocinada por el Laboratorio Dr. Esteve
mmasotti@clinic.ub.es