Comité de la ESC para la elaboración de Guías de Práctica Clínica (GPC): Silvia G. Priori (Presidente) (Italia), María Ángeles Alonso García (España), Jean-Jacques Blanc (Francia), Andrzej Budaj (Polonia), Martin Cowie (Reino Unido), Veronica Dean (Francia), Jaap Deckers (Países Bajos), Enrique Fernández Burgos (España), John Lekakis (Grecia), Bertil Lindahl (Suecia), Gianfranco Mazzotta (Italia), Keith McGregor (Francia), João Morais (Portugal), Ali Oto (Turquía), Otto A. Smiseth (Noruega)
Revisores del documento: Jaap Deckers (Coordinador de revisión de las GPC) (Países Bajos), Jean-Pierre Bassand (Francia), Alexander Battler (Israel), Michel Bertrand (Francia), Amadeo Betriu Gibert (España), Dennis Cokkinos (Grecia), Nicolas Danchin (Francia), Carlo Di Mario (Italia), Pim de Feyter (Países Bajos), Kim Fox (Reino Unido), Ciro Indolfi (Italia), Karl Karsch (Reino Unido), Manfred Niederberger (Austria), Philippe Gabriel Steg (Francia), Michal Tendera (Polonia), Frans Van de Werf (Bélgica), Freek W.A. Verheugt (Países Bajos), Petr Widimski (República Checa)
Con permiso de The European Society of Cardiology (ESC).
ÍNDICE DE CONTENIDOS
Presentación 679
Preámbulo 680
1. Introducción y definiciones 681
1.1. Método de revisión 681
1.2. Definición de los grados de recomendación 682
2. Indicación de ICP 682
2.1. Indicación de ICP en la cardiopatía isquémica estable 682
2.2. Indicación de ICP en el síndrome coronario agudo sin elevación del segmento ST 685
2.3. Indicación de ICP en el SCA con elevación del segmento ST 687
3. Medicación coadyuvante a la ICP 697
3.1. Ácido acetilsalicílico (AAS) 697
3.2. Ticlopidina y clopidogrel 698
3.3. Heparina no fraccionada 700
3.4. Heparinas de bajo peso molecular 700
3.5. Inhibidores de la glucoproteína IIb/IIIa 702
3.6. Inhibidores directos de la trombina 705
4. Técnicas y dispositivos complementarios en la ICP 708
4.1. Braquiterapia intracoronaria en la reestenosis intra-stent 708
4.2. Balón de corte 709
4.3. Aterectomía rotacional 709
4.4. Aterectomía coronaria direccional 709
4.5. Dispositivos de protección embólica 710
4.6. Tecnología diagnóstica complementaria 711
5. Stents liberadores de fármacos 712
5.1. Tamaño del vaso, lesiones largas, diabetes 713
5.2. Trombosis en stents liberadores de fármacos 714
5.3. Indicaciones para la implantación de SLF 715
Bibliografía 716
PRESENTACIÓN
La intervención coronaria percutánea (ICP) puede ser considerada como una valiosa herramienta para la revascularización inicial de los pacientes con cardiopatía isquémica estable, de todos los pacientes con isquemia importante documentada y en presencia de prácticamente todo tipo de lesiones, con una única excepción: las oclusiones totales crónicas que no pueden ser cruzadas. En los primeros estudios sobre este tema, se observó una ligera ventaja de la supervivencia tras la cirugía de bypass aortocoronario frente a la ICP sin implantación de stents. La incorporación del stent y de nueva medicación coadyuvante mejoró los resultados de la ICP. La decisión de recomendar ICP o cirugía cardíaca debe estar dictada por las innovaciones tecnológicas, tanto en el campo de la cardiología como de la cirugía, por la experiencia del centro y por las preferencias del paciente. En cualquier caso, y mientras no se demuestre lo contrario, la ICP se utilizará con reservas en los pacientes diabéticos con enfermedad coronaria multivaso y en pacientes con estenosis del tronco común izquierdo no protegida. La utilización de stents liberadores de fármacos podría cambiar esta situación.
Los pacientes que presentan síndrome coronario agudo sin elevación del segmento ST (SCASEST) (angina inestable [AI] o infarto agudo de miocardio sin elevación del segmento ST [IAMSEST]) deben ser, en primer lugar, estratificados por el riesgo de complicaciones trombóticas agudas. Sólo en los grupos de alto riesgo se ha demostrado un claro beneficio de la angiografía temprana (< 48 h) y, cuando es preciso, ICP o cirugía de bypass aortocoronario. El aplazamiento de la intervención no mejora los resultados. Se recomienda la implantación de stents de forma rutinaria en base a la previsibilidad del resultado y a la seguridad inmediata de esta técnica.
En los pacientes que presentan infarto agudo de miocardio con elevación del segmento ST (IAMEST), la ICP primaria será el tratamiento de elección siempre que el hospital disponga de servicio de cardiología intervencionista y de personal experimentado. Los pacientes en los que la trombólisis esté contraindicada deben ser transferidos inmediatamente a ICP primaria, ya que ésta podría ser la única manera de abrir rápidamente la arteria coronaria obstruida. En presencia de shock cardiogénico, la revascularización completa mediante ICP urgente puede salvar la vida del paciente y, por tanto, debe ser considerada de forma precoz. En estudios aleatorizados se observaron mejores resultados clínicos en los pacientes transferidos a un «centro cardiovascular» para la realización de ICP primaria frente a los pacientes tratados con trombólisis, a pesar del retraso producido por el traslado del paciente y, por tanto, una mayor espera entre el momento de la aleatorización y el inicio del tratamiento. La superioridad de la ICP primaria frente a la trombólisis presenta mayor relevancia clínica durante el intervalo de 3 a 12 h desde la presentación de dolor torácico u otros síntomas debido a que la ICP permite una mayor protección del miocardio. Además, a mayor intervalo desde la presentación de los síntomas, se ha observado un aumento de la tasa de eventos cardíacos adversos graves tras la trombólisis, mientras que, tras la ICP primaria, esta tasa parece que se mantiene estable. Durante las 3 primeras horas tras la presentación de dolor torácico u otros síntomas, ambas estrategias de reperfusión parecen igualmente efectivas en la reducción del tamaño del infarto y de la mortalidad. Por ello, la trombólisis sigue siendo una alternativa viable a la ICP primaria, siempre que se pueda administrar dentro de las 3 primeras horas del comienzo de los síntomas. La ICP primaria, comparada con la trombólisis, reduce significativamente los accidentes cerebrovasculares (ACV). En general, se prefiere la ICP primaria frente a la trombólisis durante las 3 primeras horas de presentación de dolor torácico para prevenir los ACV, y en pacientes con una evolución de los síntomas de 3-12 h para salvar miocardio además de prevenir los ACV. Por el momento, no existe evidencia que permita recomendar la ICP facilitada. Se recomienda la ICP de rescate siempre que fracase la trombólisis durante los 45-60 min tras el inicio de la administración.
En el caso de una trombólisis eficaz, se recomienda la realización de una angiografía coronaria de rutina e ICP, si está indicado, durante las primeras 24 h, incluso en pacientes asintomáticos, sin isquemia demostrable, para mejorar su evolución. Si no se dispone de un centro de cardiología intervencionista en 24 h, los pacientes que han respondido positivamente al tratamiento trombolítico, con evidencia de isquemia espontánea o inducible antes del alta hospitalaria, deben ser referidos para la realización de angiografía coronaria y, si fuera preciso, revascularización, independientemente de que reciban terapia farmacológica «máxima».
PREÁMBULO
Las Guías de Práctica Clínica (GPC) y los Documentos de Consenso de Expertos tienen como objetivo presentar todas las evidencias relevantes sobre un tema específico para ayudar a los médicos a sopesar los riesgos y los beneficios de un diagnóstico particular o de un procedimiento terapéutico. Deberían ser útiles para la toma diaria de decisiones clínicas.
En los últimos años, la Sociedad Europea de Cardiología (en sus siglas inglesas, ESC) y otras organizaciones y sociedades relacionadas han elaborado un gran número de GPC y Documentos de Consenso de Expertos. Esta gran profusión puede poner en riesgo la autoridad y validez de las guías, que sólo pueden estar garantizadas si se han desarrollado mediante un proceso incuestionable de toma de decisiones. Ésta es una de las razones por las que la ESC y otras sociedades han hecho pública una serie de recomendaciones para abordar y formular las GPC y los Documentos de Consenso de Expertos.
A pesar de que los estándares para elaborar las GPC y los Documentos de Consenso de Expertos de calidad están bien definidos, algunas evaluaciones recientes de las GPC y los Documentos de Consenso de Expertos publicadas en revistas con evaluación por pares entre 1995 y 1998 han mostrado faltas en el cumplimiento de los estándares metodológicos en la mayoría de los casos. Por lo tanto, es de la máxima importancia que las guías y recomendaciones se presenten en formatos que puedan ser fácilmente interpretados. En consecuencia, sus programas de implementación también deben ser correctamente realizados. En este sentido, se han llevado a cabo algunos intentos para determinar si las guías mejoran la calidad de la práctica clínica y la utilización de los recursos sanitarios.
El Comité para las GPC de la ESC supervisa y coordina la preparación de nuevas GPC y Documentos de Consenso de Expertos elaborados por los grupos de trabajo, grupos de expertos o paneles de consenso. Se solicita a los expertos seleccionados para estos paneles que faciliten una declaración sobre todas sus posibles relaciones que puedan ser consideradas como causa de un conflicto de interés real o potencial. Estos formularios se guardan en forma de ficheros en la Casa Europea del Corazón, la oficina central de la ESC. El Comité es responsable también de la aprobación de estas GPC y Documentos de Consenso de Expertos o de sus comunicados.
El Grupo de Trabajo ha clasificado la utilidad o eficacia del procedimiento y/o tratamiento recomendados y el nivel de evidencia tal como se indica en la siguiente tabla:
GRADOS DE RECOMENDACIÓN (*)
Clase I Evidencia y/o acuerdo general de que un determinado procedimiento diagnóstico/ tratamiento es beneficioso, útil y efectivo;
Clase II Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento;
Clase IIa El peso de la evidencia/opinión está a favor de la utilidad/eficacia;
Clase IIb La utilidad/eficacia está menos establecida por la evidencia/opinión.
NIVELES DE EVIDENCIA
Nivel de evidencia A Datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis
Nivel de evidencia B Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados
Nivel de evidencia C Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros
(*) La eliminación de la Clase III de los Grados de Recomendación es una importante novedad de estas guías que contrasta con los 4 niveles de recomendación utilizados clásicamente por otras sociedades científicas (I, IIa, IIb y III), en las que la clase III «recomienda no recomendar» un determinado procedimiento para una determinada circunstancia por considerarlo en ese contexto «inútil/ineficaz y potencialmente peligroso». El Comité para la elaboración de las Guías de Práctica Clínica de la Sociedad Europa de Cardiología considera que este grado de recomendación resulta confuso en la práctica clínica. Por tanto, desaconseja la utilización de la clase III, y considera que las contraindicaciones que pueda tener un determinado procedimiento diagnóstico o terapéutico en una determinada situación deben expresarse de forma explícita como tales.
1. INTRODUCCION Y DEFINICIONES
A partir del espectacular aumento del número de publicaciones científicas, las GPC se hacen cada vez más necesarias, ya que permiten hacer llegar al médico la información más relevante y, al mismo tiempo, permiten mejorar el cuidado de los pacientes en la evidencia1,2. Además, estas guías son utilizadas de forma creciente por responsables de la asistencia sanitaria y políticos para evaluar «el uso apropiado de los recursos» y desarrollar programas o protocolos de actuación para el manejo de las enfermedades. Desde 1992, la ESC ha publicado anualmente informes y análisis sobre cardiología intervencionista3, no obstante, aún no se habían establecido las GPC para la ICP. El propósito de estas guías es ofrecer recomendaciones de orientación práctica sobre cuándo realizar una ICP partiendo de los datos disponibles en la actualidad procedentes de ensayos clínicos aleatorizados o no (*).
(*) Éstas son la primeras guías de actuación de la Sociedad Europea de Cardiología sobre intervención coronaria percutáneo. Aparecen 5 años después de que la Sociedad Española de Cardiología publicase sus Guías de Práctica Clínica sobre «angioplastia coronaria y otras técnicas»1. Aunque las guías europeas están exclusivamente enfocadas a las intervenciones coronarias terapéuticas, la estructura de ambos documentos es muy s imilar; el contenido del texto presente es una actualización de las recomendaciones realizadas por la Sociedad Española de Cardiología en el año 2000.
1. Esplugas E, Alfonso F, Alonso JJ, Asín E, Elízaga J, Iñiguez A, et al. Guías de Práctica Clínica de la Sociedad Española de Cardiología en cardiología intervencionista: angioplastia coronaria y otras técnicas. Rev Esp Cardiol. 2000;53:218-40.
1.1. Método de revisión
Se ha llevado a cabo una revisión exhaustiva de la bibliografía aparecida en publicaciones especializadas a partir de Medline (PubMed). Para la elaboración de las GPC se desaconseja la utilización de abstracts. De acuerdo con las recomendaciones de la ESC para la creación de grupos de trabajo y emisión de informes, se incluyó los ensayos clínicos presentados en las reuniones científicas más importantes para la toma de decisiones, con la condición de que los autores proporcionaran un borrador del documento final enviado para su publicación4.
1.2. Definición de los grados de recomendación
Los grados de recomendaciones fueron elaborados siguiendo las recomendaciones de la ESC4. A diferencia de los grados de recomendación propuestos por la ACC/AHA5, la ESC desaconseja el uso de la clase III («evidencia o acuerdo general de que el tratamiento no es útil/efectivo y que en algunos casos puede ser perjudicial»)4 (véase la tabla sobre los grados de recomendación). En todas las recomendaciones se alcanzó el consenso en base a la evidencia (véase la tabla sobre niveles de evidencia). Para verificar la aplicabilidad de las recomendaciones en un campo específico, el panel de expertos otorgó especial importancia al objetivo primario de los ensayos clínicos aleatorizados, dando alta prioridad a la demostración de mejoría significativa en la evolución de los pacientes como objetivo primario en estudios con una muestra con poder estadístico adecuado.
2. INDICACION DE ICP
2.1. Indicación de ICP en la cardiopatía isquémica estable
2.1.1. Indicación general de ICP en la cardiopatía isquémica estable
2.1.1.1. ICP frente a tratamiento farmacológico. En 3 ensayos clínicos aleatorizados se comparó la IC P con el tratamiento farmacológico. El estudio ACME6,7 fue diseñado para evaluar si la ICP es superior a la terapia farmacológica óptima en el tratamiento de la angina en pacientes con afectación de 1 o 2 vasos. La ICP ofreció un alivio más completo y más temprano de la angina que la terapia farmacológica y estuvo asociado a una mejor tolerancia al ejercicio y/o menos isquemia durante la prueba de esfuerzo6. Algunos de los beneficios inmediatos de la ICP en pacientes con cardiopatía en un solo vaso se mantienen y por ello resulta una opción terapéutica atractiva para estos pacientes7. El ensayo ACIP8 se orientó a pacientes con isquemia severa en la vida cotidiana. Los pacientes presentaban tanto isquemia inducida por estrés como, al menos, un episodio de isquemia silente durante 48 h de monitorización por Holter (tabla 1). Dos años después de la aleatorización, la mortalidad total se redujo significativamente del 6,6% en el grupo guiado por la presencia de angina al 4,4% en el grupo guiado por la presencia de isquemia y al 1,1% en el grupo con estrategia de revascularización9. (Recomendación de ICP para tratar isquemia importante documentada: I, A.)
Sin embargo, en los pacientes con síntomas leves o asintomáticos la situación es diferente y es poco probable que se mejore mediante la ICP, como se demostró en el estudio AVERT10,11. A los 18 meses, el 13% de los pacientes que recibieron tratamiento hipolipemiante agresivo presentaron eventos isquémicos, frente al 21% de los pacientes que fueron sometidos a una ICP, como se había programado. Esta diferencia fue, en principio, estadísticamente significativa, pero perdió su relevancia tras el ajuste estadístico realizado para el análisis provisional. El estudio AVERT presenta 2 limitaciones importantes: a) no proponía una comparación objetiva entre la terapia farmacológica y la ICP debido a que se utilizó un tratamiento hipolipemiante más agresivo en el grupo asignado a terapia farmacológica; la implantación de stents sólo se realizó en el 30% de los pacientes y la reestenosis es más probable en el grupo asignado a ICP que en el grupo de tratamiento conservador, y b) el estudio AVERT no demostró el efecto antiisquémico de las estatinas, pero sí se observó que las estatinas pueden prevenir eventos coronarios agudos. El estudio RITA-2 fue un ensayo clínico aleatorizado en el que se compararon los efectos a largo plazo de la ICP frente a la terapia conservadora (farmacológica) en pacientes con cardiopatía isquémica considerados candidatos para ambas opciones de tratamiento12. Después de un seguimiento medio de 2,7 años, la muerte o el infarto de miocardio documentado ocurrió en el 6,3% de los pacientes tratados con ICP y en el 3,3% de los tratados con tratamiento convencional (p = 0,02). Por otra parte, la ICP se asoció a una mejor evolución de los síntomas, especialmente en los pacientes con angina más severa. De cualquier modo, las conclusiones del estudio RITA-2 no son aplicables a la ICP moderna; sólo el 7,6% de los pacientes fueron sometidos a la implantación de stents y no se tuvo en consideración la ticlopidina, el clopidogrel ni los inhibidores de la glucoproteína IIb/IIIa (GP IIb/IIIa).
En un metaanálisis de ensayos clínicos aleatorizados y controlados se observó que la ICP puede conducir a una mayor reducción de la angina, comparada con el tratamiento farmacológico; sin embargo, estos estudios no incluyeron un número suficiente de pacientes como para permitir realizar cálculos informativos del efecto de la ICP en el infarto de miocardio, la muerte o las resvascularizaciones subsiguientes13. En el estudio TIME14 la supervivencia a largo plazo fue similar en los pacientes de 75 años de edad o mayores, con angina clase II o mayor según la clasificación de la CCS, que recibían 2 fármacos antianginosos, independientemente de su asignación a terapia invasiva o farmacológica. Los beneficios de ambos tratamientos en el alivio de la angina y la mejora de la calidad de vida se mantuvieron, pero en los pacientes asignados a terapia farmacológica se observó una mayor frecuencia de eventos no fatales. Las tasas de supervivencia fueron mejores en los pacientes que fueron revascularizados durante el primer año, independientemente de que el cateterismo se realizara de forma inmediata o sólo después del fracaso de la terapia farmacológica14. Los costes no deben suponer una objeción al manejo invasivo del paciente mayor con angina crónica15.
2.1.1.2. PCI frente a cirugía de bypass aortocoronario. Los datos utilizados en el análisis comparativo de la ICP frente a la cirugía de bypass aortocoronario (CABG) proceden de 13 estudios que incluyen 7.964 pacientes y fueron realizados entre 1987 y 1999. Durante un período de seguimiento de 8 años, no se observó ninguna diferencia estadísticamente significativa en el riesgo de muerte entre las 2 estrategias de revascularización a 1 año, 3 y 8 años (excepto a los 5 años)16. El uso de stents desempeña un papel importante: en los primeros estudios, realizados sin stents, había una tendencia a favor de la CABG frente a la ICP en el seguimiento a los 3 años que, sin embargo, no se observó en los estudios más recientes, en los que se incorpora el uso de stents16. La tendencia a favor de la cirugía de bypass desapareció a pesar de una reducción de la mortalidad en el grupo asignado a CABG del 5,2%, en los estudios sin stents, al 3,5% en los estudios más recientes con stents16. El stent redujo a la mitad la diferencia de riesgo de una nueva revascularización16. Tanto la ICP como la CABG son eficaces en el control de los síntomas.
2.1.2. Indicación de ICP en subgrupos especiales de pacientes estables
2.1.2.1. Oclusión total crónica. La oclusión total crónica (OTC) todavía representa el subgrupo anatómico asociado con las tasas más bajas de éxito en la ICP. En los casos en los que se puede cruzar la oclusión con una guía hasta la luz distal, la implantación de stents ofrece resultados satisfactorios, tal y como ha sido demostrado en varios ensayos clínicos cuyos objetivos primarios eran fundamentalmente angiográficos (GISSOC17, PRISON18, SARECCO19, SICCO20, SPACTO21, STOP22 y TOSCA23), a pesar de un alto porcentaje de reestenosis, que oscila entre el 32 y el 55%. En la actualidad se está evaluando la eficiencia de los stents liberadores de fármacos en relación con este tema. En el estudio PACTO, el tratamiento de la OTC con la implantación del stent Taxus redujo considerablemente los eventos cardíacos adversos mayores (MACE) y la reestenosis, eliminando prácticamente la incidencia de reoclusión, todas ellas secuelas frecuentes de los stents no recubiertos24. Los primeros resultados del registro realizado con el stent Cypher fueron alentadores25. Antes de intentar recanalizar una OCT, es preciso considerar el posible aumento del riesgo de oclusión de una rama lateral o de perforación. (Recomendación de ICP en pacientes con oclusión total crónica: IIa, C.)
2.1.2.2. ICP en pacientes de alto riesgo quirúrgico. En el estudio AWESOME26 se comprobó la hipótesis de que la ICP es una alternativa segura y efectiva a la CABG para los pacientes con isquemia refractaria y alto riesgo de resultados adversos. En un análisis de pacientes que habían sido tratados previamente con CABG, las tasas de supervivencia libre de cirugía repetida y de ICP a los 3 años fueron del 73 y el 76%, respectivamente27. Los pacientes con la función ventricular izquierda severamente afectada parecen beneficiarse de la revascularización mediante ICP, especialmente cuando hay evidencia sugestiva de viabilidad residual en el miocardio disfuncionante. Un «registro de las preferencias de los pacientes» reveló que la mayoría de los pacientes tratados previamente con CABG prefieren la ICP a la CABG27. Las conclusiones del ensayo aleatorizado y registro AWESOME son aplicables al subgrupo de pacientes que presentaban una baja fracción de eyección ventricular izquierda (FEVI)28. (Recomendación de ICP en pacientes con alto riesgo quirúrgico: IIa, B.)
2.1.2.3. ICP en pacientes con enfermedad multivaso y/o diabetes mellitus. En pacientes con enfermedad coronaria multivaso y otros factores de alto riesgo, la CABG se asoció a mayor supervivencia que la ICP tras el ajuste del perfil de riesgo29. Sin embargo, las diferencias iniciales en costes y calidad de vida entre la CABG y la ICP no fueron significativas en el seguimiento a los 10-12 años en los pacientes con enfermedad multivaso30. La decisión de realizar una revascularización completa o restringida al vaso causante puede ser tomada de forma individual, dependiendo de cada paciente31.
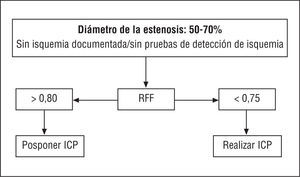
A pesar de que por el momento no disponemos de un estudio formal que evalúe la ICP frente a la CABG en el paciente diabético, todos los análisis de subgrupos o análisis post-hoc muestran invariablemente que el resultado de los pacientes diabéticos fue peor tras la ICP comparado con la CABG. En el estudio ARTS32,33, en el que se comparó la ICP con la cirugía de bypass en pacientes con enfermedad multivaso, el resultado de los pacientes diabéticos fue malo en ambos grupos de tratamiento, pero incluso peor tras la ICP. Después de 3 años, la mortalidad en el grupo de ICP fue del 7,1% y en el grupo de CABG del 4,2% y, además, se observó una diferencia significativa en la supervivencia libre de eventos, que en el grupo de ICP fue del 52,7% y en el grupo asignado a CABG fue del 81,3%33. En los pacientes con enfermedad multivaso, la ICP en los pacientes con 1 o 2 lesiones hemodinámicamente significativas identificadas por una reserva fraccional del flujo (RFF) < 0,75 (véase apartado 4.6.2) ofreció un resultado favorable, similar a la CABG en pacientes con 3 o más vasos causantes, a pesar de que la extensión de la enfermedad era angiográficamente similar34. (Recomendación de ICP en pacientes con enfermedad multivaso y/o diabetes mellitus: IIb, C.) Los datos que aparecerán próximamente sobre el uso de los stents liberadores de fármacos en los pacientes con enfermedad multivaso y/o diabetes mellitus podrían cambiar esta situación.
2.1.2.4. ICP en la enfermedad del tronco común izquierdo no protegida. La presencia de una estenosis en el tronco común izquierdo identifica a un subgrupo anatómico que todavía precisa de la cirugía de bypass aortocoronario para su revascularización. En la enfermedad de tronco común izquierdo protegida (protegida parcialmente por un bypass) se puede realizar ICP, aunque la tasa de MACE del 25% al año sigue siendo muy alta y puede reflejar un aumento de la mortalidad en pacientes con cardiopatía isquémica severa que hayan sido tratados previamente con cirugía de bypass aortocoronario35,36. Una tasa de mortalidad periprocedimiento del 2% y una tasa de supervivencia al año del 95% tras la implantación de stents en la enfermedad del tronco común izquierdo protegida son comparables a los resultados de la cirugía CABG repetida, pero con la primera se evita la morbilidad potencial asociada a la repetición de la intervención quirúrgica36.
La implantación de stents en la enfermedad de tronco común izquierdo no protegida sólo debe ser considerada cuando no existan otras opciones de revascularización36. En este subgrupo de pacientes se recomienda ICP siempre que la cirugía de bypass presente un riesgo perioperatorio muy alto (EuroSCORE > 10%). Los datos iniciales sobre el uso de stents liberadores de fármacos en la enfermedad de tronco común izquierdo no protegida son muy prometedores37,38. (Recomendación de ICP en pacientes con estenosis en el tronco común izquierdo no protegida, en ausencia de otras opciones de revascularización: IIb, C.) (*)
(*) Las recomendaciones de estas guías sobre la realización de una ICP en el tronco común izquierdo no protegido reflejan la doble intención de conjugar la evidencia científica con la realidad clínica cotidiana. A pesar de los indudables avances técnico-instrumentales, la recomendación clase IIb-C es concordante con la metodología empleada e inevitable1. Por otra parte, teniendo en cuenta la práctica cotidiana en nuestro medio, debe destacarse de estas guías la consideración del alto riesgo quirúrgico en la toma de decisiones, la desaparición de la clase III y la ausencia de una alusión explícita a la contraindicación de la técnica en este escenario. También es relevante el comentario final acerca de la importancia de tener en cuenta la experiencia local y las preferencias del paciente2.
1. Soriano Triguero J. Intervencionismo percutáneo en la enfermedad del tronco común izquierdo: ¿es hora de cambiar las guías de actuación? Rev Esp Cardiol. 2004;57:1009-13.
2. López-Palop R, Pinar E, Saura D, Pérez-Lorente F, Lozano I, Teruel F, et al. Resultados a corto y medio plazo del intervencionismo coronario percutáneo sobre el tronco coronario común izquierdo no protegido en pacientes malos candidatos para revascularización quirúrgica. Rev Esp Cardiol. 2004;57:1035-44.
2.1.3. ¿Implantación provisional o electiva de stents en la cardiopatía isquémica estable?
Los stents son, sin lugar a dudas, una herramienta muy valiosa en el tratamiento de disecciones que suponen una amenaza de oclusión del vaso y cuando los resultados de la angioplastia con balón no son satisfactorios. Por lo general, la implantación de stents se considera superior a la angioplastia con balón (BENESTENT-I39, STRESS40, REST41 y otros estudios42-45) en base a las siguientes razones:
* La fractura de la placa y la disección provocadas por la angioplastia con balón resultan a menudo en un procedimiento seudoexitoso en el que se obtiene un aumento limitado de la luz del vaso.
* Mientras que la oclusión aguda durante las primeras 48 h tras la angioplastia con balón es relativamente frecuente (hasta el 15% en presencia de una disección residual severa), tras la implantación de stents la lesión tratada muestra una mayor estabilidad aguda y subaguda.
* Los resultados angiográficos que se pueden obtener tras la implantación de stents son predecibles, independientemente de la complejidad de la estenosis.
* A medio y a largo plazo, la implantación de stents resulta en un número menor de oclusiones o reoclusiones y en tasas más bajas de reestenosis clínica.
En un metaanálisis de 29 ensayos clínicos que incluían a 9.918 pacientes, la implantación de stents coronarios, comparada con la angioplastia con balón, redujo la tasa de reestenosis y la necesidad de repetición de la ICP en aproximadamente el 50%46. En otro metaanálisis47 realizado recientemente, se observó que la implantación de stents está asociada a una mayor reducción de la mortalidad que la angioplastia con balón y que los pacientes tratados con stents presentaban un riesgo de MACE significativamente menor cuando la revascularización de la lesión tratada estaba incluida en los objetivos del estudio48. Los beneficios de la implantación rutinaria de stents son incluso más evidentes cuando se trata de arterias coronarias pequeñas49. Se ha observado beneficios similares en los injertos de vena safena (SAVED50, VENESTENT51). Tras la implantación de stents convencionales, los resultados clínicos a los 5 años muestran una progresión de la enfermedad hacia segmentos diferentes del de la lesión tratada, permaneciendo ésta relativamente estable52,53. (Recomendación de la implantación rutinaria de stents en lesiones de novo en arterias coronarias nativas o en injertos de vena safena en pacientes con cardiopatía isquémica estable: I, A.)
2.1.4. Elevación de los valores de troponina tras ICP en la cardiopatía isquémica estable
La liberación de troponina es relativamente frecuente tras ICP en la cardiopatía isquémica estable y está asociada a complicaciones del procedimiento, como la oclusión de ramas laterales, la formación de trombos, intervención en injerto de vena safena, utilización de varios stents y utilización de inhibidores de la GP IIb/IIIa54,55. En los pacientes que no presentan infarto agudo de miocardio, la elevación de la troponina I tras ICP no es un predictor de mortalidad56 y la elevación superior a 3 veces el límite normal no representa un incremento del riesgo de resultados clínicos adversos a los 8 meses57. Un metaanálisis en el que se incluye a 2.605 pacientes sugiere que, tras la ICP, las concentraciones que se utilizan como valor de corte en el límite bajo no se correlacionan con un aumento de la incidencia de eventos adversos (muerte cardíaca, infarto de miocardio, cirugía de bypass o repetición de la ICP en el vaso tratado) y que, por lo tanto, sería más apropiado utilizar algún múltiplo de tal valor de corte para la predicción de eventos adversos58. En un estudio reciente, se observó que la elevación de los niveles de troponina I a 5 veces por encima del límite superior de la normalidad no fue un predictor de eventos tras el alta hospitalaria59. Consecuentemente y en referencia a la elevación periprocedimiento de los marcad ores cardíacos, hay cada vez más evidencia de que solo la elevación de la fracción MB de la creatincinasa (CK-MB) a más de 5 veces del límite normal (y no cualquier elevación del valor de troponina I) está asociada a una mayor mortalidad durante el seguimiento, mientras que una elevación moderada de la CK-MB (de 1 a 5 veces del límite normal) se considera, de forma creciente, como un evento común relacionado con el procedimiento y con una relevancia pronóstica muy limitada56.
En resumen, las ICP pueden ser consideradas como una valiosa herramienta para la revascularización inicial de los pacientes con cardiopatía isquémica estable, pacientes con isquemia importante documentada y en presencia de casi cualquier tipo de lesiones, con una única excepción: las oclusiones totales crónicas que no pueden ser cruzadas. En los primeros estudios sobre este tema, se observó una ligera ventaja de la supervivencia tras la cirugía de bypass aortocoronario frente a la ICP sin implantación de stents. La incorporación del stent y de nueva medicación coadyuvante mejoró los resultados de la ICP. La decisión de recomendar ICP o cirugía cardíaca debe estar dictada por las innovaciones tecnológicas, tanto en el campo de la cardiología como de la cirugía, por la experiencia del centro y por las preferencias del paciente. En cualquier caso, y mientras no se demuestre lo contrario, la ICP sólo se utilizará con reservas en los pacientes diabéticos con enfermedad coronaria multivaso y en pacientes con estenosis del tronco común izquierdo no protegida. La utilización de stents liberadores de fármacos podría cambiar esta situación.
2.2. Indicación de ICP en el síndrome coronario agudo sin elevación del segmento ST
La ESC publicó recientemente una guía para el manejo general de los síndromes coronarios agudos (SCA) en pacientes que no presentan una elevación persistente del segmento ST (SCASEST)60. Esta guía se centra en la utilización de la ICP para optimizar el manejo del paciente con SCASEST. Los pacientes que presentan una elevación demostrada de los marcadores séricos (troponina [Tn]-I, Tn-T o CK-MB) se considerarán pacientes con infarto de miocardio sin elevación del segmento ST (IAMSEST).
2.2.1. Estratificación del riesgo en los síndromes coronarios agudos sin elevación del segmento ST
La importancia de la clasificación de los pacientes con AI o IAMSEST en grupos de alto riesgo y grupos de bajo riesgo radica en que sólo se ha informado de beneficios claros de la angiografía precoz y, en caso necesario, ICP en los grupos de alto riesgo61-65.
De acuerdo con la guía de la ESC sobre el manejo del SCASEST60, las características de los pacientes con alto riesgo de evolución rápida a infarto de miocardio o muerte, y que deben ser sometidos a una angiografía coronaria durante las primeras 48 h, se pueden consultar en la tabla 266-76.
Por otra parte, los siguientes marcadores de enfermedad subyacente severa, es decir, con alto riesgo a largo plazo, pueden ser útiles a la hora de valorar el riesgo en el SCASEST63-73,77-80:
* Edad > 65-70 años.
* Historia de cardiopatía isquémica conocida, IAM previo, ICP o CABG previas.
* Insuficiencia cardíaca congestiva, edema pulmonar, nuevo soplo de regurgitación mitral.
* Marcadores inflamatorios elevados (como PCR, fibrinógeno, interleucina [IL] 6).
* BNP o NT-proBNP en cuartiles superiores.
* Insuficiencia renal.
Un análisis a posteriori del estudio TACTICS-TIMI 18 sugirió que la estrategia invasiva de rutina mejoraba significativamente los resultados de la isquemia en pacientes mayores con SCASEST81.
2.2.2. ¿Estrategia conservadora, estrategia invasiva inmediata o invasiva temprana?
Algunos estudios publicados recientemente revelan que menos del 50% de los pacientes con SCASEST son tratados con procedimientos invasivos (GRACE82 y CRUSADE83). Los defensores de la estrategia conservadora en el manejo de la AI y del IAMSEST basan su opinión en los resultados de los estudios TIMI IIIB84, MATE85 y VANQWISH86. Sin embargo, en los estudios mencionados se observa una serie de problemas metodológicos (altas tasas de crossover, uso mínimo o nulo de stents, ausencia de inhibidores de la GP IIb/IIIa), que sugieren que sus conclusiones no son aplicables en el momento actual. En el estudio GUSTO IV-ACS, la revascularización durante los 30 primeros días se asoció a un mejor pronóstico87. La tasa relativamente alta de mortalidad en los pacientes asignados a tratamiento farmacológico podría estar relacionada, parcialmente, a la selección de los pacientes.
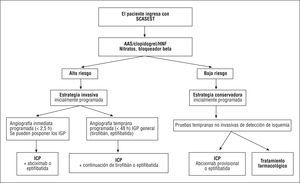
Además de 2 estudios europeos pequeños (TRUCS88 y VINO89), la elección de terapia invasiva precoz frente a una estrategia conservadora inicial se basa en los resultados de 6.487 pacientes incluidos en 3 estudios: FRISC II90, TACTICS-TIMI 1891 y RITA-392 (tablas 3 y 4, fig. 1). (Recomendación de ICP temprana en pacientes con SCASEST de alto riesto: I, A.)
Fig. 1. Planificación de la angiografía coronaria e intervención coronaria percutánea (ICP) (si fuera necesaria), de acuerdo con la estratificación del riesgo en pacientes con SCASEST (angina inestable o IAMSEST). Si por algún motivo la demora entre el cateterismo diagnóstico y la ICP programada llega a 24 h, se puede administrar también abciximab. En caso de no ser aplicable la estrategia invasiva, la enoxaparina puede sustituir a la heparina no fraccionada (HNF) en pacientes de alto riesgo con SCASEST. (Las clases de recomendación se detallan en las tablas 4, 8 y 13.) AAS: ácido acetilsalicílico; IGP: inhibidor de la glucoproteína IIb/IIIa; SCASEST: síndrome coronario agudo con elevación del segmento ST.
Aunque es preciso interpretar los datos con prudencia, parece que existen diferencias entre los 2 sexos93. En la actualidad se están desarrollando otros estudios (como el estudio ICTUS) que incluyen un régimen antiplaquetario más agresivo y que podrían modificar las recomendaciones relativas al uso de la estrategia invasiva. En el estudio ISAR-COOL94 se comparó el tratamiento farmacológico («de enfriamiento») frente a ICP inmediata en pacientes de alto riesgo con depresión del segmento ST (65%) o de elevación de los valores de troponina T (67%). El intervalo para la realización del cateterismo fue de 86 h (mediana) en el grupo con estrategia de «enfriamiento» y de 2,4 h en el grupo de intervencionismo inmediato. En sólo el 5,8% de los pacientes del primer grupo fue preciso adelantar el cateterismo. El objetivo primario, definido como muerte por cualquier causa e IAM extenso pero no mortal a los 30 días, ocurrió en el 11,6% de los pacientes asignados a terapia «de enfriamiento» («pretratamiento antitrombótico prolongado») frente al 5,9% en los pacientes asignados a estrategia invasiva inmediata (p = 0,04). Este resultado se podría atribuir a eventos ocurridos antes del cateterismo. Los investigadores concluyeron que, en los pacientes de alto riesgo con SCASEST, el retraso de la intervención no mejoraba los resultados y que el pretratamiento antitrombótico debía ser reducido al tiempo mínimo requerido para organizar el cateterismo y la revascularización cardíaca. (Recomendación de ICP inmediata, aprox. 2,5 h, en pacientes con SCASEST de alto riesgo: IIa, B.)
En la mayoría de los estudios en los que se evaluó el uso de ICP en la AI o en el IAMSEST, la implantación de stents fue el tratamiento final más frecuente. (Recomendación de la implantación rutinaria de stents en lesiones de novo en pacientes con SCASEST de alto riesgo: I, C.)
En resumen, los pacientes que presentan SCASEST (AI o IAMSEST) deben ser inicialmente estratificados según el riesgo de complicaciones trombóticas agudas. Sólo se ha demostrado un beneficio claro de la angiografía temprana (< 48 h) y, en caso necesario, de ICP o cirugía CABG en los grupos de alto riesgo. El retraso de la intervención no mejora los resultados. Se recomienda la implantación rutinaria de stents sobre la base de la previsibilidad del resultado y de su seguridad inmediata (*).
(*) En este punto las presentes guías de actuación presentan algunas diferencias remarcables en comparación con las recomendaciones previas de la Sociedad Española de Cardiología1,2. La más relevante es la consideración de 2 únicos niveles de riesgo en la estratificación inicial. Ello se debe a la ausencia de datos que apoyen la superioridad del manejo invasivo precoz frente al conservador en individuos de «no alto riesgo», y tiene fuertes implicaciones desde el punto de vista logístico y organizativo. El esquema derivado de este hecho sienta las bases para el desarrollo de sistemas locales de estratificación de este proceso que permitan seleccionar sobre bases sencillas a aquellos individuos.
1. Esplugas E, Alfonso F, Alonso JJ, Asín E, Elízaga J, Iñiguez A, et al. Guías de Práctica Clínica de la Sociedad Española de Cardiología en cardiología intervencionista: angioplastia coronaria y otras técnicas. Rev Esp Cardiol. 2000;53:218-40.
2. López Bescós L, A rós Borau F, Lidón Corbi RM, Cequier Fillat A, Bueno H, Alonso JJ, et al. Actualización (2002) de las Guías de Práctica Clínica de la Sociedad Española de Cardiología en angina inestable/infarto sin elevación del segmento ST. Rev Esp Cardiol. 2002;55:631-42.
2.3. Indicación de ICP en el SCA con elevación del segmento ST (SCAEST)
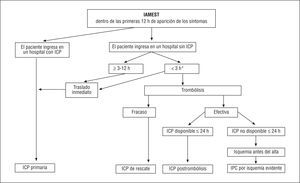
La ESC ha publicado recientemente una guía sobre el manejo general de los pacientes con infarto de miocardio con elevación del segmento ST (IAMEST), es decir, pacientes que refieren dolor torácico/malestar asociado a una elevación persistente del segmento ST o (sospecha) un nuevo bloqueo de rama95. La presente guía se centra más específicamente en el uso de la ICP en esta enfermedad (fig. 2).
Fig. 2. Durante las primeras 3 horas de aparición de dolor torácico u otros síntomas, la trombólisis es una alternativa viable a la intervención coronaria percutánea (ICP) primaria. *Si la trombólisis está contraindicada o el paciente presenta alto riesgo, se recomienda el traslado inmediato del paciente para la realización de una ICP primaria. La razón fundamental para la elección de ICP primaria frente a la trombólisis durante las primeras 3 horas de evolución de los síntomas es la prevención del accidente cerebrovascular (ACV). Las razones fundamentales para la elección de ICP primaria frente a la trombólisis durante las primeras 3-12 h es salvar el miocardio y prevenir los ACV. Si se prefiere la trombólisis, ésta no debe ser considerada el tratamiento final. Incluso tras la trombólisis efectiva, se debe considerar la realización de una angiografía coronaria durante las primeras 24 h e ICP si fuera preciso. El shock cardiogénico se discute en el apartado 2.3.4. Las clases de recomendación se presentan en la tabla 7. IAMEST: infarto agudo de miocardio con elevación del segmento ST.
La realización de ICP en el tratamiento del IAMEST requiere de un grupo experimentado de cardiólogos intervencionistas que cuenten con personal de apoyo bien formado. Esto implica que sólo los hospitales con un servicio de cardiología intervencionista bien establecido deben usar ICP en el IAMEST en lugar de trombólisis intravenosa. La mayoría de los estudios diseñados para comparar la trombólisis frente a la ICP primaria se realizaron en centros con un alto volumen de casos, con cardiólogos intervencionistas experimentados y una pronta respuesta de actuación. Es por ello que los resultados de estos estudios no se pueden extrapolar a otro tipo de circunstancias. Se han documentado grandes variaciones entre distintas instituciones96-104. Por lo general, para realizar ICP primaria se requiere un nivel más alto de experiencia y mayor volumen de pacientes que para la ICP en los pacientes con cardiopatía isquémica estable104. En los pacientes con enfermedad multivaso, la ICP primaria debe estar dirigida solamente a la arteria relacionada con el infarto (vaso causante); la decisión de tratar con ICP las lesiones no causantes debe estar basada en evidencia objetiva de isquemia residual en el seguimiento posterior105.
Afortunadamente, se ha demostrado que la implementación de las GPC en pacientes con IAM agudo ha mejorado la calidad de los cuidados médicos106. En un estudio se observó que los pacientes tratados fuera de los horarios normales de servicio tuvieron una mayor incidencia de angioplastias fallidas y, por tanto, peores resultados clínicos en comparación con los pacientes tratados durante el horario normal107. En otro estudio, los pacientes tratados mediante ICP primaria fuera del horario laboral normal alcanzaron tasas de flujo TIMI grado 3, una mortalidad a los 30 días y 1 año, una mejora de la fracción de eyección y contractilidad regional miocárdica similares a los pacientes tratados durante el horario normal de servicio108.
2.3.1. ICP primaria
La ICP primaria se define como una intervención del vaso causante durante las primeras 12 h de la presentación del dolor torácico u otros síntomas, sin terapia trombolítica previa (completa o concomitante) u otro tratamiento para la disolución de trombos. La ICP primaria se realizó por primera vez en 1979109, es decir, sólo 2 años después de la introducción de esta técnica110. Desde entonces, numerosos ensayos clínicos aleatorizados han demostrado la superioridad de la ICP primaria frente a la trombólisis intravenosa en el tratamiento inmediato del IAMEST (restauración más efectiva de la permeabilidad coronaria, menos isqu emia miocárdica recurrente, menos reoclusión coronaria, menos IAM recurrente, mejora de la función ventricular izquierda residual y mejores resultados clínicos, incluidos los ACV). También se cree que las mujeres111 y los pacientes mayores112 se benefician especialmente de la ICP primaria frente al tratamiento trombolítico.
Un metaanálisis de 23 ensayos clínicos aleatorizados113, que incluían a un total de 7.739 pacientes con IAMEST, candidatos para tratamiento trombolítico y asignados a ICP primaria o bien a medicación trombolítica, reveló los siguientes hallazgos: la ICP primaria fue mejor que la terapia trombolítica en la reducción de la mortalidad total a corto plazo (definida como mortalidad a las 4-6 semanas) (el 9,3 frente al 7,0%, p = 0,0002), reinfarto no fatal (el 6,8 frente al 2,5%, p < 0,0001), desarrollo de ACV (el 2,0 frente al 1,0%, p = 0,0004) y el objetivo combinado de muerte, reinfarto no fatal y ACV (el 14,5 frente al 8,2%, p < 0,0001). En el seguimiento a largo plazo (6-18 meses), los resultados de la ICP primaria seguían siendo mejores que los observados en la terapia trombolítica: el 12,8 frente al 9,6% para la mortalidad, el 10,0 frente al 4,8% para el IAM no fatal y el 19 frente al 12% para el objetivo combinado de muerte, reinfarto no fatal y ACV113-116.
La diferencia más llamativa entre la trombólisis y la ICP primaria fue la significativa reducción de la isquemia recurrrente, del 21% con terapia trombolítica al 6% tras la ICP primaria en el seguimiento a corto plazo (p < 0,0001) y también a largo plazo (el 39 frente al 22%, p < 0,0001)113. (Recomendación de ICP primaria en el IAMEST: I, A.)
Los estudios más importantes que apoyan el grado de evidencia A para la ICP fueron los estudios PAMI117, GUSTO-IIb118, C-PORT119, PRAGUE-1120, PRAGUE-2121 y DANAMI-2122 (tabla 7).
2.3.1.1. Traslado de pacientes para la realización de ICP primaria. No hay duda de que los pacientes que se presentan durante las primeras 12 h de la aparición de dolor torácico u otros síntomas en hospitales que no disponen de servicio de cardiología intervencionista y que tienen contraindicación para la trombólisis deben ser trasladados de inmediato a otro hospital para la realización de una angiografía coronaria y, cuando sea posible, ICP primaria, ya que ésta podría ser la única posibilidad de abrir rápidamente la arteria coronaria obstruida. Los siguientes cuadros clínicos son una contraindicación total para la trombólisis: la disección aórtica, el período post-ACV hemorrágico, cirugía/ trauma severo reciente, sangrado gastrointestinal durante el último mes o un problema conocido de sangrado95. Los pacientes con contraindicación para la trombólisis tienen una morbilidad y mortalidad más alta que los pacientes elegibles para este tratamiento123. La ICP primaria no se ha evaluado formalmente en ningún ensayo clínico aleatorizado con este subgrupo de pacientes, pero se ha observado que, en la mayoría de los casos, es viable y segura124. (Recomendación de ICP primaria en pacientes con contraindicación a la trombólisis: I, C.)
La decisión de transferir a un paciente a un centro de cardiología intervencionista depende también de la evaluación del riesgo clínico individual en cada caso. La elección entre ICP o trombólisis está normalmente condicionada por las dificultades logísticas y los retrasos en el traslado125. Los estudios en los que se ha investigado la posible superioridad de la ICP primaria a pesar del traslado del paciente a otro hospital con servicio de cardiología intervencionista son los estudios Limburg (LIMI)126, PRAGUE-1120, PRAGUE-2121, Air-PAMI127 y DANAMI-2122. Los detalles sobre estos estudios se pueden consultar en la tabla 5.
El estudio DANAMI-2122 fue el primero en demostrar una reducción significativa en el objetivo primario de muerte, reinfarto y ACV a los 30 días post-ICP, a pesar de los retrasos producidos por el traslado del paciente (tabla 5). El estudio PRAGUE-2121 se interrumpió prematuramente debido a que en el grupo asignado a trombólisis la mortalidad registrada excedía en 2,5 veces en los pacientes tratados después de > 3 h de la aparición de los síntomas. En los pacientes aleatorizados > 3 h después de la presentación de los síntomas, la mortalidad en el grupo de trombólisis alcanzó el 15,3% comparado con el 6% en el grupo asignado a ICP (p < 0,02). En los pacientes reclutados durante < 3 h de la aparición de los síntomas no hubo diferencias en la mortalidad entre el grupo tratado con trombólisis (7,4%) y el grupo transferido a ICP primaria (7,3%). Aproximadamente 2 tercios de los pacientes fueron aleatorizados después de > 3 h tras la aparición del dolor torácico, por lo que el PRAGUE-2 no pudo alcanzar el objetivo primario.
Durante las primeras 3 h de la aparición de dolor torácico, la trombólisis constituye una alternativa viable, como se demostró en los estudios PRAGUE- 2121, STOPAMI-1 y 2128, MITRA y MIR129 así como en el CAPTIM130, en el que se utilizó trombólisis prehospitalaria131 (fig. 2). Podemos afirmar, por tanto, que durante las primeras 3 horas tras la presentación de dolor torácico, ambas estrategias de reperfusión parecen igualmente efectivas en la reducción del tamaño del infarto y de la mortalidad. Las dudas acerca de la superioridad de la ICP primaria respecto de la trombólisis durante las primeras 3 horas se podrían resolver mediante el análisis combinado de los estudios STOPAMI-1 y 2128. Sin embargo, el «índice de miocardio salvado» no fue estadísticamente diferente entre la trombólisis y la ICP primaria durante los primeros 165 min (0,45 frente a 0,56), pero mostró una superioridad altamente significativa en la ICP primaria pasados 165-280 min (0,29 frente a 0,57, p = 0,003) y después de 280 min (0,20 frente a 0,57). Esta superioridad de la ICP primaria, que depende del intervalo transcurrido desde la presentación de los síntomas, comparada con la trombólisis (es decir, al aumentar el tiempo desde la presentación de los síntomas, las tasas de MACE aumentan tras la trombólisis pero parece que permanecen relativamente estables tras la ICP) había sido observada previamente en el metaanálisis PCAT que incluía a 2.635 pacientes132 y en pacientes con un retraso prehospitalario > 3 h (registros MITRA y MIR129). Por lo tanto, «llegar tarde no implica llegar demasiado tarde»133.
La razón más importante para la elección de una ICP primaria frente a trombólisis, incluso durante las primeras 3 horas tras la presentación de los síntomas, es la prevención de ACV. Un metaanálisis de 23 ensayos clínicos aleatorizados113 mostró que la ICP primaria, comparada con la trombólisis, reduce significativamente el total de ACV (el 2,0 frente al 1,0%). Según el metaanálisis PCAT132, la ventaja de la reducción del ACV por la ICP primaria frente a la trombólisis es del 0,7% en pacientes que se presentan durante las primeras 2 horas, del 1,2% durante las primeras 2-4 horas y del 0,7% durante las 4-12 horas entre la aparición del dolor torácico y el ingreso en el hospital. Estos datos son consistentes con los resultados del estudio CAPTIM, en el que se observó un 1% (4/419) de ACV en el grupo de trombólisis y un 0% (0/421) en el grupo de ICP primaria130. Un metaanálisis realizado sobre ensayos clínicos con «traslado de pacientes» reveló una reducción significativa del 1,2% en la aparición de ACV, del 1,88 (trombólisis) al 0,64% (ICP primaria)134. Por lo tanto, la razón más importante para la elección de la ICP primaria frente a la trombólisis en los pacientes que se presentan entre 3 y 12 h tras la aparición del dolor torácico no es solamente salvar el miocardio, sino también prevenir los ACV. (Recomendación de ICP primaria en pacientes que se presentan entre 3 y 12 horas tras la aparición del dolor torácico: I, C.)
Los estudios PRAGUE-2 y DANAMI-2 tienen especial importancia porque han demostrado que la ICP primaria en el IAMEST se puede aplicar en grandes zonas parcialmente urbanizadas de Europa con buenos resultados135. La ICP primaria en pacientes de alto riesgo con IAMEST en hospitales que no disponen de servicio de cirugía cardíaca parece ser segura y eficaz136,137.
2.3.1.2. Implantación rutinaria de stents en el IAMEST. Los resultados de un ensayo clínico sugieren que la implantación directa de stents (sin dilatación previa de balón) se asocia a una resolución más completa del segmento ST138. Tres estudios han documentado la utilidad de la implantación de stents en pacientes con IAMEST: Zwolle139, Stent-PAMI140 y CADILLAC141. (Recomendación de implantación rutinaria de stents en el IAMEST: I, A.)
2.3.2. ICP facilitada
La ICP facilitada se define como la intervención coronaria programada en las primeras 12 h tras la presentación de dolor torácico u otros síntomas y poco tiempo después de la administración de medicación capaz de disolver el trombo, que se utiliza para salvar el tiempo transcurrido entre el primer contacto médico y la realización de la ICP primaria. Sin embargo, el término «ICP facilitada» no se utiliza de forma uniforme: debe referirse a la ICP planeada inicialmente, que se realiza poco tiempo después del inicio de la administración de trombolíticos y/o inhibidores de la GP IIb/IIIa. Por lo tanto, en los estudios aleatorizados que evalúan el concepto de ICP facilitada, todos los pacientes (con/sin pretratamiento) deben ser tratados con ICP primaria programada.
2.3.2.1. ICP primaria facilitada con trombólisis. La ICP facilitada fue evaluada en pequeños subgrupos de los estudios PRAGUE-1120 y SPEED (GUSTO-4 Pilot142). Los nuevos conceptos sobre la administración de media dosis de t-PA antes de la ICP primaria sistemática se asociaron a una mejora de las tasas del flujo TIMI-3 a la llegada del paciente al laboratorio de hemodinámica, pero esta mejora no se tradujo en beneficios clínicos relev antes (estudio PACT143). En el estudio BRAVE144, se asignó a los pacientes al grupo de pretratamiento con media dosis de reteplasa más abciximab o abciximab solo antes de ser transferidos a la ICP planeada con implantación de stents; la administración temprana de reteplasa más abciximab no llevó a una reducción del tamaño del infarto comparado con el abciximab solo. Aunque el concepto de «trombólisis a dosis bajas»145 combinada con clopidogrel e inhibidores de la GP IIb/IIIa poco tiempo antes de la implantación de stents en el IAMEST resulta muy interesante, los estudios dedicados a evaluar la ICP facilitada sugieren que no se obtienen beneficios e incluso se podría incurrir en daños potenciales116. Se esperan los datos de los estudios ASSENT-4 (asignación a ICP primaria facilitada con TNK frente a ICP primaria con inhibidores de la GP IIb/IIIa cuando se consideren indicados) y FINESSE146 (asignación a ICP primaria facilitada con reteplasa o abciximab o ICP primaria no facilitada). Por el momento, no hay evidencia que apoye la recomendación de ICP facilitada con trombólisis.
2.3.2.2. ICP primaria facilitada con inhibidores de la GP IIb/IIIa. En el estudio ADMIRAL147, el análisis del subgrupo predefinido de pacientes que recibieron abciximab en el servicio de urgencias o en la ambulancia mostró mejores resultados que el grupo de pacientes al que se administró el fármaco más tarde, lo que sugiere ciertas ventajas de la ICP facilitada. En el estudio ON-TIME148, los pacientes fueron aleatorizados de forma prospectiva a iniciación prehospitalaria (precoz) de tirofibán o a iniciación en el laboratorio de hemodinámica (tardía). En la angiografía basal, se documentó un flujo TIMI 3 en el 19% del grupo de iniciación precoz y en el 15% del grupo de iniciación tardía (no significativo). No se observaron efectos beneficiosos en la angiografía post-ICP ni en los resultados clínicos. No obstante, el estudio piloto TIGER-PA149 y el estudio BRIDGING150 sugieren que la administración precoz de tirofibán o abciximab mejora los resultados angiográficos de los pacientes tratados con ICP primaria. Aunque en un metaanálisis realizado sobre 6 ensayos clínicos aleatorizados151 la administración temprana de inhibidores de la GP IIb/IIIa en el IAMEST parece que mejora la permeabilidad coronaria y muestra una tendencia favorable para los resultados clínicos, por el momento no se puede elaborar una recomendación basada en la evidencia para la utilización de la ICP primaria facilitada con inhibidores de la GP IIb/IIIa a efectos de mejorar los resultados de los pacientes.
2.3.3. ICP de rescate tras fracaso de la trombólisis
La ICP de rescate se define como una ICP en una arteria coronaria que permanece ocluida a pesar de la terapia trombolítica. Generalmente, se sospecha del fracaso de la trombólisis cuando el dolor torácico persistente y la falta de resolución de la elevación del segmento ST son evidentes a los 45-60 min del inicio de la administración. Entonces, se confirma angiográficamente (estenosis coronaria epicárdica significativa y afectación del flujo, TIMI < 3). Un estudio de la Cleveland Clinic investigó la utilidad de la ICP de rescate tras el fracaso de la trombólisis152. Los pacientes fueron asignados a aspirina, heparina y vasodilatadores coronarios (terapia conservadora) o a la misma terapia farmacológica además de ICP. La incidencia del objetivo primario (muerte o insuficiencia cardíaca severa) se redujo significativamente en el grupo de ICP de rescate (del 17 al 6%). El metaanálisis de los estudios RESCUE I, RESCUE II y de otros ensayos clínicos sugiere un beneficio probable de la ICP de rescate153. Por otra parte, en el estudio MERLIN154, la ICP de rescate no mejoró la supervivencia a los 30 días, pero mejoró la supervivencia libre de eventos, debido casi por completo a una reducción de nuevas revascularizaciones. Sin embargo, la limitación más importante del estudio MERLIN fue su escaso poder estadístico155. El estudio REACT156, que ha sido recientemente finalizado (con pacientes que en el ECG realizado a los 90 min no presentan una resolución de > 50% de los cambios del segmento ST), indica que la ICP de rescate es superior a la repetición de la trombólisis o al tratamiento conservador en los pacientes que no alcanzan una buena reperfusión tras la trombólisis. La incidencia de cualquier tipo de eventos a los 6 meses se redujo aproximadamente a la mitad en el grupo de ICP de rescate, comparado con los grupos de repetición de la trombólisis o terapia conservadora (muerte: el 18 frente al 9%). Comparado con el estudio MERLIN, en este estudio el uso de los inhibidores de la GP IIb/IIIa y de stents fue mayor y el tiempo de espera para la realización de la ICP de rescate fue menor. Al igual que en la ICP primaria, en la ICP de rescate la implantación de stents fue superior a la angioplastia con balón157. (Recomendación de ICP de rescate tras el fracaso de la trombólisis: I, B.)
2.3.4. ICP de urgencia en el shock cardiogénico
El shock cardiogénico se define como un estado clínico de hipoperfusión caracterizado por una presión sistólica < 90 mmHg y una presión de enclavamiento capilar > 20 mmHg o un índice cardíaco < 1,8 l/min/m2 (GPC de la ESC sobre el IAMEST95). La ICP o cirugía de urgencia deben ser consideradas en una fase temprana ya que pueden salvar la vida del paciente95. En caso de no poder realizarse una ICP o cirugía de urgencia, se administrará terapia trombolítica95. Las mujeres presentan una mortalidad más elevada que los hombres, independientemente del tratamiento recibido.
En 2 estudios aleatorizados y controlados (SHOCK158,159 y SMASH160) se ha evaluado la revascularización temprana (ICP o cirugía CABG) en pacientes con shock cardiogénico provocado por disfunción ventricular izquierda tras un IAMEST. La ICP en este tipo de pacientes se diferencia de la ICP en pacientes con IAMEST «normal» en que: el intervalo de tiempo de espera recomendado de 12 h tras la aparición de los síntomas es más amplio161 y la ICP multivaso debe ser seriamente considerada. En todos los estudios sobre ICP primaria se ha analizado la estrategia de limitar el procedimiento de revascularización aguda al vaso causante. Sólo en caso de shock cardiogénico hay consenso sobre la recomendación de intentar una ICP multivaso en pacientes seleccionados que presentan estenosis críticas múltiples. Siempre debe plantearse el uso de balón de contrapulsación intraaórtico (BCPIA). Si la enfermedad multivaso no responde a una revascularización percutánea relativamente completa, en estos pacientes se considerará la cirugía161. En el estudio Benchmark Counterpulsation Outcomes Registry (25.136 pacientes), la mortalidad intrahospitalaria fue más elevada en los pacientes tratados solamente con terapia farmacológica (32,5%) que en los pacientes referidos a intervenciones percutáneas (18,8%) y quirúrgicas (19,2%)162. Conviene recordar que los pacientes con shock cardiogénico e IAMSEST presentan una mortalidad intrahospitalaria similar a los pacientes con shock e IAMEST163. La mortalidad intrahospitalaria de los pacientes con IAM complicado con shock cardiogénico sigue siendo alta, incluso cuando se ha practicado una ICP temprana164. Entre los pacientes mayores de 75 años con IAM y shock cardiogénico, los resultados pueden ser mejores de los que se creía anteriormente cuando son revascularizados de forma precoz. En este grupo, el 56% de los pacientes sobrevivió hasta el alta hospitalaria y, de ellos, la supervivencia al año fue del 75%165. En los últimos años se ha observado un aumento en el número de revascularizaciones re alizadas en pacientes con IAM y shock cardiogénico, posiblemente debido a un número mayor de ingresos de este tipo de pacientes en hospitales que disponen de cardiología intervencionista166. (Recomendación de ICP de urgencia en pacientes con shock cardiogénico: I, C.)
2.3.5. Angiografía de rutina tras la trombólisis
En el estudio ALKK167, 300 pacientes (inicialmente diseñado para 800) fueron aleatorizados a ICP o a tratamiento farmacológico. Antes de la asignación de tratamiento, se administró trombólisis al 63% del grupo de ICP y al 57% del grupo de terapia farmacológica. La ICP se realizó en un intervalo medio de 24 días tras el IAMEST. La supervivencia libre de eventos al año mostró una tendencia favorable a la ICP (el 90 frente al 82%). Esta tendencia está asociada fundamentalmente a la diferencia en la necesidad de (re)intervención (el 5,4 frente al 13,2%, p = 0,03). Un análisis multinivel de los pacientes incluidos en el estudio ASSENT-2 demostró una mortalidad más baja en los países con las tasas más altas de ICP tras tratamiento trombolítico168. Un metaanálisis de los estudios TIMI 4, 9 y 10B e InTIME-II (20.101 pacientes) reveló que la ICP realizada durante la hospitalización del paciente está asociada a una tasa más baja de IAM recurrente intrahospitalario (el 4,5 frente a 1,6%, p < 0,001) y a una menor incidencia de la mortalidad a los 2 años (el 11,6 frente al 5,6%, p < 0,001)169. Los resultados de un estudio prospectivo de la cohorte de pacientes del Registro Nacional Sueco de Causas de Muerte (Swedish National Cause of Death Registry)170 apoyan el uso de una estrategia invasiva precoz tras el IAM. En el estudio GUSTO-I, las tasas de cateterismos cardíacos y revascularizaciones durante el ingreso en pacientes de Estados Unidos fueron 2 veces mayores a las tasas de los pacientes canadienses171. La tasa de mortalidad a los 5 años fue del 19,6% entre los pacientes de Estados Unidos y del 21,4% entre los pacientes canadienses (p = 0,02). Por lo tanto, la estrategia conservadora comparada con la revascularización precoz tuvo un efecto negativo en la supervivencia a largo plazo171.
Los resultados de 4 estudios aleatorizados han contribuido a la recomendación de la angiografía coronaria de rutina e ICP (cuando es preciso) poco tiempo después del tratamiento trombolítico. Los datos sobre estos estudios (SIAM III172, GRACIA-1173, CAPITAL-AMI174 y Leipzig Prehospital Lysis Study-[LPLS]175) se pueden consultar en la tabla 6.
Los estudios SIAM III, GRACIA-1, CAPITAL-AMI, LPLS, ALKK, el análisis del ASSENT-2, el metaanálisis del TIMI 4, 9 y 10B y del InTIME-II, así como el estudio GUSTO-I, han contribuido a la solución de un viejo pero importante problema: la incidencia del reinfarto, el «talón de Aquiles» de la trombólisis. La trombólisis, pues, aun en el caso de que sea eficaz no debe considerarse como el tratamiento final: «trombólisis primero, stent después»176. (Recomendación de angiografía coronaria de rutina e ICP, si es preciso, tras la trombólisis efectiva: I, A.)
2.3.6. ICP por evidencia de isquemia tras la trombólisis
El estudio DANAMI-1177 fue el primer ensayo clínico, y el único prospectivo y aleatorizado, en el que se comparó una estrategia invasiva (ICP/CABG) con una estrategia conservadora en pacientes que presentaban una isquemia miocárdica inducible antes del alta hospitalaria y después de haber recibido tratamiento trombolítico debido a un primer IAMEST. La incidencia del objetivo primario (muerte, reinfarto e ingreso por angina inestable) se redujo significativamente del 29,5 al 15,4% al año, del 36,6 al 23,5% a los 2 años y del 44,0 al 31,7% a los 4 años. Con estos datos, los pacientes tratados con trombolíticos por un primer IAMEST e isquemia inducible antes del alta deben ser referidos a angiografía coronaria y revascularización (si fuera preciso) independientemente de que reciban tratamiento farmacológico «máximo». (Recomendación de ICP por evidencia de isquemia tras trombólisis efectiva: I, B.)
2.3.7. ICP en pacientes que no han sido reperfundidos en las primeras 12 h
Muy frecuentemente los pacientes acuden al médico demasiado tarde y o no son tratados con una terapia de reperfusión o esta terapia fracasa en la recanalización de la arteria. La terapia de reperfusión tardía se define como la trombólisis o la ICP que se inicia > 12 h después de la aparición de los síntomas (para la ICP tardía en el shock cardiogénico véase el apartado 2.3.4). La terapia trombolítica en el tratamiento tardío de los pacientes que refieren IAMEST no reduce el tamaño del infarto ni conserva la función ventricular izquierda, posiblemente debido a que no puede reestablecer la permeabilidad coronaria178.
Si se interpretan con prudencia los resultados de los estudios PCAT132, PRAGUE-2121 y CAPTIM130, se podría observar un posible efecto beneficioso de la ICP tardía. Sin embargo, esta consideración no es consistente con los resultados del estudio TOAT179 (más pequeño que los anteriores), en el que se observó un efecto adverso de la ICP tardía sobre el remodelado ventricular izquierdo. En el estudio DECOPI180, 212 pacientes con un primer IAM con onda Q y un vaso infartado y ocluido fueron asignados a ICP (realizada entre 2 y 15 días tras la presentación de los síntomas) o a terapia farmacológica. El objetivo primario fue el combinado de muerte cardíaca, IAM sin muerte o taquiarritmia ventricular. A pesar de que a los 6 meses la FEVI fue significativamente superior (5%) en el grupo de terapia invasiva frente al grupo de terapia farmacológica y que un número significativamente mayor de pacientes mantenían la permeabilidad de la arteria (el 82,8 frente al 34,2%), en el seguimiento medio a los 34 meses, la incidencia del objetivo primario fue similar en el grupo de terapia farmacológica y en el de terapia invasiva (el 8,7 frente al 7,3%, respectivamente). En cualquier caso, este estudio carece de poder estadístico adecuado, debido a que el número de pacientes reclutados y las tasas de eventos fueron inferiores a lo que se había planeado inicialmente. Es por ello que, a pesar de que la «hipótesis de la arteria abierta a largo plazo» resulta muy atractiva181, debemos esperar todavía los resultados del estudio OAT. Hoy día, no hay acuerdo sobre las recomendaciones de tratamiento para este grupo de pacientes.
2.3.8. Reducción máxima de los tiempos de demora
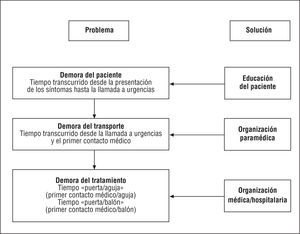
Existe un acuerdo unánime de que se deben realizar todos los esfuerzos necesarios para minimizar el tiempo transcurrido entre la presentación del dolor torácico/otros síntomas y el inicio de una estrategia de reperfusión segura y eficaz en los pacientes con IAMEST182,183 (consultar la tabla 7, Recomendaciones para la ICP en el SCAEST [IAMEST]). La reducción del tiempo total de isquemia es fundamental, no solamente para la terapia trombolítica, sino también para la realización de la ICP primaria184 (fig. 3). La reducción de la demora entre la presentación de los síntomas y el tratamiento mejora significativamente los resultados clínicos, mientras que el aumento de este intervalo está asociado a una perfusión miocárdica afectada, independientemente del flujo epicárdico185. Los esfuerzos deben comenzar con la educación del paciente e incluyen también mejoras en la organización del servicio de ambulancias y la optimización de los procedimientos interhospitalarios, públicos y privados (fig. 3). En cuanto a la ICP primaria, los esfuerzos deben dirigirse a mantener un intervalo medio entre el primer contacto médico y la ICP inferior a 90 min (incluido el intervalo «puerta-balón»). Si se prescinde del servicio de urgencias y se transfiere directamente al paciente con IAMEST al laboratorio de hemodinámica, podemos reducir adicionalmente este intervalo. No obstante, los pacientes que presentan una evolución de los síntomas > 3 h deben ser tratados igualmente con ICP primaria. Sólo cuando se prevé un retraso importante (> 2-3 h) en la realización de la ICP primaria, se debe considerar la administración de una terapia de reperfusión con agentes fibrinolíticos de segunda o tercera generación186.
Fig. 3. Posibles causas de demora desde la aparición de los síntomas hasta el comienzo de la terapia de reperfusión en pacientes con infarto agudo de miocardio con elevación del segmento ST. Las soluciones para reducir al mínimo la suma de estas demoras («tiempo total de isquemia») incluyen la optimización de la organización de los servicios de ambulancias y de la organización interhospitalaria pública o privada. Una de las medidas más importantes es la educación de los pacientes para minimizar el retraso entre la presentación de los síntomas y la llamada al servicio de urgencias.
En resumen, la ICP primaria debe ser el tratamiento de elección para los pacientes que refieren IAMEST en los hospitales que disponen de un servicio de cardiología intervencionista y un equipo médico experimentado. En caso de contraindicación a la trombólisis, el paciente debe ser transferido inmediatamente para ICP primaria, ya que ésta podría ser la única posibilidad de abrir rápidamente la arteria obstruida. En presencia de shock cardiogénico, la revascularización completa mediante ICP urgente puede salvar la vida del paciente y, por tanto, debe ser tomada en consideración de forma temprana. En varios estudios aleatorizados se observaron mejores resultados clínicos en los pacientes transferidos a un «centro cardiovascular» para la realización de ICP primaria frente a los pacientes tratados con trombólisis, a pesar del retraso producido por el traslado del paciente y, por tanto, una mayor espera entre el momento de la aleatorización y el inicio del tratamiento. La superioridad de la ICP primaria frente a la trombólisis presenta mayor relevancia clínica durante el intervalo de 3 a 12 h desde la presentación de dolor torácico u otros síntomas, debido a que la ICP permite una mayor protección del miocardio. Además, a mayor intervalo desde la presentación de los síntomas, se ha observado un aumento de la tasa de eventos cardíacos adversos graves tras la trombólisis, mientras que tras la ICP primaria parece que se mantiene estable.
Durante las primeras 3 horas tras la presentación de dolor torácico u otros síntomas, ambas estrategias de reperfusión parecen igualmente efectivas en la reducción del tamaño del infarto y de la mortalidad. Por ello, la trombólisis sigue siendo una alternativa viable a la ICP primaria, siempre que se pueda administrar dentro de las primeras 3 horas del comienzo de los síntomas. La ICP primaria, comparada con la trombólisis, reduce significativamente el índice de ACV. En general, se prefiere la ICP primaria frente a la trombólisis durante las primeras 3 horas de presentación de dolor torácico para prevenir el infarto y, en pacientes con una evolución de los síntomas de 3-12 h, para salvar el miocardio y también prevenir los ACV. Por el momento, no existe evidencia que permita recomendar la ICP facilitada.
Se recomienda la ICP de rescate siempre que fracase la trombólisis durante los 45-60 min tras el inicio de la administración. En caso de eficacia de la trombólisis, se recomienda la realización de una angiografía coronaria de rutina durante las primeras 24 h e ICP, si está indicado, incluso en pacientes asintomáticos, sin isquemia demostrable, para mejorar su evolución. Si no se dispone de un centro de cardiología intervencionista en 24 h, los pacientes que han respondido positivamente al tratamiento trombolítico, con evidencia de isquemia espontánea o inducible antes del alta hospitalaria, deben ser referidos a angiografía coronaria y, si fuera preciso, revascularización, independientemente de recibir terapia farmacológica «máxima» (*).
(*) Las recomendaciones de la ESC sobre el papel de la angioplastia en el IAMEST incluyen novedades importantes. Quizá las más relevantes son el reconocimiento de la equivalencia entre angioplastia primaria y trombólisis en pacientes con retraso inferior a 3 h desde el comienzo de los síntomas, y la recomendación explícita de estrategias farmacomecánicas de reperfusión como una alternativa razonable a la angioplastia primaria cuando ésta no es posible o exige un retraso superior al recomendado.
Efectivamente, la demostración de que la trombólisis muy temprana (en las primeras 3 h) puede abortar el infarto y tiene un efecto dramático sobre la mortalidad1 choca con las dificultades reconocidas para realizar la angioplastia primaria dentro del límite temporal útil para recuperar miocardio e influir sobre el pronóstico2. Ello está consolidando el concepto de que en materia de reperfusión miocárdica «todo tratamiento retrasado es un tratamiento denegado»3 y cuestiona la conveniencia de denegar el tratamiento trombolítico a pacientes que contactan con el sistema sanitario muy pronto (atención móvil u hospitalaria en las primeras 3 h), pero que por motivos logísticos o de infraestructura no pueden ser sometidos inmediatamente a angioplastia primaria.
En relación con lo anterior, es evidente por datos procedentes del mundo real y de estudios observacionales y aleatorizados que, en la era actual, la combinación de trombólisis y angioplastia complementaria rutinaria con stent es segura y beneficiosa4-6. Todo ello dibuja un nuevo panorama en el que la angioplastia primaria y la trombólisis dejan de verse como mutuamente excluyentes y parecen tener un efecto sinérgico que puede beneficiar a una alta proporción de pacientes con IAMEST independientemente de las barreras logísticas7.
1. Taher T, Fu Y, Wagner GS, Goodman SG, Fresco C, Granger CB, et al. Aborted myocardial infarction in patients with ST-segment elevation. J Am Coll Cardiol. 2004;44:38-43.
2. Nallamothu BK, Bates ER, Herrin J, Wang Y, Bradley EH, Krumholz HM, NRMI Investigators. Times to treatment in transfer patients undergoing primary percutaneous coronary intervention in the United States: National Registry of Myocardial Infarction (NRMI)-3/4 analysis. Circulation. 2005;111:761-7.
3. Williams DO. Treatment delayed is treatment denied. Circulation. 2004;109:1223-5.
4. Fernández-Avilés F, Alonso JJ, Castro-Beiras A, Vázquez N, Blanco J, Alonso-Briales J, et al. GRACIA Group (Grupo de Análisis de la Cardiopatía Isquémica Aguda). Routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet. 2004;3:1045-53.
5. Gibson CM, Karha J, Murphy SA, James D, Morrow DA, Cannon CP, et al. Early and long-term clinical outcomes associated with reinfarction following fribrinolytic administration in the TIMI trials. J Am Coll Cardiol. 2003;42:7-16.
6. Stenestrand U, Wallentin L. Early revascularization and 1-year survival in 14-day survivors of acute myocardial infarction: a prospective cohort study. Lancet. 2002;359:1805-11.
7. Sánchez PL, Fernández-Avilés F. Angioplastia facilitada: ni blanco ni negro. Rev Esp Cardiol. 2005;58:111-8.
3. MEDICACION COADYUVANTE A LA ICP
Se recomienda el pretratamiento de rutina con bolo intracoronario de nitroglicerina (NTG) a efectos de descartar el vasospasmo, valorar el tamaño verdadero del vaso y reducir el riesgo de reacciones vasospásticas durante el procedimiento (Recomendación para el uso de NTG: I C). Dependiendo de la presión sanguínea, el bolo se puede repetir durante y después del procedimiento. En el caso poco frecuente de un espasmo resistente a la NTG, el verapamilo es una buena alternativa.
En relación a la presencia de «no reflujo» o «flujo lento» (véase el apartado 4.5), existen numerosas investigaciones sobre la aplicación intracoronaria de verapamilo y adenosina en diferentes dosis187. El nitroprusiato, un donante directo de óxido nítrico, también puede ser un tratamiento efectivo y seguro en caso de reducción del flujo sanguíneo o fenómeno de «no reflujo» asociado a la ICP188,189. A demás el balón de contrapulsación intraaórtica también podría ser útil. La combinación de adenosina y nitroprusiato se tradujo en una mejora del flujo coronario, superior a la obtenida con adenosina intracoronaria sola190. (Recomendación de uso de adenosina, verapamilo y nitroprusiato en el fenómeno de no reflujo o flujo lento: IIa, C.)
3.1. Ácido acetilsalicílico (AAS)
Desde los comienzos de la cardiología intervencionista, los fármacos antiplaquetarios han sido la piedra angular de la medicación coadyuvante debido a la activación plaquetaria producida por el trauma inducido por la ICP en el endotelio y en otras capas más profundas de la pared arterial. En un documento de consenso191 elaborado recientemente por la ESC se detallan las aplicaciones farmacológicas básicas y las aplicaciones clínicas generales de los agentes antiplaquetarios en pacientes con enfermedad cardiovascular aterosclerótica. La presente guía trata de forma más específica la utilización de estos agentes en la ICP.
3.1.1. Ácido aceltilsalicílico en la cardiopatía isquémica estable
En el metaanálisis Antithrombotic Trialists Collaboration, se observó una reducción del 22% de la muerte por causas vasculares, IAM o ACV en los pacientes con alto riesgo de eventos vasculares asignados a tratamiento con ácido aceltilsalicílico (AAS), comparados con el grupo placebo192. El estudio M-HEART II193 fue el único ensayo clínico en ICP que comparó un grupo control a placebo con el tratamiento con AAS, demostrando la superioridad de este tratamiento en comparación con el placebo en la evolución clínica (el 30 frente al 41%). La tasa de IAM se redujo de forma significativa con el tratamiento con aspirina, del 5,7 al 1,2%. En la actualidad, el AAS continúa desempeñando un papel importante en la reducción de las complicaciones isquémicas de la ICP. En caso de que los pacientes no se encuentren en tratamiento crónico con AAS o si existen dudas sobre el seguimiento de este tratamiento, se administrará una dosis oral de carga de 500 mg, 3 h antes de la intervención o un mínimo de 300 mg por vía intravenosa inmediatamente antes del procedimiento. Este tratamiento sólo se omitirá en aquellos pacientes con alergia conocida al AAS. Como se ha señalado en el documento de consenso de la ESC, en el tratamiento crónico no se requieren dosis superiores a los 100 mg diarios191. (Recomendación de administración de AAS en la ICP para la cardiopatía isquémica estable: I, B.)
3.1.2. Ácido acetilsalicílico en el SCASEST
El metaanálisis citado en el apartado anterior reveló también una reducción del 46% en la muerte por causas vasculares, IAM o ACV (del 13,3 al 8,0%)192. A pesar de que los estudios fueron realizados antes del uso extendido del ICP, sus conclusiones llevaron a la recomendación universal de la administración de AAS como terapia estándar en el SCASEST, con o sin ICP. (Recomendación para la administración de AAS en la ICP para el SCASEST: I, C.)
3.1.3. Ácido acetilsalicílico en el SCAEST (IAMEST)
En el ensayo ISIS-2 se comprobó la eficacia del AAS comparado con placebo, demostrándose que el AAS era casi tan efectivo como la estreptoquinasa194. La administración de ambos fármacos fue aditiva. A pesar de las limitaciones y de los efectos secundarios del AAS, debe ser administrado a todos los pacientes con IAMEST (si se justifica clínicamente) tan pronto como sea posible tras el establecimiento del diagnóstico95. (Recomendación para la administración de AAS en la ICP para el IAMEST: I, B.)
Recientemente se ha planteado el problema de la «resistencia a la aspirina»195. Sin embargo, son necesarios más estudios que permitan relacionar tal falta de respuesta a la aspirina con el desarrollo de eventos clínicos adversos.
3.2. Ticlopidina y clopidogrel
3.2.1. Tienopiridinas (ticlopidina/clopidogrel) en la cardiopatía isquémica estable
La ticlopidina y el clopidogrel son 2 compuestos con un alto poder antiplaquetario. Existe evidencia convincente de que, para la reducción de la trombosis aguda y subaguda del stent tras ICP con implantación de stents, la terapia combinada a base de una tienopiridina más AAS es superior al AAS aislado o al AAS más un anticoagulante oral (Milán/Tokio196, ISAR197, STARS198, FANTASTIC199 y MATTIS200). Según los resultados de 3 estudios aleatorizados y controlados (CLASSICS201, TOPPS202, Bad Krozingen203) y de acuerdo con una serie de registros y metaanálisis204-209, el clopidogrel parece ser, como mínimo, tan eficaz como la ticlopidina. Comparado a la ticlopidina, el clopidogrel tiene menos efectos secundarios y se tolera mejor. (Recomendación para la administración de ticlopidina o clopidogrel durante 3-4 semanas además de AAS tras la implantación de stents convencionales en la cardiopatía isquémica estable: I, A.)
En la actualidad, la gran mayoría de los procedimientos de ICP concluyen con la implantación de stents, por ello, se debe considerar el pretratamiento con clopidogrel en todos los pacientes programados para ICP, se haya previsto o no la implantación210. Sin embargo, el tratamiento previo con 300 mg, 2,5 h antes del procedimiento, podría ser insuficiente211. Para asegurar una actividad antiplaquetaria completa, se debe iniciar la administración de clopidogrel con una dosis de carga de 300 mg al menos 6 h antes del procedimiento y, si fuera posible, el día anterior a la ICP programada (estudio CREDO212 y análisis TARGET213). De lo contrario, se administrará una dosis de carga de 600 mg al menos 2 h antes de la ICP; hay datos procedentes de estudios aleatorizados que apoyan esta indicación, aunque no han sido publicados en su totalidad (estudio ARMYDA-2)94,214-216. En caso de que la angiografía diagnóstica sea negativa o si no se realiza la implantación de stents o cuando esté indicada la cirugía cardíaca, se puede interrumpir la administración del clopidogrel. Los pacientes que no hayan sido pretratados con clopidogrel, pueden recibir una dosis de carga (posiblemente más alta) inmediatamente después del procedimiento. (Recomendación para el pretratamiento con 300 mg de clopidogrel al menos 6 h antes de la ICP: I, C.)
Tras la implantación de stents, no es necesario prolongar el tratamiento (> 4 semanas) en pacientes con angina estable, a excepción de los pacientes tratados con braquiterapia o stents recubiertos (tabla 8; véase también el capítulo 5). (Recomendación para la administración de clopidogrel tras la braquiterapia durante 12 meses o tras la implantación de stents recubiertos durante 6-12 meses: I, C.)
3.2.2. Clopidogrel en el SCASEST
El momento óptimo para el inicio de la terapia con clopidogrel en los pacientes con SCASEST es motivo de discusión. Por una parte, en el estudio CURE217 se observó que la frecuencia de eventos adversos se redujo significativamente con la administración de clopidogrel durante las primeras horas tras la entrada en el estudio218. Por otra parte, en los pacientes tratados con clopidogrel y referidos a cirugía cardíaca, la pérdida de sangre perioperatoria durante la cirugía constituye un motivo de preocupación. En el estudio CURE no se observó un exceso significativo de episodios importantes de hemorragias tras la cirugía de bypass aortocoronario (el 1,3 frente al 1,1%). En los pacientes que no interrumpieron la medicación del estudio hasta 5 días antes de la cirugía, la tasa de sangrados importantes fue mayor en el grupo de clopidogrel (el 9,6 frente al 6,3%)217. En suma, los beneficios obtenidos por la iniciación del tratamiento con clopidogrel al ingreso del paciente parecen ser superiores a los riesgos, incluso en los pacientes referidos a cirugía de bypass durante el mismo ingreso hospitalario219. En varios casos fue necesario administrar concentrados plaquetarios. Se observó un incremento del riesgo de sangrado con el aumento de la dosis de AAS de 100 a 100-200 mg o ≥ 200 mg en pacientes tratados con AAS solo (el 1,9, el 2,8, el 3,7% de sangrados importantes) y con AAS más clopidogrel (el 3,0, el 3,4, el 4,9%)220. Los datos disponibles sugieren que, en los pacientes con SCASEST, una dosis diaria de AAS en el rango de 75-100 mg puede ser considerada óptima220.
Según las guías de práctica clínica de la ACC/AHA para el manejo de los pacientes con SCASEST221, en muchos hospitales en los que los pacientes con AI o IAMSEST son sometidos a un cateterismo diagnóstico durante las primeras 24-36 h del ingreso, no se administra clopidogrel hasta que se decida si el paciente va a ser referido a cirugía de bypass en los días siguientes. El amplio seguimiento actual de la estrategia invasiva precoz, combinada con la implantación de stents y el uso de los inhibidores de la GP IIb/IIIa, reduce la posibilidad de la cirugía cardíaca de urgencia en la mayoría de los pacientes de riesgo. En base a los efectos positivos del clopidogrel218, recomendamos el inicio de la administración de este fármaco lo antes posible, siempre que esté clínicamente justificado. (Recomendación para la administración inmediata de clopidogrel en el SCASEST: I, B.)
Tras la fase aguda del SCASEST, la administración de AAS y clopidogrel durante 9-12 meses es beneficiosa (CURE217, PCI-CURE222). (Recomendación para la administración de clopidogrel durante 9-12 meses tras el SCASEST: I, B.)
3.2.3. Clopidogrel en el SCAEST (IAMEST)
Aunque no pueden ser considerados estudios sobre ICP, los estudios CLARITY (dosis de carga de 300 mg) y COMMIT CCS-2 (sin dosis de carga) mostraron que el AAS más clopidogrel fue más efectivo en el IAMEST que el AAS solo. En referencia a la ICP primaria y a la implantación de stents en el IAMEST, se administrará adicionalmente clopidogrel a estos pacientes, preferiblemente con una dosis de carga de 600 mg. En relación con la duración del tratamiento con clopidogrel, se podrían extrapolar los resultados obtenidos en el SCASEST pero este extremo debe ser científicamente comprobado.
Ciertos hallazgos de laboratorio previenen sobre la combinación del clopidogrel con estatinas de metabolización hepática, especialmente la atorvastatina223, aunque estos hallazgos no parecen tener importancia clínica224. La cuestión suscitada sobre una posible resistencia al clopidogrel requiere ser estudiada con más profundidad225,226.
En resumen, la «doble» terapia antiplaquetaria a base de AAS y clopidogrel constituye un estándar para el pretratamiento de los pacientes con cardiopatía isquémica estable que van a ser sometidos a una ICP, con o sin implantación de stents programada. Tras la implantación de stents no recubiertos, se continuará el tratamiento con clopidogrel durante 3-4 semanas y el de AAS debe ser indefinido. En los pacientes que ingresan con SCASEST, el tratamiento con AAS y administración inmediata de clopidogrel, si está justificado clínicamente, se considera el régimen antiplaquetario estándar básico. Tras la fase aguda, el tratamiento con AAS (100 mg/día) más clopidogrel (75 mg/día) durante 9-12 meses es beneficioso. Se administrará AAS por vía intravenosa a todos los pacientes con IAMEST lo antes posible, cuando se haya establecido el diagnóstico y si está clínicamente justificado. En base al concepto de ICP primaria e implantación primaria de stents en el IAMEST, se administrará adicionalmente clopidogrel a estos pacientes. Tras la braquiterapia se administrará clopidogrel, además de AAS, durante 12 meses y tras la implantación de stents recubiertos con fármacos durante 6-12 meses para evitar la trombosis tardía del vaso.
3.3. Heparina no fraccionada
3.3.1. Heparina no fraccionada para la ICP en la cardiopatía isquémica estable
Desde los inicios de la ICP, se ha utilizado la heparina no fraccionada (HNF) para prevenir el desarrollo de trombosis sobre el instrumental y minimizar la formación de trombos sobre el daño vascular y la rotura de placa iatrogénicos. Por razones obvias, no existen estudios con grupo placebo sobre la ICP, ya que la omisión de la anticoagulación no es posible en este tipo de intervenciones. La HNF se administra en bolo intravenoso y la dosis se calcula en base al tiempo de coagulación activado (TCA del rango de 250-350 s o 200-250 s, cuando se administra un inhibidor de la GP IIb/IIIa) o ajustada al peso (normalmente 100 U/kg o ~50-60 U/kg, cuando se administra un inhibidor de la GP IIb/IIIa). Debido a la marcada variabilidad de la biodisponibilidad de la HNF, se recomienda el cálculo de la dosis en base al TCA, especialmente en procedimientos largos en los que probablemente serán necesarios bolos adicionales. Por lo general, la respuesta terapéutica a la HNF es difícil de predecir. Existe evidencia de que su efecto beneficioso está asociado a una dosis efectiva, aunque se han utilizado dosis bajas (5.000 U o menos) en procedimientos de rutina227. Tras la finalización del procedimiento, no se recomienda la administración de heparina, especialmente antes o después de la retirada del introductor.
3.3.2. HNF para la ICP en el SCASEST
Normalmente, se recomienda la adición de HNF al régimen estándar en base a los resultados de un metaanálisis realizado sobre 6 ensayos clínicos aleatorizados, en el que se observó una tasa del 7,9% de muerte/IAM en pacientes con angina inestable tratados con AAS más heparina, comparada a una tasa del 10,3% en pacientes tratados sólo con AAS228. La interrupción de la HNF en los pacientes con AI está asociada al riesgo inherente de un efecto rebote229.
3.3.3. HNF para la ICP en el SCAEST (IAMEST)
La HNF forma parte de la terapia estándar de los pacientes con IAMEST, especialmente de los pacientes que van a ser sometidos a una ICP primaria. La HNF se ha utilizado como tratamiento del grupo control en numerosos ensayos clínicos en los que se investigó el efecto de las heparinas de bajo peso molecular (HBPM; véase apartado 3.4.3) o de la bivalirudina. (Recomendación para la administración de heparina en todos los procedimienos de ICP: I, C.)
3.4. Heparinas de bajo peso molecular (HBPM)
Tanto la HNF como la HBPM actúan uniéndose a la antitrombina III (AT-III) y, por tanto, acelerando el efecto de este agente inhibidor de la trombina. Sin embargo, la HNF presenta algunas limitaciones: debido a su fuerte unión a las proteínas plasmáticas, los efectos antitrombóticos de la HNF son variables y las concentraciones de heparina libre son impredecibles. La HNF inhibe en la misma medida los factores Xa y la trombina, mientras que la HBPM inhibe predominante y más extensamente el factor Xa. En base a que sus valores en plasma son más consistentes, la HBPM se considera un anticoagulante más predecible, que no requiere monitorización de laboratorio.
3.4.1. HBPM para la ICP en la cardiopatía isquémica estable
Los datos sobre la utilización de la HBPM como único anticoagulante durante la ICP en pacientes con cardiopatía isquémica estable son escasos. Se recomienda actuar con precaución y administrar adicionalmente HNF a los pacientes que ingresan pretratados con HBPM; la dosis dependerá del intervalo transcurrido desde la última dosis de HBPM.
3.4.2. HBPM para la ICP en el SCASEST
El resultado clínico, valorado como objetivo primario, del uso de HBPM comparado con el de la HNF fue investigado en 4 ensayos clínicos importantes que incluían a un total de 12.048 pacientes con SCASEST. Estos estudios han sido ampliamente revisados en la guía sobre el SCASEST de la ESC60 y en otros documentos230. No obstante, es preciso señalar que estos estudios no son aplicables a la ICP, ya que la ICP fue excluida (dalteparina, FRIC231), no recomendada en las primeras 24 h (enoxaparina, TIMI-11B232,233), o realizada a discreción del especialista (enoxaparina-ESSENCE233,234 y nadroparina-FRAXIS235).
La dalteparina fue superior a la HNF en los pacientes inestables (FRISC-II236). Sin embargo, esta superioridad sólo fue demostrada en el brazo no invasivo; en los pacientes revascularizados de forma temprana, la dalteparina no fue superior90. En los estudios ESSENCE234 y TIMI 11 B232 se observó una superioridad de la enoxaparina sobre la HNF en la estrategia predominantemente conservadora en pacientes de alto riesgo con SCASEST, a coste de un incremento significativo de hemorragias menores64. En el estudio SYNERGY237, 9.978 pacientes con SCASEST fueron aleatorizados a tratamiento con HNF o a enoxaparina (más AAS) con una estrategia invasiva precoz. Los criterios de inclusión (alto riesgo) fueron los síntomas isquémicos mantenidos durante al menos 10 min y aparecidos durante las 24 h previas al reclu tamiento del paciente y además 2 de los siguientes factores: ≥ 60 años de edad, elevación de los valores de troponina o creatincinasa sobre el límite superior de la normalidad o cambios del segmento ST en el ECG. El objetivo combinado de muerte e IAM después de 30 días fue del 14,5 frente al 14,0%. La incidencia de sangrados importantes (según criterios TIMI) aumentó significativamente en el grupo de enoxaparina (el 7,6 frente al 9,1%). Estos resultados son consistentes con los resultados del estudio A-to-Z238, en el que no se observaron beneficios clínicos de la enoxaparina, comparada con la HNF, en pacientes con SCASEST tratados con una estrategia invasiva precoz y AAS más tirofibán, pero la tasa de sangrados fue significativamente mayor en los grupos de ICP con enoxaparina (el 4,4 frente al 2,8%).
Por lo general, se debe evitar el cambio de tratamiento de HNF a HBPM o viceversa239. Cuando se haya administrado HBPM antes de la ICP, la administración de una terapia anticoagulante adicional depende del intervalo transcurrido desde la última dosis de HBPM240.
De acuerdo con el análisis combinado de los resultados de los estudios ESSENCE, TIMI 11B, SYNERGY y A-to-Z, se recomienda la elección de HNF en los pacientes de alto riesgo con SCASEST que van a ser tratados mediante una estrategia invasiva programada (fig. 1). Además, y a pesar de que se puede administrar enoxaparina antes de la ICP en pacientes con SCASEST241, el Grupo de Trabajo de la ESC recomienda la utilización de HNF ya que su efecto es reversible mediante la administración de protamina. No existe evidencia concluyente sobre la seguridad de la utilización de enoxaparina en el laboratorio de hemodinámica, pero esta posibilidad está siendo investigada en la actualidad.
Si la estrategia invasiva, por alguna razón, no está indicada en los pacientes de alto riesgo con SCASEST, se recomienda la administración de enoxaparina para reducir el riesgo de complicaciones isquémicas242. (Recomendación para la administración de HBPM en sustitución de la HNF en pacientes de alto riesgo con SCASEST, cuando no está indicada una estrategia invasiva: I, C.)
3.4.3. HBPM para la ICP en el SCAEST (IAMEST)
El uso de la HBPM en el IAMEST fue investigado en varios estudios angiográficos. En el estudio HART II243 se observó una tendencia hacia la mayor eficacia del uso inmediato de la enoxaparina con un activador del plasminógeno tisular (t-PA), comparado con la HNF, en la obtención de la permeabilidad de la arteria causante del infarto (flujo TIMI 2 y 3), 90 min después del inicio del tratamiento. Los pacientes del grupo de enoxaparina presentaron una tasa de reoclusión a los 5-7 días significativamente inferior, sin aumento de hemorragias importantes. En los pacientes tratados con una dosis completa de tenecteplasa (TNK) o media dosis de TNK más abciximab, la enoxaparina se asoció a una tasa de flujo TIMI-3 similar a la HNF (estudio ENTIRE-TIMI-23244). El estudio PENTALYSE245 evaluó la eficacia y seguridad del uso de fondaparinux en pacientes con IAMEST en evolución. Los pacientes estudiados mediante angiografía coronaria a los 90 min y a los 5-7 días mostraron tasas similares de flujo TIMI 3 a los 90 min. No hay, pues, evidencia que recomiende el uso de la HBPM respecto de la HNF para la ICP en pacientes con IAMEST, mientras no se conozcan más datos de investigaciones importantes.
En resumen, la HNF se administra en un bolo intravenoso, dependiendo la dosis del TCA. Con sus ventajas farmacológicas, la HBPM se considera un anticoagulante más predecible, que no requiere monitorización analítica. Sin embargo, no se dispone de datos suficientes sobre el uso de la HBPM como único anticoagulante para la ICP en los pacientes con cardiopatía isquémica estable. Es preferible el uso de la HNF en pacientes de alto riesgo con SCASEST que van a ser tratados con una estrategia invasiva y en pacientes de bajo riesgo tratados con una estrategia conservadora. Cuando la estrategia invasiva, por alguna razón, no esté indicada en los pacientes de alto riesgo con SCASEST, se recomienda la administración de enoxaparina, considerando el aumento de sangrados menores. La HNF es el tratamiento estándar para los pacientes con IAMEST que van a ser sometidos a una ICP primaria.
3.5. Inhibidores de la glucoproteína IIb/IIIa
Los inhibidores de la glucoproteína IIb/IIIa (GP IIb/IIIa) son los compuestos farmacológicos antiplaquetarios más potentes que actúan bloqueando los receptores del fibrinógeno.
3.5.1. Inhibidores de la GP IIb/IIIa para el ICP en la cardiopatía isquémica estable
En el estudio ISAR-REACT215 se asignó de forma aleatoria tratamiento con abciximab o placebo a pacientes de bajo riesgo con cardiopatía isquémica, excluyendo los SCA, la diabetes dependiente de insulina y los trombos visibles (tabla 10). El abciximab no alcanzó el objetivo primario en estos pacientes de bajo riesgo programados para la implantación electiva de stents.
A pesar de que el análisis retrospectivo del subgrupo de pacientes diabéticos del EPISTENT246, que incluía una población mixta con cardiopatía isquémica estable e inestable (tabla 10), sugiere un beneficio pronóstico del abciximab en el grupo de stents, los resultados del estudio prospectivo ISAR-SWEET, en pacientes con cardiopatía isquémica estable (excluidos los SCA y el trombo visible), no permiten corroborar este extremo247. En base al bajo riesgo de la ICP en los pacientes con cardiopatía isquémica estable, al riesgo potencial de los inhibidores de la GP IIb/IIIa de incrementar las complicaciones de hemorragia y a su alto coste, estos fármacos no están incluidos en la medicación estándar periprocedimiento. A pesar de que los resultados de un importante metaanálisis (20.186 pacientes) sugieren la administración rutinaria de inhibidores de la GP IIb/IIIa en la ICP248, y de los resultados de otro metaanálisis reciente (8.004 pacientes) que sugieren una reducción de la mortalidad mediante el uso de inhibidores de la GP IIb/IIIa en los pacientes tratados con stents y enfermedad coronaria no aguda (cardiopatía isquémica no aguda)47, la administración de inhibidores de la GP IIb/IIIa en la ICP de pacientes con angina estable debe ser estudiada caso por caso. Siempre que haya un riesgo elevado (superior a la media) de complicaciones en los pacientes con cardiopatía isquémica estable, los inhibidores de la GP IIb/IIIa son una herramienta útil en las lesiones inestables, como medicación de rescate en caso de oclusión del vaso (posible/confirmada), en presencia de trombo visible o del fenómeno de «no reflujo/flujo lento». Los inhibidores de la GP IIb/IIIa resultan útiles también en las intervenciones complejas249. (Recomendación para la administración de inhibidores de la GP IIb/IIIa para la ICP en la cardiopatía isquémica estable con lesiones complejas, oclusión posible/confirmada del vaso, trombo visible, fenómeno de «no reflujo/flujo lento»: IIa, C.)
3.5.2. Inhibidores de la GP IIb/IIIa para la ICP en el SCASEST
En la guía sobre los SCASEST de la ESC60 se han revisado de forma pormenorizada todos los estudios sobre el uso de inhibidores de la GP IIb/IIIa en pacientes con SCASEST.
En relación con la ICP, los estudios que investigan la utilidad de los inhibidores de la GP IIb/IIIa en el SCASEST se pueden dividir en 2 grupos: los que incluyen la ICP programada por protocolo y los que desaconsejan una terapia invasiva. La ICP no estaba programada o incluso estaba desaconsejada en los estudios GUSTO-IV-ACS (abciximab)250, PRISM251 y PRISM-PLUS252 (tirofibán) y PARAGON-A253 (lamifibán). La ICP se realizó a discreción del especialista en los estudios PURSUIT254 (eptifibatida) y PARAGON-B255 (lamifibán). Por tanto, las tasas de ICP en estos estudios son bajas y varían entre el 1,6 y el 30,5% (tabla 9).
Los estudios sobre la utilidad de los inhibidores de la GP IIb/IIIa con ICP programada aparecen detallados en la tabla 10. En general, se recomienda el uso de cualquiera de los 3 inhibidores de la GP IIb/IIIa en pacientes con SCASEST que van a ser sometidos a una ICP y presentan alto riesgo de complicaciones trombóticas agudas60 (fig. 1). El abciximab administrado antes de la intervención es superior al placebo en la reducción del riesgo de complicaciones isquémicas agudas (CAPTURE256, EPIC257, EPILOG258, EPISTENT259). Aunque se pueden considerar estudios sobre la ICP, conviene recordar que la implantación programada de stents fue un criterio de exclusión en el estudio EPILOG, el porcentaje de stents fue muy bajo (7,6%) en el CAPTURE e inferior al 2% en el EPIC, en el que se desaconsejó su uso (tabla 10). En el estudio EPISTENT, el 43% de los pacientes tenía angina estable y en el ERASER260, con implantación de stent programada, los pacientes con trombo intracoronario evidente fueron excluidos (tabla 10).
Se observan resultados similares en el análisis retrospectivo de subgrupos en estudios realizados con eptifibatida (ESPRIT261, IMPACT-II262), mientras que la evidencia relativa al tirofibán es menos concluyente (RESTORE263). La eptifibatida ofrece una eficacia antiplaquetaria superior al AAS y al clopidogrel en los pacientes con IAMSEST (estudio PEACE)264. Sin embargo, la administración rutinaria y precoz de eptifibatida en el servicio de urgencias, con un porcentaje bajo de ICP, no modificó las medidas serológicas del tamaño del infarto en pacientes con SCASEST (estudio EARLY)265.
En el estudio TARGET266,267, la comparación directa del abciximab con tirofibán en pacientes tratados con ICP reveló una eficacia menor del tirofibán en el subgrupo de pacientes de alto riesgo. El objetivo primario combinado de muerte, IAM no fatal o revascularización urgente del vaso tratado a los 30 días tuvo una incidencia significativamente mayor en el grupo de pacientes tratados con tirofibán, comparado con el grupo de abciximab (el 7,6 frente al 6,0%). Sin embargo, a los 6 meses no se observaron diferencias estadísticas entre los 2 grupos. Se ha cuestionado si estos resultados se deben a una dosis insuficiente de tirofibán y si los resultados mejorarían con un incremento de la dosis de 2 o de 2,5 veces268-270. El estudio TENACITY ha sido diseñado para la comparación directa de una dosis más elevada de tirofibán que la utilizada en TARGET con el abciximab.
En las condiciones actuales de la ICP, un estudio que pretenda comparar la utilidad del uso de un inhibidor de la GP IIb/IIIa administrado de forma rutinaria (antes de la angiografía coronaria) o en el laboratorio de cateterismos (antes de la ICP), debería cumplir los siguientes requisitos: inclusión únicamente de pacientes de alto riesgo con SCASEST, ICP programada para todos los pacientes e implantación de stents programada para todos los pacientes. Debido a que no disponemos de dicho estudio (tablas 9 y 10), las siguientes recomendaciones se han elaborado partiendo de estudios más antiguos: para el manejo general del paciente (inicio de la terapia al ingreso del paciente, antes del cateterismo diagnóstico), el tirofibán y la eptifibatida muestran un claro beneficio271,272. En una población tratada mayoritariamnete sin uso de stents, el abcimad fue efectivo cuando se administró dentro de las 24 h desde el cateterismo diagnóstico y la ICP programada. En una población no seleccionada con AI/IAMSEST y cuando la ICP no estaba programada, el abciximab no ofreció ningún beneficio250. De hecho, el abciximab es innecesario en los pacientes tratados con una estrategia no invasiva221,273. En los pacientes de alto riesgo con SCASEST y cuando no se prevea la realización del cateterismo cardíaco en las siguientes 2,5 h, se iniciará el tratamiento con tirofibán o eptifibatida274-276 (fig. 1). En caso contrario (si se prevé el cateterismo en menos de 2,5 h), se puede iniciar el tratamiento con inhibidores de la GP IIb/IIIa (abciximab o eptifibatida) en el laboratorio de hemodinámica274,275,277 (fig. 1). Generalmente, el abciximab se administra durante 12 h y la eptifibatida durante 16 h tras la ICP278. (Recomendación para la administración de inhibidores de la GP IIb/IIIa en los pacientes de alto riesgo con SCASEST e ICP programada o realizada: I, C.)
3.5.3. Inhibidores de la GP IIb/IIIa para la ICP en el SCAEST (IAMEST)
El efecto del tirofibán y de la eptifibatida en los pacientes con IAMEST ha sido menos estudiado que en pacientes con SCASEST. El abciximab ha sido evaluado en 5 ensayos clínicos aleatorizados y controlados (RAPPORT279, ISAR-2280, CADILLAC141, ADMIRAL147 y ACE281) en asociación a la ICP primaria (tabla 11). Un reciente metaanálisis282, que incluía también un pequeño estudio con ICP de rescate283, concluyó que el abciximab, como medicación coadyuvante a la ICP, reduce la mortalidad, la revascularización del vaso diana (RVD) y los MACE a los 6 meses tras el IAMEST. Los beneficios a largo plazo del abciximab administrado durante la implantación de stents coronarios requieren más investigación284. (Recomendación para la administración de abciximab en la ICP primaria: IIa, A.)
3.6. Inhibidores directos de la trombina
3.6.1. Inhibidores directos de la trombina para la ICP en la cardiopatía isquémica estable
A diferencia de los análogos de la hirudina (desirudina y lepirudina), la inhibición de la trombina por medio de la bivalirudina es reversible, y sus efectos duran ~25 min. Los estudios sobre la hirudina han mostrado repetidas veces un aumento del riesgo de hemorragias, mientras que los resultados de la bivalirudina en la ICP son bastante esperanzadores287. El estudio CACHET288 fue el primer ensayo clínico aleatorizado en el que se sugirió que, en pacientes estables, el tratamiento provisional con abciximab y bivalirudina, como agente antitrombótico de base, puede ser, como mínimo, equivalente al tratamiento con abciximab y heparina para todos los pacientes sometidos a una ICP. Hoy día, se sugiere la sustitución de la HNF por la bivalirudina289 en base a la reducción de sangrados, comparada con la HNF sola (estudio BAT290). Además, el grupo asignado a bivalirudina del estudio REPLACE-2 fue comparado, indirectamente pero de forma y prospectiva, con un grupo control imputado (heparina)291. Respecto de la heparina sola, la razón de riesgo fue de 0,62, cumpliendo los criterios estadísticos de superioridad de la bivalirudina respecto de la heparina291. En los pacientes tratados con bivalirudina, el TCA se normalizó en un intervalo significativamente menor, a pesar de que la media de los TCA era significativamente mayor, y se observó un número significativamente menor de TCA subterapéuticos292. (Recomendación para la sustitución de la HNF o de la HBPM por bivalirudina para reducir las complicaciones de sangrado: IIa, C.)
Actualmente, se recomienda unánimemente la sustitución de la HNF (y HBPM) por la bivalirudina en pacientes con trombocitopenia inducida por la heparina (TIH). En el estudio ATBAT, 52 pacientes con TIH fueron sometidos a una ICP con bivalirudina: ningún paciente presentó trombocitopenia significativa (recuento plaquetario < 150.000/100 ml). La bivalirudina parece segura y proporciona una anticoagulación efectiva durante la ICP en este subgrupo especial de pacientes293. (Recomendación para la sustitución de la HNF o de la HBPM por bivalirudina en pacientes con TIH: I, C.)
3.6.2. Inhibidores directos de la trombina para la ICP en el SCASEST
Existen 2 ensayos clínicos aleatorizados, considerados estudios «puros» sobre ICP, en los que se comparó un inhibidor directo de la trombina con la HNF (tabla 12 ). En el estudio HELVETICA, no se alcanzó el objetivo primario (reducción de la supervivencia libre de eventos a los 7 meses) con la hirudina, comparada con la HNF294. Los resultados del estudio BAT290 (angioplastia con bivalirudina) fueron inicialmente publicados para el análisis por protocolo. Según este análisis, no se alcanzó el objetivo primario (muerte en el hospital, IAM, oclusión abrupta del vaso o rápido deterioro clínico por causas cardíacas). La bivalirudina redujo significativamente las complicaciones de sangrado del 9,8 al 3,8%. El informe final fue publicado con el análisis «por intención de tratar» de la base de datos completa, utilizando objetivos adjudicados295. El objetivo combinado de muerte, IAM o repetición de la revascularización (definido a los 7, 90 y 180 días) se alcanzó a los 7 y 90 días. Por lo tanto, el informe final apoya la hipótesis de que la bivalirudina reduce las complicaciones isquémicas y la hemorragia tras la ICP, comparada a la HNF a dosis altas (tabla 13).
El estudio REPLACE-1296 comparó la eficacia de la bivalirudina y de la heparina en pacientes aleatorizados a revascularización urgente o electiva. En cuanto a la eficacia, el objetivo combinado de muerte, IAM o repetición de la revascularización antes del alta hospitalaria o durante las primeras 48 h ocurrió en el 6,9% y en el 5,6% de los pacientes en los grupos de heparina y bivalirudina, respectivamente (no significativo). El estudio REPLACE-2291 determinó la eficacia y seguridad del tratamiento con bivalirudina sola comparada con la heparina y un inhibidor de la GP IIb/IIIa, en relación con la protección ante complicaciones hemorrágicas e isquémicas perioperatorias, en pacientes sometidos a una ICP. A los 30 días, el objetivo primario combinado (muerte, IAM, repetición urgente de la revascularización o sangrado intrahospitalario importante) había ocurrido en el 9,2% de los pacientes del grupo de bivalirudina frente al 10,0% de los pacientes del grupo de heparina más un inhibidor de la GP IIb/IIIa (no significativo). A pesar de una tendencia inicial hacia una frecuencia más elevada del IAM (por determinación enzimática) en el grupo de bivalirudina, después de un año se observó una tendencia a una mortalidad más baja en este grupo (1,89%), comparada con el grupo de heparina más un inhibidor de la GP IIb/IIIa (2,46%, p = 0,16)297. Por lo tanto, los resultados clínicos a largo plazo de la bivalirudina y el uso provisional de los inhibidores GP IIb/IIIa son comparables con los del tratamiento con heparina más inhibición programada de la GP IIb/IIIa en las ICP modernas297. Para la elaboración de las recomendaciones finales sobre la utilización de la bivalirudina en el SCASEST, se esperan los resultados del estudio ACUITY, actualmente en fase de desarrollo.
3.6.3. Inhibidores directos de la trombina para la ICP en el SCAEST (IAMEST)
En la actualidad, incluso tras el análisis específico de los subgrupos de ICP, no hay evidencia que recomiende el uso de los inhibidores directos de la trombina para la ICP en el IAMEST298,299.
En resumen, dado el bajo riesgo de la ICP en los pacientes con cardiopatía isquémica estable y sobre el riesgo potencial de los inhibidores de la GP IIb/IIIa de incrementar las complicaciones de hemorragia y a su alto coste, estos fármacos no están incluidos en la terapia periprocedimiento estándar. La administración de inhibidores de la GP IIb/IIIa en la ICP de pacientes con angina inestable debe ser estudiada de forma electiva: siempre que exista un riesgo superior a la media de complicaciones en los pacientes con cardiopatía isquémica estable (intervenciones complejas, lesiones inestables, como tratamiento de rescate ante la amenaza/presencia de oclusión vascular, trombo visible o fenómeno de «no reflujo/flujo lento»), los inhibidores de la GP IIb/IIIa pueden ser muy útiles.
En el SCASEST, sólo se administrarán inhibidores de la GP IIb/IIIa a los pacientes de alto riesgo para los que se haya programado una estrategia invasiva. Para el manejo «general» del paciente (cuando se inicia la terapia al ingreso del paciente, antes del cateterismo diagnóstico o cuando no se prevé su realización en las siguientes 2,5 h), el tirofibán y la eptifibatida muestran un claro beneficio. Cuando se prevé la realización del cateterismo cardíaco en las próximas 2,5 h, los inhibidores de la GP IIb/IIIa se pueden posponer y el tratamiento con abciximab o eptifibatida se iniciará en el laboratorio de hemodinámica. Si por alguna razón la demora entre el cateterismo diagnóstico y la ICP programada llega hasta 24 h, tambi& eacute;n se puede administrar abciximab.
El efecto del tirofibán y de la eptifibatida en los pacientes con IAMEST ha sido menos estudiado. En el IAMEST, la implantación de stents y el uso de abciximab parece una estrategia de reperfusión apoyada por más evidencia. La bivalirudina se propone hoy día como tratamieno sustitutivo de la HNF (o HBPM), en una posible reducción significativa de las hemorragias, comparada con la HNF sola o con la HNF más inhibidores de la GP IIb/IIIa. En la actualidad, se recomienda unánimemente la sustitución de la HNF (y HBPM) por la bivalirudina en pacientes con TIH.
4. TÉCNICAS Y DISPOSITIVOS COMPLEMENTARIOS EN LA ICP
4.1. Braquiterapia intracoronaria en la reestenosis intra-stent
La reestenosis intra-stent se debe a la hiperplasia de la íntima dentro del stent e incluso en sus bordes. A pesar de que la angioplastia de balón se considera segura para el tratamiento de la reestenosis intra-stent, está asociada a elevadas tasas de recurrencia (hasta el 80%)300,301. Los factores de riesgo para la reestenosis intra-stent están bien perfilados y, fundamentalmente, son los siguientes: una estenosis larga (> 30 mm), un stent largo, diámetro del vaso pequeño (< 2,5 mm), diámetro luminal final pequeño, oclusiones totales crónicas, localización en el ostio o en segmentos en bifurcación y la presencia de diabetes mellitus302-304.
En una serie de estudios aleatorizados y controlados con placebo, la braquiterapia intracoronaria mostró una mejora significativa de los resultados clínicos y angiográficos en arterias coronarias nativas (GAMMA-I305, WRIST306, LONG-WRIST307, START308, INHIBIT309) y en injertos de vena safena (SVG-WRIST310). Estos resultados reflejaban la situación del «mundo real», como se confirmó en el registro europeo RENO311. La reestenosis en los bordes del stent fue una de las mayores preocupaciones al comienzo de la era de la braquiterapia. El riesgo del «fenómeno del borde» se minimiza con la utilización de fuentes largas (o secuenciales, como en el caso de la técnica de pull-back) que permiten la radiación efectiva de todo el segmento a tratar. Los resultados clínicos a largo plazo, con una reducción significativa y mantenida de MACE, observados en el estudio START312 con radiación beta fueron comparables a los obtenidos con radiación gamma en los estudios SCRIPPS-I313, GAMMA-1314 y WRIST315 (tabla 14).
Se han comunicado buenos resultados a largo plazo, en el seguimiento a 3 y 5 años, mediante la utilización de radiación gamma316,317. Para prevenir la oclusión tardía del vaso, generalmente se recomienda la administración de clopidogrel durante 1 año tras la terapia de radiación318,319. (Recomendación de braquiterapia en la reestenosis intra-stent en arterias coronarias nativas: I, A; recomendación de braquiterapia para el tratamiento de la reestenosis intra-stent en injertos de vena safena: I, B.)
4.2. Balón de corte
El balón de corte (BC) incorpora 3 o 4 cuchillas metálicas que permiten la realización de incisiones longitudinales en la placa en el momento de la dilatación. Teóricamente, estas incisiones permiten una redistribución favorable de la placa a una presión de dilatación inferior a la utilizada en la angioplastia de balón.
En el «estudio global del balón de corte» se probó el concepto de «dilatación controlada» en una población de 1.238 pacientes con estenosis de novo320. El objetivo primario (la tasa binaria de reestenosis angiográfica a los 6 meses) fue del 31,4% para el BC y del 30,4% para la angioplastia con balón; por lo que el mecanismo propuesto de dilatación controlada no redujo la tasa de reestenosis angiográfica en el grupo de BC comparado con la angioplastia de balón convencional. En base a una serie de estudios retrospectivos y a varios estudios aleatorizados pequeños, se ha propuesto la utilización del BC para el tratamiento de la reestenosis intra-stent. Sin embargo, los datos del estudio aleatorizado RESCUT321 no justifican el uso del BC en estos casos. El BC podría ser útil en el tratamiento de la reestenosis intra-stent porque evita el desplazamiento involuntario del balón, reduciendo el trauma infligido al vaso. Combinado con la braquiterapia, el balón de corte es una elección razonable a efectos de reducir la posibilidad de «pérdida geográfica» mediante la reducción de los desplazamientos involuntarios de los dispositivos. (Recomendación de uso de balón de corte para la reducción del trauma vascular ocasionado por el desplazamiento involuntario durante la ICP de la reestenosis intra-stent: IIa, C.)
4.3. Aterectomía rotacional
La aterectomía rotacional (AR) utiliza una fresa recubierta de polvo de diamante que, al girar a alta velocidad (140.000-180.000 rpm), pulveriza la placa de ateroma. Debido a la mayor incidencia de espasmos y del fenómeno de «no reflujo/flujo lento», es preciso estar preparado para resolver estas complicaciones (estudio CARAFE322), en especial, las asociadas directamente con esta tecnología. El estudio COBRA323 fue diseñado para probar la eficacia de la AR en lesiones de novo complejas, comparada con la angioplastia de balón. Los resultados no demostraron ningún beneficio a largo plazo. El estudio STRATAS324 no demostró ninguna ventaja de la utilización de una AR más agresiva y el estudio CARAT325 demostró que la AR más agresiva, utilizando fresas de mayor tamaño, se tradujo en una tasa de complicaciones más alta y en peores resultados clínicos que la AR menos agresiva. También se ha propuesto la AR para el tratamiento de la reestenosis intra-stent, basándose en que la ablación de la placa podría ser más efectiva que la compresión o extrusión mediante angioplastia convencional. Sin embargo, esta estrategia continúa siendo un motivo de controversia. El estudio ARTIST326 obtuvo resultados significativamente peores con la utilización de la AR que con la angioplastia con balón. Por otra parte, en el estudio ROSTER327 la tasa de MACE al año fue significativamente mejor en el grupo de AR. En este estudio, se utilizó el ultrasonido intravascular (IVUS) en todos los pacientes para excluir a aquéllos en los que la expansión del stent no se consideró adecuada. En términos generales, no recomendamos el uso de la AR para el tratamiento de la reestenosis intra-stent.
Con el aumento del uso de los stents recubiertos, que requieren la liberación homogénea del fármaco basada en la aposición óptima de los filamentos del stent en las estenosis calcificadas, la AR podría volver a tener un papel más relevante. En términos prácticos, sabemos que las estenosis que han sido cruzadas con la guía de angioplastia, pero que no se pueden dilatar de forma adecuada y homogénea incluso con balones no distensibles, podrían ser tratadas, en algunos casos, mediante AR328. (Recomendación para el uso de la AR en lesiones fibróticas o severamente calcificadas, que no se pueden cruzar o dilatar adecuadamente con balón, antes de la implantación programada de stents: I, C.)
4.4. Aterectomía coronaria direccional
La posibilidad de eliminar la placa ateromatosa obstructiva para obtener una luz mayor del vaso (en lugar de comprimir la placa) mediante aterectomía coronaria direccional (ACD) resulta muy interesante. Sin embargo, el estudio CAVEAT-I329 dio como resultado una tasa más elevada de complicaciones tempranas, a un mayor coste y sin beneficios clínicos. El estudio CAVEAT-II330 comparó la ACD y la angioplastia con balón en injertos de vena safena (IVS), sin obtener diferencias en las tasas de reestenosis a los 6 meses. En los estudios BOAT331, CCAT332 y OARS333, la ACD no tuvo ningún impacto en los resultados clínicos en un período de 18 meses. En el estudio AMIGO334, algunos de los resultados negativos podrían tener su explicación en la existencia de marcadas diferencias entre los centros participantes. En el campo de la investigación histológica, la aterectomía es la única técnica percutánea que permite obtener tejido de las placas ateromatosas obstructivas o de lesiones reestenóticas de forma segura. (Recomendación de ACD para el tratamiento de lesiones de novo localizadas en el ostio coronario o en bifurcación, realizada por un equipo experto: IIb, C.)
4.5. Dispositivos de protección embólica
La mayoría de los pacientes tratados con una ICP están potencialmente expuestos a una embolización coronaria distal335, especialmente en los casos de intervención en IVS336. La ICP de las estenosis de novo en IVS debe ser considerada intervención de alto riesgo337,338. El análisis conjunto de 5 ensayos clínicos aleatorizados reveló que la utilización de inhibidores de la GP IIb/IIIa no mejora los resultados tras ICP en IVS339. El uso de stents recubiertos de una membrana de politetrafluoroetileno (PTFE) no redujo la tasa de eventos clínicos producidos por la embolización distal (STING340, RECOVERS341 y SYMBIOT-III).
El fenómeno de «no reflujo» se caracteriza por un flujo insuficiente a nivel tisular, a pesar de la dilatación/abertura completa de una arteria coronaria epicárdica. Estas zonas miocárdicas de «no reflujo» pueden estar causadas por alteraciones microvasculares, disfunción endotelial, edema miocárdico o por la embolización de residuos trombóticos o ateromatosos, y pueden resultar en un deterioro hemodinámico crítico342. Por esta razón, se están estudiando diferentes métodos para prevenir la embolización distal, utilizando dispositivos de filtros343 o de aspiración344 de las partículas embólicas.
4.5.1. Dispositivos de protección distal (filtro, bloqueo)
La utilización de un sistema de protección consistente en un balón de obstrucción distal y un catéter de aspiración (Guard-Wire) mejora significativamente el grado de perfusión miocárdica en la ICP del IVS345. Este tema fue investigado en el estudio SAFER en pacientes tratados con una ICP en el IVS346. El objetivo primario (muerte, IAM, bypass de urgencia o revascularización de la lesión diana [RLD] a los 30 días) se redujo significativamente, del 16,5 al 9,6%. Esta reducción relativa del 42% en los MACE se debe especialmente a la reducción de la incidencia del IAM (el 14,7 frente al 8,6%) y del fenómeno de «no reflujo» (el 9 frente al 3%)346. A diferencia del balón de oclusión, la protección distal con filtros incorporados a un catéter ofrece la ventaja inherente de permitir la perfusión anterógrada. El estudio FIRE fue un ensayo clínico aleatorizado, controlado, de «no inferioridad», en el que se compararon 2 dispositivos de protección distal diferentes en lesiones localizadas en el IVS347. La incidencia del objetivo combinado de muerte, IAM o RVD a los 30 días, ocurrió en el 9,9% de los pacientes tratados con el dispositivo FilterWire EX y en el 11,6% del grupo GuardWire. En el estudio CAPTIVE, el CardioShield no fue capaz de demostrar «no inferioridad» comparado con el GuardWire, en la reducción de los émbolos durante la ICP en el IVS. El TriActiv es otro sistema de protección distal que incorpora un mecanismo de succión y que, en el estudio PRIDE, no fue inferior al GuardWire y al FilterWire. Sin embargo, un número considerable de pacientes con estensosis en IVS presentan unas características anatómicas que no pueden ser abordadas con la tecnología de protección distal actual348 y, por tanto, son necesarios nuevos avances. (Recomendación para el uso de sistemas de protección distal en la ICP realizada en el IVS: I, A.)
Por otra parte, los resultados positivos obtenidos en los IVS no se corroboraron en la ICP primaria realizada en vasos nativos en pacientes con IAMEST. En el estudio EMERALD, el tamaño del infarto se redujo en el 17% del grupo de protección distal y en el 16% del grupo control349.
4.5.2. Dispositivos de protección proximal (succión, trombectomía)
Una de las limitaciones de la protección distal mediante un balón de oclusión o de filtro es la necesidad de cruzar la lesión sin lacerarla y buscar una «zona de despliegue» adecuada para el balón o el filtro. Posiblemente, sería más conveniente la utilización de dispositivos alternativos de succión instantánea y/o balones de oclusión proximal. La técnica más sencilla sería utilizar como «dispositivo de succión» el propio catéter guía. En un ensayo clínico aleatorizado, el dispositivo de succión AngioJet se comparó con una infusión de uroquinasa, en pacientes con trombo en el IVS documentado por angiografía (estudio VeGAS-2350); no se observaron diferencias en la incidencia del objetivo primario combinado de MACE. El AngioJet también fracasó en la reducción del tamaño del infarto en pacientes con IAMEST (estudio AiMI). El X-SIZER es otro dispositivo de succión que podría resultar útil en pacientes con infarto agudo de miocardio351,352. En el estudio aleatorizado X-TRACT, pacientes con IVS o arterias coronarias nativas con contenido trombótico fueron asignados a implantación de stents solamente o a implantación de stents con trombectomía previa mediante el dispositivo X-SIZER353. El IAM a los 30 días ocurrió en el 15,8% de los pacientes asignados al grupo de trombectomía (X-SIZER) frente al 16,6% del grupo control (no significativo). Un análisis de subgrupo indicó que la trombectomía mediante el X-SIZER puede reducir la extensión, pero no la incidencia de la necrosis miocárdica. No se observó una mejora de la supervivencia libre de eventos a corto y largo plazo mediante el uso rutinario de trombectomía con este dispositivo. La protección distal con un dispositivo de filtrado podría ser útil en las lesiones con alto potencial embólico354. (Recomendación para el uso de sistemas de protección distal y proximal en la ICP de lesiones con alta carga trombótica: IIb, C.)
Para el manejo urgente de las perforaciones coronarias, se recomienda el uso de stents recubiertos de PTFE («stents graft») sobre la base del consenso de expertos (clase de recomendación: I, C) (tabla 15)355.
En resumen, se ha demostrado que la braquiterapia intracoronaria es el único tratamiento no quirúrgico basado en la evidencia para la reestenosis intra-stent. Para prevenir la oclusión tardía del vaso, se recomienda la administración de clopidogrel durante un año tras la terapia de radiación.
Se recomienda el uso de la AR en lesiones fibróticas o severamente calcificadas, que no se pueden cruzar o dilatar adecuadamente mediante balón convencional, antes de la implantación programada de stents. Es preciso estar preparado para el manejo de las complicaciones inherentes a la AR.
La ICP en el IVS o la ICP primaria en el SCA con una alta carga trombótica presentan un riesgo elevado de embolización coronaria. Dos dispositivos de protección distal (GuardWire y FilterWire EX) han demostrado ser seguros y eficaces como mecanismos complementarios de la ICP en lesiones localizadas en el IV S.
El hecho de que los sistemas de balón de oclusión y aspiración o los catéteres de filtrado sean aplicables en otros contextos clínicos, como por ejemplo la ICP primaria en el IAMEST, precisará de más estudios aleatorizados con un objetivo primario clínico. Por el momento, no se pueden establecer recomendaciones definitivas en relación con el uso de dispositivos de protección embólica en los casos de IAMEST.
4.6. Tecnología diagnóstica complementaria
4.6.1. Ecografía intravascular
Mientras que la angiografía representa el perfil bidimensional de la luz vascular, el IVUS permite una valoración tomográfica del área vascular, del tamaño de la placa y de su distribución y composición. El IVUS es un valioso complemento de la angiografía, ampliando las posibilidades diagnósticas y terapéuticas, entre las que se incluye la implantación de stents en la enfermedad coronaria356-359. Aunque la cardiología ha realizado importantes progresos gracias al IVUS, ha resultado difícil documentar una traducción de su uso en términos de una reducción de los eventos clínicos adversos mayores durante el seguimiento. La realización sistemática de IVUS durante la implantación de stents no mejora los resultados clínicos a los 9 meses360.
4.6.2. Reserva fraccional de flujo
Aunque las técnicas de imagen de estrés no invasivas (con una sensibilidad del 76-88% y una especificidad del 80-88%) deben representar el método de referencia antes del cateterismo cardíaco, en la práctica diaria muchos pacientes llegan al laboratorio de hemodinámica sin pruebas funcionales previas. Siempre que sea posible, se deben realizar pruebas funcionales adecuadas antes del procedimiento. En caso de contraindicación a las pruebas de imagen de estrés no invasivas o cuando no se pueda excluir una isquemia inducida por el ejercicio en el territorio de perfusión de una arteria coronaria con estenosis intermedia, la reserva fraccional de flujo (RFF) puede ser de utilidad. Además, los cardiólogos intervencionistas normalmente prefieren no tratar las estenosis que no parecen hemodinámicamente significativas. Sin embargo, los estudios patológicos y el IVUS han demostrado que las estenosis coronarias difusas son complejas, especialmente tras la rotura de la placa, con formas distorsionadas que son difíciles de valorar mediante angiografía. Resulta muy difícil, incluso para cardiólogos intervencionistas experimentados, determinar con precisión la relevancia de la mayoría de las estenosis intermedias mediante una valoración visual o por medio de la angiografía coronaria cuantitativa361.
Una RFF < 0,75 es un parámetro muy específico y siempre representa una isquemia inducible (fig. 4). Una RFF > 0,80 excluye la isquemia en un 90%362. Dentro de esta ventana, pueden aparecer «falsos positivos» y «falsos negativos» (fig. 4). La RFF parece, pues, el método ideal para valorar las estenosis coronarias intermedias, siempre que no se disponga de pruebas anteriores o se hayan documentado signos de isquemia miocárdica. Los análisis retrospectivos sugieren que el aplazamiento de la angioplastia en pacientes con una RFF > 0,75 es seguro y ofrece resultados clínicos excelentes363,364. En el estudio DEFER365, se señaló la importancia de demostrar que una estenosis determinada «que va a ser dilatada» impide realmente el flujo máximo del miocardio: si la RFF era < 0,75, la ICP se realizó como estaba programado (grupo de referencia); si la RFF era ≥0,75, la ICP se aplazaba o se realizaba, de forma aleatorizada. La supervivencia libre de eventos fue similar en los 2 grupos, tanto en el grupo de ICP aplazadas como en el grupo de ICP realizadas (el 92 frente al 89% a los 12 meses y el 89 frente al 83% a los 24 meses). Por lo tanto, la medición de la RFF es una herramienta valiosa para identificar a los pacientes con estenosis limítrofes, para los que la ICP es un tratamiento adecuado, incluidos los pacientes con una reestenosis angiográfica intra-stent del 40-70%366.
Fig. 4. Toma de decisiones en el manejo de las estenosis coronarias de severidad intermedia (angiográfica) sin isquemia miocárdica documentada (ausencia de información que permita localizar la estenosis causante, como cambios en el electrocardiograma en reposo, nuevas alteraciones de la contractilidad miocárdica o pruebas de estrés previas). Los valores de la reserva fraccional de flujo (RFF) comprendidos entre 0,75 y 0,80 confirman la existencia de una «zona gris».
El concepto de «sellado de la placa»367,368 es decir, la implantación de stents en estenosis leves, también llamadas «no significativas», no se puede recomendar debido a que las tasas de MACE superan a los hipotéticos beneficios a largo plazo, al menos con stents no recubiertos369-371. Los primeros resultados del tratamiento con stents recubiertos de sirolimus en pacientes con estenosis de novo leves (definida como una estenosis de diámetro < 50%) indican que no ha sido necesario revascularizar ninguna de las lesiones tratadas en un seguimiento medio de 400 días372.
5. STENTS LIBERADORES DE FARMACOS
Los stents liberadores de fármacos (SLF) han sido el centro de atención de la cardiología intervencionista desde la presentación del estudio RAVEL en el congreso de la Sociedad Europea de Cardiología en septiembre de 2001373. Se han investigado diferentes fármacos que se liberan desde distintos modelos de stents, con o sin un polímero portador. En numerosos estudios se han evaluado los efectos de varias sustancias antiproliferativas y antiinflamatorias: sirolimus, paclitaxel y tacrolimus, everolimus, ABT-578, biolimus y QP2, dexametasona, estradiol 17-ß, batimastat, actinomicina-D, metotrexato, angiopeptina, inhibidores de la tirosincinasa, vincristina, mitomicina, ciclosporina y también Resten-NG y AVI-4126. También se han propuesto las estatinas, el carvedilol, el abciximab y el trapidil. La aplicación intracoronaria por medio de SLF de muchas de estas sustancias fue abandonada a pesar de que los primeros resultados experimentales y clínicos parecían esperanzadores, pero algunos efectos clínicos fueron perjudiciales (QP2 en el estudio SCORE374,375, actinomicina-D en el estudio ACTION376) o demasiado débiles (dexametasona en el estudio STRIDE377; incluso los stents cargados de una dosis alta de dexametasona no consiguieron reducir significativamente la proliferación de la neoíntima378). Los resultados de estos estudios indican que no todos los fármacos antiproliferativos muestran un efecto de clase uniforme en la prevención de la reestenosis.
Los objetivos primarios de los estudios aleatorizados sobre los SLF fueron angiográficos (como la pérdida luminal tardía [PLT]) o clínicos (como la RVD). Para los pacientes, la evolución clínica es más importante que los parámetros angiográficos. Como el poder estadístico de un estudio aleatorizado sólo es válido para su objetivo primario, nos limitaremos a los ensayos clínicos aleatorizados sobre los SLF con un objetivo primario clínico379. Hasta el momento, sólo se han publicado 4 estudios aleatorizados con un objetivo primario clínico con un intervalo de tiempo adecuado (tabla 16). El paclitaxel, sin un polímero portador, no alcanzó el objetivo primario a pesar de los resultados angiográficos positivos en el estudio DELIVER-I380. Por el contrario, en los estudios TAXUS-IV381 y TAXUS-VI382, el paclitaxel liberado por un polímero portador mejoró significativamente los resultados clínicos (tabla 16). Por lo tanto, no todos los stents liberadores de paclitaxel son iguales383,384. El sirolimus sólo ha sido probado clínicamente liberado por un polímero portador, como en el estudio SIRIUS385 (tabla 16). Aunque la materialización del sueño de la «reestenosis del 0%»386 está más allá de lo posible, los SLF reducen a números de una sola cifra las tasas de reestenosis angiográfica y clínica a los 9 meses (tabla 16). En pacientes del «mundo real» (registro RESEARCH387), el riesgo de RVD al año por necesidad clínica con el stent recubierto de sirolimus fue del 3,7%. En un registro sueco, la supervivencia libre de MACE a los 6-9 meses fue del 95,6%388. En las lesiones de la arteria descendente anterior, las tasas de revascularización del stent recubierto de sirolimus son comparables a las tasas históricas de revascularización de la cirugía de bypass de un solo vaso al año389. Los primeros resultados de la comparación prospectiva y aleatorizada de los stents Cypher y Taxus (estudio TAXi390) confirmaron que las altas tasas de éxito obtenidas con ambos stents en los grandes estudios aleatorizados se pueden repetir en la práctica clínica de rutina. En este pequeño estudio (202 pacientes) no se pudo demostrar ninguna ventaja de un stent sobre otro.
5.1. Tamaño del vaso, lesiones largas, diabetes
En la tabla 17 aparecen los efectos del stent Cypher en el estudio SIRIUS y del Taxus en el estudio TAXUS-IV, tras el análisis de subgrupos en el que se clasifica el tamaño del vaso en 3 categorías (terciles).
En el estudio TAXUS-VI, la RLD se redujo significativamente en los vasos pequeños (< 2,5 mm), del 29,7 al 5,0%382. Un análisis de un subgrupo del registro RESEARCH sobre 112 lesiones en 91 pacientes tratados con stents Cypher de 2,25-mm (diámetro de referencia = 1,88 ± 0,34 mm) informó de una pérdida tardía de 0,07 ± 0,48 mm y de una tasa de reestenosis del 10,7%391.
La diabetes mellitus es otro factor de riesgo conocido para la reestenosis tras la implantación de stents392. En el análisis de todos los pacientes con diabetes mellitus, la repetición de la revascularización y la RLD pudieron reducirse significativamente en los estudios SIRIUS y TAXUS-IV (tabla 18).
Aunque los resultados del análisis de subgrupos del estudio SIRIUS son prometedores, se mantiene una tendencia de mayor frecuencia de necesidad de repetición de la intervención en los pacientes diabéticos comparados con los no diabéticos, especialmente en los dependientes de insulina393. En los pacientes diabéticos con estenosis largas incluidos en el estudio TAXUS-VI, la RLD se redujo significativamente, del 22,0 al 2,6%382.
5.2. Trombosis en stents liberadores de fármacos
No se ha detectado la trombosis del stent como un problema relevante en los estudios aleatorizados cuando se ha administrado clopidogrel además de AAS durante intervalos diferentes: durante 2 meses en el estudio E-SIRIUS394, durante 3 meses en el SIRIUS y durante 6 meses en la serie TAXUS. La tasa de trombosis en el stent del estudio DELIVER-I después de 1 año fue del 0,4% en ambos grupos; en el SIRIUS, después de 9 meses, fue del 0,4% en el grupo de SLF y de 0,8% en el grupo control. En el estudio E-SIRIUS, los 2 casos de trombosis subaguda del stent (1,1%), con subsiguiente IAM, ocurrieron en el grupo de sirolimus, mientras que en el grupo control no hubo ninguna incidencia de trombosis subaguda o tardía. En el TAXUS-IV, la trombosis del stent a los 9 meses ocurrió en el 0,6% del grupo de SLF y en el 0,8% del grupo control. En el estudio TAXUS-VI (más del 50% de lesiones complejas), la trombosis del stent a los 300 días ocurrió en el 1,3% del grupo control y en el 0,5% del grupo de SLF382. Entre los días 31 y 300 no hubo ninguna incidencia de trombosis del stent en ninguno de los 2 grupos382.
Por otra parte, conviene recordar que para la cicatrización completa del SLF pueden ser necesarios hasta 2 años. Los registros son importantes porque permiten comprobar si los resultados de los estudios aleatorizados son aplicables a la práctica diaria. La interrupción prematura de las tienopiridinas estuvo claramente asociada al desarrollo de la trombosis del stent395. (Recomendación para la administración de clopidogrel durante 6-12 meses tras la implantación de un SLF: I, C.)
En los pacientes en los que se prevean dificultades para la administración prolongada de clopidogrel (p. ej., pacientes programados para cirugía extracardíaca mayor396), se debe considerar con atención la implantación de SLF. En estos casos, los stents convencionales pueden ser una opción más segura.
5.3. Indicaciones para la implantación de stents liberadores de fármacos (SLF)
Los temores frente a las repercusiones médico-legales del tratamiento con SLF (indicación/no indicación de SLF) no tienen fundamento y es poco probable que se materialicen397; en ningún caso se indicará el tratamiento con SLF para evitar posibles litigios397.
Existen dos planteamientos diferentes para establecer recomendaciones en cuanto al uso de SLF: uno se basa en cálculos de coste-efectividad398 y el otro, en los criterios de inclusión/exclusión de los ensayos clínicos aleatorizados más importantes.
De acuerdo con los niveles de evidencia, sólo los stents Cypher y Taxus pueden ser recomendados en el grado I B, en base a los criterios de inclusión/exclusión de los estudios SIRIUS, TAXUS-IV y TAXUS-VI (tabla 19).
El Instituto NICE del Reino Unido (UK NHS NICE Institute)399 recomienda el uso de SLF Cypher (sirolimus) o Taxus (paclitaxel) para la ICP en pacientes con cardiopatía isquémica sintomática cuando el calibre de la arteria a tratar sea < 3 mm (diámetro interno) o la longitud de la estenosis sea > 15 mm. Esta recomendación no es aplicable a los pacientes que hayan sufrido un IAM en las 24 h precedentes o en los que existe evidencia angiográfica de trombos en la arteria a tratar399. No obstante, los SLF se han utilizado en la angina inestable y en el IAM400.
Las siguientes aplicaciones, especialmente cuando existe un mayor riesgo de reestenosis401-403, requieren la realización de futuras evaluaciones basadas en la evidencia (recomendación actual: IIa, C):
* Vasos peque&ntild e;os.
* Oclusiones crónicas totales.
* Estenosis en el ostio coronario/en bifurcación.
* Estenosis del bypass.
* Diabetes mellitus insulinodependiente.
* Enfermedad multivaso.
* Estenosis de tronco común izquierdo no protegida.
* Reestenosis intra-stent.
Aunque por el momento no se han realizado ensayos aleatorizados, la implantación directa (sin predilatación) parece segura y eficaz con los stents Cypher y Taxus404.
Se podría lograr una reducción importante de los costes de los cuidados médicos si se demuestra que los SLF reducen significativamente la necesidad de cirugía de bypass aortocoronario, especialmente en los pacientes con enfermedad multivaso y/o diabetes mellitus.
En resumen, sólo 2 SLF han demostrado efectos positivos significativos en estudios prospectivos y aleatorizados, con objetivos primarios clínicos y con un intervalo adecuado: el stent Cypher (sirolimus) y el stent Taxus (paclitaxel). Las recomendaciones basadas en la evidencia para el uso de SLF se deben elaborar de acuerdo con los criterios de inclusión/exclusión de los estudios SIRIUS, TAXUS-IV y TAXUS-VI. En estos estudios, las tasas de RVD se mantuvieron por debajo del 10%. Los resultados de los análisis de subgrupo, relativos a vasos pequeños y a pacientes con diabetes, son esperanzadores. Aunque los datos de los registros sobre la reestenosis intra-stent y también de lesiones con alto riesgo de reestenosis intra-stent (estenosis en ostio coronario/bifurcación, oclusiones crónicas totales, enfermedad multivaso, estenosis del bypass y estenosis del tronco común izquierdo no protegida son prometedores), hacen falta más estudios aleatorizados que ofrezcan un grado mayor de evidencia en estos subgrupos de pacientes. En la actualidad, consideramos impresicindible el tratamiento prolongado con clopidogrel (al menos 6 meses, además de AAS) para evitar la trombosis tardía del stent. Por ello, no se recomienda la implantación de SLF en pacientes en los que se prevea una cirugía extracardíaca mayor, programada o urgente. Para estos pacientes, los stents convencionales son, posiblemente, una opción más segura. Tanto los médicos como los pacientes deben recordar que el clopidogrel no debe ser interrumpido de forma prematura, ni tan siquiera para intervenciones menores, como prodecimientos dentales.
Los comentarios-anotaciones (*) incluidos en esta traducción de las Guías han sido realizados por el Dr. Francisco Fernández-Avilés (Valladolid, España).
*Correspondencia. Coordinador: Prof. Sigmund Silber, MD, FACC, FESC, Kardiologische Praxis und Praxisklinik, Am Isarkanal 36, 81379 München, Alemania. Tel.: +49 89 742 15130; fax: +49 89 742 151 31.
Correo electrónico: sigmund@silber.com