La hiperglucemia es habitual en los supervivientes de una parada cardiaca extrahospitalaria (PCEH). Se relaciona con un aumento de la mortalidad y con peor pronóstico neurológico. Las directrices actuales recomiendan su tratamiento1, pero no hay ensayos clínicos aleatorizados en los que se haya evaluado cuál es la glucemia óptima en esta población.
Para determinar si el control hospitalario de la glucemia se relaciona con el pronóstico neurológico a los 6 meses, se realizó un estudio observacional con una cohorte de superviviente de una PCEH ingresados en la unidad de cuidados cardiológicos agudos del centro entre mayo del 2019 y abril del 2021. El estudio fue aprobado por el comité de ética y todos los pacientes/familiares firmaron el consentimiento informado. El criterio de inclusión fue ingresar a causa de una PCEH y permanecer comatoso tras el retorno de la circulación espontánea (RCE). Los criterios de exclusión fueron la negativa a firmar el consentimiento informado y la pérdida de seguimiento. Como parte del tratamiento hospitalario habitual, se aplicó un protocolo de tratamiento con inyección de insulina en bolo basal, por vía intravenosa o subcutánea, a todos los pacientes a criterio del médico responsable del tratamiento. Se realizaron análisis de diagnóstico inmediato de la glucemia antes del desayuno, la comida y la cena, y a medianoche en el tratamiento con inyección de insulina en bolo basal o cada hora en el tratamiento por vía intravenosa. La dosis de insulina se modificó con el objetivo de mantener la glucemia entre 100 y 180mg/dl durante toda la estancia hospitalaria. En cada paciente, los valores analizados fueron: la primera glucemia al ingreso, la glucemia media durante la hospitalización, la glucemia media de la mañana, de la tarde y de la noche, la glucemia máxima y el porcentaje de valores de glucemia dentro del objetivo 100-180 mg/dl. No se pudo obtener información sobre las dosis de insulina administradas.
La evaluación de la evolución neurológica fue estructurada, multimodal y multidisciplinar. En aquellos pacientes con muy mal pronóstico de recuperación neurológica la retirada del tratamiento de soporte vital se consensuóentre todo el equipo. Para la valoración del pronóstico neurológico a los 6 meses se usó la clasificacióncerebral performance category, CPC. Se dividió a los pacientes en dos grupos: pronóstico neurológico «bueno» (CPC 1-2) o pronóstico neurológico «malo» (CPC 3-5). Los pacientes que fallecieron se incluyeron en este último grupo.
Se aplicó el análisis univariante entre los dos grupos, seguido de un modelo de regresión logística gradual para determinar las covariables asociadas de forma independiente con el pronóstico neurológico.
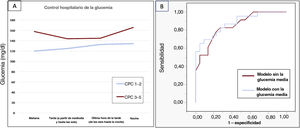
Tras un registro de cribado inicial de 50 pacientes, se incluyó a 45 en el análisis final (tres se perdieron durante el seguimiento y dos no firmaron el consentimiento informado). La media de edad fue de 60,1 años [intervalo intercuartílico: 50,9-70,6], la mayoría eran hombres (86,7%). En 22 pacientes (48,9%) el pronóstico neurológico fue bueno (CPC 1-2). La mortalidad a los 6 meses fue del 46,7%. La mayor parte de los decesos (85,7%) tuvieron lugar durante la hospitalización y fueron consecuencia de una lesión neurológica o de la retirada del tratamiento de soporte vital. Las características demográficas y clínicas fueron similares en ambos grupos: en el 76% se constató un primer ritmo desfibrilable y en el 58% la causa fue un síndrome coronario agudo. Todos los pacientes requirieron ventilación mecánica invasiva y recibieron tratamiento con control activo de la temperatura central, conforme a las directrices actuales1. La mayoría (89%) requirieron vasopresores e inotrópicos. Los valores de glucemia, lactato, y de las escalas APACHE-II y SOFA fueron mayores en los pacientes con CPC 3-5 (tabla 1). Durante la hospitalización se obtuvo un total de 3.190 determinaciones de glucemia. Los pacientes con buen pronóstico neurológico tuvieron una menor glucemia media durante la hospitalización (130 mg/dl [124-138] frente a 166 mg/dl [131-187], p <0,01), menor glucemia media en todos los intervalos de tiempo (figura 1) y mayor porcentaje de controles glucémicos dentro del objetivo 100-180mg/dl (83,8% frente al 64,8%; p <0,01). Además, la glucemia máxima fue menor en los pacientes con buen pronóstico neurológico (218 [180-259] frente a 278 [232-242]; p <0,01). Como era de esperar, la glucemia media durante la hospitalización fue inferior en los sujetos sin diabetes (132 [124-138] frente a 185 [130-217]; p <0,01). No obstante, no se observó ninguna interacción entre las variables del control glucémico y la situación de diabetes en relación al pronóstico neurológico. En el análisis de regresión logística, solo la glucemia durante la hospitalización (odds ratio: 1,03; intervalo de confianza del 95%: 1,006-1,07) y la escala APACHE-II (odds ratio, 1,34; intervalo de confianza del 95%: 1,10-1,64) se asociaron de forma independiente con el pronóstico neurológico (área bajo la curva del modelo 0,879, p<0,01).
Características demográficas y clínicas iniciales
| CPC 1-2 (n=22) | CPC 3-5 (n=23) | p | |
|---|---|---|---|
| Edad, años | 57,3 [49,5-62,7] | 65,2 [54,9-79,9] | 0,02 |
| Sexo masculino | 19 (42,2) | 20 (44,4) | 0,95 |
| Sexo femenino | 3 (6,7) | 3 (6,7) | |
| Duración de la estancia en la UCCA (días) | 8 [6-11,5] | 8 [4-11] | 0,43 |
| Duración de la estancia hospitalaria (días) | 32 [20,5-50] | 44 [23-86] | 0,20 |
| Tiempo transcurrido entre el ingreso y la muerte (días)* | - | 36 [22-54,25] | - |
| Glucemia al ingreso (mg/dl) | 202,1 (126,4-277,8) | 285,9 (167,1-404,7) | <0,01 |
| Porcentaje de HbA1c | 5,5 (5,2-5-7) | 5,6 (5,5-6,1) | 0,09 |
| Troponina máxima (ng/l) | 10.049,5 (3.024,8-50.520,5) | 22.187 (4.013-83.896) | 0,38 |
| Lactato máximo (mg/dl) | 45,5 (30,8-68,5) | 70 (39-92) | 0,03 |
| IMC (kg/m2) | 26,5 (24,7-28,8) | 26,3 (24,7-28,3) | 0,96 |
| Hipertensión | 8 (36,4) | 14 (60,9) | 0,11 |
| Dislipidemia | 9 (40,9) | 14 (60,9) | 0,18 |
| Diabetes | 3 (13,6) | 6 (26,1) | 0,29 |
| EPOC | 2 (9,1) | 6 (12,8) | 0,10 |
| Ictus | 0 | 0 | - |
| ERC | 1 (4,6) | 2 (8,7) | 0,58 |
| EHC | 2 (9,1) | 0 | 0,14 |
| Neoplasia | 1 (4,6) | 1 (4,4) | 0,97 |
| EVP | 0 | 4 (17,4) | 0,04 |
| Consumo de tabaco | 11 (50) | 6 (26,9) | 0,10 |
| Etanol | 3 (13,6) | 3 (13) | 0,95 |
| Síndrome coronario crónico | 3 (13,6) | 3 (13) | 0,95 |
| Otras miocardiopatías | 4 (18,2) | 6 (26,1) | 0,52 |
| NYHA 1-2 | 21 (95,5) | 22 (95,6) | 0,91 |
| NYHA 3-4 | 1 (4,5) | 1 (4,4) | |
| Ritmo desfibrilable | 18 (81,8) | 16 (69,6) | 0,34 |
| RCE (minutos) | 19,5 [11-37,5] | 30 [24-38] | 0,06 |
| Dosis prehospitalaria de adrenalina (mg) | 1 (0,4-1,6) | 2 (1,5-2,5) | 0,49 |
| Síndrome coronario agudo | 12 (54) | 14 (60) | 0,67 |
| Revascularización | 14 (64) | 14 (61) | 0,17 |
| Fracción de eyección (%) | 45 [33,8-55] | 45 [35-55] | 0,55 |
| Escala SOFA | 9 [6,5-11] | 11 [8-12] | 0,08 |
| Escala APACHE-II | 19 [17-22,3] | 26 [22-30] | <0,01 |
Escala APACHE-II; sistema de clasificación II de fisiología aguda y enfermedad crónica; CPC: categoría desempeño cerebral; DE: desviación estándar; EHC: enfermedad hepática crónica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; EVP: enfermedad vascular periférica; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; NYHA: clasificación funcional de la New York Heart Association; RCE: retorno de la circulación espontánea; SOFA: escala de evaluación de la insuficiencia orgánica secuencial; UCCA: unidad cuidados cardiológicos agudos.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
A: control hospitalario de la glucemia basado en el pronóstico neurológico a los 6 meses. B: comparación del modelo de regresión con curvas de característica operativa del receptor (ROC) para el pronóstico neurológico. La adición de la glucemia media en el modelo mejoró el área bajo la curva de 0,848 (curva roja) a 0,879 (curva azul). CPC: categoría de desempeño cerebral.
En este estudio observacional de supervivientes de una PCEH que permanecen en estado comatoso, unos valores promedio de la glucemia durante la hospitalización inferiores, se relacionaron con un mejor pronóstico neurológico a los 6 meses, independientemente de la situación de diabetes. En estudios previos se hallaron resultados similares. En un análisis multicéntrico2 se objetivo que, en los supervivientes de una PCEH, una glucemia de entre 70 y 140mg/dl se relacionaba con una menor mortalidad hospitalaria. Como en los resultados del presente estudio, estos datos indican que los supervivientes de una PCEH podrían beneficiarse de objetivos de glucemia inferiores durante la hospitalización. No obstante, las últimas directrices ILCOR (International Liasion Committee on Resuscitation) recomiendan un objetivo de glucemia de 140-180mg/dl y evitar la hipoglucemia1, ya que el control riguroso de la glucemia y la hipoglucemia también se han relacionado con mal pronóstico neurológico3. En consecuencia, en los pacientes con PCEH, se ha sugerido una relación en forma de U entre la glucemia y el pronóstico neurológico, aunque aún no se ha determinado el intervalo óptimo.
Los pacientes con diabetes incluidos en este estudio presentaban mayores cifras de glucemia y un menor porcentaje de valores dentro del objetivo predeterminado durante la hospitalización, pero la situación de diabetes no se relacionó de forma independiente con el pronóstico neurológico. En algunos estudios se ha observado un peor pronóstico neurológico en los sujetos con diabetes tras sufrir una PCEH4. En la cohorte del presente estudio, el control previo de la glucemia en los pacientes con diabetes (20%) fue bueno (HbA1c promedio: 6,4%), lo que explicaría que no hubiera diferencias en el pronóstico.
La eficacia de la escala APACHE-II para predecir el pronóstico neurológico tras sufrir una PCEH es controvertida, lo cual podría estar relacionado con el momento de su medición5. En el presente estudio, la APACHE-II se determinó en el período de 24horas posterior a la RCE y se constató una asociación muy fuerte con el pronóstico neurológico y buena capacidad de discriminación: un valor en la escala APACHE-II de 23 tenía una sensibilidad del 73,9% y una especificidad del 77,3% en la predicción de un mal pronóstico neurológico.
La principal limitación de este estudio es su naturaleza observacional, que implica la presencia de factores de confusión, y solo permite mostrar asociaciones pero no causalidad. Además, las determinaciones de la glucemia se hicieron como parte de los cuidados habituales de los pacientes y no de manera estandarizada para el estudio. No obstante, el estudio es generador de hipótesis y podría ser de ayuda en el diseño de futuros trabajos con pacientes tras una PCEH en los que se investigue el objetivo óptimo de glucemia durante la hospitalización para mejorar el pronóstico neurológico.
En conclusión, en supervivientes de una PCEH, una menor glucemia durante la hospitalización se relacionó de manera independiente con un mejor pronóstico neurológico a los 6 meses. La glucemia óptima en esta población está aún por definir. La escala APACHE-II también mostró una buena capacidad para predecir el pronóstico neurológico tras la RCE.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESJ.C. Valerio-Rojas: redacción del artículo, obtención, análisis e interpretación de los datos. M. Izquierdo: inclusión de pacientes, obtención, análisis e interpretación de los datos, revisión crítica del artículo por contenido intelectual importante. O. de Diego: inclusión de pacientes, obtención, análisis e interpretación de los datos, revisión crítica del artículo por contenido intelectual importante. E. Ortega: redacción del artículo, obtención, análisis e interpretación de los datos. I. Conget: análisis e interpretación de los datos, revisión crítica del artículo por contenido intelectual importante. R. Andrea: diseño y planificación del artículo, inclusión de pacientes, obtención, análisis e interpretación de los datos, redacción y presentación del artículo.
CONFLICTO DE INTERESESLos autores no tienen ningún conflicto de intereses que declarar directamente relacionado con el asunto de este artículo.