Analizar mediante resonancia magnética cardiaca los factores que determinan la magnitud del miocardio salvado tras infarto de miocardio y su valor predictivo del remodelado adverso ventricular.
MétodosA 118 pacientes con un primer infarto de miocardio con elevación del ST (angioplastia primaria, 65 pacientes; estrategia farmacoinvasiva, 53 pacientes) se les realizó resonancia magnética (6 [5-8] días y 6 meses; n=83). Se cuantificó el índice de miocardio salvado como el porcentaje de área en riesgo (secuencias ponderadas en T2) que no muestra realce tardío.
ResultadosEl índice de miocardio salvado > 31% (mediana) se asocia a menor tiempo dolor-reperfusión (153 frente a 258 min), menor frecuencia de diabetes (el 12 frente al 32%), menor retraso hasta la resonancia magnética y mejores parámetros cardiovasculares (p<0,05 para todos ellos). No existen diferencias según el tipo de reperfusión. Mediante regresión logística, los predictores de índice de miocardio salvado > 31% son el retraso hasta la reperfusión (odds ratio = 0,42 [0,29-0,63]; p<0,0001), diabetes (odds ratio=0,32 [0,11-0,99]; p<0,05) y el retraso hasta la resonancia magnética (odds ratio=0,86 [0,76-0,97]; p<0,05). Los predictores de volumen telesistólico dilatado al sexto mes son el número de segmentos con necrosis > 50% (odds ratio=1,51 [1,21-1,90]; p<0,0001) y el volumen telesistólico en la primera semana (odds ratio=1,12 [1,06-1,18]; p<0,0001).
ConclusionesLa resonancia magnética permite cuantificar el miocardio salvado tras el infarto. La rapidez en recibir el tratamiento de reperfusión constituye su principal predictor. Se debe confirmar la posible relación entre el retraso en la realización de la resonancia magnética y el miocardio salvado. El miocardio salvado no mejora el valor de la resonancia para predecir remodelado adverso.
Palabras clave
La resonancia magnética cardiaca (RMC) es una herramienta de valor establecido para la caracterización de la necrosis tras un infarto1. En fases precoces, además, tanto la isquemia aguda como la reperfusión conducen a la formación de un edema miocárdico detectable mediante secuencias ponderadas en T22. Se ha demostrado en estudios histológicos que el área del edema es comparable con el área de miocardio en riesgo tras una oclusión coronaria experimental3. Así, se puede cuantificar la diferencia entre esta y el área de realce tardío de gadolinio (área de la necrosis), y se denomina miocardio salvado4, que es la razón de ser de toda estrategia de reperfusión tras un infarto. La RMC es una técnica única porque permite su cuantificación retrospectivamente al persistir el edema temporalmente tras el evento agudo5.
El retraso de la reperfusión ejerce una influencia lógica en la magnitud del miocardio salvado, aunque la literatura médica no es concluyente respecto a la importancia y los límites de esta influencia6, 7. Por lo tanto, el objetivo principal de este trabajo es analizar mediante RMC los factores que determinan la magnitud del miocardio salvado en pacientes tras un infarto agudo de miocardio con elevación del ST (IAMCEST) reperfundido. El objetivo secundario es valorar la influencia del miocardio salvado en el remodelado del ventrículo izquierdo (VI), precoz y a los 6 meses, y su valor predictivo adicional respecto a los demás parámetros de la RMC.
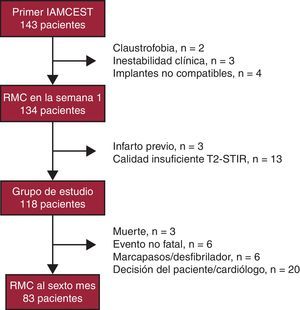
MétodosGrupo de estudioSe ha incluido prospectivamente, desde febrero de 2008 a agosto de 2010, a los pacientes consecutivos ingresados en un hospital terciario con un primer IAMCEST tratados con intervención coronaria percutánea (ICP) primaria o estrategia farmacoinvasiva (trombolisis en las primeras 12 h desde el inicio de los síntomas, y sistemáticamente ICP al menos 3 h después; se revasculaba a aquellos con lesiones residuales severas)8 y evaluados con RMC antes del alta hospitalaria y a los 6 meses de evolución. Los criterios de exclusión se muestran en la Figura 1.
Figura 1. Diagrama de flujo de los pacientes incluidos en el estudio. IAMCEST: infarto agudo de miocardio con elevación del ST; RMC: resonancia magnética cardiaca. STIR: short tau inversion recovery.
Se han recogido las variables clinicobiológicas principales, los factores de riesgo, la clase Killip al ingreso, el porcentaje de resolución del segmento ST a los 90 min tras la reperfusión y los valores máximos de troponina I (ng/ml). Asimismo se han registrado los tiempos desde el inicio del dolor hasta la reperfusión, desde el inicio del dolor hasta llegar a urgencias y desde urgencias hasta la reperfusión. Se ha administrado tratamiento médico a criterio del cardiólogo clínico. Un observador experto determinaba el flujo Thrombolisis in Myocardial Infarction (TIMI) antes y después de la ICP utilizando un software estándar (Integris HM3000, Philips; Best, Países Bajos).
El comité ético local aprobó el protocolo. Se obtuvo de todos los pacientes el consentimiento informado por escrito.
Resonancia magnética cardiacaDe manera protocolizada2, 9, se realizó RMC (equipo de 1,5 T Magnetom Sonata®,, Siemens; Erlangen, Alemania) antes del alta hospitalaria y a los 6 meses de evolución. Todas las imágenes se adquirieron mediante una antena de superficie corporal acoplada en fase durante apneas repetidas y utilizando sincronización electrocardiográfica.
Las imágenes de cine se adquirieron en proyecciones de 2, 3, 4 cámaras y eje corto desde la válvula mitral hasta el ápex, utilizando secuencias de precesión libre en estado estacionario.
Para la detección del área en riesgo, se utilizaron secuencias segmentadas T2-STIR (short tau inversion recovery) turbo-spin echo de recuperación de la inversión, adquiriendo imágenes en idénticas proyecciones que los cines, en mesodiástole.
La detección de la necrosis miocárdica se llevó a cabo al menos 10 min tras la administración de 0,1 mmol/kg de gadolinio (gadopentetato de dimeglumina; Magnevist®) en proyecciones idénticas a los cines, utilizando secuencias segmentadas de recuperación de la inversión y anulando la señal del miocardio sano.
Análisis de las imágenes de resonancia magnética cardiacaAnalizaron los estudios dos observadores experimentados que desconocían los datos clínicos de los pacientes mediante el software QMASS MR 6.1.5 (Medis; Leiden, Países Bajos).
Se cuantificaron los volúmenes del VI (ml/m2), la fracción de eyección del VI por el método de Simpson (%) y la masa del VI (g/m2) mediante definición manual de los bordes endocárdicos y epicárdicos en todos los cines de eje corto. Se aplicó el modelo de 17 segmentos10.
Se cuantificó el área de miocardio en riesgo en las imágenes T2-STIR como aquella con una intensidad de la señal ≥ 2 desviaciones estándar por encima de la señal del miocardio remoto no infartado (% masa del VI). Se consideró que había hemorragia intramiocárdica ante el hallazgo de un área de baja intensidad de señal rodeada por un área hiperintensa11.
Se cuantificó el área de la necrosis en las secuencias de realce tardío como aquella cuya intensidad de la señal es ≥ 2 desviaciones estándar por encima de la señal del miocardio remoto no infartado (% masa del VI). Asimismo se cuantificó en número de segmentos con un porcentaje de transmuralidad > 50%. Se definió obstrucción microvascular como áreas con ausencia de señal localizadas dentro de un área con realce de señal8.
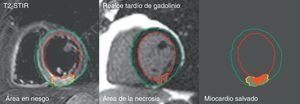
Los operadores revisaron todas las medidas y las corrigieron manualmente en caso necesario. Se definió miocardio salvado como la diferencia entre el área en riesgo y el área de la necrosis, expresada como % masa del VI o porcentaje de área en riesgo (índice de miocardio salvado [IMS]) (Figura 2).
Figura 2. Representación del área en riesgo a partir de las imágenes potenciadas en T2-STIR, área de la necrosis a partir de las imágenes de realce tardío de gadolinio y miocardio salvado resultante a partir de la diferencia entre ambas. STIR: short tau inversion recovery.
A los 6 meses tras el IAMCEST se repitió la RMC y se reevaluaron todos los índices.
Se analizó la reproducibilidad de las medidas en un subgrupo de 20 pacientes, y es > 95% para todas las variables de la RMC. Concretamente, la cuantificación del área en riesgo en las secuencias T2 muestra acuerdo entre observadores —coeficiente de correlación intraclase, 0,96 (intervalo de confianza del 95% [IC95%], 0,91-0,99)— e intraobservador, 0,98 (IC95%, 0,95-0,99).
Análisis estadísticoSe ha empleado el test de Kolmogorov-Smirnov para valorar la normalidad de la distribución de las variables. En consecuencia, los datos se expresan como media ± desviación estándar o mediana [percentiles 25-75] y se han utilizado tests paramétricos o no paramétricos para el análisis univariable según el caso.
No se conoce la cantidad mínima de miocardio que hay que salvar para conseguir una mejoría pronóstica significativa. Por ello, con un interés práctico y utilizando la división de los resultados de IMS en cuartiles, hemos hecho una curva ROC (receiver operating characteristic) para calcular qué tiempo desde el inicio del dolor hasta la reperfusión no hay que superar para conseguir al menos un IMS > percentil 25%.
Mediante regresión logística multivariable, se han analizado los predictores independientes de IMS > mediana, así como de remodelado adverso del VI. Se han retenido en el modelo las variables clínicamente importantes con p < 0,10. Se ha considerado significativo un valor de p < 0,05.
Se ha utilizado el software SPSS V.17,0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
ResultadosSe realizó RMC en la primera semana a 134 pacientes. Se excluyó a 3 por infarto previo y a 13 por mala calidad de las imágenes T2-STIR (Figura 1), por lo que el grupo final es de 118 pacientes. A 65 pacientes se aplicó ICP primaria (55%) y a 53, estrategia farmacoinvasiva (45%).
A los 6 meses (181 ± 11 días) se repitió la RMC en 83 pacientes (70%).
Los valores medios de miocardio salvado y de IMS son 9,8 ± 8,1 y 35 ± 23.
Las características clínicas y angiográficas del grupo total y de los subgrupos con IMS > mediana e IMS ≤ mediana (31%) se muestran en la Tabla 1. La prevalencia de diabetes es mayor en los pacientes con menos IMS. No existen otras diferencias significativas en las características basales ni en el tratamiento médico recibido. Tampoco se han encontrado diferencias en la magnitud de IMS según la estrategia de reperfusión inicial (ICP primaria, 36 ± 23% frente a farmacoinvasiva, 35 ± 23%; p=0,9). La presencia de un menor grado de IMS se asocia a peor clase Killip, mayor troponina I máxima y menor porcentaje de resolución del segmento ST.
Tabla 1. Características de los pacientes agrupados según la mediana del índice de miocardio salvado
| Grupo total | IMS > mediana (31%) | IMS ≤ mediana (31%) | p | |
| Pacientes | 118 | 59 | 59 | |
| Edad (años) | 59 ± 13 | 60 ± 12 | 58 ± 13 | 0,5000 |
| Varones | 89 (75) | 43 (73) | 46 (76) | 0,4000 |
| Superficie corporal (m2) | 1,8 ± 0,4 | 1,8 ± 0,5 | 1,9 ± 0,2 | 0,1000 |
| Diabetes | 22 (19) | 7 (12) | 15 (32) | < 0,0500 |
| Hipertensión | 68 (58) | 33 (51) | 35 (66) | 0,1000 |
| Dislipemia | 52 (44) | 28 (48) | 24 (41) | 0,6000 |
| Fumadores | 64 (54) | 29 (49) | 35 (59) | 0,4000 |
| Número de factores de riesgo | 1,9 ± 0,9 | 1,7 ± 0,8 | 2 ± 1 | 0,1000 |
| Antecedentes de intervención coronaria | 7 (6) | 4 (6,8) | 3 (5,2) | 0,5000 |
| Creatinina (mg/dl) | 1 ± 0,4 | 1 ± 0,3 | 1 ± 0,6 | 0,7000 |
| Troponina I máxima (ng/ml) | 83 ± 90 | 60 ± 48 | 107 ± 114 | < 0,0100 |
| Tiempo dolor-reperfusión (min) | 180 [139-300] | 153 [113-184] | 258 [180-420] | < 0,0001 |
| Tiempo dolor-puerta de urgencias (min) | 111 [71-158] | 90 [60-120] | 120 [90-300] | < 0,0001 |
| Tiempo puerta de urgencias-revascularización (min) | 60 [32-110] | 51 [30-80] | 74 [46-128] | < 0,0100 |
| Retraso RMC (días) | 6 [5-8] | 6 [5-7] | 7 [5-9] | < 0,0500 |
| Clase Killip | ||||
| I | 103 (88) | 57 (97) | 46 (79) | < 0,0500 |
| II | 12 (9) | 2 (3) | 10 (16) | |
| III | 2 (2) | 0 | 2 (3) | |
| IV | 1 (1) | 0 | 1 (2) | |
| Vaso ADA | 58 (49) | 23 (39) | 35 (58) | < 0,0500 |
| Resolución ST | 85 ± 22 | 90 ± 16 | 79 ± 25 | < 0,0100 |
| Estrategia de ICP primaria | 65 (55) | 30 (49) | 35 (56) | 0,6000 |
| Estrategia farmacoinvasiva | 53 (45) | 30 (51) | 23 (39) | 0,3000 |
| TIMI inicial | 0,1000 | |||
| 0 | 62 (53) | 31 (54) | 31 (52) | |
| 1 | 9 (7) | 1 (2) | 8 (12) | |
| 2 | 11 (9) | 4 (7) | 7 (12) | |
| 3 | 36 (31) | 24 (37) | 12 (24) | |
| TIMI final | 0,2000 | |||
| 0 | 2 (2) | 1 (2) | 1 (2) | |
| 1 | 2 (2) | 1 (2) | 1 (2) | |
| 2 | 11 (8) | 3 (3) | 8 (14) | |
| 3 | 103 (88) | 55 (93) | 48 (82) | |
| Antiagregantes | 113 (98) | 56 (98) | 57 (99) | 0,9000 |
| Anticoagulantes | 8 (7) | 3 (4) | 5 (10) | 0,3000 |
| Anti-GPIIb/IIIa | 44 (37) | 22 (38) | 22 (36) | 0,9000 |
| Bloqueadores beta | 81 (69) | 40 (68) | 41 (70) | 0,9000 |
| IECA | 91 (77) | 46 (79) | 45 (76) | 0,8000 |
| ARA-II | 18 (15) | 11 (20) | 7 (14) | 0,7000 |
| Estatinas | 98 (83) | 50 (85) | 48 (80) | 0,8000 |
ADA: arteria descendente anterior; anti-GPIIb/IIIa: inhibidores de la glucoproteína IIb/IIIa; ARA-II: antagonistas de los receptores de la angiotensina II; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IMS: índice de miocardio salvado; RMC: resonancia magnética cardiaca; TIMI: Thrombolysis in Myocardial Infarction.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Hay más presencia de afección de la arteria coronaria descendente anterior entre los pacientes con IMS ≤ mediana. En esto puede influir que el área en riesgo dependiente de este vaso sea mayor que en los demás (38 ± 15 frente a 23 ± 12; p < 0,0001). Asimismo, los pacientes con mayor IMS tienden a tener mayor grado de flujo TIMI al inicio y al final del cateterismo.
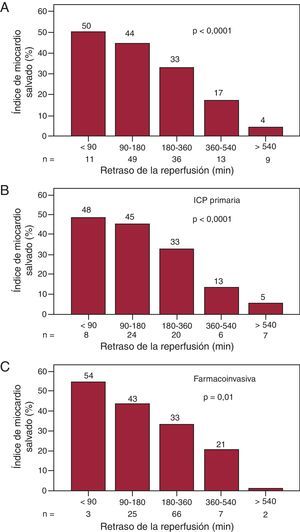
Relación del miocardio salvado con el retraso de la reperfusiónEl tiempo desde el inicio del dolor hasta la reperfusión ha tenido una mediana de 3 h en nuestros pacientes (180 [139-300] min) y comprobamos que tanto el tiempo total como los tiempos parciales (tiempo dolor-puerta de urgencias y puerta de urgencias-reperfusión) son significativamente mayores en los pacientes con menos IMS, así como el retraso hasta la realización de la RMC (Tabla 1). Cuando estratificamos el retraso hasta la reperfusión, observamos como su incremento se asocia a cantidades progresivamente menores de IMS (Figura 3). Esta tendencia es significativa tanto si consideramos el grupo total como si lo dividimos según la estrategia de reperfusión empleada.
Figura 3. Gráfico de barras que representa el índice de miocardio salvado respecto al tiempo total desde el inicio del dolor hasta la reperfusión. A: grupo total. B: pacientes con intervención coronaria percutánea primaria. C: pacientes con estrategia farmacoinvasiva. En todos los casos la p para la tendencia es significativa. ICP: intervención coronaria percutánea.
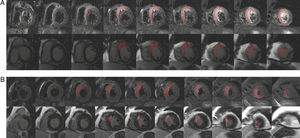
Para conseguir el objetivo de IMS > percentil 25 (16,3%), el tiempo dolor-reperfusión no debe superar las 5 h y 35 min: área bajo la curva ROC, 0,77 (0,66-0,88) (p < 0,0001); sensibilidad, 59%; especificidad, 92%; valor predictivo positivo, 0,88 y valor predictivo negativo, 0,75. La Figura 4 muestra las imágenes del área en riesgo y el área de la necrosis en dos pacientes de nuestra serie.
Figura 4. Áreas de hiperintensidad representativas del área en riesgo (imágenes T2-STIR, arriba) y área de la necrosis (imágenes de realce tardío de gadolinio, abajo) en las proyecciones de eje corto. El paciente A se reperfundió a los 340 min del inicio del dolor y tiene un índice de miocardio salvado del 16%. El paciente B se reperfundió a los 115 min del inicio del dolor y tiene un índice de miocardio salvado del 82%. STIR: short tau inversion recovery.
Predictores de miocardio salvadoLa variable con más fuerte relación independiente con un IMS > mediana es el tiempo total hasta la reperfusión (Tabla 2). Las otras variables incluidas son la diabetes y un mayor retraso en la realización de la RMC durante la hospitalización. Si analizamos únicamente a los pacientes en que la RMC se hace antes del día 8 (n=95), esta variable deja de tener valor predictivo tanto en el análisis univariable como en el multivariable, pero persisten el tiempo dolor-reperfusión y la diabetes como variables predictoras independientes.
Tabla 2. Análisis multivariable
| OR (IC95%) | p | |
| Predictores independientes de índice de miocardio salvado > mediana (31%)a | ||
| Tiempo total hasta la reperfusión | 0,42 (0,29-0,63) | < 0,0001 |
| Diabetes | 0,32 (0,11-0,99) | < 0,0500 |
| Tiempo hasta la RMC | 0,86 (0,76-0,97) | < 0,0500 |
| Predictores independientes de IMS > mediana (31%)b | ||
| Tiempo total hasta la reperfusión | 0,42 (0,28-0,64) | < 0,0001 |
| Diabetes | 0,25 (0,07-0,99) | < 0,0500 |
IC95%: intervalo de confianza del 95%; IMS: índice de miocardio salvado; RMC: resonancia magnética cardiaca.
a Se incluyen en el modelo diabetes, tiempo total hasta la reperfusión, tiempo hasta la RMC, clase Killip, porcentaje de resolución del ST y flujo Thrombolysis in Myocardial Infarction inicial.
b Se incluye sólo a los pacientes con RMC realizada en los primeros 8 días tras el infarto (n=95). Se incluyen en el modelo diabetes, tiempo total hasta la reperfusión, clase Killip y porcentaje de resolución del ST.
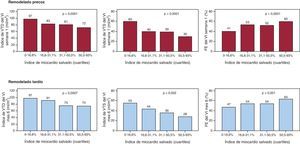
Hemos encontrado asociación entre los valores de IMS ≤ mediana y peores valores de las principales variables de RMC en la primera semana (Tabla 3). A los 6 meses se mantenía esta asociación, aunque ya no se detectó edema, obstrucción microvascular o hemorragia intramiocárdica en ningún caso. En la Figura 5 se muestran los índices de remodelado del VI precoz y tardío según los valores de IMS divididos en cuartiles, y en todos los casos hay diferencias significativas. Si consideramos como variable dependiente el volumen telesistólico del VI al sexto mes aumentado (de acuerdo con los valores de referencia para edad, sexo y superficie corporal12), las variables predictoras independientes son el volumen telesistólico del VI en la primera semana y el número de segmentos con necrosis > 50% en la primera semana (Tabla 4). Por lo tanto, en nuestra serie el IMS no aporta valor predictivo adicional de remodelado adverso (p=0,4).
Tabla 3. Características de la resonancia magnética cardiaca de los agrupados según la mediana del miocardio salvado
| Grupo total | IMS > mediana (31%) | IMS ≤ mediana (31%) | p | |
| RMC primera semana | ||||
| Pacientes (n) | 118 | 59 | 59 | |
| Volumen telediastólico (ml/m2) | 83±23 | 76±18 | 90±26 | 0,0010 |
| Volumen telesistólico (ml/m2) | 42±22 | 34±14 | 50±25 | < 0,0001 |
| Fracción de eyección (%) | 51±13 | 56±11 | 47±13 | < 0,0001 |
| Masa del VI (g/m2) | 75±17 | 71±14 | 78±20 | < 0,0500 |
| Área en riesgo (% masa del VI) | 30±16 | 29±14 | 31±16 | 0,2000 |
| Área de la necrosis (% masa del VI) | 21±15 | 13±9 | 28±15 | < 0,0001 |
| Número de segmentos con necrosis > 50% | 3,8±3 | 2,4±2,2 | 5,1±3 | < 0,0001 |
| Obstrucción microvascular (% masa del VI) | 3,6±5,4 | 1,8±3,7 | 5,3±6,2 | 0,0010 |
| Hemorragia intramiocárdica (% masa del VI) | 2,5±3,9 | 1,1±2,3 | 3,7±4,8 | 0,0010 |
| RMC sexto mes | ||||
| Pacientes (n) | 83 | 43 | 40 | |
| Volumen telediastólico (ml/m2) | 84±26 | 75±22 | 94±28 | 0,0010 |
| Volumen telesistólico (ml/m2) | 40±24 | 32±15 | 49±29 | 0,0010 |
| Fracción de eyección (%) | 55±14 | 59±11 | 51±15 | < 0,0100 |
| Masa del VI (g/m2) | 73±20 | 70±19 | 76±20 | 0,1000 |
| Área de la necrosis (% masa del VI) | 17±10 | 14±11 | 20±8 | 0,0500 |
IMS: índice de miocardio salvado; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
Salvo otra indicación, los datos expresan media ± desviación estándar.
Figura 5. Gráfico de barras que representa los índices de remodelado ventricular izquierdo precoz (arriba) y tardío (abajo) según los cuartiles de índice de miocardio salvado. En todos los índices se observan valores significativamente mejores a mayores valores de índice de miocardio salvado. FE: fracción de eyección; VI: ventrículo izquierdo; VTD: volumen telediastólico; VTS: volumen telesistólico.
Tabla 4. Análisis multivariable. Predictores independientes de remodelado adverso a los 6 meses (volumen telesistólico dilatado)
| OR (IC95%) | p | |
| Volumen telesistólico semana 1 (ml/m2) | 1,12 (1,06-1,18) | < 0,0001 |
| Número de segmentos con necrosis > 50% semana 1 | 1,51 (1,21-1,90) | < 0,0001 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Este trabajo confirma la importancia de la RMC como herramienta no invasiva para detectar y cuantificar el miocardio salvado tras un IAMCEST reperfundido. Su carácter no invasivo y la posibilidad de realizarla retrospectivamente la convierten en la principal técnica para evaluar cualquier estrategia de reperfusión tras un infarto. Asimismo se demuestra que la rapidez en recibir el tratamiento de reperfusión y la diabetes son los principales determinantes de su magnitud. El retraso en la realización de la RMC puede tener influencia en las medidas de miocardio salvado. Tanto el tamaño y la transmuralidad del infarto como el remodelado precoz del VI son superiores al miocardio salvado como predictores de remodelado adverso del VI tardío.
La RMC actualmente es la mejor técnica para medir con exactitud el tamaño del infarto y la transmuralidad de la necrosis13. Por otra parte, tanto el infarto como la reperfusión producen una inflamación con edema secundario intracelular y extracelular que aumenta la intensidad de la señal en las imágenes ponderadas en T214. Se ha demostrado que el área edematizada refleja el lecho de perfusión de una arteria coronaria (área en riesgo) en infartos tanto reperfundidos15 como no reperfundidos16. Se puede medir retrospectivamente tras la revascularización, puesto que el edema permanece transitoriamente tras el infarto agudo, lo que facilita su utilización clínica2, 15. Así, el área en riesgo incluye tanto el área de la necrosis como el área periinfarto de miocardio dañado de forma reversible y fundamentalmente viable, y el miocardio salvado se obtiene a partir de la diferencia entre ambas áreas.
Varios estudios han analizado el miocardio salvado tras un IAMCEST mediante RMC4, 7. Estos trabajos han demostrado que es un método robusto para evaluar la eficacia de la reperfusión en un contexto clínico, y es mejor indicador del éxito que el tamaño del infarto6. Algunos estudios han atribuido al miocardio salvado también un valor pronóstico sobre el remodelado del VI17 o los eventos7.
No hay un acuerdo general respecto de la influencia del retraso de la reperfusión en la cantidad de miocardio salvado. Así, en un metanálisis de Boersma et al18 se señala que el retraso en la reperfusión no es tan importante en la ICP primaria como en la trombolisis. En un estudio realizado con isótopos, Schomig et al19 no encuentran relación significativa entre el tiempo hasta la ICP y el tamaño del infarto. Según la teoría del frente de onda isquémico postulada por Reimer y Jennings14, el miocardio isquémico progresa rápidamente hacia la necrosis en los primeros minutos tras la oclusión coronaria, y el proceso se completa a las 6 h. Aunque con valores variables, los trabajos publicados6, 7 muestran que el miocardio salvado disminuye más o menos rápidamente conforme se retrasa la reperfusión. En nuestros pacientes se mantiene esta tendencia, aunque persiste cierta cantidad de miocardio salvado tras las 6 h, lo que hace pensar en la influencia de otros factores como la presencia de circulación colateral y la historia de precondicionamiento isquémico20.
Nuestro estudio aporta información en pacientes tratados con estrategia farmacoinvasiva, no representados en otros estudios, que indica que la influencia del tiempo hasta la reperfusión es crucial independientemente de la estrategia de manejo inicial. Esto está de acuerdo con la recomendación de las guías de práctica clínica de la Sociedad Europea de Cardiología de llevar a cabo reperfusión farmacológica o mecánica (ICP) temprana durante las primeras 12 h de la aparición de los síntomas en pacientes con IAMCEST21. Recientemente hemos demostrado que esta estrategia constituye una alternativa de resultados similares a los de la ICP primaria en cuanto a afección del VI a corto y largo plazo8.
Otro de los factores predictores de IMS es la diabetes, cuya influencia puede estar relacionada con la preexistencia de daño y disfunción microvascular en estos pacientes, que a su vez determina mayor obstrucción microvascular tras el infarto y la revascularización22.
Hemos constatado que el tiempo desde el evento agudo hasta la realización de la RMC tiene valor predictivo de la magnitud de IMS en el grupo total de pacientes, pero no si excluimos a aquellos en que la RMC se hace más tarde de 8 días. No está completamente aclarado en la literatura médica cuál es la duración del edema tras el daño isquémico agudo y, si bien su magnitud es máxima durante la primera semana23, también se han documentado reducciones significativas antes del séptimo día24 que podrían explicar que se subestime el área en riesgo «real» de los pacientes en que la RMC se hace tardíamente.
Respecto de la influencia del miocardio salvado en el remodelado adverso del VI, hemos encontrado en la literatura médica resultados positivos17 y negativos25. En nuestro trabajo hay asociación entre la magnitud del IMS y un mayor remodelado del VI, pero no tras ajustar por las demás variables. Estos resultados están de acuerdo con la tesis de que el tamaño final del infarto es el parámetro que más influye en la disfunción sistólica y, en consecuencia, el pronóstico25, independientemente de la magnitud del IMS. Por lo tanto, se necesitan más estudios que aclaren la relación entre el IMS y el pronóstico. Más aún, en nuestro estudio el número de segmentos con necrosis > 50% en un análisis visual es un predictor de remodelado adverso superior incluso al propio tamaño del infarto. La causa probablemente sea que en un solo parámetro se combina información relativa a la extensión del infarto y a su transmuralidad.
Implicaciones clínicasEl presente trabajo demuestra el valor clínico de la RMC como una alternativa de imagen no invasiva para valorar cuantitativamente el daño reversible e irreversible en IAMCEST reperfundidos. La RMC puede ser el método óptimo para valorar el miocardio salvado, ya que tiene una elevada resolución espacial y se puede llevar a cabo retrospectivamente en una sola prueba sin interferir con el manejo en la fase aguda y sin irradiar al paciente.
Parece estar clara la superioridad del IMS como mejor parámetro para evaluar las terapias de reperfusión centrado en el miocardio con edema pero sin necrosis, es decir, con daño reversible y, por lo tanto, viable. La ventaja de una aproximación basada en ajustar el miocardio salvado respecto del área en riesgo en contraposición a medir sólo el área del infarto reside en que se evita en parte el sesgo producido por las diferencias en las características clínicas basales entre los pacientes26 y otros factores, como el flujo colateral, la duración de la isquemia y las demandas metabólicas27, que condicionan la gran variabilidad existente en el tamaño del infarto.
Nuestros resultados, que demuestran la relación entre el miocardio salvado y el tiempo hasta la reperfusión, apoyan las recomendaciones de revascularizar a los pacientes con IAMCEST lo antes posible21.
Hemos detectado una relación entre el retraso en la realización de la RMC y el IMS, por lo que parece aconsejable llevarla a cabo precozmente. Sin embargo, aún no está completamente aclarado cuál es la evolución temporal del edema y cuáles son los determinantes de su persistencia, por lo que se necesitan más estudios antes de llevar a cabo recomendaciones firmes en este sentido.
Limitaciones del estudioSe ha llevado a cabo una estrategia farmacoinvasiva o ICP primaria según la disponibilidad y el criterio del cardiólogo clínico, por lo que no se trata de un estudio aleatorizado. Así, puede haber diferencias en el perfil clínico de los pacientes que condicionen los resultados aunque, como hemos visto, estas han sido pequeñas.
Las imágenes T2-STIR tienen peor relación señal/ruido que en la mayor parte de las imágenes de RMC y una en ocasiones mala interpretación de la sangre no suprimida por flujo lento, que en ciertos casos hacen difícil definir con claridad el borde de la hiperintensidad. Por lo tanto, aún son necesarias mejoras técnicas en este tipo de imágenes para que puedan llegar a ser tan robustas como las del realce tardío. Se está investigando con imágenes de cartografía T2 que pueden corregir alguna de las limitaciones de las imágenes T2 y podrían, tal vez en un futuro cercano, cambiar este panorama28.
En el análisis multivariable se han eliminado algunas covariables clínicamente menos importantes o que pudieran aportar información redundante con la finalidad de evitar un modelo con excesivo sobreajuste, por lo que es necesario confirmar su capacidad predictiva con tamaños muestrales mayores.
ConclusionesLa RMC es una técnica esencial para valorar la cantidad de miocardio salvado tras un IAMCEST. Su carácter no invasivo y la posibilidad de realizarla retrospectivamente la convierten en la mejor técnica para evaluar cualquier estrategia de reperfusión tras un infarto. La rapidez en recibir el tratamiento de reperfusión es su predictor más importante. Hay una posible relación entre el retraso en la realización de la RMC y el miocardio salvado que se debe confirmar en estudios específicos. El tamaño y la transmuralidad del infarto son índices superiores al miocardio salvado para predecir remodelado adverso a los 6 meses.
FinanciaciónEl presente estudio ha sido financiado por el Instituto de Salud Carlos III (subvenciones PI080128 y Heracles).
Conflicto de interesesNinguno.
Recibido 22 Noviembre 2011
Aceptado 29 Enero 2012
Autor para correspondencia: Unidad de Imagen Cardiaca (ERESA), Hospital Clínico Universitario de Valencia, Avda. Blasco Ibáñez 17, 46010 Valencia, España. jmonmeneu@eresa.com