Los stents farmacoactivos se asocian con retraso en la endotelización y fenómenos inflamatorios persistentes demostrados histológicamente. En la superficie luminal, mediante microscopio electrónico de barrido se observan también cúmulos de células inflamatorias. Para cuantificar esta respuesta inflamatoria se implantaron un stent de acero y dos stents farmacoactivos con distintas dosis de vinblastina y el mismo polímero en las coronarias de 12 cerdos domésticos. Se analizó 3 y 7 días después la densidad de células inflamatorias por área representativa (100 x 100 μm). La endotelización del stent de acero fue más completa que en los stents farmacoactivos a los 3 días (p=0,016) y a los 7 días (p=0,0001). Los stents farmacoactivos indujeron un grado de inflamación mayor que los stents de acero a los 3 días (11,8±3.5% frente al 4,5±2%; p=0,001) y a los 7 días (26,3±4,4% frente al 1,2±1,5%; p=0,0001), con un patrón opuesto: la respuesta inflamatoria aumentaba con el tiempo en los stents farmacoactivos, al contrario de lo que sucedía con los stents de acero.
Palabras clave
Los stents coronarios farmacoactivos (SFA) han demostrado su eficacia en la reducción de la reestenosis1,2. Sin embargo, bien sea por los efectos antiproliferativos de los fármacos empleados, bien por el propio polímero empleado para su liberación controlada, los SFA se asocian con retraso en la endotelización y fenómenos inflamatorios persistentes3,4,5,6. Ambos fenómenos se han relacionado con la aparición de la complicación más grave relacionada con estos dispositivos: la trombosis del stent, incluso en fases muy tardías4.
Los datos referidos se basan en el análisis histológico de las piezas procedentes de experimentación animal y de necropsias humanas. Para el análisis de la endotelización de los stents, se ha empleado frecuentemente el microscopio electrónico de barrido (Scanning Electron Microscopy [SEM]), con el que se puede observar células inflamatorias en la pared arterial y el stent. El objetivo de este estudio es describir un método de análisis de la inflamación superficial (luminal) inducida por los stents coronarios que permita valorar su magnitud y la evolución en distintos tipos de dispositivo.
MétodosLos procedimientos experimentales se llevaron a cabo en 12 cerdos domésticos (25±3 kg), siguiendo las directivas generales para la protección de los animales de experimentación (Directiva 86/609/CEE, RD 1201/2005), bajo la supervisión de nuestro comité bioético.
Los procedimientos de sedación, analgesia, anestesia y endovascular se han descrito previamente7. Se implantaron un stent de acero inoxidable (SA, Apolo® 3,5 x 18 mm, Iberhospitex S.A., España) y dos stents farmacoactivos con distintas dosis de vinblastina (SFA1, 0,18μg/mm2 y SFA2, 0,36μg/mm2) y el mismo polímero liberador (polímero P5®, Iberhospitex S.A.-Palau Pharma S.A., España) en cada una de las tres coronarias de forma aleatoria para que la distribución por arterias (descendente anterior, circunfleja y coronaria derecha) de los stents fuese la misma. La presión de implantación se adecuó para obtener una sobredimensión del 10%.
La eutanasia de los animales a los 3 (n=6) y 7 días (n=6) tras la implantación se describió previamente7. El procesado para el estudio con SEM sigue la metodología descrita por Farb et al8. Las superficies luminales de las hemisecciones se examinaron con microscopio electrónico de barrido JSM-6480 LV (JEOL, Japón). Cada hemisección se fotografió digitalmente y se analizó la superficie endotelizada en imágenes a 25 aumentos, empleando imágenes en detalle (150-250 aumentos) para diferenciar las células endoteliales de formaciones de fibrina u otros tipos celulares. Se determinó el porcentaje de endotelización midiendo el área total de la pieza, valor corregido por la relación metal/arteria (14%) y el área metálica no endotelizada mediante la siguiente fórmula: %=100 x [1 – (área no endotelizada / área total metálica)]. Se seleccionaron 3-5 áreas representativas (100 x 100μm) (Figura 1) de pared arterial adyacente al stent para estudiar la densidad de células inflamatorias, de mayor tamaño que el resto de los elementos formes sanguíneos. Tras el procesado de la imagen mediante la determinación automática de umbral con el software ImageJ-NIH Image 1.4 (National Institutes of Health, Estados Unidos), se cuantificó la densidad de leucocitos con respecto al área analizada (porcentaje del área total ocupada por células inflamatorias).
Figura 1. Procesado de las imágenes para análisis de la inflamación. A: respuesta inflamatoria al stent en zona adyacente de la pared. B: procesado del umbral de grises y selección de área representativa de 100 x 100 μm (cuadro rojo). C: detalle del tamaño y la morfología de leucocitos (esféricos, ∼10 μm; flecha roja), hematíes (bicóncavos, ∼5 μm; flecha azul) y plaquetas (pequeños puntos<1 μm; flecha verde).
Se presentan los datos como media±desviación estándar. Se analizan las diferencias entre medias con el test de la t de Student y las correlaciones mediante la r2 de Pearson.
En la versión electrónica de este artículo se puede consultar material adicional asociado a este apartado.
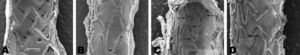
ResultadosLa endotelización de los SA fue mayor que la de ambos SFA a los 3 días (82±18% frente al 28%±14%; p=0,016) y 7 días (97±3% frente al 44±15%; p=0,0001) (Figura 2). No se observaron diferencias en la endotelización entre los dos SFA, las distintas arterias (descendente anterior, circunfleja y coronaria derecha) ni relación con la razón stent/arteria (SA, 1,17±0,1; SFA1, 1,07±0,07; SFA2, 1,13±0,16; p=0,4).
Figura 2. A y B: endotelización de stent de acero. A: a los 3 días, endotelización parcial del stent; áreas desnudas (flechas). B: a los 7 días, endotelización completa del stent. C y D: endotelización de stent farmacoactivo. C: a los 3 días, áreas desnudas (flechas) y el resto cubierto de fibrina. D: a los 7 días, endotelización irregular; presencia de células gigantes (flechas).
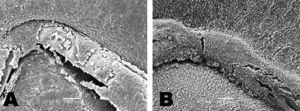
Los SA mostraron menor densidad de células inflamatorias que los SFA tanto a los 3 días (4,5±2% frente al 11,8±3,5%; p=0,001) como a los 7 días (1,2±1,5% frente al 26,3%±4,4%; p=0,0001) (Figura 3). No se apreciaron diferencias significativas entre los dos SFA. En los SA disminuyó de forma significativa la densidad de células inflamatorias con el tiempo (4,5±2% frente al 1,2±1,5%; p=0,0001), mientras en los SFA el comportamiento fue inverso y aumentó de forma significativa a los 7 días (11,8±3,5% frente al 26,3±4,4%; p=0,0001).
Figura 3. Grados de inflamación. A: stent de acero, a los 3 días, escasa presencia de células inflamatorias (pared y stent); endotelización parcial del stent; áreas con fibrina. B: stent farmacoactivo, a los 7 días, intensa reacción inflamatoria alrededor del stent; cobertura de fibrina y plaquetas en el stent.
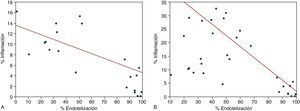
Se observaron correlaciones inversas entre el grado de inflamación y el porcentaje de endotelización, con valores de r2=–0,4 (p<0,011) a los 3 días y r2=–0,84 (p<0,0001) a los 7 días (Figura 4).
Figura 4. Correlación entre el grado de endotelización y el de inflamación. Resultados a los 3 días (A) y a los 7 días (B).
DiscusiónEn el reciente documento de consenso9 para el análisis preclínico de los SFA, se recomienda la valoración semicuantitativa de la inflamación inducida como uno de los parámetros más relevantes. El método aquí descrito muestra escasa variabilidad y ofrece resultados en una escala cuantitativa, lo que permitiría comparar la respuesta a distintos dispositivos de forma más detallada.
Recientemente se ha publicado6 la diferente respuesta a largo plazo que se observa entre los dos SFA de primera generación en modelo porcino: la respuesta inflamatoria en profundidad y la deposición de fibrina distinguen uno de otro stent. Aunque los autores reconocen la difícil extrapolación al terreno clínico, no es menos cierto que se trata de hallazgos no deseables. El análisis de la inflamación luminal completa el estudio de la respuesta a los SFA con los fenómenos que tienen lugar en la interfaz stent-luz arterial, esencial para la posterior endotelización5. De hecho, hemos observado una significativa correlación inversa entre la intensidad de la respuesta inflamatoria y el porcentaje de superficie del stent endotelizada.
Un hallazgo reseñable es el patrón temporal de inflamación, decreciente en los stents metálicos y creciente en los SFA. En nuestros resultados la liberación del fármaco puede tener un papel relevante, al tratarse de análisis a corto plazo. Sin embargo, la persistencia de estos fenómenos a muy largo plazo en otros estudios5,6,9 parecen confirmar el papel causal de los polímeros empleados. El papel que pudiera desempeñar el polímero P5® en un potencial aumento de la respuesta inflamatoria no puede determinarse con los datos aquí presentados, pero hallazgos preliminares10 no sustentan esa relación.
La limitación más notable es la difícil extrapolación de los datos del modelo animal (joven y sano) al humano enfermo, aunque es lo recomendado por el documento de consenso9. El empleo de modelos de animales enfermos (diabéticos, hiperlipémicos por deficiencia genética o inducida) se está validando y aún no está recomendado. La falta de correlación de los hallazgos con otras técnicas de análisis (histopatología) puede percibirse como otra limitación. Sin embargo, creemos que el método descrito, más que sustituir, complementa la información obtenida por otros medios. Queda por definir el papel que otros fármacos antiproliferativos pueden desempeñar en la respuesta inflamatoria.
En conclusión, los SFA liberadores de vinblastina utilizados en este estudio inducen un grado de inflamación mayor que los stents metálicos convencionales, con un patrón temporal opuesto: aumenta con el tiempo en los SFA y disminuye con los convencionales. Hay una correlación significativa entre la respuesta inflamatoria analizada y la endotelización del stent coronario.
FinanciaciónFinanciado por una ayuda no condicionada de Cordynamic-Iberhospitex, S.A. (Barcelona, España).
Conflicto de interesesNinguno.
Anexo. Material adicionalSe puede consultar material adicional asociado a este artículo en su versión electrónica disponible en doi:10.1016/j.recesp.2010.04.001.
Anexo A. Material suplementarioRecibido 23 Febrero 2010
Aceptado 24 Abril 2010
Autor para correspondencia: Servicio de Cardiología Intervencionista, Hospital de León, Altos de Nava, s/n. 24008 León, España. aperez@secardiologia.es