Validar el acceso axilar como una opción eficaz y segura para el implante percutáneo de válvula aórtica percutánea CoreValve®, en pacientes con contraindicación para el acceso femoral, en tres hospitales españoles.
MétodosIncluimos a pacientes con estenosis aórtica severa sintomática y alto riesgo quirúrgico o contraindicación para cirugía, seleccionados por un equipo multidisciplinario para implante percutáneo de válvula aórtica; además, los pacientes tenían contraindicación para el abordaje arterial femoral.
ResultadosIncluimos a 19 de los 186 pacientes (10,2%) a los que se implantó una válvula percutánea entre noviembre de 2008 y marzo de 2010. La media de edad era 78,3±8,65 años y el 73,7% eran varones. El EuroSCORE logístico medio de la muestra fue del 28,7%±16,3%. La tasa de éxito de implante fue del 100%. Tras el implante, el gradiente transvalvular máximo pasó de 81,7±21,5 a 15,8±5,5 mmHg, y ningún paciente presentó insuficiencia aórtica residual > 2. La mortalidad total, con un seguimiento medio de 9,2±3,2 meses, fue del 10,5%, con nula mortalidad intraoperatoria y a los 30 días. La incidencia total de complicaciones mayores atribuibles al procedimiento fue del 15,7%. Se implantó marcapasos definitivo por bloqueo auriculoventricular en 8 pacientes (44,4%).
ConclusionesEl uso del acceso axilar en pacientes seleccionados para implante percutáneo de válvula aórtica CoreValve® con contraindicación para el acceso femoral es seguro y eficaz y proporciona excelentes resultados en términos de éxito del implante y mortalidad, tanto intrahospitalaria como a los 30 días.
Palabras clave
La estenosis aórtica severa (EAS) degenerativa es la valvulopatía más prevalente en el mundo occidental; el recambio valvular mediante cirugía es el tratamiento de elección por la amplia experiencia existente y sus buenos resultados1. Sin embargo, hasta un tercio de los pacientes con indicación para recambio valvular aórtico tienen un elevado riesgo quirúrgico o alguna contraindicación para la cirugía, por lo que no puedan beneficiarse de este tipo de terapia2. En los últimos años el implante percutáneo de válvula aórtica (IPVA) ha experimentado un gran auge, avalado por los buenos resultados de los registros y gracias a una simplificación de la técnica, y en la actualidad es una alternativa válida para el importante subgrupo de pacientes con elevado riesgo quirúrgico3,4. Actualmente se comercializan dos modelos de válvula percutánea para el tratamiento percutáneo de la EAS, el CoreValve ReValving System (CoreValve Inc.) y el Edwards SAPIEN RetroFlex System (Edwards Lifesciences). A diferencia de los primeros dispositivos implantados en humanos a principios de esta década, cuando el procedimiento se realizaba por vía anterógrada desde la vena femoral y por punción transeptal5, el implante se lleva a cabo actualmente por vía retrógrada desde la arteria femoral. A esta simplificación de la técnica ha contribuido sin duda la reducción en el calibre de los introductores necesarios para el avance de los dispositivos, que es de 18 Fr para la válvula CoreValve (están en desarrollo y próximos a su comercialización introductores de 16 Fr para la válvula pequeña, que comprende anillos valvulares de hasta 23 mm) y de 18 (recientemente comercializado), 22 o 24 Fr, según el tamaño de la válvula, para la SAPIEN. Sin embargo, a menudo concurren algunas circunstancias a nivel de los vasos femorales e iliacos, como el pequeño calibre, la elevada tortuosidad o la enfermedad arterial obstructiva, que hacen imposible utilizar este acceso para el IPVA. Esta dificultad se puede solventar mediante el implante transapical en el caso de la válvula SAPIEN usando el sistema de liberación Ascendra; sin embargo, en el caso de la válvula CoreValve no disponemos de esta opción. El objetivo de este estudio es presentar la experiencia de tres centros españoles en el implante percutáneo de la prótesis valvular aórtica CoreValve® a través de la arteria axilar en pacientes con contraindicación para el acceso femoral. Para ello analizamos los resultados hospitalarios y en el seguimiento a medio plazo.
MétodosPoblaciónIncluimos a 19 pacientes reclutados en tres hospitales entre noviembre de 2008 y marzo de 2010. Todos ellos eran pacientes con EAS sintomática e indicación para cirugía según las guías de práctica clínica de la Sociedad Europea de Cardiología6. La selección de pacientes, siguiendo esta premisa, la realizó un equipo multidisciplinario formado por cardiólogos clínicos e intervencionistas y cirujanos cardiacos. Se consideró subsidiarios de recambio valvular percutáneo a los pacientes con un elevado riesgo quirúrgico (EuroSCORE logístico > 20%) o con contraindicaciones técnicas para la cirugía como la aorta en porcelana. Previamente, se realizó a todos los pacientes un ecocardiograma transtorácico y/o transesofágico, un estudio hemodinámico que incluyó coronariografía, ventriculografía, angiografía de la aorta ascendente y del sector ileofemoral, y estudio de presiones pulmonares y de ventrículo izquierdo. A los pacientes con contraindicación para el acceso femoral, se realizó además angiografía de las arterias subclavia y axilar izquierda, localizando también el origen de la arteria mamaria interna izquierda (AMII). Dadas las características del dispositivo, los pacientes debían cumplir las siguientes características anatómicas: diámetro del anillo aórtico medido por ultrasonidos ≥ 20 y ≤ 27 mm y diámetro de la aorta ascendente 5 cm por encima del plano valvular aórtico ≤ 40 (para la prótesis de 26 mm) o ≤ 43 mm (para la prótesis de 29 mm).
Incluimos a los pacientes que, cumpliendo los requisitos previos, tenían contraindicación para el acceso femoral, que resumimos en tamaño de la arteria femoral < 6 mm (bien de forma natural, bien por importante enfermedad aterosclerótica) o elevada tortuosidad del sector aortoiliaco que impidiese el avance del catéter liberador.
Los criterios de exclusión según protocolo fueron: contraindicación para la administración de alguno de los fármacos necesarios durante el procedimiento, inestabilidad hemodinámica, realización de angioplastia coronaria en los 15 días anteriores al procedimiento, presencia de trombos en las cavidades izquierdas, accidente cerebrovascular reciente, sepsis o endocarditis, coagulopatía o diátesis hemorrágica e insuficiencia mitral severa con inversión del flujo de las venas pulmonares.
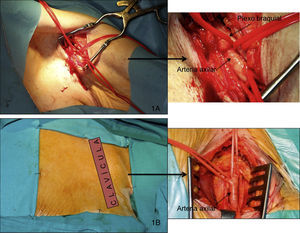
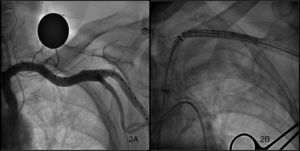
ProcedimientoTodos los procedimientos se llevaron a cabo en el laboratorio de hemodinámica utilizando anestesia general o sedación con anestesia local según el protocolo de cada hospital; se realizó extubación precoz in situ al finalizar el procedimiento en caso de haberse intervenido con anestesia general. Los accesos utilizados fueron la arteria axilar izquierda (AAI) en la mayoría de los casos y la arteria axilar derecha (AAD) en tan sólo un procedimiento. Todos los pacientes estaban pretratados con 100 mg/día de ácido acetilsalicílico y 75 mg de clopidogrel. Antes de la intervención se administró profilaxis antibiótica siguiendo el protocolo habitual en cada hospital para cirugía cardiaca convencional y se implantó un marcapasos temporal en el ventrículo derecho por vía yugular. Para la inserción del catéter pig-tail en el seno de valsalva no coronariano, que sirve de marca del anillo valvular y para inyectar el contraste y monitorizar la presión arterial, se utilizó la vía femoral, si era posible, o la vía radial contralateral. Para acceder a la arteria axilar se realizaron dos tipos de abordaje distintos, uno a través de la fosa axilar (Figura 1A) y otro a nivel infraclavicular (Figura 1B). Cuando el brazo está extendido a lo largo del cuerpo, la arteria axilar se dirige oblicuamente inferior, lateral y posterior, describiendo una curva de concavidad inferomedial a nivel de la fosa axilar, pero es rectilínea cuando el brazo se extiende horizontalmente; por eso en el abordaje desde la axila se colocó al paciente en esta posición y se realizó una incisión transversal a nivel de la fosa axilar. En el abordaje infraclavicular se realizó una incisión a ese nivel siguiendo el eje largo de la subclavia, con el paciente con los brazos pegados a lo largo del cuerpo. Una vez el cirujano vascular había expuesto la arteria, debidamente aislada con cintas quirúrgicas de silicona que permiten su pinzamiento, se procedía a insertar un introductor valvulado de 9 Fr mediante técnica de Seldinger y, a través de este con la ayuda de un catéter AL 1, se introducía una guía recta de 0,035 ” en el ventrículo izquierdo, que después se intercambiaba por una guía de alto soporte super-stiff de 260 cm (Amplatz Cook, Inc., Bloomington, Indiana). Finalmente se retiraba el introductor de 9 Fr y se introducía por la guía de alto soporte un introductor de 18 Fr y 30 cm de longitud (William Cook Europe, Bjaeverskov, Dinamarca); cuando éste alcanzaba la arteria axilar, se realizaba una pequeña arteriotomía transversal al eje mayor de la arteria para evitar desgarrarla y se continuaba progresando el introductor con control fluoroscópico hasta que quedara alojado en la aorta ascendente. Durante esta maniobra hay que tener control fluoroscópico de la guía introducida en el ventrículo izquierdo para evitar que produzca daño miocárdico. Una vez implantado el introductor de 18 Fr, y después de asegurarnos de que no habían producido complicaciones vasculares, se administraba heparina Na++ (80-100 UI/kg) y se procedía al implante de la válvula de igual manera que en el acceso femoral ya descrito ampliamente en la bibliografía4,7 (Figura 2A y B). De forma resumida, se estimula el ventrículo derecho con una frecuencia superior a 180 lpm y, después de comprobar que la curva de presión aórtica cae y se hace plana, se dilata la válvula aórtica con un balón dedicado (Numed Canada, Inc., Cornwall, Ontario, Canadá) de 22 o 25 mm, según se trate de una válvula pequeña o grande, y finalmente se libera la prótesis y se comprueba mediante fluoroscopia y angiografía su correcto posicionamiento y el grado de regurgitación aórtica residual. Por último, una vez acabado el procedimiento, el cirujano vascular procedía a retirar el introductor y suturar la arteria axilar y la zona de abordaje por planos hasta la piel. Se realizaba control angiográfico para comprobar la ausencia de fugas o complicaciones. Tras el procedimiento, los pacientes eran trasladados a la unidad coronaria con el marcapasos temporal, donde se los monitorizaba durante al menos 48 h con el fin de detectar posibles trastornos del ritmo que precisasen del implante de marcapasos definitivo. Se realizaban también curas diarias de la herida quirúrgica.
Figura 1. Acceso quirúrgico a la arteria axilar desde la fosa axilar (A) y desde la región infraclavicular (B).
Figura 2. Angiografía de la arteria axilar (A) y progresión de la prótesis a través del introductor en la arteria axilar (B).
SeguimientoSe realizó seguimiento clínico, ecocardiográfico y electrocardiográfico de todos los pacientes a la semana tras el alta hospitalaria, a los 30 días y luego cada 6 meses.
Análisis estadísticoPara el análisis de la muestra se utilizó el programa estadístico SPSS 15.0. Realizamos un análisis descriptivo donde las variables continuas se expresan como media±desviación estándar, y las variables categóricas se presentan como valor absoluto y porcentaje.
ResultadosCaracterísticas de los pacientesDe los 186 pacientes en los que se realizó IPVA en los tres hospitales, se utilizó el acceso axilar en 19 pacientes (10,2%). La media de edad de los pacientes era 78,3±8,65 años y en su mayoría eran varones (73,7%). Las características clínicas basales y las variables ecocardiográficas de los todos los pacientes a los que se implantó una válvula percutánea, ya fuera por vía femoral o axilar, se muestran en la Tabla 1. Cabe destacar que se trata de pacientes con riesgo quirúrgico elevado, significativamente mayor el de los pacientes con implante por vía axilar que el de aquellos en que se usó el abordaje femoral (EuroSCORE logístico, el 28,7 frente al 18,4%; p=0,003). Destaca también la alta prevalencia de hipertensión arterial (89,5%) e insuficiencia renal crónica (31,6%), así como una clase funcional de la New York Heart Association ≥ III en el 80% de los casos.
Tabla 1. Características clínicas y ecocardiográficas basales de la población *
| Acceso axilar | Acceso femoral | p | |
| Pacientes | 19 (10,2) | 167 (89,8) | |
| Edad (años) | 78,3±8,65 | 81±5,5 | 0,194 |
| Varones | 14 (73,7) | 55 (32,9) | 0,001 |
| EuroSCORE logístico (%) | 28,7±16,3 | 18,4±18,4 | 0,003 |
| IMC | 28,5±3,9 | 27,9±5 | 0,607 |
| Hipertensión arterial | 17 (89,5) | 122 (73,1) | 0,165 |
| Diabetes mellitus | 8 (42,1) | 42 (25,1) | 0,169 |
| Dislipemia | 15 (78,3) | 74 (44,3) | 0,006 |
| IRC | 6 (17,1) | 31 (19) | 0,21 |
| EPOC | 10 (52,6) | 49 (29,3) | 0,082 |
| Cardiopatía isquémica revascularizada | |||
| Percutánea | 3 (15,7) | 23 (13,8) | |
| Quirúrgica | 4 (21) | 11 (6,6) | |
| Ambas | 1 (5,3) | 1 (0,6) | |
| Clase NYHA>II | 15 (78,9) | 110 (82,1) | 0,753 |
| ICP previo al procedimiento | 3 (15,8) | 22 (13,2) | 0,458 |
| Área valvular aórtica (cm2) | 0,64±0,19 | 0,63±0,16 | 0,29 |
| Gradiente máximo (mmHg) | 81,7±21,5 | 83,6±21,5 | 0,72 |
| Gradiente medio (mmHg) | 47,3±11,3 | 52,7±15 | 0,133 |
| Anillo aórtico (mm) | 22,7±1,8 | 22,3±1,8 | 0,427 |
| FEVI>50% | 13 (68,3) | 113 (84,3) | 0,108 |
EPOC: enfermedad pulmonar obstructiva crónica; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervencionismo coronario percutáneo; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; NYHA: New York Heart Association.
* Los datos expresan n (%) o media±desviación estándar.
En la Tabla 2 se recogen las variables relativas al procedimiento. Se utilizaron dos tipos de procedimiento anestésico, uno con anestesia general, que fue el más frecuente (63,1%), y otro consistente en sedación profunda combinada con infiltración de un anestésico local. El acceso arterial fue mayoritariamente a través de la AAI (94,7%); por la AAD se practicó tan sólo en un paciente que estaba revascularizado con AMII.
Tabla 2. Características técnicas del implante protésico por vía axilar
| n (%) | |
| Anestesia | |
| General | 12 (63,1) |
| Local+sedación | 7 (36,9) |
| Acceso arterial | |
| Arteria axilar izquierda | 18 (94,7) |
| Arteria axilar derecha | 1 (5,3) |
| Abordaje | |
| Infraclavicular | 11(57,8) |
| Axilar | 9 (42,2) |
Los resultados del procedimiento se muestran en la Tabla 3. Se consiguió implantar la prótesis con éxito en todos los pacientes, con una importante reducción de los gradientes transvalvulares máximo y medio, y en ningún caso hubo regurgitación aórtica significativa. Todos estos resultados fueron comparables a los obtenidos para pacientes en los que se usó la vía femoral para el implante protésico. En cuanto a las complicaciones, se produjo una disección sobre el origen de la AMII durante el procedimiento en un paciente revascularizado con AMII a la arteria descendente anterior, que se resolvió mediante implante de un stent. En otra paciente, con fibrilación auricular crónica y episodios previos de accidente cerebrovascular (ACV), 9 días después del implante se produjo un nuevo episodio de ACV embólico múltiple con afección cerebelosa izquierda y del territorio dependiente de la arteria cerebral media izquierda, que dejaron importantes secuelas motrices. La paciente en ese momento recibía doble antiagregación y heparina de bajo peso molecular a dosis anticoagulantes, por lo que, dada la secuencia temporal, lo atribuimos al procedimiento. Por último, uno de los pacientes presentó una endocarditis infecciosa precoz por Staphylococcus lugdunensis, que se controló con tratamiento antibiótico. Se necesitó implante de marcapasos definitivo en casi la mitad de los pacientes.
Tabla 3. Resultados y complicaciones del implante *
| Acceso axilar | Acceso femoral | p | |
| Pacientes | 19 (10,2) | 167 (89,8) | |
| Éxito del implante | 19 (100) | 165 (98,8) | |
| Gradiente máximo (mmHg) | 15,8±5,5 | 18,7±6,5 | 0,222 |
| Gradiente medio (mmHg) | 8,8±3 | 10,2±4,2 | 0,350 |
| Insuficiencia aórtica>grado II | 0 | 0 | |
| Complicaciones | |||
| Vasculares | 1 (5,3) | 7 (4,2) | |
| Accidente cerebrovascular | 1 (5,3) | 0 | |
| Endocarditis infecciosa precoz | 1 (5,3) | 0 | |
| Necesidad de marcapasos definitivo | 8 (44,4) | 56 (35) | 0,446 |
* Los datos expresan n (%) o media±desviación estándar.
Con un seguimiento medio < 9 meses, la mortalidad fue del 10,5% de los pacientes con abordaje axilar y el 14,4% de los pacientes en los que se usó la vía femoral. Es de destacar que entre los pacientes con acceso axilar no se produjo ningún fallecimiento durante el procedimiento, la hospitalización o durante los 30 días tras el implante (Tabla 4). En total, fallecieron 2 pacientes; uno de ellos sufrió una muerte súbita poco después del mes del implante, y no quedó esclarecida la causa de la muerte, aunque pudiera deberse a un trastorno del ritmo, ya que previamente había sufrido bloqueo de rama izquierda con una anchura del complejo QRS de 180 ms. La segunda muerte fue la paciente que había sufrido el ACV, a consecuencia de una infección respiratoria 6 meses después del implante.
Tabla 4. Seguimiento y mortalidad *
| Acceso axilar | Acceso femoral | p | |
| Pacientes | 19 (10,2) | 167 (89,8) | |
| Seguimiento medio (meses) | 9,2±3,2 | 9,1±3,4 | 0,972 |
| Mortalidad acumulada | |||
| Total | 2 (10,5) | 24 (14,4) | |
| Periprocedimiento | 0 | 6 (3,5) | |
| Hospitalaria | 0 | 14 (8,4) | |
| 30 días | 0 | 14 (8,4) | |
* Los datos expresan n (%) o media±desviación estándar.
Describimos el abordaje a través de la arteria axilar como una opción terapéutica factible en pacientes con EAS candidatos a implante percutáneo de válvula aórtica y con contraindicación para el acceso femoral. Esta técnica mostró en nuestra serie, la mayor de las publicadas, una elevada tasa de éxito, comparable o mayor que la de los pacientes de nuestra muestra en que usamos el acceso femoral y que la registrada en otras series publicadas para el implante de este tipo de prótesis, también mediante acceso femoral4,8. Además, permite optimizar todas las opciones de tratamiento endovascular de la EAS con el CoreValve ReValving System®, ya que, a diferencia del otro dispositivo comercializado, carece de sistema liberador para el abordaje transapical. En comparación con el implante transapical, el acceso axilar es menos cruento y más seguro, sobre todo en pacientes con disfunción sistólica severa donde la vía transapical está, al menos relativamente, contraindicada.
Además del abordaje axilar o subclavio, en los últimos años se han comunicado accesos distintos para el IPVA de prótesis CoreValve® en pacientes con contraindicación para el acceso femoral. Destaca el acceso transaórtico a través de la aorta ascendente9,10, mediante la realización de una miniesternotomía y puncionando directamente sobre la aorta ascendente. En total, 3 pacientes se han sometido a este tipo de intervención, con buenos resultados tra el implante, sin complicaciones de importancia. Más recientemente se ha comunicado también un implante con éxito a través la arteria carótida izquierda11. La experiencia comunicada con este tipo de accesos es muy escasa y, en opinión de los autores, se debe reservar para casos muy seleccionados en que no sea posible otro tipo de abordaje menos cruento, valorando siempre el riesgo-beneficio; es preferible el acceso axilar en caso de imposibilidad de realizar un abordaje femoral, que además es posible en la inmensa mayoría de los casos, ya que, aun en pacientes con enfermedad arterial periférica muy evolucionada a nivel del sector aortoiliaco, el sistema subclavioaxilar presenta habitualmente un calibre adecuado que permite realizar con seguridad el implante valvular. De hecho, no se desechó por enfermedad arteriosclerótica y/o calibre insuficiente a ningún paciente evaluado. Generalmente, este subgrupo de pacientes con contraindicación para el acceso femoral tiene más comorbilidades y un riesgo quirúrgico mayor; así, el EuroSCORE medio de nuestra muestra fue del 28,7%, superior al de los pacientes en los que usamos la vía femoral (18,4%) y al de otros registros en los se incluyó fundamentalmente también a pacientes con abordaje femoral, que varían entre el 16%4 y el 25,2%12, y en línea con otras series publicadas de pacientes realizados por abordaje axilar, como las de De Robertis et al13 y Modine et al14, que comunican EuroSCORE medios del 29,5 y el 34% respectivamente. Esto es así aun teniendo en cuenta los últimos datos publicados, que apuntan a que el cálculo del riesgo quirúrgico para el recambio valvular aórtico mediante el EuroSCORE podría estar sobrestimándolo15. En comparación con esto, nuestra mortalidad intraprocedimiento, hospitalaria y a los 30 días fue nula, y la mortalidad total, con un seguimiento medio de más de 9 meses, fue del 10,5%, lo que representa una reducción en más de un 50% de la inicialmente prevista para la cirugía convencional. Estos datos son también comparables o incluso mejores que los publicados recientemente para el implante femoral de este tipo de prótesis4,8,12 y los obtenidos en nuestra propia población con acceso femoral.
Tanto el acceso a la arteria axilar por cualquiera de los abordajes descritos como la posterior sutura por el cirujano son relativamente fáciles y tienen la ventaja con respecto a la vía femoral, donde las complicaciones vasculares son potencialmente graves, que, al encontrarse expuesta la arteria, la resolución de un eventual problema es más rápida y de consecuencias menos serias, ya que, en el caso extremo de tener que ligar la arteria, se mantendría el flujo sanguíneo entre el tórax y el brazo a través de las anastomosis arteriales existentes entre las distintas ramas de la arteria subclavia y la axilar, conocidas como el círculo arterial periescapular16. Los pacientes toleran bien el postoperatorio del acceso axilar, con la ventaja de poder iniciar una pronta deambulación si las circunstancias del paciente lo permiten. Otra de las ventajas de esta técnica se refiere a la navegabilidad del dispositivo; a diferencia del acceso femoral, el introductor se aloja en la aorta ascendente, por lo que el dispositivo llega casi hasta la válvula protegido por el propio introductor, al contrario de lo que ocurre en el acceso femoral, donde el sistema liberador recorre libre retrógradamente la aorta desde su porción torácica descendente hasta el plano valvular aórtico, lo que conlleva, en ocasiones, embolia de placas de ateroma, sobre todo en su paso a través del cayado, donde sufre el mayor grado de rozamiento. Por esto mismo, el control que se tiene sobre la válvula a la hora de la liberación es mayor que en el acceso femoral, pues se transmiten los movimientos de tensión o relajación ejercidos sobre el catéter de liberación de forma casi directa en relación 1:1, lo que aporta un extra de control en el posicionamiento de la prótesis. Esta particularidad ya ha sido descrita antes por otros autores13 y también en el caso del acceso transapical con la prótesis SAPIEN17. Sin embargo, no hay evidencia de que esto se traduzca en mayores tasas de éxito o mejores resultados a corto o medio plazo.
Un aspecto importante relacionado con este tipo de acceso es el de los pacientes revascularizados con AMII. En nuestra serie se incluyó a 2 pacientes, uno de ellos se realizó por AAD y en el otro, realizado por la AAI, se produjo una disección proximal en la propia AMII, que se consiguió solventar con el implante de un stent sin implicaciones pronósticas para el paciente. No está claro qué procedimiento seguir con estos pacientes: para algunos autores supone una contraindicación absoluta13, mientras que otros han publicado alguna experiencia exitosa18. En nuestra opinión, no debe ser una contraindicación, aunque sí se deben tomar precauciones, como localizar la AMII de forma adecuada y no progresar el introductor de 18 Fr más allá de ella para no producir isquemia en el territorio dependiente y minimizar el riesgo de una complicación vascular. Además, quizá sea preferible un abordaje axilar, ya que, al ser un acceso más distal en la arteria axilar, permite avanzar el introductor unos centímetros más adentro de la arteria antes de posicionarlo anterior al origen de la AMII, lo que aporta un poco más de estabilidad al sistema.
La incidencia de ACV durante el IPVA es aproximadamente del 10%8. La causa más frecuente es la liberación de partículas de placas de calcio durante la valvuloplastia de la válvula nativa o de la pared de la aorta durante el avance del dispositivo, sobre todo a nivel del cayado aórtico, donde se produce una gran fricción. Evitar esta fricción a nivel del cayado y que la válvula avance hasta casi el plano valvular aórtico protegida por el introductor serían ventajas adicionales del acceso axilar en la reducción del número de embolias. Hay que extremar las precauciones en la manipulación de los dispositivos y en el manejo de la medicación antiagregante y anticoagulante en pacientes con riesgo, a fin de disminuir la tasa de ACV.
La endocarditis infecciosa (EI) precoz es una complicación poco frecuente pero potencialmente mortal, ya que el tratamiento antibiótico suele ser ineficaz por el importante sustrato anatómico para el posible acantonamiento de los gérmenes. El tratamiento quirúrgico de la EI en estos pacientes con elevado riesgo, al que se añade una situación de inestabilidad, es muchas veces inasumible. Por este motivo, en estos pacientes, en los que se expone quirúrgicamente la arteria mediante incisión cutánea, debemos prestar especial atención a las medidas antisépticas y el tratamiento antibiótico, ya que el riesgo de infección durante el acto quirúrgico es mayor.
La necesidad de implantar marcapasos definitivo por bloqueo auriculoventricular de alto grado tras el procedimiento fue del 44,4%, una incidencia superior a la comunicada por otros autores, que la sitúan ligeramente por encima del 30%4,19. Estimamos que esta diferencia se debe al azar o a que los pacientes, por tener mayor riesgo y más comorbilidades, pudieran tener también alteraciones basales de la conducción con más frecuencia, ya que no encontramos una explicación dependiente de la vía de acceso; además, si lo comparamos con el número de pacientes en los que usamos la arteria femoral como vía de acceso en nuestra serie y necesitaron implante de marcapasos, este también fue mayor, pero sin alcanzar significación estadística (el 44 frente al 35%; p=0,446).
En el futuro, los avances tecnológicos harán que el perfil de los dispositivos sea cada vez de menor calibre y los pacientes que queden excluidos del acceso femoral sean proporcionalmente menos. Sin embargo, siempre existirá un porcentaje de pacientes que podrán beneficiarse de accesos alternativos como el axilar, cuya seguridad y eficacia aumentarán según se acumule más experiencia.
ConclusionesEl acceso axilar para el implante de prótesis aórtica biológica percutánea CoreValve® en pacientes con contraindicación para el acceso femoral se ha demostrado en nuestra serie como una alternativa eficaz y segura, con resultados comparables a los del acceso femoral tanto en nuestra serie como en otras series publicadas, pese a tratarse de pacientes con mayor riesgo quirúrgico. El uso de este abordaje alternativo aumenta el número de pacientes que pueden beneficiarse de esta técnica, que en los últimos años ha experimentado un gran auge, avalada por sus buenos resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Recibido 30 Abril 2010
Aceptado 14 Agosto 2010
Autor para correspondencia: Urb. Rua Das Flores, 37A. 15896 Roxos-Santiago de Compostela, A Coruña, España. birihh@yahoo.es