La vitamina D es fundamental para el metabolismo óseo y mineral y se han identificado receptores de la vitamina D en el corazón y los vasos sanguíneos, lo que ha suscitado el estudio de posibles efectos cardiovasculares (CV) de esta molécula. En varios estudios epidemiológicos, el déficit de vitamina D se asocia con un mayor riesgo CV. Los resultados de los ensayos clínicos aleatorizados y controlados con placebo no han demostrado que administrar suplementos de vitamina D a la población general produzca una reducción de eventos CV. Sin embargo, estos ensayos clínicos no se centraron en las personas con déficit de vitamina D o en población con cardiopatía previa. En este artículo se revisan los estudios que han asociado el déficit de vitamina D como un marcador de riesgo de enfermedad CV y su relación con los factores de riesgo CV y la fisiopatología de la ateroesclerosis, así como la situación actual de los suplementos de vitamina D en los eventos CV y la mortalidad en la población general.
Palabras clave
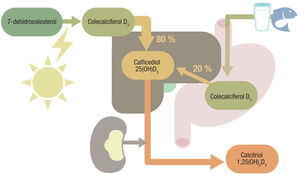
La vitamina D fue la cuarta vitamina en ser descubierta a principio del siglo xx. Inicialmente se la consideró una molécula activa capaz de curar el raquitismo, pero hoy se sabe que es una molécula precursora de su metabolito activo, que es el calcitriol. Procede de 2 rutas, una minoritaria por ingesta de alimentos (huevo, leche, sardinas…) y la ruta mayoritaria, que se debe a la producción de colecalciferol cuando la piel se expone directamente al sol a partir del 7-dehidrocolesterol (sintetizado en el hígado). En el hígado el colecalciferol es hidroxilado y se transforma en 25-OH-colecalciferol o calcifediol forma parcialmente activa que circula en plasma con una vida media de unos 15 días. En los riñones, el calcidiol se hidroxila de nuevo para dar lugar a la forma activa de la vitamina D, el 1,25-dihidroxicolecalciferol o calcitriol (figura 1).).
La vitamina D realiza su acción a través de unos receptores denominados VDR. Se ha puesto de manifiesto la presencia de VDR en casi todos los tejidos humanos, por lo que su actividad no se centra exclusivamente en la regulación del metabolismo fosfocálcico encargado de la homeostasis del hueso, sino que presenta funciones más complejas en distintos sistemas del organismo, como los sistemas inmu- nitario, cardiovascular (CV), renal o gastrointestinal.
La hipótesis de que el déficit de vitamina D podría ser perjudicial para el sistema cardiovascular fue planteada a principios de los años ochenta por Robert Scragg. Pensaba que el aumento de las enfermedades cardiovasculares en invierno podría ser un resultado de bajas concentraciones de calcifediol como consecuencia de una menor exposición a la luz solar durante este periodo1. Esta hipótesis estimuló la investigación sobre los posibles beneficios cardiovasculares de la vitamina D, y en los últimos años se han publicado muchos estudios clínicos y epidemiológicos que destacan la asociación entre concentración de vitamina D y enfermedades CV, ateroesclerosis e hipertensión arterial.
El objetivo de esta revisión es definir qué es el déficit de vitamina D, así como revisar los principales estudios que han demostrado que la vitamina D es un factor protector de enfermedad CV. Se resumen los resultados que respaldan la relación del déficit de vitamina D con los factores de riesgo CV como la diabetes, con los eventos CV y la mortalidad y, finalmente, se revisa la situación actual sobre el efecto de los suplementos de vitamina D en los eventos CV y la mortalidad en la población general.
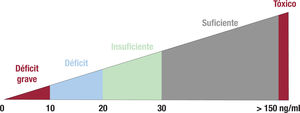
Déficit de vitamina DEl estado de la vitamina D se evalúa midiendo el calcifediol en sangre. Al hablar de déficit de vitamina D, se hace referencia al calcifediol, porque es la forma circulante más abundante y fácil de medir en sangre; además, como su síntesis no está regulada por hormonas, refleja muy bien el estado de la vitamina D, es decir, la cantidad de sustrato que tiene el organismo para ejercer acciones tanto endocrinas como autocrinas. Según el Instituto de Medicina de la National Academy of Sciences de Estados Unidos, los valores entre 20 y 30 ng/ml se consideran insuficientes y los < 20 ng/ml, deficientes2 (figura 2).). Hay una alta prevalencia de déficit de vitamina D en la población general aplicando estos criterios, pero existen dudas sobre a qué pacientes suplementar3.
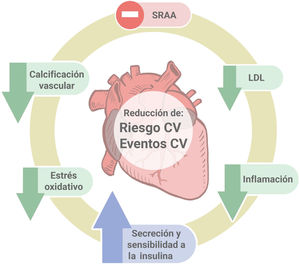
Asociación de la vitamina D con la fisiopatología de la ateroesclerosisLos mecanismos fisiopatológicos que relacionan a la vitamina D con la enfermedad CV son múltiples (figura 3).).
Calcificación vascularLa calcificación arterial conlleva pérdida de distensibilidad y aumento de la rigidez vascular. La patogénesis de la calcificación arterial es un proceso activo y sujeto a regulación4.
El papel de la vitamina D en la calcificación vascular podría ser un «arma de doble filo», ya que pueden inducirla tanto la deficiencia como el exceso de vitamina D5. Por un lado, los ratones knockout de VDR desarrollan una calcificación vascular significativa6 que establece una asociación entre el déficit de estímulo de vitamina D y la calcificación vascular. Por otro lado, el déficit de vitamina D lleva a un aumento de la absorción intestinal de calcio. Se ha objetivado que el hueso de los pacientes con enfermedad renal crónica tiene reducida la capacidad para fijar el calcio, y el calcio absorbido contribuye a la calcificación vascular incluso en ausencia de cambios en el calcio sérico7. Además, los estímulos inflamatorios promueven la microcalcificación con actividad osteogénica a través de la conversión fenotípica de las células musculares lisas vasculares (CMLV) en células similares a los osteoblastos. Este proceso esta mediado por el gen Runx2 en las CMLV8. El calcitriol aumenta la expresión del ARNm de Runx2 (Cbfal) y de la osteocalcina en la aorta, independientemente del producto calcio-fosfato9, lo que favorecería la actividad osteogénica y con ello la calcificación vascular.
Reducción del estrés oxidativo y la inflamaciónLa estimulación de VDR retrasa la progresión de la ateroesclerosis y reduce significativamente la expresión del estrés oxidativo y la inflama- ción10. En modelos animales, el empleo de agonistas del receptor de la vitamina D se ha asociado con la reducción de la inflamación y el estrés oxidativo y previene la formación de placas en ratones ApoE-/-13. Se ha demostrado que el calcidiol reduce la expresión de genes proinflamatorios (TNFa, IL1 e IL6)10y estimula los genes antiinflamatorios (IL10). En el hígado el colecalciferol es hidroxilado y se transforma en 25-OH-cole- calciferol o calcifediol o calcidiol. Además, el calcitriol inhibe las células TH1-17 y afecta a las funciones de las células dendríticas.
En pacientes en hemodiálisis, la administración de agonistas del VDR disminuye las concentraciones plasmáticas de proteína C reactiva de alta sensibilidad (hs-CRP), factor de necrosis tumoral alfa (TNFa) e interleucina 6 (IL-6)11. Sin embargo, en pacientes con diabetes mellitus tipo 2 y enfermedad renal crónica en estadio 3–4, la administración del agonista del VDR no induce una disminución significativa en las citocinas inflamatorias (TNFa, IL-6, proteína C reactiva, proteínas de superficie endotelial, molécula de adhesión intercelu- lar-1 y proteína quimiotáctica de monocitos-1)12.
Relaciones con el sistema renina-angiotensinaEl déficit de vitamina D aumenta la síntesis de renina y angioten- sina II13. Los efectos sistémicos de la vitamina D en la presión arterial pueden explicarse por el papel del calcitriol como regulador negativo del sistema renina-angiotensina. Se ha objetivado en estudios in vitro que el calcitriol inhibe la expresión del gen de la renina14.
Asociación entre el déficit de vitamina D y los distintos factores de riesgo cardiovascularLípidosLos efectos de la vitamina D en el metabolismo de los lípidos son objeto de estudio. Por un lado, se ha objetivado que la activación del VDR suprime la expresión de la apolipoproteína AI, el principal componente del colesterol unido a lipoproteínas de alta densidad (cHDL). Además, podría aumentar indirectamente la absorción de grasas en el intestino ya que, debido al aumento de la absorción de calcio inducida por la vitamina D, podría reducir la formación de los jabones de ácidos grasos que se excretan en las heces15. Por el contrario, otra hipótesis es que el aumento de la absorción de calcio inducido por la vitamina D podría haber una reducción de la concentración sérica de triglicéridos al disminuir su formación hepática a través de un efecto sobre el calcio hepatocelular16.
En un metanálisis publicado de 14 estudios publicados, parece que los suplementos de vitamina D frente al placebo tienen un efecto beneficioso en la reducción de la concentración sérica de colesterol total, colesterol unido a lipoproteínas de baja densidad (cLDL) y triglicéridos, pero no afectan al cHDL17.
Hipertensión arterialLas propiedades antihipertensivas de la vitamina D podrían estar mediadas por la supresión del sistema renina-angiotensina, como ya se ha comentado. En un metanálisis de estudios prospectivos que incluyeron a 283.537 participantes y 55.816 casos de hipertensión, el riesgo de hipertensión se reduce un 11% (odds ratio [OR] = 0,88; IC95%, 0,81–0,97) por cada incremento de 10 ng/ml respecto al calcidiol basal18.
Diabetes mellitusVarios estudios preclínicos indicaron que la activación del VDR tiene propiedades antidiabéticas: aumento de la secreción de insulina y la sensibilidad a la insulina, así como la protección contra la disfunción de las células β inducida por citocinas y la muerte de las células P19. Además, la vitamina D también podría prevenir la diabetes mellitus mediante acciones antiinflamatorias y el aumento de las células T reguladoras que protegen contra las enfermedades autoinmunitarias y la ateroesclerosis20.
En un metanálisis publicado en 2018, los resultados proporcionaron pruebas prometedoras de que los suplementos de vitamina D podrían mejorar el control glucémico y atenuar la resistencia a la insulina en personas prediabéticas21.
Sin embargo, en 2019 se publicó un ensayo clínico con más de 2.400 pacientes prediabéticos con un periodo de seguimiento de 2,5 años. Los participantes fueron asignados aleatoriamente a vitamina D diaria (4.000 UI) o a placebo, independientemente de la concentración sérica de vitamina D de referencia. El ensayo no mostró diferencias significativas en el desarrollo de diabetes (hazard ratio [HR] = 0,88; IC95%, 0,751,04; p = 0,12)22. En el análisis de subgrupos preespecificado, el riesgo de contraer diabetes de los participantes con vitamina D < 20 ng/ml o > 20 ng/ml fue el mismo. Pero en un análisis post hoc de los datos de los participantes con cifras basales de vitamina D < 12 ng/ml (n = 103), los pacientes con suplementos de vitamina D tenían menor riesgo de contraer diabetes (HR = 0,38; IC95%, 0,18–0,80).
Asociación entre el déficit de vitamina D y la morbimortalidad cardiovascularEventos cardiovascularesEn varios estudios observacionales en población general, cifras bajas de vitamina D se han asociado con mayor riesgo de varios factores de riesgo CV, como la hipertensión, la obesidad, la diabetes mellitus y el síndrome metabólico23, y con más incidencia de enfermedad coronaria24 e ictus25.
En estudios realizados en pacientes con enfermedad CV estable, los valores de calcidiol < 20 ng/ml siguieron asociados de manera independiente a eventos CV (HR = 1,30; IC95%, 1,01-1,67)26,27. Sin embargo, el mecanismo fisiopatológico exacto que explica la influencia de la vitamina D en la aparición de la enfermedad CV sigue siendo objeto de debate y no se conoce bien. Así, nosotros encontramos que las cifras de vitamina D bajas solo predicen una mayor incidencia de eventos CV en los pacientes con valores aumentados del factor 23 de crecimiento fibroblástico (FGF23)26. Se trata de otro componente del sistema del metabolismo mineral que es antagónico a la vitamina D en sus efectos y tiene carácter proinflamatorio28. Estos hallazgos muestran la relación entre la concentración plasmática de vitamina D y otros componentes del metabolismo mineral.
En un estudio in vitro con células musculares lisas de aorta, el déficit de vitamina D se asoció con un aumento de la producción local de angiotensina II, lo que podría explicar la senescencia vascular prematura. Esto indica que la vitamina D modula la proliferación de las células musculares lisas vasculares (desde la reparación normal de la pared vascular hasta la hiperproliferación de las células musculares lisas vasculares mediada por el sistema renina-angiotensina)23. En otro estudio en modelos animales, la administración de paricalcitol redujo la fibrosis vascular (1,6% ± 0,3%; p < 0,05) en ratones con sobrecarga de presión (por constricción aórtica transversal), lo que se asoció con una mejora de los índices de relajación y contracción del ventrículo izquierdo29.
MortalidadEn verano se produce una disminución de las muertes relacionadas con enfermedades CV y en invierno hay un aumento, y se ha especulado que uno de los mecanismos que podrían explicar esta diferencia en mortalidad sería la concentración sérica de vitamina D, menor durante el invierno30.
En un estudio clínico en el que participaron 1.237 personas de Italia y Suiza, se observó que, en los pacientes con insuficiencia cardiaca crónica y estable, un cociente calcitriol/PTH más bajo podía ser un factor independiente predictivo de mortalidad e ingresos por motivos CV31.
Potenciales efectos cardioprotectores de la suplementación con vitamina DUna revisión Cochrane de ensayos aleatorizados encontró que ningún tipo de suplemento de vitamina D (colecalciferol, ergocalciferol, alfacalcidol), cualesquiera fueran la dosis, la duración y la vía de administración, tuvo efectos beneficiosos en la mortalidad estadísticamente significativos frente a placebo. Cuando se evaluaron las diferentes formas de vitamina D por separado, solo la vitamina D2 disminuyó la mortalidad de manera significativa (RR = 0,94; IC95%, 0,91-0,98), pero no el alfacalcidol o el calcitriol32.
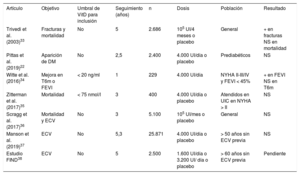
La tabla 1). resume los principales estudios prospectivos con suplementos de vitamina D.
Principales estudios prospectivos publicados o pendientes de publicación con suplementos de vitamina D
| Artículo | Objetivo | Umbral de VitD para inclusión | Seguimiento (años) | n | Dosis | Población | Resultado |
|---|---|---|---|---|---|---|---|
| Trivedi et al. (2003)33 | Fracturas y mortalidad | No | 5 | 2.686 | 105 UI/4 meses o placebo | General | + en fracturas NS en mortalidad |
| Pittas et al. (2019)22 | Aparición de DM | No | 2,5 | 2.400 | 4.000 UI/día o placebo | Prediabéticos | NS |
| Witte et al. (2016)34 | Mejora en T6m o FEVI | < 20 ng/ml | 1 | 229 | 4.000 UI/día | NYHA II-III/IV y FEVI < 45% | + en FEVI NS en T6m |
| Zitterman et al. (2017)35 | Mortalidad | < 75 nmol/l | 3 | 400 | 4.000 UI/día o placebo | Atendidos en UIC en NYHA > II | NS |
| Scragg et al. (2017)36 | Mortalidad y ECV | No | 3 | 5.100 | 105 UI/mes o placebo | General | NS |
| Manson et al. (2019)37 | ECV | No | 5,3 | 25.871 | 4.000 UI/día o placebo | > 50 años sin ECV previa | NS |
| Estudio FIND38 | ECV | No | 5 | 2.500 | 1.600 UI/día o 3.200 UI/ día o placebo | > 60 años sin ECV previa | Pendiente |
Tabla de elaboración propia. DM: diabetes mellitus; ECV: eventos cardiovasculares; FEVI: fracción de eyección del ventrículo izquierdo; NS: no significativo; NYHA: clase funcional de la New York Heart Association; T6m: test de los 6 min de marcha; UIC: unidad de insuficiencia cardiaca; VitD: vitamina D.
El estudio VIDA es un ensayo aleatorizado de 3 años de duración realizado en Nueva Zelanda con más de 5.000 personas sin enfermedad CV de base. Se incluyó a los pacientes independientemente de sus valores basales de vitamina D. Recibieron suplementos de 100.000 UI de vitamina D mensualmente, y no hubo diferencias significativas en la incidencia de eventos CV mayores (HR = 1,02; IC95%, 0,871,20)36. Es de destacar que este estudio incluyó únicamente un 2% de pacientes (91 participantes) con cifras basales < 10 ng/ml, lo que podría explicar la ausencia de beneficio clínico.
El estudio VITAL es un ensayo aleatorizado, a doble ciego y controlado con placebo sobre los beneficios de la vitamina D (vitamina D3 2.000 UI/día) y el ácido graso omega-3 marino (1 g/día) en la prevención primaria del cáncer y la enfermedad CV en más de 25.000 pacientes. El seguimiento medio fue de 5,3 años. Se conocía la concentración basal de vitamina D de un 61% de los pacientes, una media de 30,8 ng/ml. En el grupo suplementado con vitamina D no se objetivó una menor incidencia de eventos CV que en el grupo tratado con placebo (HR = 0,97; IC95%, 0,85-1,12; p = 0,69) y en el análisis de subgrupos preespecificado, no hubo diferencia entre los participantes con vitamina D < 20 ng/ml o > 20 ng/ml (HR = 1,09 frente a HR = 1,00; p = 0,75), teniendo en cuenta que los pacientes con cifras < 20 ng/ml representaban únicamente el 8% de la población del estudio con solo 34 eventos en cada brazo37.
El ensayo finlandés sobre la vitamina D (FIND) es un estudio de 5 años de duración sobre los beneficios y riesgos de la vitamina D en la prevención primaria de enfermedades CV y cáncer. El FIND evaluará la incidencia de cáncer y enfermedad CV en los brazos de vitamina D frente al brazo de placebo entre 2.500 varones de 60 años o más y mujeres de 65 años o más38. Ya se ha completado la inclusión de pacientes, pero los resultados aún no se han publicado.
En cuanto a estudios de suplementos de vitamina D en el área CV, destaca el ensayo VINDICATE34, que incluyó a pacientes con disfunción sistólica del ventrículo izquierdo crónica. Tras 1 año de tratamiento, los suplementos de vitamina D no mejoraron la distancia recorrida en 6 min, que era el objetivo primario, aunque sí se produjo una leve mejoría de la fracción de eyección, que era uno de los objetivos secundarios. Por otra parte, el estudio PRIMO incluyó a pacientes con enfermedad renal crónica e hipertrofia del ventrículo izquierdo con fracción de eyección conservada39. Tras 1 año de tratamiento con vitamina D, no hubo mejoría en el remodelado ventricular medido por resonancia magnética. Sin embargo, cabe decir que ambos estudios analizaron a pacientes con cardiopatía de larga duración, y 1 año parece insuficiente para que se aprecien reversiones en unos cambios morfológicos producidos en largo tiempo. Nuestro grupo está trabajando sobre el efecto de la vitamina en un modelo de infarto agudo para analizar el posible efecto de los suplementos de vitamina D en el remodelado miocárdico, ya que a partir de este evento comienza un fenómeno de remodelado que sí se podría limitar con un tratamiento experimental. Por esa razón, nuestro grupo está llevando a cabo el ensayo clínico VITDAMI (Vitamin D in Acute Myocardial Infarction) para estudiar el efecto de los suplementos de vitamina D (calcifediol) en el remodelado del ventrículo izquierdo tras un infarto de miocardio anterior, cuyos resultados se conocerán en 202340.
ConclusionesEl déficit de vitamina D es un marcador de riesgo CV, y esto está respaldado por la literatura actual. A la luz de los estudios publicados, no hay pruebas de que los suplementos de vitamina D disminuyan el número de eventos CV en la población general.
Con otros factores de riesgo —por ejemplo, la dislipemia o la hipertensión—, hay relación directa entre valores altos de colesterol o presión arterial y eventos CV, pero en estos casos, estaría recomendado el tratamiento de la hipovitaminosis D a partir de un determinado umbral, que varía en función de las características clínicas del paciente, para reducir los eventos clínicos. Sin embargo, no hay estudios que respalden la administración indiscriminada de estatinas o antihipertensivos a la población general sin tener en cuenta las cifras de colesterol o la hipertensión. Otro ejemplo sería la diabetes mellitus. Actualmente se sabe que no todos los fármacos antidiabéticos orales son iguales, y algunos de ellos pueden tener un efecto neutro o deletéreo en la evolución CV de los pacientes pese a controlarse adecuadamente el perfil metabólico41.
Así pues, dadas las múltiples posibilidades en cuanto a suplementa- ción de vitamina D, como la molécula, el esquema de administración o la causa de la hipovitaminosis, y que la mayoría de los estudios no tenían como criterio de inclusión un umbral concreto de concentración plasmática de vitamina D, pensamos que son necesarios estudios más específicos centrados en pacientes con cifras bajas de vitamina D (≤ 20 ng/ ml) para determinar el valor protector del suplemento de vitamina D. Otro dato que tener en cuenta es la concentración plasmática de otros componentes del metabolismo mineral, pues no se puede descartar que los suplementos de vitamina D sean más efectivos en determinados subgrupos como, por ejemplo, los pacientes con FGF23 aumentado.
AgradecimientosLas figuras han sido adaptadas por Guido Rodríguez-de-Lema- Tapetado y Juan Sánchez-Verde-Bilbao, de la Unidad de Ilustración de la Fundación Jiménez Díaz.
FinanciaciónEste trabajo ha sido apoyado por becas del Fondo de Investigaciones Sanitarias (PS09/01405, PI10/00072, P17/01615, PI 20/00923), RTC2019-006826-1, Sociedad Española de Cardiología, Fundación Española del Corazón y Sociedad Española de Arteriosclerosis.
Contribución de los autoresTodos los autores han contribuido sustancialmente a la concepción, el diseño y la redacción del artículo.
Conflicto de interesesFAES Farma financia parcialmente el ensayo clínico VITDAMI, llevado a cabo por los autores.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Sistema endocrino de la vitamina D y enfermedades cardiovasculares», que ha sido patrocinado por FAES Farma.