El sistema endocrino de la vitamina D es esencial para mantener la homeostasis del calcio y el fósforo y para prevenir el raquitismo y la osteomalacia. La mayor parte de la vitamina D circulante procede de la síntesis cutánea, por acción de la radiación ultravioleta en el 7-dehidrocolesterol. Solo un 10–20% de la requerida procede de la dieta. Tras una primera hidroxilación hepática, la vitamina D sintetizada en la piel o provista por la dieta se transforma en 25-hidroxivitamina D, compuesto de vida media larga que se utiliza en la clínica como estimador de los depósitos corporales de esta vitamina. Posteriormente, una segunda hidroxilación en el túbulo renal lo transforma en un compuesto activo, el 1,25-dihidroxivitamina D, que se une al receptor intracelular de vitamina D y es capaz de regular la expresión de un gran número de genes. Desde hace años se conocen múltiples efectos extraesqueléticos de la vitamina D, como son la regulación de la función muscular, el crecimiento celular, el sistema inmunitario y la defensa contra las infecciones. Estudios clínicos han relacionado los trastornos de la vitamina D con la aparición de diabetes mellitus, cáncer, enfermedades autoinmunitarias, trastornos metabólicos y enfermedad cardiovascular. La deficiencia de vitamina D es un serio problema de salud pública, dado que su prevalencia alcanza proporciones pandémicas. Por ello, diversas sociedades científicas han definido criterios de insuficiencia y deficiencia de esta vitamina y han emitido recomendaciones para prevenir y tratar esta deficiencia y sus consecuencias clínicas.
Palabras clave
El sistema hormonal de la vitamina D está formado por una serie de compuestos esteroideos derivados del 7-dehidrocolesterol, sus proteínas transportadoras y sus receptores celulares. Ese sistema desempeña un papel fundamental en la regulación del metabolismo óseo, el control del metabolismo fosfocálcico, la modulación del sistema inmunitario, la síntesis de mediadores inflamatorios, la presión arterial y varios procesos implicados en la multiplicación y la diferenciación celulares. Los trastornos por deficiencia grave de este sistema causan anomalías del metabolismo del calcio y el fósforo (hipocalcemia, hipofosfatemia, hiperparatiroidismo secundario), así como raquitismo y osteomalacia en niños y osteomalacia en adultos1.
El término vitamina D se refiere tanto al ergocalciferol (vitamina D2) como al colecalciferol (vitamina D3). La vitamina D2, de origen vegetal, se encuentra en hongos y levaduras, y habitualmente esta y sus metabolitos no se detectan en la circulación. La vitamina D3, colecalciferol, se encuentra principalmente en el aceite de hígado de pescado, los pescados grasos, la yema de huevo, el hígado y los riñones2. Existen pocas fuentes naturales de vitamina D en la dieta, por lo que la principal vía de adquisición de vitamina D para la especie humana es, con mucho, la exposición de la piel a la luz solar.
Biosíntesis y metabolismoSíntesis cutánea y absorción intestinalLa radiación ultravioleta B (UVB) alcanza la epidermis y, en las membranas plasmáticas de los queratinocitos, inicia la síntesis de vitamina D3 (colecalciferol) mediante una reacción no enzimática en 2 pasos3. En el primero, el 7-dehidrocolesterol (provitamina D3) se transforma en precolecalciferol (previtamina D3), un compuesto termodinámicamente inestable. El segundo paso consiste en una isomerización térmica que tiene lugar a la temperatura corporal y convierte el precolecalciferol en una molécula estable, el colecalciferol. La exposición prolongada a los rayos UVB induce la conversión del precolecalciferol en lumisterol y taquisterol, así como la fotoconversión del colecalciferol en 5,6-transvitamina D3 y supraesteroles I y II, lo que constituye un mecanismo de regulación de la producción epidérmica de la vitamina D3 que evita la toxicidad por exceso de exposición solar4.
Por lo tanto, la síntesis epidérmica de vitamina D depende de factores externos que condicionan la cantidad de radiación ultravioleta que alcanza la piel. Entre ellos, el ángulo cenital solar —que depende de la latitud, la estación y la hora del día—, la concentración de ozono en la atmósfera, la contaminación atmosférica con compuestos orgánicos volátiles y el uso de cremas de protección solar. Pero también depende de factores individuales como la pigmentación cutánea, la edad y la obesidad. Por ello, muchas situaciones en que la exposición al sol es escasa se acompañan de deficiencia de esta vitamina y hacen preciso suplementaria1,5.
Por otra parte, el colecalciferol y el ergocalciferol de la dieta se incorporan a los quilomicrones y se absorben en el sistema linfático, a través del cual entran en la circulación. Estos compuestos, junto con la vitamina D3 sintetizada en la piel, circulan unidos a la proteína transportadora de vitamina D (DBP) y, en menor grado, a la albúmina6,7.
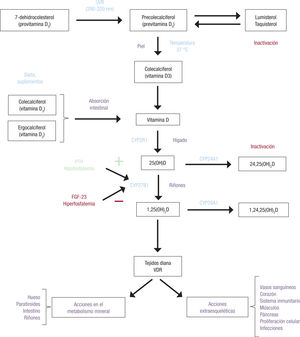
Activación de la vitamina DLa conversión de la vitamina D en su compuesto activo requiere una doble hidroxilación (figura 1).). La primera de ellas tiene lugar en el hígado, donde la mayoría de la vitamina D de la circulación se hidroxila en posición 25 a través de la enzima mitocondrial citocromo P450 25-hiroxilasa (CYP2R1), lo que da lugar a la 25-hidroxivitamina D —25(OH)D3, calcidiol o calcifediol—. La segunda hidroxilación acontece, principal pero no exclusivamente, en las células epiteliales del túbulo proximal renal, a través de la 1a-hidroxilasa (CYP27B1), que transforma la 25(OH)D3 en el metabolito activo, la 1,25-dihidroxivita- mina D8 —1,25(OH)2D o calcitriol—.
Representación esquemática de la síntesis, el metabolismo y las acciones del sistema endocrino de la vitamina D. La previtamina D, sintetizada en la epidermis por acción de la radiación ultravioleta B (UVB) sobre el 7-dehidrocolesterol, se transforma a la temperatura corporal en vitamina D o se inactiva, de modo reversible, a taquisterol y lumis- terol. La vitamina D obtenida por síntesis cutánea, junto con la absorbida en el intestino procedente de la dieta, se hidroxila en el hígado por acción de la 25-hidroxilasa (CYP2R1), lo que da lugar a la 25-hidroxivitamina D —25(OH)D3—, compuesto inactivo que circula en plasma unido a la proteína transportadora de vitamina D (DBP) y cuya concentración constituye un marcador bioquímico del estado corporal de esta vitamina. Una segunda hidroxilación renal por la 1α-hidroxilasa (CYP27B1) da lugar a la vitamina D activa, 1,25-di- hidroxivitamina D —1,25(OH)2D o calcitriol—. Esta síntesis está controlada por la fosfatemia, la hormona paratiroidea (PTH) y el factor de crecimiento fibroblástico 23 (FGF-23). La enzima 24-hidroxilasa (CYP24A1) transforma en metabolitos inactivos tanto la 25(OH)D3 como la 1,25(OH)2D. La unión de la 1,25(OH)2D al receptor intracelular de vitamina D (VDR) en los tejidos diana da lugar a las distintas acciones esqueléticas y extraesqueléticas de este sistema endocrino. Figura de elaboración propia.
El colecalciferol adquirido por irradiación solar y dieta se almacena en el músculo y el tejido adiposo, desde donde se libera progresivamente para una producción continua de calcidiol y calcitriol9. De los aproximadamente 250 μg diarios que pueden generarse diariamente a través de la irradiación solar, solo 1–2 μg se convierten en calcitriol. Tanto 25(OH)D3 como 1,25(OH)2D circulan unidos a la mencionada DBP y la albúmina6,7. Solo un 1–2% de la vitamina D circula libre10. La vida media funcional del 25(OH)D3, cuando se genera a partir de los depósitos tisulares de colecalciferol, es de 2-3 meses, mientras que la del 1,25(OH)2D es alrededor de 8 h, por lo que el 25(OH)D3 se utiliza en clínica como marcador bioquímico del estado corporal de vitamina D11.
Mecanismo de acciónEn los últimos años ha habido cierto debate en torno a la consideración de estos compuestos como vitaminas u hormonas. Una visión integradora es la proporcionada recientemente por Vieth9, que establece que únicamente el colecalciferol cumple la definición de vitamina, ya que se trata de una sustancia orgánica, presente en mínimas cantidades en la alimentación natural, que es esencial para el metabolismo y cuya ausencia de la dieta causa una enfermedad por deficiencia. El 25(OH)D3, por su parte, se ajusta a la definición de prehormona, ya que es un producto de secreción con poca o nula potencia biológica que se convierte periféricamente en una hormona activa. Por último, el 1,25(OH)2D es una sustancia formada en un tejido, transportada en la circulación a otros órganos y con capacidad de alterar la actividad funcional del órgano diana, es decir, se ajusta a la definición de hormona. Por lo tanto, el calcitriol es el metabolito hormonalmente activo del sistema hormonal D, mientras que el colecalciferol es un precursor inactivo.
Tras su disociación de la DBP, el 1,25(OH)2D se une al receptor cito- sólico de vitamina D (VDR) de los órganos diana. Esta unión induce en este cambios conformacionales en el receptor que conducen a su heterodimerización con el receptor retinoide X (RXR) y a la translocación de este complejo al núcleo, donde se une a los elementos respondedores a vitamina D en la región promotora de los genes diana. Ello da lugar a la síntesis de proteínas reguladas por la vitamina D12.
RegulaciónLa producción hepática de 25(OH)D3 no está regulada, y ello implica que, a mayor cantidad de vitamina D ingerida o sintetizada en la epidermis, mayor será la concentración de 25(OH)D3 circulante. Esta característica, junto con la prolongada vida media, hacen que sus concentraciones plasmáticas se utilicen en clínica como la mejor estimación de los depósitos de vitamina D de una persona1.
El calcitriol es el único metabolito del sistema hormonal D que está sometido a una estrecha regulación por la fosfatemia, la hormona paratiroidea (PTH) y el factor de crecimiento fibroblástico 23 (FGF-23) para mantener las concentraciones séricas de calcio y fósforo dentro de unos márgenes relativamente estrechos. En concreto, una reducción de la calcemia estimula la síntesis de PTH que, a su vez, activa la 1α-hidroxilasa renal. La hipofosfatemia también estimula la 1α-hidro- xilación renal. La hiperfosfatemia y el FGF-23, hormona fosfatúrica producida en los osteocitos, inhibe la 1a-hidroxilasa y activa la 24-hidroxilasa. El gen que codifica esta enzima, CYP24A1, se induce no solo por el FGF-23, sino también por 1,25(OH)2D y 25(OH)D3, por lo que se considera un factor crítico en el relativamente amplio margen terapéutico de la vitamina D13. La consecuencia de la acción de la 24-hidroxilasa es la conversión del calcifediol y calcitriol en los meta- bolitos inactivos 24,25-dihidroxivitamina D y 1,24,25-trihidroxivita- mina D respectivamente. Estos compuestos dan lugar al ácido calci- troico y metabolitos conjugados como glucuronatos y sulfatos que se eliminan por la bilis, entre otros, lo que constituye un sistema de regulación catabólica del sistema hormonal de la vitamina D14.
Acciones del sistema endocrino de la vitamina DEl control del metabolismo óseo y mineral se ejerce gracias a las acciones de la 1,25(OH)2D en el intestino (aumento de la absorción intestinal de calcio y fósforo), riñón (aumento de la reabsorción tubular de ambos), hueso (facilitación de la osteoclastogénesis y regulación de la producción de proteínas implicadas en la mineralización ósea) y paratiroides (inhibición de la secreción de PTH), a través de las cuales se consigue mantener una adecuada homeostasis esquelética y unas concentraciones séricas normales de calcio y fósforo1.
Sin embargo, una peculiaridad del sistema endocrino de la vitamina D es que tanto el VDR como la 1α-hidroxilasa están presentes en tejidos diferentes de los directamente implicados en el metabolismo óseo y mineral. En concreto, el VDR se expresa en casi todas las células, y se estima que aproximadamente el 3% del genoma humano se regula por la 1,25(OH)2D15. Además, la enzima 1α-hidroxilasa (CYP27B1) se expresa en diversos tejidos aparte de los riñones, por lo que la síntesis del metabolito activo puede ser autocrina o paracrina en estos tejidos extrarrenales, que también pueden catabolizar la 1,25(OH)2D16.
Estas características pueden explicar los llamados efectos extraesqueléticos de la vitamina D, que incluyen vías genómicas y no genó- micas y abarcan un amplio espectro de acciones que afectan a la función muscular, el crecimiento celular y el riesgo de cáncer, la adhesión celular, el sistema inmunitario y la defensa contra las infecciones, el sistema cardiovascular, la diabetes y otras alteraciones metabóli- cas11,17,18. Además, se ha demostrado que la 1,25(OH)2D puede tener efectos epigenéticos que afectan a los genes diana de la vitamina D y modifican la conformación de histonas, y por lo tanto la accesibilidad de la cromatina, lo que explicaría las diferentes sensibilidades individuales a las concentraciones de 25(OH)D319.
En particular, en lo que se refiere al sistema cardiovascular, se han encontrado VDR en los principales tipos celulares del sistema cardiovascular, tales como células endoteliales, fibras musculares lisas vasculares, cardiomiocitos, plaquetas, macrófagos y otras20. En estudios animales, la ablación del VDR provoca un aumento en la producción de renina y angiotensina II, lo que conduce a hipertensión e hipertrofia cardiaca20. Los animales knockout para el VDR muestran también aumento de la trombogenicidad y la calcificación vascular21.
Los estudios observacionales en humanos han mostrado una asociación entre bajas concentraciones de vitamina D y el riesgo de hipertensión y enfermedad cardiovascular22. Sin embargo, un meta- nálisis de 46 ensayos no mostró beneficio de la suplementación de vitamina D en la presión arterial sistólica o diastólica23. Distintos estudios prospectivos también han mostrado una relación inversa entre los valores séricos de 25(OH)D3 y el riesgo de enfermedad cardiovascular24. No obstante, los estudios de suplementación con vitamina D no han logrado demostrar un efecto significativo en resultados cardiovasculares como el infarto de miocardio y el ictus25–29.
Dos ensayos clínicos recientes, el VITAL30 y el ViDA31, han concluido que la suplementación con vitamina D no da lugar a una menor incidencia de eventos cardiovasculares en comparación con el placebo. En el ensayo DO-Health32, tampoco se encontraron beneficios significativos de la suplementación con vitamina D en los 2 objetivos primarios de naturaleza cardiovascular que se analizaron.
Deficiencia del sistema endocrino de la vitamina DDefiniciónNo existen definiciones universalmente aceptadas de insuficiencia y deficiencia de vitamina D, ya que los diferentes expertos y sociedades científicas han adoptado criterios dispares, si bien todos emplean la concentración sérica de 25(OH)D3 como marcador integral del estado de vitamina D5,11,33. Así, el Institute of Medicine en 2011 consideraba que la concentración sérica mínima de 25(OH)D3 necesaria para el mantenimiento de la salud es de 20 ng/ml34, mientras que otros especialistas apuntaban valores entre 20 y 50 ng/ml16. En su guía de práctica clínica de 2011, la Endocrine Society definió la deficiencia como cifras de 25(OH)D3 < 20 ng/ml y la insuficiencia, como valores entre 21 y 29 ng/ml35.
La falta de coincidencia entre los diferentes autores puede explicarse por los distintos criterios utilizados para definir el nivel óptimo de 25(OH) D3 que incluyen el necesario para obtener una máxima supresión de PTH o lograr una adecuada absorción intestinal de calcio o el nivel apropiado para evitar un determinado evento clínico como, por ejemplo, las fracturas. Según una reciente declaración de una conferencia internacional de expertos36, se considera suficiencia de vitamina D una concentración de 25(OH)D3 > 20 ng/ml. La insuficiencia de esta vitamina se define como valores entre 12 y 20 ng/ml, mientras que los < 12 ng/ml indican deficiencia. Los valores > 100 ng/ml conllevan un riesgo de toxicidad por vitamina D. Todos los autores están de acuerdo en que deben evitarse las concentraciones de 25(OH)D3 < 10 ng/ml en todas las edades2.
En nuestro país, la Sociedad Española de Endocrinología y Nutrición (SEEN) recomienda mantener concentraciones séricas de 25(OH) D3 entre 30 y 50 ng/ml para conseguir los beneficios de salud que aporta la vitamina D37. La Sociedad Española de Investigación Ósea y Metabolismo Mineral (SEIOMM) recomienda estos mismos valores para pacientes con osteoporosis o riesgo de fractura38.
CausasLas necesidades de vitamina D en población sana oscilan entre 400 y 800 UI diarias (10-20 μg/día), dependiendo de la edad de los sujetos, el tipo de piel y otros factores condicionantes como la exposición solar, el embarazo o la comorbilidad, por lo que muchos países han editado guías con sus propias recomendaciones2. Algunas sociedades, como la SEIOMM, recomiendan una ingesta diaria de 800 UI de vitamina D para la población general adulta, 800-1.000 UI para las mujeres posmenopáusicas y los varones mayores de 50 años y de 8002.000 UI para los pacientes con osteoporosis o fracturas o los ancianos institucionalizados38.
Dado que el 80–90% de la vitamina D requerida procede de la producción cutánea, resulta claro que una exposición solar insuficiente es la principal causa de deficiencia de vitamina D. Algunos expertos consideran que una exposición solar de 10-15 min 2-3 veces a la semana de la cara, los brazos y las piernas es suficiente para lograr valores adecuados de vitamina D. Sin embargo, la eficiencia de la síntesis epidérmica de esta vitamina depende del fototipo cutáneo. Los fototipos caucásicos muestran una eficiencia de síntesis 5–10 veces superior a la de los fototipos altos39. Cabe recordar aquí que la edad avanzada se acompaña de una disminución de la síntesis cutánea de vitamina D y que la aplicación de cremas con filtro de radiación ultravioleta reduce la síntesis cutánea de vitamina D. Además, la mayor parte de España se encuentra por encima del paralelo 35°, donde la posibilidad de sintetizar vitamina D es escasa en invierno38.
La deficiencia de vitamina D puede tener otras causas distintas de la falta de exposición solar, como son la disminución de su absorción intestinal (como sucede en los trastornos que cursan con síndrome de malabsorción) y algunos trastornos del metabolismo del sistema hormonal D (deficiencia de 25-hidroxilación hepática, deficiencia de 1α-hidroxilación renal como sucede en la insuficiencia renal crónica, el hipoparatiroidismo y el raquitismo dependiente de vitamina D tipo I). Diversos fármacos, como antiepilépticos, antirretrovirales, glucocorti- coides e inmunosupresores, incrementan el catabolismo de la vitamina D. Otras causas de deficiencia de este sistema endocrino son el hiperpa- ratiroidismo, la enfermedad de Paget, las enfermedades granulomato- sas crónicas, algunos linfomas, el síndrome nefrótico, las anomalías del receptor de 1,25(OH)2D y el raquitismo dependiente de vitamina D tipo II35,37,38. Por otra parte, es bien conocido que la obesidad se acompaña de una reducción de la biodisponibilidad de vitamina D, ya que el exceso de grasa corporal se comporta como un almacén de vitamina D y altera la cinética entre los depósitos y la circulación40.
Cribado de deficiencia de vitamina DLa mejor actitud para la detección de la deficiencia del sistema endocrino de la vitamina D es un tema controvertido en la comunidad científica. Una reciente revisión de la evidencia disponible ha concluido que, hasta la fecha, ningún estudio ha evaluado los beneficios o riesgos del cribado de esta deficiencia41. En el momento actual, no se recomienda la cuantificación de la 25(OH)D3 sérica como cribado sistemático de la deficiencia de vitamina D en la población general. Sin embargo, tanto las guías internacionales35,42 como las españolas37,38 recomiendan determinar la 25(OH)D3 de las personas con determinados factores de riesgo de hipovitaminosis D (tabla 1).). Los factores de riesgo considerados no solo son las clásicas alteraciones esqueléticas asociadas con deficiencia de vitamina D, sino también los síndromes de mala absorción de cualquier etiología, las enfermedades granulo- matosas y otras enfermedades crónicas como la insuficiencia renal o hepática. Se debe incluir también a los pacientes en tratamiento con medicaciones que interfieren con el metabolismo de la vitamina D y grupos de población especiales como los ancianos con antecedente de caídas o fracturas no traumáticas, los obesos, las personas con exposición solar insuficiente y las mujeres embarazadas o lactantes35,37,38.
| Trastornos esqueléticos |
|---|
| Raquitismo |
| Osteomalacia |
| Osteoporosis |
| Enfermedad ósea de Paget |
| Síndromes de malabsorción |
| Fibrosis quística |
| Enfermedad inflamatoria intestinal |
| Enfermedad de Crohn |
| Cirugía bariátrica |
| Enteritis rádica |
| Enfermedades granulomatosas |
| Sarcoidosis |
| Tuberculosis |
| Histoplasmosis |
| Coccidiomicosis |
| Berilioisis |
| Otras enfermedades crónicas |
| Enfermedad renal crónica |
| Enfermedad hepática |
| Hiperparatiroidismo |
| Hipoparatiroidismo |
| Algunos linfomas |
| Fármacos |
| Anticonvulsivos |
| Antirretrovirales |
| Antifúngicos |
| Glucocorticoides |
| Colestiramina |
| Grupos especiales |
| Embarazo y lactancia |
| Niños y adultos con obesidad |
| Ancianos con antecedente de caídas |
| Ancianos con antecedente de fracturas no traumáticas |
| Razas no caucásicas |
| Personas con exposición solar insuficiente |
| Desnutrición o riesgo de desnutrición |
La deficiencia de vitamina D afecta a cientos de millones de personas en todo el mundo y se considera un serio problema de salud pública global5,43–45. Según un estudio reciente46, las prevalencias en Europa de valores de 25(OH)D3 < 20 ng/ml y < 12 ng/ml son del 40,4 y el 13,0% respectivamente. En algunos grupos de población como niños, mujeres y ancianos de países con niveles de ingresos bajos o intermedios, la prevalencia de valores < 10-12 ng/ml oscila entre un 40 y un 90%47. En España se ha estimado que la prevalencia de valores de 25(OH)D3 < 20 ng/ml es del 80-100% de las personas mayores de 65 años y del 40% de los menores de esa edad37.
Aunque el raquitismo ha dejado de ser un problema de salud pública en los países desarrollados, las formas más leves de deficiencia de vitamina D son extraordinariamente frecuentes en nuestro medio, y múltiples estudios epidemiológicos, así como la evidencia experimental, las han relacionado con enfermedades graves y comunes como cáncer, diabetes, obesidad, trastornos inmunológicos, infecciones y, como ya se ha comentado, enfermedad cardiovascular48. Recientemente se ha formulado la hipótesis de una relación entre la vitamina D y la enfermedad por SARS-CoV-2 (COVID-19), ya que algunos estudios retrospectivos y transversales han mostrado que la deficiencia de esta vitamina se asocia tanto con un aumento del riesgo de infección por SARS-CoV-249 como a una enfermedad más grave50,51.
Tratamiento de pacientes deficitariosEn España están disponibles diferentes preparados farmacéuticos para el tratamiento de personas deficitarias. La SEEN recomienda utilizar colecalciferol o cacifediol. El cacitriol y el alfacalcidol no deben utilizarse habitualmente como suplementación para pacientes con deficiencia de vitamina D, por su mayor riesgo de hipercalcemia. Estos agentes deben reservarse para trastornos específicos con imposibilidad de síntesis de 1,25(OH)2D como el hipoparatiroidismo y la insuficiencia renal.
El colecalciferol y el cacifediol son eficaces y seguros y pueden emplearse para la prevención y el tratamiento de la deficiencia de vitamina D. El calcifediol presenta una vida media más corta, es 3–6 veces más potente y tiene mayor rapidez de acción que el colecalciferol en el tratamiento de la deficiencia de vitamina D52,53. Además, el calcifediol presenta mejores tasas de absorción intestinal y es preferible para los pacientes que presenten interferencia en la síntesis hepática de 25(OH)D337’38’54.
Las dosis empleadas dependerán de la etiología, los condicionantes clínicos y la gravedad de la deficiencia. Para las personas con deficiencia grave de vitamina D —25(OH)D3 < 10 ng/ml—, el tratamiento puede comenzar con calcifediol 266 pg/semana durante 5 semanas o colecalciferol 50.000 UI/semana durante 4-6 semanas, para posteriormente continuar con pauta de insuficiencia. En personas con insuficiencia de vitamina D —25(OH)D3 entre 10 y 25-30 ng/ ml—, el tratamiento sería calcifediol 266 μg/mes o colecalciferol 25.000 UI/mes o, si se prefiere, 800 UI/día. Para poblaciones en riesgo como obesos, ancianos y pacientes con osteoporosis o fracturas, las dosis de mantenimiento pueden incrementarse a calcifediol 266 pg cada 3–4 semanas o colecalciferol 50.000 UI/mes o 1.0002.000 UI/día.
Además se recomienda acompañar la suplementación de vitamina D con una adecuada ingesta de calcio (1.000-1.200 mg/día), preferentemente con los alimentos, y ejercicio físico de moderada intensidad, sobre todo para los pacientes con osteoporosis o riesgo de fracturas38. El control del tratamiento se realiza a intervalos de 3–4 meses y, una vez alcanzadas las concentraciones séricas de 25(OH) deseadas se debe continuar con dosis de mantenimiento para evitar un nuevo déficit37.
ConclusionesEl sistema endocrino de la vitamina D presenta algunas peculiaridades que lo hacen único. Una de ellas es la singularidad de la síntesis cutánea de la vitamina D mediante una serie de reacciones químicas puestas en marcha por la radiación UVB. Otra de ellas es la ubicuidad del VDR y el hecho de que este sistema controle una nada despreciable cantidad de genes, de modo que es capaz de regular funciones celulares en los más diversos órganos y sistemas10,15,18. La vitamina D activa —1,25(OH)2D— puede actuar no solo como una hormona, sino también vía autocrina y paracrina en diversos órganos. Estas acciones pleiotrópicas son origen de los efectos no clásicos —esto es, extraesqueléticos— de la vitamina D8, entre los que destacan sus conocidas acciones en el sistema inmunitario, la defensa contra las infecciones, la proliferación celular y el sistema cardiovascular. En este último ámbito, aunque los estudios epidemiológicos han mostrado que la deficiencia de vitamina D se asocia con trastornos como la hipertensión,la cardiopatía isquémica y la insuficiencia cardiaca25–27, los ensayos clínicos realizados hasta la fecha no permiten concluir que su suplementación reduzca el riesgo de enfermedad cardiovascular30–32. No obstante, estos ensayos tienen sus limitaciones, ya que solo incluyeron un pequeño porcentaje de sujetos con insuficiencia o deficiencia de vitamina D, por lo que la falta de beneficios no debe excluir su prescripción para las indicaciones reconocidas10.
La necesidad de estudio en este campo resulta evidente tanto para los investigadores básicos y clínicos como para los epidemiólogos. Es llamativo que, aunque el descubrimiento de la cuarta vitamina ocurrió hace ya un siglo55, son todavía muchas las lagunas de conocimiento sobre su fisiopatología y sus implicaciones en la salud y la enfermedad. Además, desde un punto de vista sociosanitario, las autoridades con competencias en salud pública deberían tener en cuenta el hecho de que la deficiencia de ese sistema hormonal afecta a mil millones de personas45.
FinanciaciónEste trabajo se ha elaborado sin ninguna fuente de financiación.
Conflicto de interesesJ. Díez declara haber recibido honorarios de FAES ajenos a este proyecto.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Sistema endocrino de la vitamina D y enfermedades cardiovasculares», que ha sido patrocinado por FAES Farma.