El síndrome de Marfan es una enfermedad hereditaria que afecta al tejido conectivo. Estudios experimentales recientes indican que la utilización de losartán en pacientes con síndrome de Marfan podría prevenir la progresión de la enfermedad. En el presente artículo se describen el diseño y los principales objetivos de un ensayo clínico para evaluar la eficacia y la seguridad del losartán frente al atenolol en la prevención de la dilatación de la aorta en pacientes con este síndrome.
MétodosSe trata de un ensayo clínico en fase IIIb y coordinado en dos centros. Se incluirá a 150 pacientes diagnosticados de síndrome de Marfan según los criterios de Gante, con edades comprendidas entre 5 y 60 años. El estudio será aleatorizado y a doble ciego en grupos paralelos en tratamiento con la misma dosis de atenolol o losartán (50 mg al día en pacientes con menos de 50 kg y 100 mg al día en pacientes con más de 50kg). Se valorarán el tamaño y la distensibilidad de la aorta mediante ecocardiografía y resonancia magnética. El seguimiento será de 3 años.
ConclusionesEste ensayo clínico permitirá evaluar la eficacia del losartán frente al atenolol en la prevención de la dilatación de la aorta y en la mejora de su distensibilidad, así como la incidencia de eventos adversos. También aportará información sobre el beneficio terapéutico en relación con la edad y la dilatación basal de la aorta.
Palabras clave
El síndrome de Marfan (SM) es una enfermedad hereditaria que afecta al tejido conectivo y se transmite de forma autosómica dominante. La incidencia estimada es de 1/3.000-5.000 nacimientos, sin diferencias entre razas. Se la considera entre las más frecuentes de las denominadas «enfermedades raras»1, 2, 3. El defecto genético básico se debe a una mutación en el gen que codifica la fibrilina, proteína necesaria para el adecuado ensamblamiento de las fibras de colágeno. Según este modelo, las microfibrillas anómalas que conforman la matriz extracelular originarían un tejido conectivo «débil», que sería el origen de las anomalías que sufren estos pacientes. Pero esta teoría estructural no revela la patogenia de diversas manifestaciones como el sobrecrecimiento óseo, la osteopenia, la reducción de masa muscular o las anomalías craneofaciales3. Recientemente varios estudios han investigado la función regulatoria de las microfibrillas en la matriz extracelular, lo que indica un mecanismo patogénico diferente. Así, usando modelos animales demostraron que muchas de las manifestaciones pulmonares, cardiovasculares y esqueléticas se deben a una sobreactivación del factor de crecimiento transformador beta (TGFβ), que a su vez es un inductor de fibrosis, tiene actividad proinflamatoria y activa ciertas metaloproteinasas4, 5. Para algunos autores, la combinación de las alteraciones estructurales en la matriz extracelular unidas a una desregulación de la homeostasis mediada por un exceso en la expresión de TGFβ explicaría la mayoría de las manifestaciones que sufren estos pacientes6, 7.
El espectro clínico es muy variable. Puede haber afección del aparato locomotor, oftálmica, cardiovascular o dérmica, entre otras. La supervivencia está determinada principalmente por la severidad de la afección cardiovascular, y la afección aórtica (rotura o disección aórtica) es la más frecuente causa de muerte8. Alrededor del 90% de los pacientes con SM tendrán una complicación cardiovascular durante su vida, como cirugía de la raíz aórtica, disección de aorta o cirugía de la válvula mitral.
Varios estudios han señalado un efecto beneficioso del tratamiento con bloqueadores beta (BB) en pacientes con SM9, 10, 11, 12 y han demostrado una disminución en la velocidad de crecimiento de la aorta, además de un menor número de complicaciones. Otros estudios realizados con fármacos antihipertensivos, como antagonistas del calcio o inhibidores de la enzima de conversión de la angiotensina, también han objetivado un efecto similar o incluso superior al de los BB13, 14.
Habashi et al6 han demostrado en ratones con mutación de la fibrilina 1 que el losartán (un antagonista del receptor AT1 de la angiotensina II) puede prevenir la progresión de la dilatación de aorta y otras alteraciones propias del SM. La arquitectura de la pared de la aorta mostró un deterioro progresivo en los ratones no tratados y en los tratados con propanolol, mientras que los tratados con losartán tenían a los 6 meses una aorta no distinguible de los ratones sanos. El losartán mejoró también otras manifestaciones no cardiovasculares correlacionadas con la disminución del TGFβ, dado que la presión arterial (PA) y la frecuencia cardiaca disminuyeron de forma similar en los tratados con BB y losartán. Estos datos indican que el efecto del losartán está mediado esencialmente por antagonizar el TGFβ. Con base en estos avances, se está llevando a cabo un estudio de investigación patrocinado por el National Heart, Lung and Blood Institute (Clinical Trials.gov), en 20 hospitales en Estados Unidos, Canadá y Europa, que compara el atenolol y el losartán, a fin de ver cuál es mejor para disminuir la tasa de dilatación de la aorta en niños y adultos jóvenes que tienen SM con una dilatación > 3 desviaciones estándar respecto a la media (Z score > 3).
El propósito del presente estudio es comparar la eficacia y la seguridad del losartán frente al atenolol en la prevención de la dilatación de la aorta en pacientes con este síndrome.
MétodosDiseñoEstudio en fase IIIb, coordinado en dos centros (Hospital Universitario 12 de Octubre de Madrid y Hospital Universitario Vall d’Hebron de Barcelona), aleatorizado y a doble ciego, en grupos paralelos, para evaluar la eficacia y la seguridad del losartán frente al atenolol en la prevención de la dilatación progresiva de la aorta en pacientes con SM.
Población del estudioEstará formada por los sujetos con edad comprendida entre 5 y 60 años que cumplan los criterios diagnósticos de SM descritos en Gante15. También se incluirán los casos que presenten aortas mínimamente dilatadas. Este diseño aportará información sobre el comportamiento y la actividad de estos fármacos en las fases iniciales de la dilatación de la aorta. En esta línea, Shores et al9 ya describieron que el tratamiento preventivo con BB tiene más efecto cuanto menos dilatada esté la aorta. Aunque la población pediátrica sea la que teóricamente más pueda beneficiarse de un tratamiento para enlentecer el crecimiento de la aorta, creemos que también es interesante analizar el subgrupo de población adulta. Precisamente a estos pacientes mayores de 25 años no se los incluye en el estudio multicéntrico anteriormente descrito, y obtener datos sobre el comportamiento de estas aortas es interesante, especialmente cuando es en esta población en la que se produce la mayoría de las complicaciones (disección o rotura de la aorta). Los criterios de inclusión y exclusión se presentan en la Tabla 1. Con base en estimaciones derivadas de estudios previos, un tratamiento eficaz sobre la dilatación de la aorta sería aquel que fuese capaz de disminuir el número de pacientes en los que el ritmo de crecimiento del diámetro aórtico supere el valor de 1 mm/año y, por lo tanto, en 3 años tuvieran un crecimiento > 3 mm. La resonancia magnética es la técnica con mayor precisión y reproducibilidad en la medición de los diámetros aórticos y detecta cambios de 1 mm. El tamaño de muestra necesario para detectar estos cambios con una potencia de 0,8 y un nivel de confianza del 95% se estima en 60 pacientes por rama. Asumiendo a lo largo del estudio pérdidas o retiradas de alrededor de un 7-10%, el tamaño necesario estimado sería de 75 pacientes en cada rama de tratamiento. El tamaño muestral previsto para el estudio será de 150 pacientes (100 en el Hospital 12 de Octubre y 50 en el Hospital Vall d’Hebron). Esta distribución obedece a que el volumen de pacientes adscritos a la Unidad de Marfan del Hospital 12 de Octubre era más elevado, al ser la primera unidad de esta patología en el país.
Tabla 1. Criterios de inclusión y exclusión
| Criterios de inclusión | Edad comprendida entre 5 y 60 años |
| Diámetro máximo de la aorta, en toda su extensión, < 45 mm | |
| En mujeres en edad fértil, resultado de gonadotropina negativa en la prueba de embarazo | |
| Criterios de exclusión | |
| Generales | En mujeres: embarazo, deseo de embarazo, sospecha de embarazo o lactancia |
| Participación en curso en otro ensayo clínico o que haya recibido el fármaco en investigación en el mes anterior a su inclusión en el estudio | |
| Incapacidad de cumplir con el protocolo del estudio | |
| Enfermedad en estudio | Antecedentes de cirugía previa: cardiaca o en cualquier segmento de la aorta |
| Clase funcional III-IV | |
| Diámetro máximo de la aorta > 45 mm | |
| Afección valvular más que ligera | |
| Antecedentes | Antecedentes o presencia de insuficiencia respiratoria, hepática, renal (aclaramiento de creatinina < 30 ml/min), gastrointestinal, hemática, endocrina o cualquier otra situación que a criterio del investigador pueda afectar a la evaluación del tratamiento en estudio |
| Antecedentes de disección de la aorta | |
| Antecedentes o presencia de enfermedad neurológica (especialmente convulsiones, demencia, etc.) | |
| Antecedentes o presencia de consumo excesivo de alcohol y/o sustancias tóxicas | |
| Síndrome depresivo clínicamente no controlado | |
| Tratamientos | Cualquier necesidad de otro fármaco asociado con efecto antihipertensivo |
| Hipersensibilidad, intolerancia o contraindicación a alguno de los componentes del fármaco en estudio | |
Se establecerá a priori la lista de aleatorización para asignar a cada paciente su tratamiento. Por otro lado, se prepararán sobres dobles, conteniendo el número de sujeto, su asignación a tratamiento A/tratamiento B, y la asignación de A/B a cada uno de los dos tratamientos. Uno de ellos lo tendrá el médico encargado de ajustar la dosis de la medicación y el otro se mantendrá sellado hasta que se proceda al cierre de la base de datos o sea requerida su apertura por algún motivo. Todos los sobres, abiertos o no, serán recogidos al finalizar el estudio. Todos los sujetos que cumplan todos los criterios de inclusión y no presenten ningún criterio de exclusión serán aleatorizados el día 0 a uno de los dos brazos de tratamiento. Los tratamientos serán atribuidos a los sujetos según su orden cronológico de inclusión en el estudio dentro de cada centro. Cada caja de medicación tendrá en su exterior una etiqueta con el número de tratamiento y contendrá en su interior una descripción del tratamiento adjudicado.
A los pacientes que estuvieran recibiendo alguno de los dos fármacos (losartán o atenolol), se aplicará un «tiempo de aclaramiento» previo de 2 semanas. Una vez confirmado que cumple criterios de inclusión en el estudio y obtenido su consentimiento informado, el servicio de farmacia asignará de forma aleatorizada el tratamiento que corresponda al paciente. Sólo el servicio de farmacia sabrá el tratamiento farmacológico que recibe el paciente. Se utilizará como fármaco experimental el losartán en comprimidos, administrado vía oral. La dosis inicial será 25mg/día para pacientes con peso > 50 kg y de 12,5mg/día para un peso < 50 kg. A los 15 días, dependiendo de la tolerancia clínica y el resultado del Holter de PA, se elevará a 50mg/día y a 25mg/día respectivamente. Al año de tratamiento, si es tolerable, se doblará la dosis a todos los pacientes. El fármaco control empleado será el atenolol administrado vía oral, con la misma dosificación que el losartán. Si aparecen síntomas compatibles con hipotensión y la monitorización de PA evidencia cifras sistólicas < 100mmHg, se disminuirá la dosis. Ambos fármacos se administrarán durante los 3 años de duración del estudio. En caso de intolerancia a dosis mínimas, se suspenderá el tratamiento.
Variables de estudio y evaluación de respuesta a los fármacosLa variable principal es la progresión de la dilatación de la aorta. Su elección se fundamenta en que los pacientes con SM experimentan una dilatación progresiva de aorta, que es la manifestación cardiovascular más frecuente. Se medirán los diámetros en los diferentes segmentos de la aorta (anillo aórtico, senos de Valsalva, unión sinotubular, aorta ascendente, arco aórtico, aorta torácica y aorta abdominal) mediante resonancia magnética y estudio ecocardiográfico.
Las variables secundarias son: a) eventos adversos durante el seguimiento (disección o rotura de aorta, necesidad de intervención sobre la aorta o el corazón y muerte); b) efectos adversos del losartán y del atenolol; c) distensibilidad de la pared de la aorta mediante resonancia magnética y ecocardiografía; d) estudio mediante ecocardiografía de la válvula aórtica, la válvula mitral, la función ventricular y el tamaño del ventrículo izquierdo, y e) evolución de la ectasia dural mediante resonancia magnética en pacientes con edad < 12 años. Además, estas variables secundarias determinarán la seguridad del losartán frente al atenolol.
El calendario de evaluación clínica y por técnicas de imagen se detalla en la Tabla 2.
Tabla 2. Calendario de evaluaciones del paciente
| Basal | 6 meses | 12 meses | 24 meses | 36 meses | |
| Consentimiento | X | ||||
| Datos demográficos, peso, talla, IMC y exploración física | X | ||||
| Aleatorización | X | ||||
| Visita clínica | X | X | X | X | X |
| Determinación de PA | X | X | X | X | X |
| Analítica | X | X | X | X | |
| Eco-Doppler | X | X | X | X | X |
| CRM | X | X | |||
| Acontecimientos adversos | X | X | X | X |
CRM: cardiorresonancia magnética; IMC: índice de masa corporal; PA: presión arterial.
A los 15 días del inicio del tratamiento se realizará una entrevista telefónica para valorar posibles efectos adversos y la necesidad de realizar un Holter de PA si se sospechan síntomas secundarios a hipotensión.
Los estudios ecocardiográficos y de resonancia magnética serán realizados por dos únicos observadores expertos en cada técnica de imagen de cada centro. Cada observador realizará de forma independiente y a ciegas los estudios de cada una de las técnicas. Antes de iniciar el estudio se practicarán varios estudios en cada centro y se comprobará que la adquisición sea metodológicamente adecuada. Cada uno de los centros se encargará de las medidas de una de las dos técnicas de imagen realizadas durante todo el estudio. Las medidas serán realizadas por la misma persona, que desconocerá cualquier información clínica o de los resultados de la otra técnica de imagen. Se realizará un estudio de variabilidad intra e interobservador de las variables analizadas.
Ecocardiografía1. Estudio morfológico: especialmente encaminado a diagnosticar la presencia de prolapso mitral y la dilatación de la arteria pulmonar. Las dimensiones aórticas se medirán con eco bidimensional y modo M. Se determinará el diámetro interno del vaso a nivel del anillo aórtico, senos de Valsalva, unión sinotubular, aorta ascendente tubular, aorta descendente torácica y abdominal.
2. Estudio de la biomecánica aórtica:
– La velocidad de la onda de pulso (PWV) se calculará con la fórmula PWV=ΔD/Δt. ΔD será la distancia entre los dos niveles de la aorta en estudio medida sobre la imagen bidimensional y la distancia supraesternal-abdominal medida externamente. Δt será el tiempo de tránsito del pulso entre ambos niveles obtenidos a partir de la proyección supraesternal y la subcostal. Para obtener las Δt se medirá, en el registro Doppler pulsado a cada nivel de la aorta, el tiempo entre una referencia fija del QRS y el inicio del flujo sistólico de la señal Doppler.
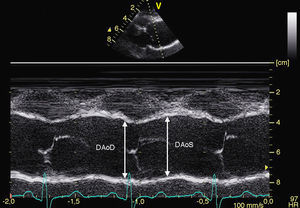
– Para el estudio de la elasticidad aórtica: se medirán los diámetros aórticos en sístole y en diástole en modo M a nivel de los senos de Valsalva aórticos, aorta ascendente y abdominal (Figura 1). Se calcularán los siguientes índices de elasticidad aórtica: strain=[(Ø Ao sistólico – Ø Ao diastólico) / Ø Ao diastólico]×100, y distensibilidad=[2×(Ø Ao sistólico – Ø Ao diastólico]×100 y distensibilidad=[2×(Ø Ao sistólico – Ø Ao diastólico)/(Ao diastólico×PP)] (cm2×din−1×10−6). La presión de pulso braquial (PP) se obtendrá simultáneamente por esfigmomanometría.
Figura 1. Medida de los diámetros aórticos en modo M a nivel de los senos de Valsalva aórticos en sístole y diástole.DAoD: diámetro diastólico aórtico; DaoS: diámetro sistólico aórtico.
Se adquirirán las siguientes secuencias con sincronización electrocardiográfica:
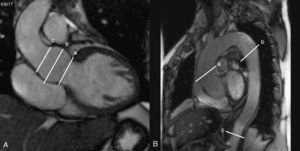
1. Secuencias cine eco-gradiente: se realizarán cortes coronales y sagitales oblicuos de la aorta que servirán de referencia anatómica para la realización de cortes transversales a diferentes niveles aórticos: anillo, aorta ascendente (a nivel de la bifurcación de la pulmonar), aorta descendente (distal al cayado aórtico y a nivel de la bifurcación pulmonar) y aorta abdominal distal al diafragma. Dichas referencias anatómicas servirán para los estudios de seguimiento. Se medirán las dimensiones del anillo aórtico, aorta ascendente, aorta descendente y abdominal. Todos los diámetros serán medidos en dos planos ortogonales y serán divididos por la superficie corporal del paciente para obtener valores indexados (Figura 2). Se medirán las áreas aórticas máximas (sistólicas) y mínimas (diastólicas) a cada nivel. La distensibilidad aórtica se calculará según la ecuación: D=(Amáx−Amín) / (Amín×PP), siendo D la distensibilidad (en mmHg−1), Amáx el área aórtica máxima (sistólica, en mm2), Amín el área aórtica mínima (diastólica, en mm2), y PP la presión de pulso braquial por esfigmomanometría. Se calculará la PP como la diferencia en mmHg entre la presión arterial sistólica (PAS) y la presión arterial diastólica (PAD). También se calculará la PA media: PAD+1/3 (PP).
Figura 2. A: plano coronal de la raíz aórtica en el que se observan los diferentes niveles de corte: a) anillo aórtico; b) senos de Valsalva, y c) unión sinotubular. B: plano sagital oblicuo de la aorta en el que se observan los diferentes niveles de corte: a) aorta ascendente, b) aorta descendente, y c) aorta abdominal.
2. Secuencias de contraste de fase con codificación de velocidad: en los mismos niveles citados previamente para evaluación de la PWV. Se medirá la diferencia de tiempo entre la llegada de la onda de flujo a los diferentes niveles. Se medirá la distancia entre dichos niveles y se calculará la PWV con la misma fórmula usada en el ecocardiograma: PWV=ΔD/Δt.
Se empleará la plataforma de trabajo con el paquete de aplicaciones para el análisis de flujos QFlow 5.1 (Medis, Leiden, Países Bajos).
Análisis estadísticoLos resultados se expresan como media±desviación estándar de valores individuales o como porcentajes. Las medias entre los dos grupos se compararán mediante el test estadístico de la t de Student para dos colas y el test de la U de Mann-Whitney para datos no paramétricos.
El riesgo en los pacientes se estimará valorando la incidencia de eventos adversos. La incidencia acumulada tiende a subestimar el riesgo cuando el seguimiento es corto. La superviviencia libre de eventos es preferible en este caso. Por lo tanto se realizará un análisis de supervivencia según las tablas de Kaplan-Meier para muerte, disección de aorta, rotura de aorta, necesidad de intervención cardiovascular e insuficiencia aórtica.
Los cambios en el diámetro de la aorta son consecuencia de dos procesos: el del propio crecimiento biológico del paciente, fundamentalmente apreciable en niños y adultos jóvenes, y el de la dilatación de la aorta secundaria al defecto en el colágeno propio de la enfermedad. Para tratar estas dos variables, calcularemos un cociente aórtico resultante de dividir el diámetro medido mediante ecocardiograma por el diámetro esperado según superficie corporal, edad y sexo del paciente. Todos los análisis se realizarán con el programa SPSS®(Statistical Package for Social Sciences).
Aspectos éticosEl estudio está autorizado por el Ministerio de Sanidad y Consumo, y ha obtenido el informe favorable de los comités éticos de investigación clínica de ambos hospitales, así como por la Agencia Española del Medicamento. Este estudio se realizará de acuerdo con los principios éticos que tienen su origen en la Declaración de Helsinki y que coinciden con la buena práctica clínica y las normas reguladoras aplicables. No hay ningún conflicto de intereses para ninguno de los autores del estudio y la financiación proviene de una beca de investigación otorgada por el Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III, que igualmente se hace cargo del coste de la medicación del estudio.
DiscusiónLa supervivencia de los pacientes con SM está determinada principalmente por las complicaciones de la afección aórtica (rotura o disección aórtica). Parece incuestionable que los pacientes con SM deben recibir un tratamiento farmacológico para prevenir las complicaciones cardiovasculares, causa del 90% de las muertes de estos pacientes. A pesar de que el uso profiláctico de BB en pacientes con SM está aceptado y es práctica habitual en la mayoría de los centros, se han realizado estudios con otros fármacos hipotensores y se ha demostrado también un efecto beneficioso e incluso superior al de los BB, como en el estudio publicado por Yetman et al13, en el que el enalapril fue superior al propanolol y al atenolol y consiguió mejorar más la rigidez de la aorta y enlentecer su crecimiento. Incluso en un metaanálisis publicado en 2006 por el grupo de Mount Sinai16 concluyen que no hay evidencia de que los BB proporcionen beneficio en el tratamiento de los pacientes con SM.
Recientemente se ha demostrado la utilidad clínica del tratamiento con losartán en niños con SM. Brooke et al17 estudiaron a 18 niños con SM y dilatación de la raíz de aorta tras haber recibido otros tratamientos que no habían sido efectivos para parar o enlentecer el crecimiento progresivo de la aorta. Se administró losartán a 17 niños e irbesartán a 1, y se les dio seguimiente durante 12-47 meses. A pesar de ser una cohorte pequeña y muy específica, se observó que con el uso de ambos fármacos se redujo de forma significativa la progresión en el crecimiento de la raíz de la aorta. El losartán es un antagonista oral del receptor AT1 de la angiotensina II18. Además de su efecto antihipertensivo, el bloqueo del receptor AT1 induce un descenso en la concentración plasmática de TGFβ, un descenso en la repuesta celular mediada por genes y un descenso en la concentración de mediadores intracelulares de la cascada de señalización del TGFβ, como el Smad 219, 20, 21. Además, no interfiere con el receptor AT2 que, a diferencia del AT1, ejerce una acción intracelular beneficiosa, con efecto antiproliferativo y antiinflamatorio y contribuye a una correcta homeostasis en la pared aórtica22.
Aunque actualmente hay 6 ensayos clínicos prospectivos y aleatorizados (Tabla 3) que tienen como objetivo analizar la utilidad del losartán frente a los BB (atenolol o nebivolol) o losartán frente a placebo más tratamiento previo, nuestro estudio puede aportar información sobre aspectos difíciles de obtener en los otros ensayos, ya que incluye edades desde los 5 hasta los 60 años, sin exigir un criterio establecido de dilatación mientras sea < 45 mm. Por lo tanto, es previsible que se obtenga información comparativa del beneficio de los dos fármacos en relación con la edad y con la dilatación basal de la aorta. Por otra parte, se va a comparar los resultados ecocardiográficos a una dosis creciente de atenolol y losartán durante el primer año y a dosis máximas toleradas en los 2 años siguientes. El método de referencia para valorar los cambios en los diámetros y las propiedades biomecánicas será la resonancia magnética practicada inmediatamente antes del inicio del tratamiento y a los 3 años de tratamiento, dada su excelente reproducibilidad en las medidas.
Tabla 3. Principales estudios que comparan bloqueadores beta con losartán en el síndrome de Marfan
| Centro | Royal Brompton Harefield NHS Foundation | Hospital Bichat de París | Hospital de Gante | Boston Children's Hospital Pediatric Heart Network | Academic Medical Center Amsterdam | Policlinico S. Matteo |
| País | Reino Unido | Francia | Bélgica | Estados Unidos, Canadá, Bélgica | Países Bajos | Italia |
| Diseño | Multicéntrico | Multicéntrico | Multicéntrico | |||
| Casos, n | 490 | 300 | 174 | 604 | 330 | 291 |
| Edad inclusión (años) | 4-40 | > 10 | > 10 | 0,5-25 | Edad adulta | 1-55 |
| Fármaco | Irbesartán | Losartán | + losartán | Losartán | + losartán | Losartán |
| Dosis diaria | 300 mg | 50mg si < 50 kg; 100mg si > 50 kg | 50mg si < 50 kg; 100 mg si > 50 kg | Atenolol 0,5-4 mg/kg; losartán 0,3-1,4 mg/kg | Losartán 100 mg | Nebivolol 0,16 mg/kg o adultos 10 mg/día; losartán 1,6 mg/kg o 100mg si > 50 kg |
| Tratamiento adicional | Irbesartán (75mg, 1 mes) | No | BB | No | BB | No |
| Fármaco control | Placebo | Placebo | + placebo | Atenolol | + placebo | Nebivolol; losartán + ebivolol |
| Fecha de inicio | Septiembre de 2010 | Septiembre de 2008 | Junio de 2009 | Enero de 2007 | Febrero de 2008 | Julio de 2008 |
| Seguimiento (meses) | 60 | 36 | 36 | 36 | 36 | 48 |
| Objetivos | Variación anual del diámetro de la raíz aórtica (ECO) | Variación del diámetro de aorta a nivel de senos de Valsalva (ECO) | Diámetro de la raíz aórtica ajustado a la superficie corporal, Z-score (ECO) | Variación del diámetro de la raíz aórtica ajustado a la superficie corporal, Z-score (ECO) | Variación del diámetro de aorta en toda su extensión (CRM/TC) | Diámetro de la raíz aórtica ajustado a edad y superficie corporal |
BB: bloqueadores beta; CRM: cardiorresonancia magnética; TC: tomografía computarizada.
El tiempo de seguimiento de 3 años probablemente sea corto para valorar diferencias de eventos clínicos entre los dos grupos. Por este motivo, el objetivo primario es un subrogado obtenido por técnicas de imagen, más que un objetivo clínico primario. Hemos implementado técnicas de diagnóstico por imagen muy robustas para detectar parámetros biomecánicos (elasticidad y rigidez aórtica) que puedan condicionar una futura repercusión clínica. La ausencia de grupo control obedece a razones éticas, ya que está suficientemente demostrado que estos pacientes requieren algún tratamiento farmacológico para prevenir las complicaciones cardiovasculares. La ausencia de un tratamiento con placebo implicará que no podamos evaluar la eficacia real de cada uno de los tratamientos de forma independiente, sino comparar la eficacia de un fármaco respecto a otro. Incluir a niños y adultos puede ser una limitación del estudio si el número total de pacientes incluidos no permite estudiar el efecto del fármaco en estos subgrupos.
ConclusionesEste ensayo clínico aleatorizado compara la respuesta al tratamiento con losartán frente a atenolol en pacientes afectos de SM incluyendo un amplio espectro de edad y casos con aortas mínimamente dilatadas. Además, se evaluarán los posibles efectos adversos y la tolerabilidad del losartán y atenolol en esta población.
Conflicto de interesesNinguno.
Recibido 3 Octubre 2010
Aceptado 13 Febrero 2011
Autor para correspondencia: Servicio de Cirugía Cardiaca, Hospital Universitario 12 de Octubre, Avda. de Andalucía s/n, 28045 Madrid, España. apforteza@yahoo.es