Palabras clave
INTRODUCCIÓN
La imagen de perfusión mediante resonancia magnética cardiaca (RMC) de estrés se utiliza en la práctica clínica diaria1 para la evaluación de pacientes con sospecha de tener enfermedad de las arterias coronarias (EAC).
En un mismo estudio, la RMC permite la evaluación de la disfunción sistólica (DS) y del déficit de perfusión (DP) del miocardio, siendo éstos dos importantes parámetros utilizados para el diagnóstico de EAC significativa2-5. Que estos dos fenómenos ocurran secuencialmente durante la isquemia miocárdica es parte de lo que se ha descrito como «cascada isquémica»6,7.
Sin embargo, desde la llegada de la imagen de perfusión miocárdica utilizando vasodilatadores, el foco de atención se ha desplazado de la DS al DP inducido con estrés utilizando RMC. Los estudios de perfusión con estrés han proporcionado resultados prometedores con una alta precisión para la detección de lesiones angiográficas coronarias significativas4,8. La RMC ofrece una buena resolución temporal y una excelente resolución espacial que permiten la evaluación de ligeros cambios en la contractilidad del miocardio durante el estrés farmacológico; sin embargo, hay poca información sobre el uso diagnóstico de la DS inducida con estrés vasodilatador para la detección de lesiones angiográficas significativas9.
Hemos publicado recientemente que la extensión de la DS en el pico de estrés con dipiridamol es el índice de RMC más relacionado con el pronóstico en pacientes con dolor torácico de perfil coronario10. El objetivo del presente estudio es analizar si la DS inducida ofrece un valor diagnóstico adicional para la detección de la EAC.
MATERIAL Y MÉTODOS
Grupo de estudio
De una población total de 600 pacientes a los que se realizó una RMC de estrés en nuestra institución entre enero de 2003 y mayo de 2007, examinamos retrospectivamente a una población de estudio de 166 pacientes (51 [31%] mujeres; media de edad 65 ± 11 [30-85]) (tabla 1) con dolor torácico de posible origen coronario a los que se realizó una RMC de estrés con dipiridamol y una angiografía coronaria dentro de los 3 meses anteriores o posteriores a la RMC. Los pacientes se sometieron a una RMC debido a una prueba de ejercicio no concluyente en el 18% de los casos, un ECG anormal en reposo en el 26%, incapacidad de realizar ejercicio en el 28% y como la primera elección para la evaluación de la isquemia en el 28% de los casos. La mayoría (88%) de los pacientes se sometieron a una angiografía coronaria después de la imagen por RMC; 20 (12%) se examinaron mediante RMC después de una angiografía coronaria para evaluar la repercusión hemodinámica de una estenosis coronaria de severidad intermedia por angiografía. Se excluyó del análisis a todos los pacientes que habían sufrido una revascularización coronaria, habían tenido un infarto de miocardio los 3 meses anteriores al estudio de RMC o sufrían de cualquier contraindicación para dipiridamol. El protocolo de estudio se aprobó por el comité local de ética y todos los sujetos dieron su consentimiento informado.
Estudio de RMC
Se analizó a todos los sujetos mediante un equipo de 1.5 Teslas (Sonata Magnetom, Siemens, Erlangen, Alemania) utilizando un protocolo previamente descrito10 (fig. 1). Todas las imágenes se adquirieron utilizando una bobina de superficie acoplada en fase, en apnea y con sincronización cardiaca.
Figura 1. Protocolo de estudio de la resonancia magnética cardiaca de estrés con dipiridamol.
Imágenes dinámicas de cine en reposo
Se analizó la función del ventrículo izquierdo utilizando imágenes dinámicas de cine de las vistas de dos, tres y cuatro cámaras, y eje corto utilizando una secuencia de precesión libre en el estado estacionario (tiempo de repetición/tiempo de eco, 2,8/1,2 ms; ángulo de excitación, 58°; matriz 256 x 256; campo de visión, 320 x 270 mm; espesor de corte, 6 mm). De cada paciente y del conjunto de imágenes de cine de la vista de eje corto en reposo, se seleccionaron tres localizaciones de referencia en la base, el ventrículo medio y el ápex, que se repitieron para evaluar la perfusión, el movimiento de la pared en estrés y el realce tardío.
Imagen de perfusión de primer paso
Se indujo la vasodilatación con dipiridamol (0,56 mg/kg de peso corporal durante 4 min y, si el paciente lo toleraba bien, se aumentaba hasta los 0,84 mg/kg administrado de forma intravenosa durante 6 min). Tras la infusión de dipiridamol, se inyectó también de forma intravenosa 0,1 mmol/kg de ácido gadolinio-dietilentriaminopentacético (Magnograf, Schering, Berlín, Alemania) a una velocidad de 5 ml/s. Después se adquirieron, para la imagen de perfusión de primer paso y en ciclos alternos, cinco secciones equidistantes en la vista de eje corto y dos en las vistas de eje largo de dos y cuatro cámaras (secuencia de precesión libre en el estado estacionario con pulso de saturación; tiempo de inversión, 125 ms; tiempo de repetición/tiempo de eco, 202/1 ms; ángulo de excitación, 50°; matriz, 192 x 96; campo de visión, 350 x 220 mm; espesor de corte, 8 mm).
Imágenes de cine en estrés
Una vez alcanzado el pico de realce del miocardio, con el fin de evaluar la función del ventrículo izquierdo en el pico de vasodilatación inducida por el dipiridamol (aproximadamente 2-3 min después de la infusión), se utilizó una secuencia de adquisición rápida de imagen dinámica de precesión libre en el estado estacionario multicorte (tiempo de repetición/tiempo de eco, 35/1,1 ms; ángulo de excitación, 65°; matriz, 192 x 159; campo de visión, 350 x 304 mm; espesor de corte, 8 mm) adquiriendo durante un periodo de 14 s y en una única apnea cuatro cortes en la vista de eje corto, incluyendo las mismas tres localizaciones de referencia definidas en las imágenes dinámicas de cine en reposo.
Imagen de realce tardío
La imagen de realce tardío se adquirió 10 min después de la inyección de contraste en las mismas localizaciones evaluadas para las imágenes de cine en reposo (secuencia de precesión libre en el estado estacionario con recuperación de la inversión segmentada; tiempo de repetición/tiempo de eco, 700/1,26 ms; ángulo de excitación, 45°; matriz, 256 x 184; campo de visión, 340 x 235 mm; espesor de corte, 8 mm). El tiempo de inversión se ajustó para anular la señal del miocardio normal.
Análisis de los datos de RMC
Los estudios de RMC fueron analizados por un observador experimentado (M.P.L.L., 8 años de experiencia) de forma ciega para todos los datos angiográficos y de los pacientes y sin información del orden cronológico de las dos pruebas, utilizando una herramienta-software personalizada (Syngo, Siemens, Erlangen, Alemania). Se cuantificaron los volúmenes telediastólico y telesistólico del ventrículo izquierdo (ml/m2), así como la fracción de eyección (método de Simpson, %) por planimetría directa de los contornos del ventrículo izquierdo en las imágenes de cine de eje corto en reposo. La localización de los segmentos se definió en las secuencias de imagen de cine mediante la aplicación del modelo de 17 segmentos11. Se evaluaron cinco índices derivados de la RMC de estrés con dipiridamol:
1. DS en reposo (DS-reposo). Número de segmentos que muestran hipocinesia, acinesia o discinesia basalmente12.
2. DS con dipiridamol (DS-D). Número de segmentos que muestran hipocinesia, acinesia o discinesia en estrés.
3. DS inducida. Número de segmentos en los que el movimiento de la pared empeora con dipiridamol de la normocinesia a hipocinesia o de la hipocinesia a la acinesia.
4. DP con dipiridamol. Número de segmentos que muestran un retardo persistente (al menos en tres imágenes consecutivas, comparado con los otros segmentos del mismo corte) en el análisis visual del patrón de realce durante el primer paso del contraste a través del miocardio13.
5. Realce tardío (RT). Número de segmentos que muestran realce en imagen de realce tardío.
En un grupo de 20 pacientes evaluados por dolor torácico isquémico y no incluidos en este estudio, la concordancia entre observadores sobre la presencia o ausencia de más de un segmento con índices de RMC anormales fue: DS, 95%; DS-D, 95%; perfusión anormal, 90% y realce tardío, 100%10.
De acuerdo con las consideraciones fisiopatológicas de la cascada isquémica6,7, los pacientes se clasificaron en tres grupos (fig. 2):
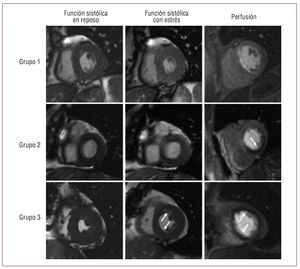
Figura 2. Grupo 1: ejemplo de un paciente sin evidencia de isquemia. Grupo 2: ejemplo de un paciente con déficit de perfusión en el área inferior (flecha) sin disfunción sistólica inducida. Grupo 3: ejemplo de un paciente con presencia simultánea de un déficit de perfusión y una disfunción sistólica inducida en todos los territorios (flechas).
- Grupo 1: sin evidencia de isquemia. Estudio de perfusión normal y sin DS inducida.
- Grupo 2: estudio de perfusión anormal pero sin DS inducida.
- Grupo 3: DS inducida independientemente del DP.
Angiografía coronaria
Los datos de angiografía fueron evaluados por un cardiólogo experto (V.B., 8 años de experiencia), sin conocimiento de la información clínica o de RMC ni del orden cronológico de ambas pruebas, mediante angiografía coronaria cuantitativa en un sistema de imagen digital estándar (HM3000, Philips, Best, Países Bajos). La EAC se definió como una estenosis ≥ 70% de la luz coronaria de una de las tres arterias coronarias principales (o en una rama secundaria con un diámetro ≥ 2 mm) o como una estenosis ≥ 50% del tronco de la coronaria izquierda.
Análisis estadístico
La información continua se expresó como media ± desviación estándar, y se comparó mediante el test de la t de Student para datos no apareados. Las variables categóricas se compararon con el test de la χ2. Para el cálculo de la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo, las variables se categorizaron de acuerdo con el mejor valor de corte obtenido en el análisis de la curva receiver-operating characteristic (ROC) (0-1 segmento frente a > 1 segmento para DS-reposo, DS-D, DS inducida y RT; 0-2 segmentos frente a > 2 segmentos para DP). El punto de corte más alto para DP se eligió debido a la susceptibilidad a los artefactos y el muy alto valor de sensibilidad y baja especificidad inherentes a este índice. La relación entre los resultados de la RMC y la información angiográfica se evaluó con un modelo de regresión logística ajustado por los parámetros clínicos que mostraron un valor de p < 0,2 en el análisis univariable. Se obtuvieron las odds ratio (OR) con su intervalo de confianza (IC) del 95%. El valor adicional de la DS inducida se evaluó mediante la comparación del test estadístico C de un modelo que incluía las características basales y DP con un modelo resultado de añadir la DS inducida. Se consideró estadísticamente significativo un valor de p < 0,05. Se utilizaron los paquetes de estadística SPSS (Versión 13.0, SPSS Inc, Chicago, Illinois, Estados Unidos) y STATA (Versión 9.0, StataCorp, College Station, Texas, Estados Unidos).
RESULTADOS
Se evaluaron los datos de RMC de estrés y los datos angiográficos de los 166 pacientes. Durante el estudio de RMC, el 31% de los pacientes tuvo un episodio de dolor torácico, el 4% mostró disnea, el 1% tuvo cefalea y el 2% de los pacientes experimentó nauseas durante la prueba. El ritmo cardiaco basal fue de 68 ± 12 y 85 ± 13 lat/min después del estrés con dipiridamol (p < 0,0001). Las presiones sanguíneas sistólica y diástolica basales fueron de 144 ± 24/84 ± 14 y 140 ± 25/81 ± 14 mmHg después de la prueba (p = 0,059 y p = 0,07, respectivamente). La fracción de eyección media del ventrículo izquierdo determinada mediante RMC fue del 61% ± 13%. La angiografía coronaria se llevó a cabo dentro de los 3 meses anteriores o posteriores al estudio de RMC (media de la ventana temporal, 16 ± 32 días). Ningún paciente tuvo ningún tipo de evento cardiaco entre ambas pruebas.
Resultados de la RMC
Los estudios de resonancia magnética revelaron al menos un índice de RMC anormal en 139 (84%) pacientes; 69 (42%) tuvieron DS-reposo; 104 (63%) mostraron DS-D; en 53 (32%) pacientes se observó DS inducida; 128 (77%) pacientes presentaron DP y 68 (41%) tuvieron una imagen de realce tardío anormal.
Resultados angiográficos
La angiografía coronaria fue anormal en 119 (72%) pacientes. La angiografía coronaria detectó 209 lesiones coronarias significativas (67 en la arteria descendente anterior izquierda, 65 en la arteria circunfleja y 77 en la arteria coronaria derecha). Hubo 58 (35%) pacientes con enfermedad en un vaso, 33 (20%) con enfermedad en dos vasos y 29 (17%) con enfermedad en tres vasos.
Detección de EAC
En la tabla 2 se muestra una comparación de pacientes con y sin EAC. Los pacientes con una angiografía anormal eran mayoritariamente varones y solían tener una historia de enfermedad cardiaca isquémica previa. Los pacientes con EAC angiográfica mostraron una extensión significativamente mayor de los cinco índices de RMC. La evaluación del diagnóstico de los cinco índices de RMC para detectar la EAC se muestra en la tabla 3. En el análisis multivariable, ajustado por los parámetros clínicos, el DP (1,6 [1,33-1,91]; p < 0,0001, por segmento), DS inducida (1,8 [1,18-2,28]; p < 0,007, por segmento) y el sexo masculino (5,67 [2,02-15,93]; p = 0,001) fueron las únicas variables independientemente relacionadas con la EAC.
Extensión de la isquemia
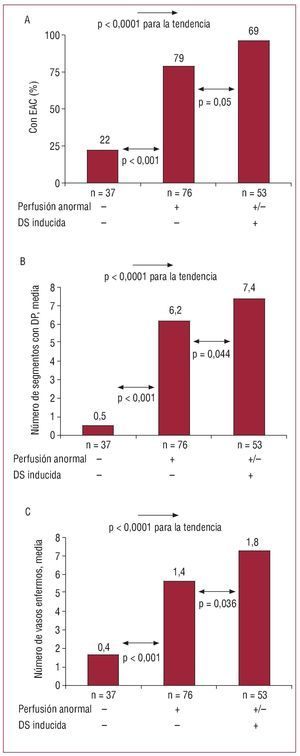
Los 166 pacientes se categorizaron en función de la cascada de isquemia en los grupos definidos anteriormente: grupo 1 (n = 37), grupo 2 (n = 76) y grupo 3 (n = 53) (fig. 3). El porcentaje de angiografía anormal en estos tres grupos aumentó progresivamente (el 22, el 79 y el 96%, respectivamente; p < 0,0001 para la tendencia) (fig. 3A). Del grupo 1 al grupo 3, la extensión de los segmentos hipoperfundidos (0,5 ± 0,8, 6,2 ± 2,62, 7,4 ± 3,4; p < 0,0001 para la tendencia) (fig. 3B) y el número de vasos patológicos se incrementaron gradualmente (0,4 ± 0,7, 1,4 ± 1, 1,8 ± 0,9; p < 0,0001 para la tendencia) (fig. 3C). Al compararlos con el grupo 2, los pacientes del grupo 3 tuvieron una prevalencia mayor de EAC (p = 0,005), una extensión mayor de segmentos hipoperfundidos (p = 0,044) y más vasos afectados (p = 0,036) (fig. 3).
Figura 3. Porcentaje de pacientes con enfermedad arterial coronaria y extensión de la isquemia para los tres grupos. A: porcentaje de pacientes con enfermedad de las arterias coronarias. B: número de segmentos hipoperfundidos. C: número de vasos enfermos. -: ausencia de índice; +/-: el índice puede estar presente o ausente; +: presencia de índice; DP: déficit de perfusión; DS: disfunción sistólica; EAC: enfermedad de las arterias coronarias.
En el análisis multivariable ajustado por parámetros clínicos, los pacientes del grupo 3 tuvieron más del doble de riesgo de tener EAC que los pacientes del grupo 2 (2,34 [1,07-5,13]; p = 0,034).
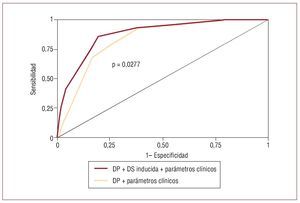
La figura 4 muestra el valor del test estadístico C para la detección de EAC de: a) el modelo que incluye una combinación de DP y los parámetros clínicos, y b) el resultado de añadir a este modelo la información aportada por DS inducida. La información aportada por la DS inducida incrementó significativamente el valor diagnóstico del modelo desde 0,829 a 0,876 (p = 0,0277).
Figura 4. Test estadístico C de la precision diagnóstica para la detección de la enfermedad de las arterias coronarias utilizando una perfusión anormal y la disfunción sistólica inducida. Las variables clínicas introducidas en el modelo de regresión logística fueron el sexo, la hipertensión y la fracción de eyección del ventrículo izquierdo. De los parámetros clínicos, sólo el sexo permaneció en el modelo final. El modelo que incluía el déficit de perfusión y los parámetros clínicos proporcionó un test estadístico C de 0,829. La adición de la disfunción sistólica inducida (en más de 1 segmento) proporcionó un valor diagnóstico superior, incrementando el test estadístico C hasta 0,876 (p = 0,028). DP: déficit de perfusión; DS: disfunción sistólica.
DISCUSIÓN
Utilizando un análisis completo de cinco parámetros derivados de la RMC, nuestro estudio demuestra que la DS inducida con dipiridamol ofrece un valor diagnóstico adicional a la información de la perfusión para la detección de lesiones angiográficamente significativas en pacientes con dolor torácico y una alta probabilidad de EAC. La evaluación adicional de la DS inducida permite la identificación de un grupo de pacientes con una mayor probabilidad de sufrir EAC angiográfica e isquemia más extensa en términos de segmentos hipoperfundidos y número de vasos afectados.
Perfusión miocárdica con estrés
Desde la llegada de la imagen de perfusión miocárdica, el foco de la RMC con estrés vasodilatador se ha desplazado de la detección de la DS inducida a la detección de un DP. De hecho, existen pocos estudios de RMC que evalúen el valor diagnóstico de la DS inducida con vasodilatadores para la detección de la EAC9,14. Un DP es normalmente la consecuencia de una estenosis arterial coronaria epicárdica significativa, aunque con ciertas limitaciones debido a la enfermedad microvascular15,16 y la circulación colateral17, y puede ser usada para diagnosticar y evaluar de forma no invasiva la severidad de una estenosis coronaria. En este estudio se utilizó un método cualitativo para evaluar la RMC de estrés. Usando esta aproximación, estudios previos han obtenido resultados alentadores para el diagnóstico de EAC angiográficamente significativa5,13,18,19. En nuestro grupo hemos observado una fiabilidad semejante a la de estos estudios en cuanto a la utilidad de DP para la detección de EAC, con una sensibilidad del 92% y una especificidad del 62%. Por lo tanto, la presencia de DP es un parámetro muy sensible pero no muy específico para la presencia EAC significativa20.
Consideraciones fisiopatológicas. La «cascada isquémica»
Con el incremento de la severidad, la isquemia miocárdica puede originar anomalías en la perfusión del miocardio, disfunción diastólica y sistólica, cambios electrocardiográficos y finalmente síntomas de angina. Esta secuencia se conoce como «cascada isquémica»6,7. La RMC de estrés farmacológico permite evaluar de manera fiable dos de los escalones de la cascada isquémica: DS inducida y el DP que la precede. En consecuencia, en nuestro estudio el 96% de los pacientes con DS inducida presentaron un estudio de perfusión anormal. La DS inducida no es un parámetro sensible, pero sí altamente específico, con un valor predictivo positivo excelente. De hecho, sólo 2 pacientes que presentaron DS inducida no tuvieron lesiones angiográficas severas. Un caso fue el de una mujer que tenía tres injertos de bypass coronario permeables en tres arterias coronarias ocluidas y el otro caso fue el de un varón que tenía una lesión de un 60% en el territorio de la DS inducida. Después de ajustar por las características clínicas y por los parámetros de RMC, la presencia de DS inducida proporcionó un valor diagnóstico adicional independiente. De hecho, los pacientes con DS inducida tuvieron una probabilidad 2 veces mayor de tener EAC que los pacientes con sólo perfusión anormal.
Clasificación de los pacientes
Desde un punto de vista fisiopatológico, este estudio valida que la cascada isquémica permite la clasificación de los pacientes de acuerdo con la severidad de la isquemia. Con el estudio de la DS inducida, fue posible identificar un grupo de pacientes que mostraban más segmentos hipoperfundidos y más vasos patológicos. De hecho, hemos demostrado previamente que los pacientes con una DS inducida están sometidos también a un mayor riesgo de eventos adversos y se benefician más de la revascularización20. Además, nuestros resultados están en consonancia con los datos derivados de un metaanálisis reciente que comparó la imagen de perfusión miocárdica con DS evaluada mediante ecocardiografía de estrés y concluía que la imagen de perfusión es una modalidad sensible pero con baja especificidad para la detección de EAC, mientras que lo contrario era cierto para la DS evaluada mediante ecocardiografía de estrés21. Nuestro estudio demuestra que utilizando la RMC, la DS inducida ofrece un valor diagnóstico adicional en combinación con los datos clínicos y de perfusión, haciendo de la RMC de estrés con vasodilatadores una aproximación realmente integral para la evaluación de la isquemia. El DP, en tanto que ocurre pronto en la cascada de isquemia, es muy sensible para la detección de la isquemia; no obstante, debido a la detección de DP irrelevantes clínicamente y la susceptibilidad a los artefactos, puede proporcionar más resultados falsos positivos. La DS inducida con dipiridamol sólo tiene lugar en estenosis epicárdicas severas. La baja sensibilidad puede deberse a que este hallazgo no se da en el caso de lesiones menos severas. Por lo tanto, la DS inducida puede suplir la carencia de especificidad de los datos de perfusión.
Influencia del fármaco utilizado en la RMC de estrés
La utilidad diagnóstica y pronóstica de la RMC de estrés con dobutamina ha sido validada previamente9,22. La dobutamina provoca más frecuentemente disfunción sistólica que los vasodilatadores (y en ocasiones en presencia de lesiones coronarias no muy severas). Como consecuencia de la alta frecuencia cardiaca, la dobutamina no es el fármaco ideal para evaluar la perfusión debido a las dificultades inherentes para reconstruir imágenes de perfusión cuando se acorta el ciclo cardiaco. Por su parte, la DS inducida utilizando vasodilatadores no es un fenómeno frecuente y cuando ocurre se asocia con una isquemia severa. Paetsch et al9 observaron que la DS inducida por adenosina ocurría en segmentos con al menos un 75% de DP transmural y estaba relacionada con una estenosis coronaria de alto grado (> 75%). Por el contrario, la DS inducida por dobutamina se observó en áreas sin DP y se asoció con estenosis coronarias menos severas (> 50%).
Por lo tanto, el uso de dipiridamol, a pesar de ser menos potente que la dobutamina para la DS inducida, puede ser ventajoso para identificar grupos de pacientes con isquemia severa y clínicamente significativa20, y por ello puede mejorar la especificidad de la RMC de estrés. Además, el valor diagnóstico adicional de la DS inducida aportado con la metodología utilizada en el presente estudio se puede obtener en un lapso muy corto (durante una apnea de 14 s) sin prolongar el tiempo de adquisición, por lo que esta aproximación es fácilmente aplicable en la práctica clínica.
Limitaciones del estudio
El presente estudio está limitado por su naturaleza retrospectiva. De los 600 pacientes que fueron sometidos a un estudio de RMC de estrés con dipiridamol, los que mostraron un estudio de RMC anormal estuvieron más predispuestos a verse sometidos a una angiografía coronaria que los que presentaron un estudio de RMC completamente normal. Esto supone una limitación para la generalización de nuestros datos y puede explicar la alta prevalencia de EAC y la baja especificidad del DP en nuestro estudio.
CONCLUSIONES
Al utilizar RMC de estrés con dipiridamol, la detección de disfunción sistólica inducida ofrece un valor diagnóstico adicional al estudio de imagen de perfusión para la detección de lesiones coronarias significativas en pacientes con dolor torácico y enfermedad arterial coronaria conocida o sospechada. Sobre la base de la cascada isquémica, la presencia de DS inducida permite identificar un grupo de pacientes con una isquemia más severa y mayor probabilidad de sufrir enfermedad coronaria significativa.
ABREVIATURAS
DP: déficit de perfusión.
DS: disfunción sistólica.
EAC: enfermedad de las arterias coronarias.
RMC: resonancia magnética cardiovascular.
RT: realce tardío.
Véase editorial en págs. 350-3
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. V. Bodí.
Servicio de Cardiología. Hospital Clínico y Universitario de Valencia. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: vicentbodi@hotmail.com
Recibido el 5 de mayo de 2008.
Aceptado para su publicación el 11 de diciembre de 2008.