La enfermedad cardiovascular es un trastorno complejo, multifactorial y poligénico que tiene un importante componente de influencia ambiental. Esto hace que la predicción y la estratificación individual del riesgo resulten muy difíciles. Los avances tecnológicos y la publicación de estudios más amplios y bien diseñados han llevado a un progreso importante en la definición de las repercusiones de la variación genética frecuente en la progresión de la enfermedad cardiovascular. El descubrimiento de variantes genéticas frecuentes, como el locus del cromosoma 9p21.3 como el factor de riesgo coronario genético independiente más potente y con una alta replicación, ha estimulado también el interés por las pruebas genéticas de variantes de riesgo cardiaco. A este conocimiento de la genética de la enfermedad cardiovascular, se suma la creciente información disponible sobre el papel de los transcritos o la expresión génica. Es probable que la combinación de ADN, ARN y datos clínicos sea útil para aclarar muchas de las complejidades que se observan en la enfermedad cardiovascular.
Asociaciones genéticas y enfermedad cardiovascular
Los estudios de asociación de genoma completo humanos existentes han analizado más de 500.000 polimorfismos de nucleótido único en un gran número de individuos y han definido genéticamente diversas enfermedades y factores de riesgo1-3. Sin embargo, a pesar de los grandes avances realizados en el diagnóstico y el tratamiento de los síndromes coronarios inestables, se estima que los eventos cardiacos recurrentes o de nueva aparición continuarán comportando una carga clínica previsiblemente importante en el futuro4. Un elemento que desempeña un papel central en la patogenia de los síndromes coronarios agudos es la adhesión y la activación de las plaquetas que da lugar a la formación de un trombo y la oclusión vascular, y el riesgo absoluto de eventos vasculares recurrentes en los pacientes tratados con antiagregantes plaquetarios continúa siendo alto4. La observación de que se produce una trombosis dependiente de las plaquetas a pesar del tratamiento con inhibidores plaquetarios, como ácido acetilsalicílico o clopidogrel, ha generado muchos estudios adicionales destinados a buscar causas alternativas del fracaso terapéutico. Los datos existentes indican que la función plaquetaria endógena está determinada en parte genéticamente, con una amplia variabilidad interindividual en la respuesta de la activación plaquetaria5.
Los factores hereditarios desempeñan también un papel importante en la función plaquetaria6, aunque es importante destacar que no se ha demostrado claramente que las variantes genéticas de los receptores plaquetarios estén correlacionadas con la función de las plaquetas, modifiquen la respuesta a los fármacos o se asocien de manera uniforme a la enfermedad cardiovascular en estudios más amplios6.
Transcriptómica en la enfermedad cardiovascular: el transcriptoma sanguíneo
Nuestro conocimiento de la enfermedad cardiovascular se ha visto facilitado por los avances en el floreciente campo de la genómica y la proteómica. Concretamente, la transcriptómica se ha utilizado con éxito en el pasado tan sólo en la determinación del perfil de expresión génica a gran escala en contextos oncológicos. La información existente respecto a los síndromes cardiovasculares es escasa, debido a la poca disponibilidad de tejidos apropiados que sean relevantes y constituyan un indicador sustitutivo de la enfermedad. Además, muchos estudios previos en casos seleccionados de enfermedad vascular son de pequeño tamaño. Un estudio reciente ha demostrado que hay transcritos específicos de sangre periférica que participan en la patogenia de la enfermedad coronaria y sus factores de riesgo7. Con el empleo de una amplia cohorte de base poblacional, se observó que los transcritos inflamatorios derivados de las plaquetas se asociaban al índice de masa corporal7. Se observó asimismo que otros transcritos, en especial los derivados de células mononucleares de sangre periférica, eran heredables7.
Además del estudio del transcrito o ARN mensajero (ARNm), otro campo de la expresión génica que se está abordando mediante el estudio de los transcritos derivados de la sangre en la enfermedad cardiovascular es el de los micro-ARN (miARN); recientemente se ha descubierto que los miARN son pequeños ARN que regulan negativamente la expresión génica mediante la supresión de la traducción a proteínas. La expresión de muchos miARN puede reflejar determinadas enfermedades8,9 y se han identificado más de 800 miARN humanos. Las predicciones bioinformáticas indican que los miARN de mamíferos pueden regular el 30% del total de genes codificadores de proteínas. Los miARN se han identificado en sangre total y pueden ser una forma útil de definir mejor la enfermedad cardiovascular.
Uso de pruebas genéticas en el tratamiento de la enfermedad coronaria
La farmacogenética intenta identificar variantes génicas específicas que puedan explicar la variabilidad existente en la respuesta de los pacientes a un determinado fármaco. Las dos preguntas específicas que puede responder son: a) ¿las características genéticas individuales pueden servir de guía para la práctica médica y el uso de los medicamentos en la actualidad?, y b) ¿la farmacogenética contribuirá a una medicina personalizada en el futuro?
Las dos principales categorías en las que la farmacogenética puede aportar algo al tratamiento de la enfermedad cardiotrombótica son: a) el uso de la genómica para comprender la variabilidad de la respuesta a los fármacos existentes y su empleo para orientar el tratamiento, y b) el uso de la información genómica para identificar nuevas dianas para los medicamentos. Aunque la mayor parte de la literatura y los datos actuales se encuentran todavía en el terreno de la especulación en cuanto a su aplicabilidad directa para orientar el tratamiento, hay unas pocas excepciones.
Warfarina
Cada año se prescribe warfarina/cumadina a millones de individuos a causa de fibrilación auricular, válvulas cardiacas protésicas, cirugía o antecedentes de trombosis vascular. El uso de warfarina y su manejo clínico son difíciles debido al índice terapéutico estrecho de este fármaco y otras muchas razones de la variabilidad en sus concentraciones. La combinación del genotipo y los factores clínicos (edad, peso y sexo) explica aproximadamente un 50-60% de la variación en las necesidades de dosis de warfarina, aunque hay diferencias raciales. Con otros algoritmos, se ha descrito la predicción de hasta un 70% de la variabilidad interindividual en las dosis. Sin embargo, no se ha demostrado que las pruebas genéticas sean útiles para valorar el riesgo de exceso de anticoagulación y hemorragia o el control de la anticoagulación. El empleo de la farmacogenética y los factores clínicos puede mejorar la exactitud y la eficiencia de la dosis inicial de warfarina, aunque no el tiempo de mantenimiento dentro del objetivo de la razón normalizada internacional10. Así pues, aunque es un método prometedor, el uso clínico habitual de la determinación genotípica de CYP2C9 o VKORC1 no está plenamente respaldado por la literatura disponible. No obstante, debe señalarse que la Food and Drug Administration de Estados Unidos (2007) ha añadido una nota de advertencia en el prospecto de warfarina, en la que se indica que «debe considerarse la conveniencia de usar una dosis inicial más baja en pacientes que presentan determinadas variaciones genéticas en las enzimas CYP2C9 y VKORC1».
Clopidogrel
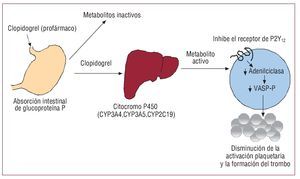
Respecto al inhibidor del receptor de P2Y12 plaquetario clopidogrel, cada vez hay más indicios de que determinadas características genéticas pueden influir tanto en la capacidad de respuesta como en la utilidad del fármaco. Sin embargo, la variante genética que lo origina no parece ser el receptor de P2Y12 tal como se esperaba, sino el citocromo P450 (CYP), una enzima encargada de su metabolismo (fig. 1). El clopidogrel es un profármaco que sufre un metabolismo hepático por enzimas de CYP específicas, y estos genes codifican los pasos oxidativos dependientes del CYP. Los genes son polimórficos, y en estudios anteriores se ha demostrado que los portadores de los alelos específicos del CYP2C1911-13 y el CYP3A414 presentan un aumento de la función plaquetaria. El aumento de la actividad plaquetaria se ha asociado también específicamente al alelo CYP2C19*2, que causa una pérdida de la función en varias poblaciones diferentes, como los pacientes a los que se ha implantado un stent coronario15 y los tratados con clopidogrel tras un infarto de miocardio sin elevación del ST16. El prasugrel, un inhibidor del P2Y12 que no se metaboliza en el hígado, no parece verse afectado por la variabilidad de la isoenzima del P450. En una cohorte de más de 2.200 pacientes tratados con clopidogrel que presentaban infarto agudo de miocardio17, se ha demostrado que los portadores de dos cualesquiera de los alelos de pérdida de función del CYP2C19 presentan una tasa más elevada de eventos cardiacos. Los portadores de la variante ABCB1, que modula la absorción de clopidogrel, presentaron también un aumento moderado de la tasa de episodios. En un estudio en que se examinaron las variantes genéticas de los genes del CYP, la concentración plasmática de clopidogrel y la función plaquetaria en individuos sanos y en casi 1.500 pacientes con síndrome coronario agudo tratados con clopidogrel en el ensayo TRITONTIMI3818, los investigadores observaron que, en los individuos sanos, los portadores de al menos un alelo de pérdida de función del CYP2C19 mostraban una disminución del metabolito activo de clopidogrel respecto a los no portadores, así como una reducción de la agregación plaquetaria. En los pacientes tratados con clopidogrel en el estudio TRITON-TIMI38, los pacientes con los alelos de pérdida de función presentaban mayor riesgo de muerte cardiovascular, infarto de miocardio o ictus que los no portadores.
Fig. 1. Metabolismo y mecanismo de acción del clopidogrel. El clopidogrel es un profármaco que se metaboliza primariamente por esterasas en metabolitos inactivos. Los metabolitos activos se generan por la enzima hepática citocromo P450 e inhiben el receptor de adenosindifosfato P2Y12, con lo que disminuye la activación plaquetaria y la trombogénesis.
En marzo de 2010, la Food and Drug Administration de Estados Unidos aprobó un nuevo prospecto (actualizado) para el clopidogrel con un «recuadro de advertencia», en el que se indica la posibilidad de reducción de la efectividad en pacientes con una disminución de la función del CYP2C1919. El prospecto actualizado en vigor ya no recomienda específicamente evitar el clopidogrel en pacientes con este polimorfismo, pero afirma que debe considerarse la posible conveniencia de un tratamiento alternativo. Teniendo en cuenta la falta de datos clínicos prospectivos actual con el empleo de un tratamiento diferente o una modificación de la dosis, no se establecen recomendaciones claras para la determinación del genotipo.
El tratamiento antiagregante plaquetario se asocia a un aumento del riesgo de hemorragia digestiva, y a muchos pacientes se les prescriben también inhibidores de la bomba de protones para prevenir estos efectos secundarios. La mayoría de los inhibidores de la bomba de protones se metabolizan predominantemente por las enzimas del CYPP450. En consonancia con la importancia de las enzimas hepáticas, se ha observado que la administración conjunta de omeprazol, que el CYP2C19 metaboliza también, reduce el efecto de la inhibición plaquetaria del clopidogrel20. Sin embargo, la administración conjunta de inhibidores de la bomba de protones actualmente está en discusión, puesto que los estudios realizados han aportado resultados poco coherentes y en algunos de ellos no se ha observado efecto alguno en la respuesta clínica al clopidogrel18. La discrepancia entre esta observación y lo indicado por estudios previos no está clara, y las recomendaciones actuales de los distintos organismos y grupos difieren.
Conclusiones
El empleo de pruebas genéticas en la enfermedad cardiovascular y la terapéutica continuará aumentando a medida que se realicen estudios más amplios y se pueda aplicar tecnologías de alto rendimiento. Ello incluye el uso de: a) enfoques de genes candidatos en los que se seleccionen genes/polimorfismos de nucleótido único basándose en la sospecha de asociación, y b) enfoques de genoma completo. Los estudios habrán de incluir exámenes del genoma que verifiquen la asociación de marcadores microsatélites situados por todo el genoma con un fenotipo, mapas de SNP amplios en todo el genoma y transcriptómica amplia. Con los datos actualmente existentes, hay muchas cuestiones fundamentales que continúan sin tener respuesta y requerirán estudios más amplios, que demuestren que las intervenciones terapéuticas basadas en pruebas genéticas aportan un mejor resultado clínico y que la determinación de marcadores genéticos es útil para el diagnóstico de la enfermedad. En resumen, nuestro conocimiento y la cantidad de información existente están aumentando rápidamente y apuntan a un futuro de uso de pruebas genéticas/transcritos en la enfermedad cardiovascular.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. J.E. Freedman.
Boston University School of Medicine.
700 Albany Street. W507 Boston. MA 02118. Estados Unidos.
Correo electrónico: freedmaj@bu.edu