Palabras clave
INTRODUCCIÓN
Los accidentes cerebrovasculares agudos (ACVA) en pacientes jóvenes son poco frecuentes. Su causa principal es embólica y para su diagnóstico debe investigarse un posible origen cardíaco. Hay que recordar también algunos síndromes clínicos poco habituales, como el síndrome antifosfolípido primario (SAF) y otras enfermedades autoinmunes que cursan con fenómenos trombóticos de repetición.
CASO CLÍNICO
Mujer de 20 años con antecedentes de migrañas ocasionales y un episodio de focalidad neurológica transitoria ocurrido un año antes, que consultó en el servicio de urgencias en abril de 1995 por hemiparesia izquierda y cefalea de aparición brusca. En la exploración física destacaba una hemiparesia faciobraquiocrural izquierda, reflejo cutáneo plantar izquierdo en extensión y desviación de la mirada conjugada y de la cabeza a la derecha. Las exploraciones complementarias básicas no pusieron de manifiesto alteraciones. En la TAC craneal realizada en el momento del ingreso se apreció un infarto isquémico antiguo en el territorio de la arteria cerebral media izquierda (ACM). La paciente fue ingresada con el diagnóstico de infarto isquémico en el territorio de la ACM derecha y se inició anticoagulación con heparina Na+ intravenosa.
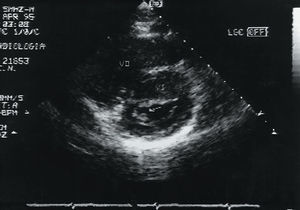
Se realizó ecocardiografía en la que se observó una masa densa y redondeada de 10 x 10 mm, ligeramente móvil, adherida a la comisura posteromedial de la válvula mitral (fig. 1) que originaba una insuficiencia de grado ligero. La válvula tenía un aspecto normal. Las cavidades y la contractilidad cardíacas eran, así mismo, normales. Con la orientación diagnóstica de fibroelastoma frente a mixoma de la válvula mitral se decidió efectuar una intervención quirúrgica para su extirpación. En la intervención se encontró una tumoración muy adherida a las 2 valvas de la válvula mitral que impidió su reparación, y requirió su extirpación y recambio por una prótesis mecánica.
Fig. 1. Plano paraesternal transversal en la válvula mitral en el que se aprecia una masa redondeada y densa (flecha) adherida a la comisura posterolateral. VD: ventrículo derecho; VI: ventrículo izquierdo.
La anatomía patológica evidenció cambios degenerativos, mixoides y fibrosos inespecíficos, con ausencia de tumoración mixomatosa. El estudio immunológico puso de manifiesto unas determinaciones de anticuerpos antinucleares (ANA) y anticuerpos anticélulas parietales y antimúsculo liso positivas. La paciente fue dada de alta en tratamiento anticoagulante con cumarínicos y se ha mantenido asintomática hasta la actualidad. En una analítica de control llevada a cabo en junio de 2000 se obtuvo una determinación de anticuerpos anticardiolipina y anticoagulante lúpico positiva.
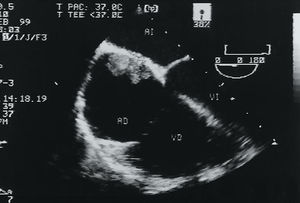
Dos años más tarde, en febrero de 1997, la madre de la paciente descrita previamente acudió al servicio de urgencias por disartria y mano izquierda torpe. Se trataba de una mujer de 48 años con antecedentes de migraña, dislipemia y síndrome depresivo. La exploración física fue normal, excepto por la focalidad neurológica anteriormente descrita, y las exploraciones complementarias básicas y la TAC craneal realizada en el momento del ingreso también fueron normales. Con el diagnóstico de ACVA isquémico se instauró tratamiento con heparina Na+ intravenosa. A las 48 h de su ingreso la enferma presentó un deterioro neurológico en forma de hemiparesia faciobraquiocrural izquierda. En la TAC realizada en ese momento se apreciaron dos lesiones isquémicas de carácter agudo en la ínsula derecha y en el núcleo lentículo-estriado (territorio de la ACM derecha). El estudio eco-Doppler de troncos supraaórticos fue normal. La ecocardiografía transesofágica (ETE) puso de manifiesto pequeñas masas inmóviles (la mayor de 5 mm) adheridas a la superficie auricular de la valva posterior de la válvula mitral (fig. 2).
Fig. 2. Plano de 2 cámaras del examen transesofágico con pequeñas masas (flecha) adheridas a la superficie auricular del punto de cierre de ambas valvas de la válvula mitral. AI: aurícula izquierda; VI: ventrículo izquierdo.
Con la orientación de fibroelastoma frente a trombovegetaciones de la válvula mitral como foco embolígeno se efectuó una intervención quirúrgica en la que se resecaron dichas masas. El resto de la válvula era normal y pudo ser conservada. El estudio histológico evidenció un material fibrinoide con células histiocitarias y leucocitos polimorfonucleares aislados, compatible con endocarditis trombótica no bacteriana (ETNB). Se descartó la existencia de neoplasia oculta y se realizó un estudio immunológico y de coagulación, que resultó normal. Se decidió mantener el tratamiento anticoagulante con dicumarínicos.
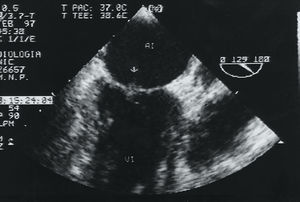
En febrero de 1999, en una ecocardiografía de control se objetivó una masa de 30 x 20 mm, homogénea y de límites bien definidos, adherida a la superficie auricular derecha del septo interauricular (fig. 3). Se efectuó resección quirúrgica de la tumoración. La histología puso de manifiesto un trombo sin evidencia de microorganismos ni de proliferación tumoral. El estudio inmunológico realizado en esos momentos presentó dos determinaciones positivas para anticuerpos anticardiolipina.
Fig. 3. Plano de 4 cámaras del examen transesofágico con gran masa de bordes definidos adherida a la superficie auricular derecha del septo interauricular. AD: aurícula derecha. Resto de abreviaturas como en las figuras anteriores.
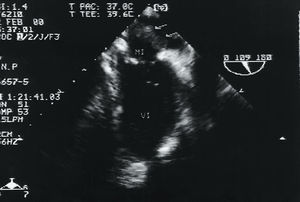
Tras un año asintomática, la paciente reingresó en febrero del 2000 por edema agudo de pulmón. Se realizó una ecocardiografía transesofágica (ETE) que puso de manifiesto una insuficiencia mitral de grado moderado y una trombosis auricular izquierda múltiple (fig. 4). La descompensación cardíaca fue atribuida a un síndrome anémico de etiologías autoinmune y hemolítica (por infartos esplénicos múltiples) concomitantes. Ante estos hallazgos se estableció el diagnóstico de SAF catastrófico1 por afección trombótica de tres órganos (corazón, páncreas y vena esplénica), con probable viraje a lupus eritematoso sistémico (LES)2 por anemia, plaquetopenia, ANA positivos e insuficiencia renal secundaria a nefropatía lúpica, y se inició tratamiento combinado anticoagulante y corticoide.
Fig. 4. Masas trombóticas en la aurícula izquierda (flechas) visualizadas en el plano de 2 cámaras del examen transesofágico. MI: válvula mitral.
DISCUSIÓN
La causa más frecuente de ACVA en pacientes jóvenes es el fenómeno embólico de origen cardíaco. La etiología de éste puede ser múltiple (fibrilación auricular, prótesis valvulares, endocarditis infecciosa y ETNB, trombos intracavitarios, etc.). Una de las exploraciones más rentables, por su capacidad de diagnóstico de trombos intracavitarios y de trombovegetaciones valvulares, es la ETE que, junto con los datos clínicos y de laboratorio, puede orientarnos al diagnóstico etiológico.
Presentamos un caso familiar de SAF primario con afección cardíaca. En nuestra primera paciente se manifestó con una masa en la válvula mitral con degeneración valvular asociada y ACVA secundario. Los antecedentes de migraña (descrita como una de las formas de manifestación precoz del SAF3) y el ACVA previo pueden ser también atribuidos al SAF. En nuestro segundo caso, el SAF se presentó con lesiones intracardíacas típicas de SAF (ETNB y trombosis auricular) y ACVA secundario. La recidiva trombótica, a pesar del tratamiento anticoagulante, confirma la extrema trombogenicidad de los AAF y la evolución posterior del caso la posibilidad de progresión del SAF primario a LES. En los 2 casos, la documentación previa de casos familiares de SAF4,5 apoya su diagnóstico.
El SAF fue definido por primera vez en 1987 y su etiología es desconocida. Se caracteriza por fenómenos trombóticos de repetición en pacientes jóvenes (trombosis venosa profunda, ACVA, infarto agudo de miocardio, abortos y pérdidas fetales de repetición) y la presencia en sangre de anticuerpos antifosfolípido (AAF) (anticardiolipina y anticoagulante lúpico)6. Los AAF son un grupo de inmunoglobulinas adquiridas de clase IgG, IgM o IgA que tienen la capacidad de unirse in vitro a los fosfolípidos de carga negativa. Se manifiestan clínicamente por una prolongación de los tiempos de coagulación dependientes de fosfolípidos (APTT) y se relacionan en la clínica con fenómenos trombóticos. Se calcula que la prevalencia de AAF en la población general es del 1-2%, siendo ésta muy superior en algunas enfermedades autoinmunes como el LES, en que se estima que es del 25-50%.
Los AAF se han relacionado con múltiples entidades clínicas7, como enfermedades autoinmunes, infecciones, neoplasias, fármacos y embarazo, aunque también se han observado en personas aparentemente sanas. Los criterios diagnósticos del SAF primario son la existencia de fenómenos trombóticos de repetición, la presencia en la sangre de AAF (anticardiolipina y/o anticoagulante lúpico) y la ausencia de LES u otras causas de SAF secundario.
Las manifestaciones clínicas que se han relacionado con los AAF son múltiples: procesos hematológicos (trombosis, trombocitopenia, anemia hemolítica, hemorragias), ginecológicos (abortos de repetición, pérdidas fetales, retraso de crecimiento intrauterino), cardiológicos, dermatológicos (livedo reticularis) y neurológicos (migraña, trastornos del movimiento, síndrome de Guillain-Barré, demencia multiinfarto, etc.).
El infarto cerebral es el síntoma neurológico más frecuentemente relacionado con los AAF8. Es más habitual en el SAF primario que en las formas secundarias y alcanza una prevalencia aproximada del 25%. La importancia de los AAF en pacientes jóvenes con ictus isquémico se demostró con el estudio de Brey et al7, quienes observaron que el 46% de los casos de ACVA en menores de 50 años presentaban AAF positivos, en comparación con sólo el 8% de los controles por edad afectados de otras enfermedades neurológicas. La diferencia principal entre los pacientes con ictus y AAF positivos y el resto es la ausencia en los primeros de los factores de riesgo clásicos para ACVA y aterosclerosis y el mayor índice de recurrencia9.
La coexistencia frecuente de lesiones valvulares cardíacas (fundamentalmente mitrales) sugiere en la mayoría de los casos su origen cardioembólico. En otros casos, el mecanismo patogénico más probable parece ser la trombosis in situ en los vasos carotídeos. Se ha sugerido que la migraña podría ser una manifestación precoz del SAF relacionada con los AAF al haberse observado que a menudo precede en el tiempo a los ACVA3.
De las manifestaciones cardíacas del SAF10,11, las lesiones valvulares son la forma más frecuente12 y pueden ser diversas: masas o vegetaciones (ETNB o de Libman-Sacks), engrosamiento difuso de las válvulas, insuficiencia valvular y mucho más raramente estenosis valvular. Su descripción fue realizada en un principio en pacientes con LES y enfermedad valvular, pero después se relacionó con los AAF. Se ha descrito una prevalencia de hasta el 89% de AAF en el LES con afección valvular, en comparación con el 44% de prevalencia en los pacientes con LES sin afección valvular13. La enfermedad valvular en el LES no está relacionada con el resto de manifestaciones clínicas de la enfermedad14, lo que podría indicar su dependencia de los AAF15. La incidencia de enfermedad valvular, así mismo, parece ser mayor en el SAF primario (36%) que en el LES (18%), pero similar en el subgrupo de pacientes con LES y AAF positivos. Estos pacientes tienen un riesgo incrementado de ACVA cardioembólicos. No se ha podido determinar si el desarrollo de AAF es el responsable de las lesiones valvulares o si únicamente constituye un marcador de su presencia.
Las otras manifestaciones cardíacas del SAF son: la enfermedad coronaria, los trombos cardíacos, la hipertensión pulmonar y una forma de miocardiopatía. La enfermedad coronaria se manifiesta en forma de infarto, angina o reoclusión precoz de derivaciones aortocoronarias. Según un estudio de Hamsten et al16, hasta un 20% de los pacientes de menos de 45 años con infarto tienen AAF positivos. Los trombos intracardíacos pueden localizarse en cualquier cavidad cardíaca y sus manifestaciones clínicas dependen de su localización, planteando a menudo el diagnóstico diferencial con otras masas intracardíacas como el mixoma. Finalmente, existe una forma de miocardiopatía difusa que se ha relacionado con los AAF y se cree que es secundaria a trastornos de la microcirculación. Kaplan et al10 describen el caso de un paciente joven afectado de LES que murió de insuficiencia cardíaca aguda secundaria a una miocardiopatía difusa. La anatomía patológica puso de manifiesto trombos intraarteriolares dispersos sin evidencia de vasculitis con necrosis del miocardio circundante. En la bibliografía se recogen otros casos similares10.
Otra cuestión importante a discutir es el tratamiento que deben recibir los pacientes identificados como portadores de AAF, así como la duración del mismo debido a la alta incidencia de recidiva de trombosis6,17,18. En un estudio retrospectivo publicado por Khamasta et al19 en 1995, con 147 pacientes, la incidencia de recidiva trombótica a los 3 años sin tratamiento era prácticamente del 95%. El objetivo de este estudio era determinar el mejor tratamiento preventivo en estos pacientes en función de los resultados obtenidos con los diversos tratamientos empíricos utilizados hasta ese momento. Se analizaron la aspirina y los cumarínicos a dosis altas (INR > 3) acompañados o no de aspirina a dosis bajas. El régimen que demostró mayor disminución de los episodios trombóticos fue la anticoagulación con dicumarínicos a dosis altas (INR > 3) combinada o no con ácido acetilsalicílico a dosis bajas, siendo inferior al 4% a los 3 años y al 12% a los 5 años. Debe destacarse el alto índice de recidivas durante los primeros 6 meses posteriores a la retirada del tratamiento anticoagulante, que es superior al 50%. A la vista de los resultados parece razonable el uso de cumarínicos a dosis plenas (INR > 3) y su mantenimiento a largo plazo, al menos mientras se mantengan positivos los AAF20.
Por último, existen diversos casos familiares de SAF descritos de forma aislada en la bibliografía5. El estudio con mayor número de casos es el publicado por Goel et al4, en el que se analiza a 7 familias con dos o más miembros afectados y se sugiere la existencia de un gen heredado de forma autosómica dominante como responsable de la enfermedad y la existencia de factores externos que determinan las diversas formas de presentación clínica.
Correspondencia: Dr. C. Paré. Institut Clínic de Malalties Cardiovasculars. Hospital Clínic. Villarroel, 170. 08036 Barcelona. Correo electrónico: jcpare@medicina.ub.es Recibido el 24 de octubre del 2000. Aceptado para s u publicación el 27 de diciembre del 2000.