(4 meses de edad) la fístula permeable. El tratamiento trombolítico con r-TPA aplicado localmente, en caso de trombosis aguda de fístula sistémico-pulmonar, puede ser una buena opción terapéutica, dado los riesgos de una nueva intervención quirúrgica.
Palabras clave
INTRODUCCIÓN
Existe una amplia experiencia sobre la terapéutica trombolítica en el adulto, mientras que en la edad pediátrica no están aún claramente definidas la seguridad ni las indicaciones de esta terapéutica.
Los fármacos fibrinolíticos más utilizados en el niño son la estreptocinasa, la urocinasa y el activador tisular del plasminógeno recombinante (r-TPA). Son muy escasas las publicaciones referidas al uso de r-TPA en el neonato para el tratamiento de trombosis de fístulas sistémico-pulmonares1,2.
Presentamos un caso de trombosis de fístula modificada de Blalock-Taussig en una niña de 15 días de vida tratada con éxito mediante terapéutica trombolítica con r-TPA.
CASO CLÍNICO
Niña producto de una tercera gestación, nacida de parto espontáneo a término y normosoma (peso: 3.110 g). Entre los antecedentes maternos destacaba una metrorragia a las 18 semanas de embarazo. Ingresó en nuestro hospital con 12 h de vida por cianosis generalizada que mejoró ostensiblemente tras la administración de PGE-1 intravenosa.
En la exploración clínica destacaba cianosis central con soplo sistólico 1/6 en línea paraesternal izquierda. La radiografía de tórax ponía de manifiesto una mesocardia con índice cardiotorácico de 0,58, isquemia pulmonar y situación visceral normal. El ECG evidenció un ritmo sinusal; el eje QRS se encontraba a +120°; se observaban signos de hipertrofia de ventrículo derecho. En la ecocardiografía 2D-Doppler se halló situs solitus, mesocardia y dextroápex, discordancia auriculoventricular y ventrículo arterial, comunicación interventricular, atresia pulmonar con tronco pulmonar y ramas confluentes, conducto arterioso permeable y ausencia de vena cava inferior.
A los 9 días de vida se realizó una fístula de Blalock-Taussig modificada derecha con tubo de PTF de 4 mm, sin que se ligara el ductus.
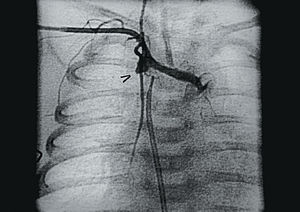
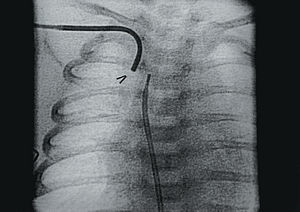
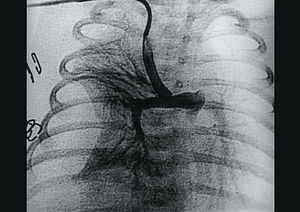
A los 15 días de vida la paciente presentó hipoxemia severa (SatO2 del 50%), comprobándose por eco 2D-Doppler ausencia de flujo a través de la fístula, por lo que se instauró de nuevo tratamiento con prostaglandina E1. Se realizó a continuación un cateterismo cardíaco confirmándose por angiografía la trombosis total de la fístula (fig. 1) con escaso paso de contraste hacia ambas ramas pulmonares a través del ductus. Dejamos colocado un catéter de mamaria interna de 4 Fr (Mallinckrodt), introducido por arteria subclavia derecha con su extremo enclavado en el lado aórtico de la fístula (fig. 2) y, a su través, comenzamos la terapia trombolítica con un bolo de r-TPA de 0,3 mg/kg que perfundimos en 15 min sin observar al final cambios en la trombosis. A continuación perfundimos r-TPA a dosis de 0,3 mg/kg/h durante 2 h y a dosis de 0,7 mg/kg/h durante 12 h. A las 14 h se detectó por radiografía de tórax un hemotórax derecho y comprobamos por angiografía (fig. 3) la repermeabilización total de la fístula, suspendiéndose la perfusión de r-TPA. La complicación hemorrágica fue tratada con plasma fresco, concentrado de hematíes y se drenó el hemotórax mediante punción pleural percutánea. Continuamos el tratamiento trombolítico durante 24 h con heparina sódica a 10 U/kg/h y posteriormente con ácido acetilsalicílico a dosis de 10 mg/kg/día.
Fig. 1. Angiografía selectiva en el extremo aórtico de la fístula, observándose la obstrucción completa de la misma (flecha).
Fig. 2. Catéter de mamaria interna con su extremo alojado en el lado aórtico de la fístula (flecha).
Fig. 3. Angiografía selectiva en la fístula tras 14 h de tratamiento con r-TPA. Se observa la repermeabilización total de la fístula y el relleno de las arterias pulmonares. Se aprecia el hemotórax derecho antes de ser drenado.
La paciente evolucionó bien y en los días sucesivos se comprobó el buen funcionamiento de la fístula con eco 2D-Doppler y el cierre del ductus arterioso. La niña fue dada de alta a los 23 días de vida, permaneciendo actualmente (4 meses de edad) asintomática con la fístula totalmente permeable (eco 2D-Doppler).
DISCUSIÓN
La trombosis de una fístula modificada de Blalock-Taussig en el postoperatorio reciente de una cardiopatía ductus dependiente puede resultar catastrófica.
Los mecanismos de hemostasia y fibrinólisis no acaban de desarrollarse en el niño hasta los 6 meses de edad3, por lo que el recién nacido (RN) tiene mayor riesgo, tanto de fenómenos trombóticos como he morrágicos.
Las concentraciones de agentes fibrinolíticos endógenos (antitrombina III, proteína C, proteína S) están disminuidas en un 50% en el neonato respecto del adulto4. Asimismo, el plasma neonatal tiene sólo el 50-70% de los valores de plasminógeno del adulto5 y este déficit ha sido asociado a los fracasos del tratamiento trombolítico en el neonato. Corrigan et al6 han demostrado en estudios in vitro de plasminógeno que el plasma del neonato necesita cinco veces la concentración de r-TPA y 11 veces la de urocinasa para alcanzar la misma capacidad fibrinolítica que el plasma del adulto. Lo comentado anteriormente, unido al efecto fibrinolítico local que posee el r-TPA, su corta vida media (4-5 min) y el no ser antigénico7,8, lo hacen el agente fibrinolítico preferido sobre los demás para su aplicación en el RN. Tiene el inconveniente de su elevado coste económico. Aunque existe contraindicación relativa a utilizar tratamiento fibrinolítico en los 10 días posteriores a proceso quirúrgico, el r-TPA produce fibrinólisis local selectiva sobre la fibrina del trombo sin provocar un estado fibrinolítico general8.
Lo ideal es aplicar el r-TPA localmente mediante un catéter en la zona del trombo, como ocurrió en nuestro caso. Antes de iniciar el tratamiento hay que solicitar estudio de coagulación junto con recuento de plaquetas y fibrinógeno. Se deben hacer controles analíticos cada 4-6 h durante el tratamiento, al igual que es necesaria una monitorización clínica intensiva.
Según nuestro conocimiento, existen muy pocas publicaciones sobre el tratamiento con r-TPA de fístulas de Blalock-Taussig trombosadas, por lo que no hay un régimen claramente establecido de la dosis a usar. Las dosis utilizadas en otros trabajos oscilan entre 0,2- 1,4 mg/k/h, siguiendo nosotros las recomendaciones de Ries et al1. En nuestro caso se produjo una complicación hemorrágica importante, probablemente causada por hemorragia en los puntos de sutura del extremo pulmonar de la fístula, que fue resuelta con éxito y sin secuelas. Es probable que dosis más bajas, como 0,4 mg/kg/h que han sido efectivas en niños en otros tipos de tromboembolismos9, sean más recomendables, aunque en casos de hipoxemia severa como el nuestro por trombosis de fístula sistémico-pulmonar creemos justificado usar nuestra dosis, aun a riesgo de episodios hemorrágicos.
En conclusión, consideramos que el tratamiento trombolítico con r-TPA aplicado localmente, en caso de trombosis aguda de fístula modificada de Blalock-Taussig, puede ser una buena opción terapéutica, dados los riesgos de una nueva intervención quirúrgica en estado de hipoxemia grave.
Correspondencia: Dr. J. Santos de Soto. Juan Pablos 21, pta.1, 2.o C. 41013 Sevilla. Correo electrónico: jsdesoto@terra.es .Recibido el 19 de diciembre del 2000. Aceptado para su publicación el 23 de febrero del 2001.