Palabras clave
INTRODUCCION
El síndrome aórtico agudo es un término moderno que incluye la disección aórtica, el hematoma intramural (HI) y la úlcera aórtica sintomática. De acuerdo con la descripción clásica, la disección aórtica aguda requiere una rotura en la íntima de la aorta, habitualmente precedida de degeneración o necrosis quística de la capa media. En la disección, la sangre pasa a través de la rotura y separa la íntima de la media o la adventicia, creando así una falsa luz intravascular. La propagación de la disección puede producirse de forma anterógrada o retrógada con respecto a la rotura inicial, afecta a las ramas laterales y da lugar a complicaciones, como los síndromes de mala perfusión, el taponamiento cardiaco o la insuficiencia de la válvula aórtica1-5.
CONSIDERACIONES FISIOPATOLOGICAS
Los trastornos, tanto adquiridos como genéticos, comparten una vía final común que da lugar a la disrupción de la íntima. Todos los mecanismos que debilitan las capas de la media aórtica terminan por provocar una mayor tensión en la pared vascular, que puede inducir la dilatación de la aorta y la formación de un aneurisma, o bien causar una hemorragia intramural, una disección aórtica o la rotura de la arteria. El factor de riesgo más frecuente en la disección aórtica es la hipertensión arterial, con exposición crónica de la aorta a altas tensiones que dan lugar a engrosamiento de la íntima, fibrosis, calcificación y depósito extracelular de ácidos grasos; la matriz extracelular puede experimentar degradación acelerada, apoptosis y elastolisis, con disrupción final de la íntima, en general en los bordes de las placas de ateroma1,6-8.
Algunas enfermedades genéticas, como el síndrome de Marfan, el síndrome vascular de Ehlers-Danlos, la anulectasia aórtica, la válvula aórtica bicúspide y la disección aórtica familiar, también pueden causar síndromes aórticos agudos. Entre los denominadores comunes de estos trastornos genéticos cabe destacar la desdiferenciación de las células del músculo liso vascular y un aumento de la elastolisis de los componentes de la pared aórtica, que dan lugar a una íntima debilitada y a la disección de la aorta9. Dada esta predisposición genética, la obtención de antecedentes familiares detallados en los pacientes diagnosticados de síndromes aórticos agudos o muerte súbita es particularmente importante para evaluar la necesidad de realizar pruebas de cribado sistemático de la familia (tabla 1).
El conocimiento de la incidencia de disección aórtica en la población general es limitado. Diversos estudios señalan una incidencia de 2,6 a 3,5 casos por 100.000 años-persona2,10,11. En una revisión de 464 pacientes del International Registry of Acute Aortic Dissection (IRAD), dos tercios de los pacientes eran varones, con una media de edad de 63 años12.
Aunque las mujeres suelen resultar afectadas con menor frecuencia por la disección aórtica aguda, su edad es significativamente mayor que la de los varones, con una media de 67 años13. Los factores predisponentes más habituales, como la hipertensión arterial en el 72% de los casos, los antecedentes de aterosclerosis en el 31% y la cirugía cardiaca previa en el 18%, están resumidos en la tabla 212-14. En el total del registro IRAD se consideró que el 5% de las disecciones aórticas agudas estaba relacionado con el síndrome de Marfan y el 4%, con causas iatrogénicas12. El análisis de los pacientes jóvenes con disección (< 40 años de edad) reveló que entre los más jóvenes había menos probabilidades de encontrar antecedentes de hipertensión arterial (el 34%) o aterosclerosis (el 1%), pero era más frecuente descubrir un síndrome de Marfan, una válvula aórtica bicúspide y/o una cirugía aórtica previa14.
CLASIFICACION DE LOS SINDROMES AORTICOS AGUDOS
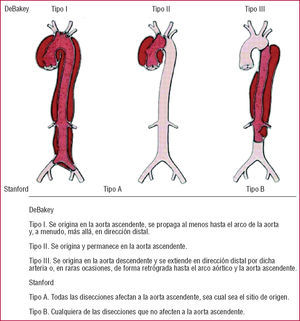
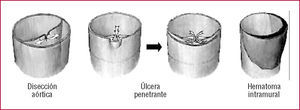
La clasificación de Stanford de la disección aórtica distingue entre los tipos A y B (fig. 1)15,16. En el tipo A, la disección afecta a la aorta ascendente, mientras que en el tipo B sólo está afectada la aorta descendente. La clasificación de DeBakey divide la disección en 3 tipos: el tipo I afecta a la aorta en su totalidad; el tipo II solamente a la aorta ascendente, y el tipo III evita tanto la aorta ascendente como el arco. Las avanzadas tecnologías de imagen han definido precursores o «variantes» de la disección, como los hematomas intramurales, las úlceras aórticas penetrantes y las roturas intimales localizadas (fig. 2)17-22.
Fig. 1. Las clasificaciones más habituales de la disección aórtica torácica: Stanford y DeBakey.
Fig. 2. Esquema de la disección aórtica (izquierda), de la úlcera penetrante (centro) y del hematoma intramural (derecha).
Disección aórtica clásica
La disección aórtica aguda se caracteriza por el rápido desarrollo de un colgajo de íntima que separa la luz intravascular verdadera de la falsa2,23-25. La disección puede extenderse hacia delante o hacia atrás a partir de la rotura de la íntima y a menudo afecta a ramas laterales, lo que provoca mala perfusión, taponamiento o regurgitación valvular2,26-28. Tanto la trombosis espontánea de la falsa luz intravascular (de mejor pronóstico) como los datos de comunicación persistente con el flujo circulatorio y/o de un falso canal permeable (de peor pronóstico) pueden ser útiles para calcular el riesgo final de expansión5,25,29,30.
Hematoma intramural
El HI aórtico está considerado como un precursor de la disección; se origina en la rotura de los vasa vasorum de las capas de la media aórtica y da lugar a un infarto de ésta que puede provocar una rotura secundaria, con la clásica disección (fig. 2)20,21. Al igual que en la disección clásica, el HI puede extenderse, progresar, retroceder o reabsorberse hasta en el 10% de los casos19,20,31-34. Está frecuentemente ubicado en la aorta descendente y se asocia con hipertensión arterial35-37. Aunque las manifestaciones clínicas del HI se parecen a las de la disección, el proceso tiende a ser más segmentario; por lo tanto, el dolor irradiado hacia la cabeza o las piernas es poco habitual. No obstante, el diagnóstico del HI depende de la obtención de imágenes tomográficas en el contexto clínico apropiado.
Úlcera aterosclerótica penetrante
La ulceración profunda de placas aórticas ateroscleróticas puede dar lugar a un HI, una disección aórtica o bien a una perforación38-42. La obtención no invasiva de imágenes ha permitido caracterizar un poco más esta entidad, que a menudo complica el HI y se presenta como una imagen ulceroide en el interior del hematoma. En asociación con el HI, series limitadas de pacientes han documentado la presencia de úlceras ateroscleróticas penetrantes casi exclusivamente en pacientes con un HI de tipo B42. Las úlceras sintomáticas con signos de erosión profunda son propensas a la rotura. Para dichos pacientes, la implantación de una endoprótesis vascular empieza a ser considerada una atractiva modalidad terapéutica.
HISTORIA NATURAL Y PRONOSTICO
Disección de tipo A (proximal)
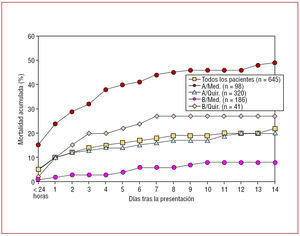
La disección aórtica aguda de la aorta ascendente es con frecuencia letal y tiene una mortalidad que se mantiene entre un uno y un 2% por hora desde muy poco después del inicio de los síntomas23,43. El riesgo de muerte aumenta en los pacientes con complicaciones tales como taponamiento pericárdico o afectación de las arterias coronarias, que provocan una deficiente perfusión cerebral2,26,28,30,44. Otros factores predictores de un incremento de la mortalidad intrahospitalaria incluyen la edad $ 70 años, la hipotensión arterial, la insuficiencia renal y el déficit del pulso (tabla 3)28. Otros factores predisponentes menos observados en la disección de tipo A son la cirugía cardiaca y valvular previa (15%) y la disección iatrogénica debida a una cirugía cardiaca o un cateterismo (5%). La disección aórtica iatrogénica tiene una mortalidad ligeramente superior que la no iatrogénica (el 35 frente al 24%)1,12,45-48. Los datos del registro más importante sobre disección aórtica aguda mostraron que, en ausencia de una reparación quirúrgica inmediata, el tratamiento médico se asocia con una mortalidad de casi el 24% el día uno, del 29% a las 48 h, del 44% el día 7 y del 50% después de 2 semanas. Incluso con reparación quirúrgica, las tasas de mortalidad intrahospitalaria son del 10% tras el primer día, del 12% a los 2 días y de casi el 20% a las 2 semanas (fig. 3). Las causas más frecuentes de muerte son la rotura aórtica, el accidente cerebrovascular, la isquemia visceral, el taponamiento cardiaco y el fallo circulatorio28,49,50.
Fig. 3. Mortalidad a los 14 días en 645 pacientes del Registro IRAD estratificados por tratamiento médico y quirúrgico en la disección aórtica de tipos A y B.
Disección de tipo B (distal)
La disección aórtica aguda que afecta a la aorta descendente suele conllevar una menor mortalidad. Los pacientes con una disección de tipo B no complicada presentan una mortalidad del 10% a los 30 días (fig. 3)12. Sin embargo, los pacientes con complicaciones tales como insuficiencia renal, isquemia visceral o rotura contenida requieren a menudo una reparación urgente, con una mortalidad del 20% en el día 2 y del 25% al cabo de un mes. Al igual que con la disección de tipo A, la edad avanzada, la rotura, el shock y la mala perfusión son importantes factores predictivos independientes de mortalidad precoz13,26,51. El uso crónico de la cocaína denominada crack parece predisponer a los pacientes a la disección aórtica aguda, con predilección por la aorta descendente52,53.
Hematoma intramural
Se considera que la localización proximal del HI es un claro factor predictivo independiente de progresión hacia la disección, la rotura contenida o la formación de un aneurisma, y ello con independencia de la edad, el sexo, la hipertensión arterial, el síndrome de Marfan, la válvula aórtica bicúspide o la extensión local y los diámetros del HI33. Si se tiene en cuenta una tasa de mortalidad del 20% a los 30 días, nuestros hallazgos están respaldados por la experiencia general en 456 casos de HI con una tasa de mortalidad precoz del 16%31,32,54-56. No obstante, con una reparación quirúrgica a tiempo, el HI proximal (de tipo A) deja de asociarse con una muerte precoz (fig. 4)18,33. Por otro lado, el elevado riesgo de adoptar una actitud clínica de «esperar y observar la evolución» en el HI de tipo A se refleja en una mortalidad precoz del 55% con tratamiento médico, en comparación con el 8% con reparación quirúrgica (p = 0,004). Si se tienen en consideración la mortalidad precoz del 12% tras la cirugía y una tasa de mortalidad del 24% con el tratamiento médico, la experiencia global del Registro IRAD confirma la tendencia hacia un mejor desenlace después de la cirugía del HI proximal (p = 0,12)18,33.
Fig. 4. Tasas de mortalidad del hematoma intramural: mortalidad global durante un año en relación con el tratamiento médico o quirúrgico.
Cabe resaltar que los pacientes asiáticos suelen presentar bajas tasas de mortalidad en el HI proximal, incluso sin cirugía32,54,56,57. Sin embargo, en 10 de 22 pacientes con HI de tipo A (45%) se realizó una reparación quirúrgica y 4 casos con tratamiento médico desarrollaron un taponamiento cardiaco58. De forma similar, se observó un taponamiento en 2 de 3 pacientes con HI de tipo A que sobrevivieron con tratamiento médico32. Nishigami et al56 informaron sobre 8 pacientes con HI de tipo A tratados médicamente, de los cuales 7 sobrevivieron; no obstante, en este análisis no se incluyeron los HI que necesitaron cirugía, como los casos con diámetros aórticos de > 50 mm o taponamiento cardiaco. De forma similar, en pacientes coreanos con HI de tipo A tratados médicamente, sólo uno entre 18 falleció y 4 necesitaron una pericardiocentesis o una cirugía para corregir la disección proximal14. Por último, el 54% de los casos con diámetros aórticos < 50 mm progresaron a disección o rotura, lo cual pone en entredicho la experiencia asiática de que, en el HI, una aorta de dimensiones normales descarta la progresión. Por lo tanto, incluso la experiencia asiática subraya las conclusiones alcanzadas en el conjunto general europeo de que el HI proximal suele conducir a complicaciones graves.
El análisis actuarial de la supervivencia del HI confirma el mejor curso clínico alcanzado con el tratamiento oral con bloqueadores beta (el 95 frente al 67% en los pacientes sin bloqueadores beta; p = 0,004), tal como se resume en la tabla 4. Los bloqueadores beta protegen mediante la reducción de la tensión de la pared, la presión arterial sistólica y la tasa de cambios tensionales y, supuestamente, a través de la estabilización de la matriz vascular extracelular de la aorta53,59. La observación de que una mayor edad (> 55 años) en el momento del diagnóstico inicial del HI conlleva un mejor pronóst ico a largo plazo puede explicarse por una mayor cantidad de microcicatrices focales a lo largo de la pared aórtica, las cuales limitan intrínsecamente la progresión longitudinal del HI18,31. Por lo tanto, los pacientes con HI que tienen más de 65 años presentan de forma sistemática resultados favorables32,54,56. Por ello, si se consideran tanto la aortoesclerosis avanzada de la vejez como el menor riesgo de progresión, en los pacientes ancianos con multimorbilidad y en el HI distal podría estar justificada una estrategia conservadora (con bloqueadores beta y técnicas de imagen seriadas)33.
Úlceras aórticas penetrantes
Las imágenes ulceroides en segmentos aórticos con HI identifican un subconjunto de pacientes de alto riesgo. Se sabe que las úlceras ateroscleróticas penetrantes (UAP) se producen por una erosión progresiva de la placa ateromatosa mural que penetra hasta la lámina elástica, lo que termina por separar las capas de la media y predispone a un hematoma intramural adyacente con progresión local o longitudinal. Las UAP se observan con más frecuencia (> 90%) en los HI de la aorta descendente, mientras que los HI sin UAP suelen estar situados en la aorta ascendente. La UAP sintomática ocasiona complicaciones como la formación de aneurismas, seudoaneurismas y disección, o bien una rotura imprevisible. La valoración meticulosa con técnicas de imagen es vital para identificar tanto el diámetro como la profundidad de las úlceras, ya que una anchura > 2 cm y una profundidad > 1 cm podrían presagiar la necesidad de una reparación intervencionista o quirúrgica para evitar la rotura y la muerte33,42.
TRATAMIENTO FARMACOLOGICO DEL SINDROME AORTICO AGUDO
Los pacientes con disección aórtica suelen presentar un inicio cataclísmico de dolor en el pecho o la espalda de naturaleza penetrante e intensa, y a veces irradiado. Sin embargo, en contraste con los datos tradicionales, en el Registro IRAD el dolor no fue descrito como cortante, desgarrador o migratorio; en lugar de esto, la queja más frecuente de presentación fue el inicio repentino de un dolor intenso y agudo. Además, el 4,5% de los pacientes negó cualquier dolor en el momento de la presentación. El dolor en el pecho fue significativamente más habitual en pacientes con disecciones de tipo A (el 79 frente al 63% en las disecciones de tipo B), mientras que tanto el dolor de espalda (el 64 frente al 47%) como el abdominal (el 43 frente al 22%) fueron significativamente más habituales en la disección de tipo B12. La hipertensión arterial es el factor de riesgo que se asocia con mayor frecuencia con la disección aórtica, si bien se observa menos en el momento de la presentación, sobre todo en pacientes con disecciones proximales de tipo A (el 36 frente al 70% en la disección de tipo B). Las disecciones agudas que afectan a la aorta ascendente están consideradas como urgencias quirúrgicas. Por el contrario, las disecciones limitadas a la aorta descendente se tratan médicamente, a menos que el paciente exhiba una progresión de la disección, un dolor resistente al tratamiento, una deficiente perfusión orgánica o una hemorragia extraaórtica.
Tratamiento médico inicial
El objetivo principal consiste en normalizar la presión arterial e iniciar un tratamiento que reduzca el ritmo cardiaco y limite así la fuerza de eyección del ventrículo izquierdo (dP/dt), ya que éstos son los principales factores determinantes de la dilatación y rotura de la falsa luz. En la mayoría de los pacientes, un ajuste de las dosis de los bloqueadores beta intravenosos permite mantener la presión arterial entre 100 y 120 mmHg, con una frecuencia cardiaca de 60 lat/min. En pacientes con intolerancia potencial a los bloqueadores beta (los que presentan asma, bradicardia o signos de insuficiencia cardiaca), el esmolol, por su corta duración de acción, parece ser una elección razonable. El control del dolor y la presión arterial puede lograrse con sulfato de morfina y bloqueadores beta intravenosos (metoprolol, esmolol o labetalol), o en asociación con fármacos vasodilatadores. Si los bloqueadores beta están contraindicados, también pueden utilizarse verapamilo intravenoso o diltiazem. La monoterapia con bloqueadores beta puede ser adecuada para controlar la hipertensión leve y, junto con el nitroprusiato sódico en dosis iniciales de 0,3 µg/kg por minuto, a menudo es eficaz para situaciones de hipertensión arterial grave. En pacientes normotensos o hipotensos, antes de administrar líquidos es obligatorio proceder a una cuidadosa evaluación (mediante ecocardiografía) que descarte la presencia de pérdidas sanguíneas, derrame pericárdico o insuficiencia cardiaca. Los pacientes con inestabilidad hemodinámica profunda requieren a menudo intubación con respiración asistida y una ecocardiografía transesofágica (ETE) urgente a la cabecera de la cama, o bien una tomografía computarizada (TC) rápida para obtener imágenes de confirmación. En casos infrecuentes, el diagnóstico ecocardiográfico de taponamiento cardiaco puede justificar la esternotomía inmediata y el acceso quirúrgico a la aorta ascendente, con el fin de prevenir la parada circulatoria, el shock cardiogénico y el daño cerebral isquémico. La pericardiocentesis percutánea es una intervención temporal que a menudo ha fracasado y que puede acelerar la hemorragia y la situación de shock60.
Disección de la aorta ascendente (de tipo A)
Las disecciones agudas de aorta ascendente (tipo A de Stanford o tipo I o II de DeBakey) deben tratarse como una urgencia quirúrgica, ya que estos pacientes presentan un alto riesgo de complicaciones potencialmente mortales, como rotura aórtica, accidente cerebrovascular, isquemia visceral, taponamiento cardíaco y fallo circulatorio. El objetivo de la cirugía en la disección aórtica proximal de tipo A (tipo I, II) es la prevención de la rotura o la aparición de un derrame pericárdico, que puede conducir al taponamiento cardiaco y a la muerte. De forma similar, la aparición repentina de regurgitación aórtica y obstrucción del flujo coronario requiere una atención quirúrgica urgente con el objetivo de extirpar la región del colgajo roto de la íntima en la disección limitada a la aorta ascendente y de reemplazarlo por un injerto mixto o interpuesto (si las valvas aórticas están intactas o pueden ser resuspendidas). Cuando la disección se extiende al arco aórtico o a la aorta descendente, es posible que la extirpación del colgajo completo de la íntima no se pueda realizar o que el paciente necesite una sustitución total o parcial del arco61. En un informe reciente se destaca el problema de extirpar o de no descubrir colgajos de íntima en el arco o la aorta torácica descendente, algo que se observa en un 20-30% de los casos y predispone a una operación posterior de la aorta distal62. Debido a que la mortalidad operatoria oscila entre el 15 y el 35%, incluso en centros de excelencia, se han utilizado medidas complementarias tales como la parada circulatoria hipotérmica profunda y la perfusión retrógrada selectiva de los vasos de la cabeza en el tratamiento quirúrgico de la reparación del arco o de la anastomosis abierta distal63. Mientras que la perfusión cerebral selectiva ha ganado recientemente aceptación debido a una mejora de los resultados con una superviviencia a los 5 años del 73 ± 6%, la parada circulatoria con hipotermia profunda no ha logrado mejorar las complicaciones iniciales, la supervivencia y las tasas de nueva operación distal en los pacientes con una disección aguda de tipo A. Así, las estimaciones de supervivencia a los 30 días, al cabo de un año y a los 5 años fueron del 81 ± 2, el 74 ± 3 y el 63 ± 3%, respectivamente y, por lo tanto, no se diferenciaron de las de otras técnicas que utilizan análisis retrospectivos con ajustes de propensión64. La clave del éxito es una cirugía inmediata antes de que aparezca cualquier inestabilidad o deterioro hemodinámico (tabla 5).
Una vez que el paciente se mantenga con circulación extracorpórea y, preferiblemente, con perfusión cerebral anterógrada (que en general se establece tras el cateterismo de una de las arterias femorales y la aurícula derecha), se moviliza la aorta para visualizar la arteria innominada y la raíz aórtica. En el caso de que las valvas estén intactas, la reconstrucción de la válvula aórtica mediante técnicas de resuspensión de David o Yacoub está adquiriendo cada vez más aceptación con respecto a la sustitución valvular65,66.
El abordaje ante una disección aguda de tipo A (tipo I, II) (fig. 1) en un aorta proximal con ectasia es diferente. En estas circunstancias, sobre todo en los pacientes con síndrome de Marfan, se prefiere un injerto mixto (inserción de un tubo aórtico con válvula integrada) con reimplantación coronaria67-69. Las operaciones que preservan la válvula son experimentos delicados en casos urgentes y requieren una gran pericia quirúrgica en centros con experiencia en casos electivos. Si la disección compromete los ostium izquierdo o derecho sin afectar al vaso coronario, el ostium puede, en general, preservarse. Un ostium coronario completamente rodeado por una pared aórtica disecada puede extirparse en forma de botón. Las capas disecadas alrededor del orificio se unen por medio de un adhesivo tisular y se suturan con puntos dobles antes de proceder a la anastomosis con el injerto tubular. La revascularización de las arterias coronarias por medio de un injerto de derivación con segmentos de vena safena se limita a los casos en que un orificio pequeño y rasgado impide su reconstrucción. Aunque el tratamiento definitivo de las disecciones aórticas agudas de tipo A incluye la cirugía, aproximadamente el 20% de los pacientes no es intervenido quirúrgicamente. Las razones que se han citado para justificar la preferencia del tratamiento médico han sido la morbilidad con enfermedades asociadas, la vejez (media de edad de 80 años) y la negativa del paciente. El mejor tratamiento de una disección aguda del arco aórtico sigue siendo un asunto aún por resolver. En la actualidad hay un consenso cada vez mayor de que cualquier arco aórtico disecado debe explorarse durante una parada circulatoria en hipotermia. En ausencia de una rotura intimal en el arco, está justificada la anastomosis distal abierta del injerto y la unión de las capas de la pared aórtica entre la aorta ascendente y el arco. Las roturas en el arco ocurren hasta en el 30% de los pacientes con disección aguda70,71. Cuando se encuentran roturas importantes que se extienden más allá de la zona de unión entre los segmentos aórticos transversal y descendente, o en casos con una disección aguda de un arco previamente aneurismático, puede ser necesaria la sustitución parcial o total del arco, con una nueva conexión al injerto de algunos (o de todos) los vasos supraaórticos durante parada circulatoria en hipotermia y perfusión cerebral anterógrada72.
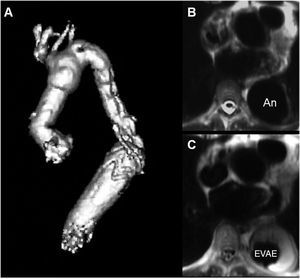
En los aneurismas disecantes y no disecantes que se extienden hasta la aorta descendente, una opción descrita por Borst et al73 es la extensión del arco protésico en trompa de elefante. Esta técnica facilita enormemente las intervenciones posteriores sobre la aorta descendente. En lugar de proceder a una anastomosis convencional entre el extremo distal del injerto y la aorta descendente, se permite que el primero flote libremente en la luz aórtica intravascular. En una intervención quirúrgica posterior, la sección de la trompa de elefante del injerto puede conectarse directamente con la aorta descendente distal o bien extenderse mediante otro injerto tubular o, de forma alternativa, puede insertarse una endoprótesis vascular fabricada para adaptarse al paciente, que se anastomosa a la altura deseada de la aorta descendente (fig. 5).
Fig. 5. Reconstrucción en tres dimensiones de una resonancia magnética (RM) tras el uso percutáneo de una endoprótesis vascular personalizada (A) para conectar una «trompa de elefante», insertada quirúrgicamente, con la aorta abdominal superior, para excluir un aneurisma que se había formado en el extremo distal de la trompa de elefante (B). Tras la inserción de la endoprótesis vascular personalizada, el aneurisma torácico fue excluido con éxito de la circulación, con formación de un trombo en torno a la endoprótesis vascular (C). AN: aneurisma; EVAE: endoprótesis vascular autoexpandible.
Papel de los procedimientos endovasculares en la disección de tipo A (proximal)
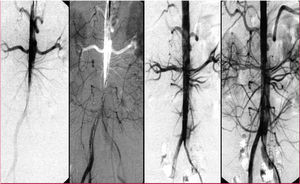
El tratamiento convencional de la disección de tipo A de Stanford (tipos I, II de De Bakey) consiste en la reconstrucción quirúrgica de la aorta ascendente con resección completa o parcial del segmento aórtico disecado. Las estrategias endovasculares no tienen aplicación clínica alguna, excepto la de aliviar una perfusión críticamente deficiente antes de la cirugía de la aorta ascendente, bien por medio de la inserción de una endoprótesis vascular autoexpandible en la aorta torácica descendente, bien mediante una fenestración distal en los raros casos de extensión toracoabdominal (tipo I de De Bakey) con complicaciones isquémicas periféricas. La reconstrucción de la verdadera luz intravascular colapsada podría permitir el restablecimiento de la circulación en las ramas laterales (fig. 6) y el restablecimiento del riego distal74-77. La mayoría de los casos de síndrome de mala perfusión son susceptibles de un tratamiento endovascular, si se tiene en cuenta que las tasas de mortalidad quirúrgica en los pacientes con complicaciones vasculares isquémicas periféricas agudas son similares a las observadas en la isquemia mesentérica, alcanzando una mortalidad intrahospitalaria del 89%78,79.
Fig. 6. Perfusión deficiente de la aorta distal por disección oclusiva de tipo B. La inserción de una endoprótesis vascular en la verdadera luz de la aorta descendente proximal restableció el flujo hacia el abdomen y las extremidades inferiores.
Disección aórtica descendente (de tipo B)
En la época actual, el enfoque que se suele adoptar para tratar las complicaciones de la disección aguda de la aorta descendente (tipo B) es la inserción de prótesis endovasculares, ya que en estos casos la reparación quirúrgica no ha demostrado superioridad alguna sobre el tratamiento médico o intervencionista. Los pacientes con disecciones aórticas no complicadas y limitadas a la aorta torácica descendente (tipo B de Stanford o tipo III de DeBakey) reciben actualmente un tratamiento médico, pero en un futuro próximo podrían pasar a ser candidatos para un tratamiento endovascular en casos seleccionados. El tratamiento médico se centra en el control hemodinámico invasivo y la administració n de bloqueadores beta y vasodilatadores, en caso necesario, para mantener la presión arterial sistólica # 120 mmHg. La analgesia con sulfato de morfina es también importante para atenuar la liberación simpática de catecolaminas provocada por el dolor, con la taquicardia e hipertensión arterial resultantes. Una vez estabilizado el paciente, se prosigue el tratamiento con bloqueadores beta orales y otros fármacos antihipertensivos bajo estrecho seguimiento con técnicas de imagen y evaluaciones clínicas seriadas con intervalos de 6 meses. En una serie del Registro IRAD que incluyó a 384 pacientes con disecciones de tipo B, el 73% recibió tratamiento médico. La mortalidad intrahospitalaria de estos pacientes fue del 10%26. La supervivencia a largo plazo con el tratamiento médico oscila entre el 60 y el 80% al cabo de 4 a 5 años y entre el 40 y el 45% a los 10 años80-82. La supervivencia es superior en los pacientes con disecciones no comunicantes o trombosis completa de la falsa luz.
Cirugía en la disección aórtica de tipo B (distal)
En la época actual, las indicaciones de un tratamiento operatorio en los pacientes con disección aórtica aguda de tipo B (tipo III) se limitan a la prevención o el alivio de las complicaciones potencialmente mortales, como el dolor resistente al tratamiento, un diámetro aórtico que aumenta con rapidez o signos de rotura aórtica inminente, aunque también pueden tratarse de forma intervencionista mediante la inserción de una endoprótesis vascular autoexpandible. El inicio de complicaciones tales como la mala perfusión de las arterias laterales vitales de la aorta justifica el tratamiento intervencionista, con la inserción de una endoprótesis vascular, con el fin de mejorar el flujo distal a través de la luz verdadera o, en casos infrecuentes, con la fenestración guiada por catéter de un colgajo intimal oclusivo. Cuando este enfoque no produce un alivio rápido de los síntomas, puede que todavía sea necesaria una intervención quirúrgica. En la actualidad, las disecciones aórticas no complicadas de tipo B (tipo III) se tratan generalmente de manera conservadora, ya que la reparación quirúrgica no ha demostrado superioridad alguna sobre el tratamiento médico o intervencionista en los pacientes estables. En los casos complicados se está explorando en la actualidad el concepto intervencionista de inserción de una endoprótesis vascular74-76. Además, debido a que los pacientes tratados quirúrgicamente son sobre todo los que tienen un curso clínico complicado, su mortalidad a corto plazo es más alta que con el tratamiento médico26.
Implantación de endoprótesis vasculares en la disección de tipo B
El concepto de insertar una endoprótesis vascular para reparar con urgencia la disección aórtica es atractivo. Un número cada vez mayor de disecciones aórticas agudas de tipo B se repara de esta manera, con pocos indicios de morbilidad periprocedimiento, lo que permite el tratamiento de la mala perfusión, la interrupción de las pérdidas sanguíneas y, finalmente, la reconstrucción de la aorta disecada. La inserción de una endoprótesis vascular en la disección aórtica complicada distal empieza a ganar adeptos y, en manos expertas, se asocia con pocas complicaciones periféricas o neurológicas83-86; con ella se obtienen mejores resultados a corto y largo plazo que con el tratamiento médico o quirúrgico en grupos de alto riesgo con una disección de tipo B.
El papel exacto de la fenestración percutánea y la inserción de una endoprótesis vascular en la disección aórtica todavía está en evolución, incluso en los pacientes con complicaciones potencialmente mortales que se manifiestan por medio de una isquemia de los órganos terminales afectados. La tasa de mortalidad de los pacientes con isquemia renal oscila entre el 50 y el 70%, y alcanza el 87% en la isquemia mesentérica. Si se tiene en cuenta que la tasa de mortalidad quirúrgica intrahospitalaria en la isquemia de los órganos terminales afectados llega al 89%, el tratamiento percutáneo de esta complicación ha surgido como una opción viable antes o después del tratamiento quirúrgico definitivo.
Hace 10 años, Nienaber et al75 compararon el curso clínico de la inserción de una endoprótesis vascular con cirugía abierta en una evaluación no aleatorizada de 24 pacientes con disección aórtica crónica de tipo B que tenían al menos una indicación para la cirugía. La inserción de la endoprótesis vascular no dio lugar a morbilidad o mortalidad, mientras que la cirugía de la disección de tipo B se relacionó con 4 muertes (el 33%) y 5 acontecimientos adversos graves durante un período de 12 meses. Dake et al76 investigaron la inserción de endoprótesis vasculares en el punto de rotura intimal primaria en 19 pacientes con disección aórtica aguda (4 pacientes con tipo A y 15 con tipo B). Las disecciones afectaban a las ramas aórticas en 14 de los 19 pacientes (el 74%), y en 7 pacientes (el 37%) se observó una afectación sintomática de múltiples ramas vasculares. La inserción de la endoprótesis vascular en la rotura primaria resultó técnicamente satisfactoria en los 19 pacientes. Se alcanzó la trombosis completa de la falsa luz en 15 pacientes (el 79%). La revascularización de la rama vascular isquémica tuvo éxito en el 76% de las arterias obstruidas. Tres de 19 pacientes (el 16%) fallecieron 30 días después, sin que se produjeran más muertes durante un seguimiento posterior medio de 13 meses.
El grupo de trabajo de la Sociedad Europea de Cardiología sobre la disección aórtica aguda publicó sus recomendaciones con las indicaciones de endoprótesis vascular o fenestración87. De manera adicional, en los pacientes de alto riesgo no candidatos a cirugía debido a la edad, la comorbilidad o una preferencia personal, la reparación endovascular ofrece un tratamiento paliativo para la enfermedad que, de otra manera, hubiese debido abandonarse a su curso natural.
Del Registro del IRAD se desprende que el 73% de los casos de disección de tipo B recibió tratamiento médico y la mortalidad intrahospitalaria de estos pacientes fue del 10%86. La tasa de supervivencia a largo plazo con el tratamiento médico oscila aproximadamente entre el 60 y el 80% a los 4-5 años y entre el 40 y el 45% a los 10 años88-90. La supervivencia es mejor en los pacientes con disecciones no comunicantes y retrógradas.
En la época actual, la inserción de una endoprótesis vascular como tratamiento de la disección aguda de la aorta descendente (tipo B) se reserva para las complicaciones de la enfermedad, ya que la reparación quirúrgica no ha demostrado superioridad alguna sobre el tratamiento médico o intervencionista en los pacientes estables. Los pacientes con disecciones aórticas no complicadas limitadas a la aorta torácica descendente (tipo B de Stanford o tipo III de DeBakey) evolucionan mejor con tratamiento médico. Éste consiste en un control hemodinámico invasivo, bloqueadores beta y vasodilatadores en el caso de que se necesite mantener la presión arterial sistólica por debajo de 120 mmHg. La analgesia con sulfato de morfina es también importante para atenuar la liberación de catecolaminas provocada por el dolor, con las resultantes taquicardia e hipertensión arterial. Una vez estabilizado el paciente, se sustituyen los bloqueadores beta orales y otros fármacos antihipertensivos y se da de alta al paciente con un estrecho seguimiento.
Existe consenso en que las indicaciones del procedimiento endovascular en los casos de disecciones aórticas agudas de tipo B se limitan a la prevención o el alivio de las complicaciones potencialmente mortales. Al igual que con la cirugía abierta, estas complicaciones incluyen la rotura aórtica, la isquemia de miembros y órganos, la hipertensión renal persistente o el dolor recurrente resistente al tratamiento, la progresión de la disección y la expansión del aneurisma. Todas estas complicaciones son más probables con una falsa luz permeable, un diámetro aórtico creciente (fig. 7) y una hipertensión arterial descontrolada. En la mayoría de las series, las operaciones abiertas clásicas para las disecciones aórticas agudas de tipo B conllevan una mortalidad elevada, que históricamente oscila entre el 35 y el 75%. Además, dado que los pacientes con un curso clínico complicado reciben preferentemente procedimientos endovasculares en vez de cirugía, puede que, en ellos, la mortalidad a corto plazo disminuya (fig. 8)86.
Fig. 7. Curvas actuariales de supervivencia de pacientes clasificados según la trombosis de la falsa luz endovascular y el diámetro aórtico total. Tomada de Marui et al106.
Fig. 8. Curvas de supervivencia debidas a disección aguda de tipo B para todos los pacientes y por grupo de tratamiento, basadas en un análisis de Kaplan-Meier de mortalidad a los 40 días. IP: intervención percutánea. Tomada de Suzuki et al86.
Estrategias terapéuticas actuales
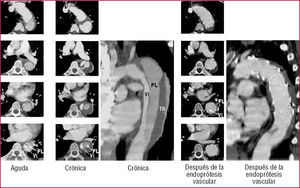
En informes recientes se apoya la noción de que la inserción de una endoprótesis vascular es más segura y proporciona mejores resultados que la cirugía en la disección de tipo B91. Los resultados del seguimiento a corto plazo son excelentes, con una supervivencia > 90% al cabo de un año; las roturas pueden sellarse y los diámetros aórticos disminuyen generalmente con la trombosis completa de la falsa luz. Esto señala que la inserción de la endoprótesis puede facilitar la curación de la disección, a veces de la aorta completa, incluidos los segmentos abdominales (fig. 9).
Fig. 9. Disección aórtica de tipo B en un varón de 48 años; nótese la obstrucción mecánica de la verdadera luz (VL) en la fase aguda. Tras la inserción de la endoprótesis vascular en la entrada aórtica proximal, la totalidad de la verdadera luz de la aorta torácica se reconstruye con el tiempo, con una «curación» completa de la pared aórtica disecada y una reducción de la falsa luz (FL) completamente trombosada. TR: trombo.
El informe del registro EUROSTAR/Reino Unido incluye los resultados de la primera gran serie de pacientes tratados con endoprótesis vasculares autoexpandibles en la aorta torácica. En este registro combinado, en 131 pacientes con disección aórtica (el 5% proximal, el 81% distal y el 14% sin clasificar) se insertaron endoprótesis vasculares; el 57% presentaba síntomas de rotura, dilatación aórtica u oclusión de una rama lateral. Aunque todavía faltan datos relevantes a largo plazo, en el 89% se alcanzó el éxito técnico primario a expensas de una mortalidad del 8,4% a los 30 días25. Al igual que en el metaanálisis91, en el 0,8% de los pacientes tratados se produjo una paraplejía y la supervivencia al cabo de un año después del tratamiento fue del 90%92.
En una serie procedente del Arizona Heart Institute en la que se incluyó a 40 pacientes con una endoprótesis vascular torácica por disección aórtica distal complicada, se alcanzó un éxito técnico en el 95% de los casos. Hubo una muerte en el perioperatorio debido a la rotura de arteria ilíaca y un caso de paraplejía, mientras que 15 pacientes (el 38%) experimentaron complicaciones postoperatorias transitorias, la mayoría renales y pulmonares. La superviviencia al cabo de un año fue del 85%. De los pacientes con TC disponible en el seguimiento, el 97% (30 de 31 pacientes) presentó un diámetro aórtico estable o menguante y no hubo ninguna rotura durante el período del estudio. Estos datos justificaron la conclusión de que la endoprótesis aórtica torácica estabilizó la aorta y redujo la incidencia de dilatación tardía y rotura aórtica93.
En una serie de 24 casos de disección aórtica distal de alto riesgo (16 agudos, 8 crónicos), la mortalidad periprocedimiento fue del 13%, debido a la rotura con fuga interna en un paciente y a disección retrógrada con taponamiento cardiaco en dos. Un paciente sobrevivió a la conversión quirúrgica en una disección retrógrada. Los 3 casos de disección retrógrada se asociaron con un modelo de endoprótesis vascular con extremo de metal descubierto insertado dentro del arco torácico. Globalmente, la mortalidad a los 2 años fue del 17% en esta incipiente población de pacientes de alto riesgo94. De manera similar, de 43 pacientes con disección aórtica distal complicada (24 agudos, 19 crónicos), 3 casos desarrollaron una disección retrógrada repentina tras el despliegue de la endoprótesis vascular (se trataba de un modelo con metal descubierto) que provocó un taponamiento cardiaco y la muerte; 2 pacientes fallecieron durante el seguimiento a causa de una disección progresiva, a pesar de la inserción de una endoprótesis vascular en la puerta de entrada. Los 38 pacientes restantes (seguimiento medio de 20 meses) sobrevivieron y desarrollaron una trombosis de la falsa luz intravascular95. El registro Talent Thoracic Retrospective (TTR) es actualmente el estudio más extenso sobre los resultados a largo plazo en una amplia cohorte de pacientes (457), con más que 3 años de seguimiento clínico y con un control con técnicas de imagen en 95 pacientes. Los resultados preliminares confirman las conclusiones de series más pequeñas, con una mortalidad intrahospitalaria del 5%, a pesar de incluir a 113 pacientes tratados en condiciones de urgencia96. Una ventaja que se observó con la reparación endovascular en el síndrome aórtico agudo fue la reducción de las pérdidas sanguíneas97,98 en comparación con la cirugía abierta, donde la hemorragia retrógrada procedente de las ramas arteriales y las anastomosis o las lesiones venosas iatrogénicas podría precipitar un shock y dejar secuelas neurológicas. En este estudio, la mayoría de las complicaciones perioperatorias en los casos de inserción endovascular de urgencia se debió a enfermedades médicas preexistentes sin relación alguna con la intervención. Además, en los pacientes con una rotura aórtica traumática (85 pacientes sin mortalidad), el tratamiento con endoprótesis vascular redujo enormemente la alta mortalidad de la reparación quirúrgica abierta convencional99. En los pacientes con traumatismos múltiples, la alternativa del tratamiento no quirúrgico de la lesión aórtica puede favorecer el tratamiento inmediato de las lesiones traumáticas asociadas y mejorar la supervivencia general. Dada la especial fragilidad de la pared aórtica en los pacientes con síndrome de Marfan, la posibilidad de un tratamiento en dovascular es objeto de polémica, pero es posible que los resultados tras la inserción de endoprótesis sean aceptables96. En la actualidad, las complicaciones más frecuentes de la intervención endovascular son el accidente cerebrovascular (3,7%) y las lesiones vasculares en el sitio de acceso (3,2%), ambas probablemente relacionadas con la dificultad inherente a la inserción y la manipulación de un calibre tan grande (22-27 Fr), así como al rígido sistema de liberación. El único factor predictivo significativo de accidente cerebrovascular fue el avance excesivo de la endoprótesis sobre la arteria subclavia izquierda sin una revascularización previa, aunque en un reciente informe99 se indica que se puede realizar con una seguridad relativa si se tienen en cuenta ciertas medidas de precaución100. No obstante, la endoprótesis vascular posee el potencial de reducir el riesgo de paraplejía al evitar el pinzamiento quirúrgico transversal, las pérdidas sanguíneas importantes y la hipotensión arterial grave. Por ello, se ha señalado que la reparación simultánea o previa de un aneurisma abdominal es un factor de riesgo de isquemia vertebral101,102. La exclusión de un largo segmento de la aorta torácica fue el factor predictivo más importante de la isquemia vertebral, con independencia de la disección o el aneurisma. Si se tiene en cuenta la posibilidad de que aparezcan complicaciones tardías, deberán obtenerse imágenes de control por medio de una resonancia magnética (RM) o una TC al cabo de 3 y 12 meses, seguidas de exámenes sucesivos a intervalos anuales. En algunos pacientes, el seguimiento con técnicas de imagen ha revelado roturas que en un principio habían sido pasadas por alto y que necesitaron endoprótesis adicionales.
El Investigation of Stent grafts in patients with type B Aortic Dissection (INSTEAD) es el primer estudio aleatorizado que analiza el tratamiento con endoprótesis vasculares en la disección aórtica no complicada de tipo B en comparación con el mejor tratamiento médico aislado103. Por ello, el ensayo INSTEAD determinará si los pacientes con una disección aórtica distal, crónica y no complicada tratada con una endoprótesis vascular tienen un mejor curso clínico inicial y no presentan las complicaciones de la disección tardía. En la actualidad no hay ningún dispositivo endoprotésico torácico específicamente aprobado para el tratamiento de la disección aórtica; sin embargo, estos dispositivos se están utilizando sin autorización oficial para dicha indicación y hay planes de futuros ensayos sobre el tratamiento endoprotésico de enfermedades aórticas, tanto complicadas como no complicadas.
Aunque los datos preliminares indican que la reparación con una endoprótesis vascular podría terminar por convertirse en el tratamiento de elección de la mayoría de los pacientes con síndromes aórticos distales, los resultados disponibles hasta el momento no justifican el uso indiscriminado de esta tecnología en pacientes que en la actualidad reciben tratamiento médico. Es evidente que se necesitan ensayos clínicos comparativos para clarificar el papel de la reparación endoprotésica en los síndromes aórticos agudos. Incluso aunque los pacientes con un alto riesgo quirúrgico se beneficiaran de la tecnología endovascular, el papel exacto de la endoprótesis vascular está aún por definir, mientras continuamos acumulando datos y experiencia a largo plazo y los dispositivos y las técnicas siguen evolucionando.
Hematoma intramural
Al igual que sucede en las disecciones aórticas de tipos A y B, en los pacientes con HI de tipo A se aconseja la cirugía, y en los pacientes con HI de tipo B, el tratamiento médico inicial. En un metaanálisis de 143 pacientes se encontró que los pacientes con lesiones de la aorta ascendente mostraron una mortalidad más baja con la cirugía que con el tratamiento médico (el 14 frente al 36%). Los pacientes con lesiones de la aorta descendente presentaron una mortalidad similar con tratamiento médico o quirúrgico (el 14 frente al 20%)36. Las comunidades cardiológica y quirúrgica han llegado a la conclusión de que el HI agudo que afecta a la aorta ascendente debe tratarse quirúrgicamente debido a que mortalidad que conlleva el tratamiento médico es demasiado alta17-21,31,104-106. Teniendo en cuenta dichas incertidumbres, muchos expertos recomiendan la reparación aórtica en el caso de HI agudos de la aorta ascendente, igual que en la disección de tipo A, y un tratamiento médico intensivo para los HI de la aorta descendente, igual que en la disección de tipo B105.
CONCLUSIONES
Durante la última década se ha aprendido mucho sobre los factores de riesgo, las características clínicas, el diagnóstico y el tratamiento del síndrome aórtico agudo. Los avances tecnológicos en las técnicas de imagen y una mejor comprensión de la biopatología de la disección aórtica aguda han conducido al descubrimiento de variantes de la enfermedad aórtica, ahora denominadas síndromes aórticos agudos. Además, las diversas estrategias quirúrgicas y percutáneas para tratar los síndromes aórticos siguen mejorando y desarrollándose. Como consecuencia del conocimiento y el interés en este campo, la evolución clínica de los pacientes tratados por síndromes aórticos agudos ha mejorado. Sin embargo, todavía queda mucho por hacer. El uso de vías diagnósticas y terapéuticas que faciliten un tratamiento eficiente y simplificado, similar al de los síndromes coronarios agudos o los accidentes cerebrovasculares, posee el potencial de mejorar la evolución de los pacientes. Por último, el continuo entusiasmo por conocer más sobre estos trastornos, junto con las incesantes mejoras en su diagnóstico y tratamiento, permite vislumbrar nuevos avances en el horizonte.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. C.A. Nienaber.
Division of Cardiology. University Hospital Rostock.
Rostock School of Medicine.
Ernst-Heydemann-Str., 6. 18057 Rostock. Alemania.
Correo electrónico: christoph.nienaber@med.uni-rostock.de