El trasplante cardiaco es actualmente un tratamiento aceptado y establecido para la insuficiencia cardiaca avanzada. Sin embargo, desde que se realizara el primer procedimiento en nuestro país en 1984, se han producido importantes cambios en el perfil del donante y el receptor, así como la situación en que los pacientes llegan al trasplante. Este cambio ha ido paralelo a una mejora en los aspectos médicos y quirúrgicos que rodean al trasplante, de forma que los resultados globales no han sufrido gran impacto. Sin embargo, estamos obligados a velar por mantener o aumentar la actividad preservando los buenos resultados obtenidos hasta el momento, manteniendo la mayor equidad posible en la distribución de órganos y reduciendo la mortalidad en lista de espera. El presente artículo analiza los diferentes cambios en el escenario y las propuestas de mejora.
Palabras clave
El trasplante cardiaco (TxC) es actualmente un tratamiento aceptado y establecido para la insuficiencia cardiaca (IC) avanzada. Aunque nunca se han realizado ensayos controlados, hay consenso en que el TxC, siempre que se aplique un criterio de selección adecuado, mejora significativamente la supervivencia, la capacidad de ejercicio, la calidad de vida y la reincorporación laboral en comparación con el tratamiento convencional1.
Sin embargo, desde que se realizara el primer procedimiento en nuestro país en 1984, se ha producido una serie de hechos que han cambiado radicalmente el panorama del TxC. Estos cambios han afectado al perfil del donante y el receptor y la situación en que los pacientes llegan al trasplante.
Trasplante cardiacoPerfil del donante para trasplante cardiacoDurante las últimas tres décadas y para bien de la ciudadanía, la calidad de las carreteras y del parque automovilístico, así como las leyes de seguridad vial y de seguridad en el trabajo, ha reducido drásticamente las tasas de mortalidad relacionadas con accidentes de adultos jóvenes. Además, la población ha envejecido. En consecuencia, la media de edad de los donantes de órganos ha aumentado, así como la edad de donantes aceptados para TxC. La mediana de edad de un donante de corazón aumentó de 25,6 años en 1984-1988 a 41,3 en el periodo 2009-2013 (Figura 1)2,3. Paralelo a ello, también han aumentado las comorbilidades médicas en los donantes –como diabetes mellitus e hipertensión– y con ello la probabilidad de transmitir enfermedad coronaria aterosclerótica al receptor. Estos cambios demográficos podrían tener un impacto real en la supervivencia postrasplante y sería esperable un aumento de un 20% del riesgo de muerte en España respecto a Estados Unidos, donde la media de edad del donante es significativamente menor4.
Figura 1. Edad de los donantes para trasplante cardiaco agrupados en periodos de 5 años, desde 1984 hasta 2013. Reproducido con permiso de González-Vílchez et al 3 .
Perfil del receptor de trasplante cardiacoLas características demográficas del receptor de TxC tal vez hayan cambiado aún más drásticamente. Mientras en el periodo 1984-1988 solo el 25% de los receptores tenían entre 50 y 60 años, en el último quinquenio analizado, el 32% de los pacientes eran mayores de 60 años y se ha incluido con más frecuencia a mayores de 70 años (Figura 2)3. Según los datos del Registro Español de Trasplante Cardiaco2, la media de edad del receptor de TxC se ha incrementado desde los 42 años en el quinquenio 1984-1988 hasta casi los 54 en el quinquenio 2009-2013. Paralelo a ello, también las comorbilidades de los receptores han aumentado de manera constante; en el momento del trasplante, el 17% de los receptores tienen diabetes mellitus; el 10%, enfermedad pulmonar obstructiva crónica moderada-grave; el 29% ya ha sufrido una cirugía cardiaca, y el 21% llega con un grado de insuficiencia renal significativa, definida como creatinina sérica > 2 mg/dl2.
Figura 2. Edad de los receptores de trasplante cardiaco agrupados en periodos de 5 años, desde 1984 hasta 2013. Reproducido con permiso de González-Vílchez et al 3 .
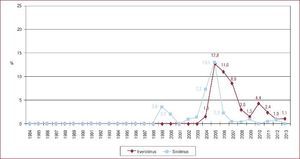
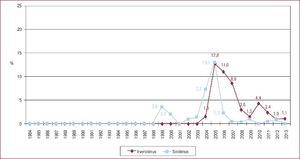
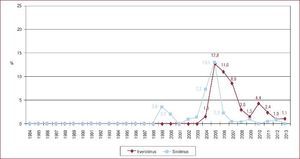
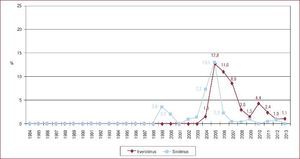
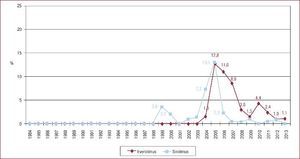
Situación del paciente en el momento del trasplante cardiacoSin embargo, el cambio más llamativo es la situación del paciente en el momento del TxC. Si en el periodo 1984-1988 se trasplantó al 7,5% de los pacientes en código urgente, en 2009-2013 fueron un 37% (Figura 3)3. Y si analizamos solo el último quinquenio, merece destacarse el significativo incremento en la indicación del trasplante urgente, que fue de un 35% en 2009 y un 47% en 2013 (p = 0,006).
Figura 3. Trasplantes cardiacos urgentes realizados (%), agrupados en periodos de 5 años, desde 1984 hasta 2013. Reproducido con permiso de González-Vílchez et al 3 .
En gran parte, este fenómeno se ha producido por un cambio cultural que se gestó hace ahora una década y que puso el acento en el concepto de utilidad, por el que se proponía priorizar el TxC al paciente que más beneficia, es decir, el paciente en situación de shock cardiogénico. Por el mismo motivo, se puso en cuestión la indicación de TxC en el paciente con IC avanzada que permanecía estable5.
Si se analiza el tipo de soporte mecánico con que se lleva al paciente a trasplante urgente, se ve que en los últimos 5 años se ha reducido discretamente la inclusión en urgencia con balón de contrapulsación intraaórtico y con asistencias de flujo pulsátil. Sin embargo, se ha duplicado el porcentaje de indicación de trasplante urgente de pacientes asistidos con membrana de oxigenación extracorpórea (ECMO) (Figura 4)3. Es esta una herramienta de asistencia circulatoria asequible y rápida de implantar y, según nuestros criterios de distribución de órganos, nos permite generar una prioridad nacional para el paciente asistido. En el lado negativo están los resultados, ya que en los últimos 5 años la mortalidad media en los primeros 60 días tras el TxC de pacientes asistidos con ECMO es del 30%.
Figura 4. Tipo de asistencia mecánica en los trasplantes urgentes realizados entre 2009 y 2013. Reproducido con permiso de González-Vílchez et al3. BCIA: balón de contrapulsación intraaórtico; ECMO: membrana de oxigenación extracorpórea.
Gestión de la lista de esperaLa gestión de la lista de espera se ha adaptado a los criterios de distribución de órganos, la demanda de donantes y la propia oferta.
En relación con los trasplantes urgentes, España forma parte del grupo de países con criterios más restrictivos del más alto grado de urgencia (urgencia 0, que implica prioridad nacional, incluye a pacientes en shock cardiogénico que precisan asistencia circulatoria externa de corta duración o de larga duración disfuncionante)4. En 2012, los trasplantes en urgencia 0 fueron el 14% de todos los TxC realizados. Esta restricción para el grado de urgencia hace que todavía consideremos el TxC urgente como un recurso terapéutico, ya que la mediana de espera es de 8 días.
Frente a los de un país con el que frecuentemente nos comparamos, Estados Unidos, nuestros datos de 2012 son que los trasplantes con el grado de máxima urgencia (1A) fueron el 56% del total. Esto supone una pérdida del carácter de recurso terapéutico del TxC urgente, ya que la mediana de espera para estos pacientes es de 102 días6. A cambio, y entre otros motivos, este hecho ha permitido el desarrollo espectacular de un programa de dispositivos de asistencia ventricular (DAV) implantables. En Estados Unidos, cerca del 40% de todos los receptores adultos de TxC utilizan un DAV como puente al trasplante3.
En cuanto a la gestión global de la lista de espera, en España hemos alcanzado un « equilibrio », y aparentemente nos movemos en « zona de confort ». Si se analiza la evolución de la tasa de trasplantes por millón de población (pmp) en los últimos años, se ve que se ha pasado de una tasa de alrededor de 9 TxC pmp en 2000 a 5,3 TxC pmp en 2013. Esta significativa reducción se ha producido paralela a la tasa de inclusión de pacientes en lista de espera, de 11 pmp en 2000 a 6,9 pmp en 2013.
Las razones para esta reducción en la tasa de inclusión en lista de espera son múltiples:
1. El impacto favorable del tratamiento médico y con dispositivos (desfibrilador automático y terapia de resincronización) en la supervivencia del paciente con IC crónica.
2. Y con ello, el retraso del momento en que se plantea la indicación de TxC. Así, se piensa en TxC a ciertas edades o con comorbilidad acumulada para las que consideramos que ya es demasiado tarde.
3. El incremento en el tiempo de espera medio para trasplante electivo de pacientes que por su comorbilidad no se considera buenos candidatos candidatos a TxC urgente puede hacer que algunos pacientes no sean incluidos en lista de espera pensando que nunca llegarán al TxC.
A pesar de esta aparente « autorregulación » del número de procedimientos a los recursos disponibles, la eficacia del sistema se ha visto reducida en la última década. Así, en 2000 se trasplantó al 70% de los pacientes que estuvieron en lista de espera, mientras que en 2013 solo ocurrió en el 56%. A pesar de estos datos aparentemente malos, se debe tener presente que la eficacia del sistema es una de las mejores, comparada con la de otros países. Así, en Estados Unidos los pacientes trasplantados en 2012 fueron el 36% de los que entraron en lista ese año.
Otros aspectos relacionados con el procedimiento del trasplante cardiacoEl TxC se ha convertido en un procedimiento terapéutico estándar para un reducido grupo de pacientes con IC avanzada y ha perdido parte del impacto social que lo ha beneficiado durante años.
A lo largo de estos años, los equipos han normalizado el procedimiento con cierto grado de autocomplacencia. Por otro lado, y aunque parcialmente protegida, la actividad trasplantadora también ha sufrido los ajustes propios de la situación económica del país.
Fruto de todo ello, así como del crecimiento en el número de urgencias con prioridad nacional, que con mucha frecuencia exigen desplazamientos muy largos, se ha incrementado de manera alarmante el tiempo de isquemia del injerto cardiaco y se ha pasado de 129 min en 1984-1988 a 208 min en el quinquenio más reciente (Figura 5)3. Se debe tener en cuenta que con este valor medio de 208 min un 28% de los trasplantes se realizan con tiempos de isquemia fría > 240 min, factor fuertemente asociado con muerte precoz postrasplante.
Figura 5. Evolución del tiempo medio de isquemia fría, por periodos de 5 años desde 1984 hasta 2013. Reproducido con permiso de González-Vílchez et al 3 .
Trasplante cardiaco en 2014: áreas de mejoraTeniendo en cuenta la creciente complejidad de las características de los donantes, el diferente perfil de los receptores y las dificultades en la gestión de las urgencias, es sorprendente que los resultados globales no se hayan modificado sustancialmente. Cuando se comparan las curvas de supervivencia por décadas, incluso en estas últimas dos décadas ha mejorado discretamente respecto a la primera. Y esto se aprecia tanto en el Registro Español de Trasplante Cardiaco como en el Registro de la International Society for Heart and Lung Transplantation (ISHLT)2,7. Todo parece indicar que los avances en los cuidados médicos y quirúrgicos han compensado con creces el peor escenario clínico en que se desarrolla el procedimiento actualmente.
Por todo ello, tenemos la obligación de encontrar vías para mantener o aumentar el volumen de actividad, preservar los buenos resultados obtenidos hasta el momento, mantener la mayor equidad posible en la distribución de órganos y reducir la mortalidad en lista de espera. Con este objetivo, se analiza a continuación una propuesta de áreas de mejora.
Optimizar el proceso de donación y la adecuada evaluación del donante 8Las intervenciones dirigidas a mejorar la hemodinámica de los donantes han sido probadas en diferentes países y han generado un aumento considerable de donantes adecuados para TxC9,10.
Por otro lado, parece razonable la aplicación de protocolos consensuados en el proceso de donación, la formación continuada de los profesionales implicados y la evaluación periódica del proceso, con vistas a obtener una mejora continua en el proceso de donación y trasplante11,12.
Por último, se debe tener como objetivo mantener el tiempo de isquemia en el intervalo adecuado. Por un lado, los equipos deben sensibilizarse sobre el efecto negativo que supone la autocomplacencia, pues seguro que algo incide en la prolongación de los tiempos de isquemia. Pero también es fundamental reclamar una adecuada coordinación que facilite el trabajo cotidiano.
Medidas para un mejor aprovechamiento de órganos torácicosAño tras año se produce un importante desequilibrio entre el número de corazones de donantes ofertados y el de extraídos para implantar. Este desequilibrio puede ser más evidente si se toma en cuenta que nuestro país tiene el privilegio de tener la más alta tasa de donantes para trasplante y que en los últimos 2 años se ha situado en torno a los 35 donantes pmp.
En 2013 concretamente, la desproporción fue de 401 corazones ofertados frente a 282 corazones extraídos. Sin duda, muchos de los corazones desechados eran no aceptables para TxC, pero cada año hay un porcentaje no despreciable de donantes menores de 45 años que se desechan, muchas veces por hallazgos patológicos en el estudio ecocardiográfico. Probablemente en muchos casos el proceso de evaluación del donante se produce en el momento menos adecuado, cuando la muerte encefálica genera el mayor grado de trastorno funcional del corazón evaluado13,14. Si se consiguiera retrasar el proceso en estos casos, monitorizando la función cardiaca y/o valorando su reserva funcional, se podría aumentar el número de donantes válidos15. Actualmente, este proceso de evaluación interfiere con frecuencia con intereses diversos, no siempre coincidentes, impuestos por la extracción multiorgánica (pulmón, hígado, riñón), en la que participan equipos de diferentes especialidades y procedencias con requisitos específicos de cada órgano, lo que se amplifica cuando la extracción se realiza en un centro sin el soporte habitual de los centros con infraestructura « trasplantadora ».
Otro aspecto que tener en cuenta es la dificultad para evaluar la presencia de enfermedad coronaria en el donante. En la práctica habitual, hay muchas resistencias para la realización sistemática de coronariografías a los potenciales donantes con riesgo cardiovascular. Probablemente, métodos no invasivos (como la angiotomografía computarizada coronaria) o de detección de isquemia (como la ecocardiografía de estrés) podrían tener un papel en los próximos años.
Por último, estudios recientes están examinando el proceso de aceptación de un injerto cardiaco. Hay que tener en cuenta que a menudo hay restricciones en la aceptación de órganos que superan lo recomendando por las guías de práctica clínica1. Pero es que, además, existen datos que demuestran que la utilización de injertos cardiacos podría aumentarse sin elevar el riesgo de muerte postrasplante16.
La cuantificación del riesgo asociado a un donante en particular es difícil. Los estudios en curso están examinando si una mejor evaluación de los riesgos asociados con un donante en particular puede resultar en un incremento en el número de corazones de donantes disponibles y aceptables para trasplante17,18.
Por otro lado, se debe considerar firmemente la creación de una lista de receptores alternativa para los receptores considerados de alto riesgo en los que se pueda emplear donantes con criterios ampliados (válidos para trasplante pero que no interfieran con la lista convencional). Los resultados de este tipo de estrategias son razonables y mejoran el pronóstico de muchos pacientes con IC avanzada19.
Mejorar el sistema de distribución de órganosNuestro sistema de asignación de órganos mantiene un buen equilibrio entre utilidad y justicia. Como principio general, el sistema permite que ante una urgencia se pueda trasplantar antes al paciente que más lo necesita y, en igualdad de condiciones, permite que se trasplante al que más tiempo lleva en lista de espera. Sin embargo, cuando no hay urgencia nacional (urgencia 0), la donación se distribuye a un centro individual o a un área geográfica, y no a un paciente individual. Esto tiene aspectos muy positivos: este sistema contiene un fuerte incentivo para los equipos locales, que maximizan el número de órganos para trasplante mediante la concienciación del proceso de donación, la identificación temprana de los donantes y una gestión óptima de los donantes potenciales. Sin perder de vista estos aspectos positivos, hay que introducir elementos de equilibrio que permitan priorizar más a los pacientes con mayor riesgo de mortalidad, aunque no estén en el centro al que se ha asignado al donante. La priorización según el mayor riesgo de muerte del receptor aumenta el beneficio del trasplante y reduce la mortalidad en lista de espera18,20. Este es un hecho no despreciable si se tiene en cuenta que, si la cifra de mortalidad oficial está próxima a un 3% (cifra realmente baja), la mortalidad «extendida» (es decir, cuando a la mortalidad real en lista de espera se añade a los pacientes que se excluye de la lista de espera por empeoramiento clínico, pues se considera que ya no son candidatos reales para trasplante) asciende al 9%.
Reducir el grado de futilidadSin duda alguna, los pacientes que más se benefician de un TxC son los más graves. Pero también es cierto que los pacientes con mayor mortalidad estimada en lista de espera son los que sufren mayor mortalidad postrasplante20.
Un modelo que introduzca el mayor beneficio en el sistema de distribución de órganos debe considerar un modelo validado de estimación de riesgo mientras el paciente está en lista de espera, con vistas a obtener la mayor utilidad del sistema. Pero a la vez es necesario un modelo validado que permita valorar el riesgo y predecir las probabilidades de supervivencia tras el trasplante y así reducir la futilidad por una inaceptable mortalidad postrasplante prevista.
En los últimos años se han desarrollado algunas escalas de riesgo que permiten predecir mortalidad postrasplante. Algunas son sencillas y unicéntricas, que con valores clínicos básicos permiten conocer la mortalidad postrasplante (CARRS score, Columbia University19), y alguna multicéntrica, validada en un amplio número de pacientes y con mayor número de variables que permiten valorar el riesgo preoperatorio con datos solo del receptor (IMPACT score, UNOS21). Seguro que la difusión de estas escalas y su puesta en práctica van a permitir poner en evidencia el riesgo que se asume con cada paciente cuando se acepta a un donante para TxC.
Porque un paciente en lista de espera precisa de una evaluación continua, sobre todo los pacientes en lista de espera urgente. Con una media de tiempo de espera a trasplante urgente de 8 días para pacientes que entran asistidos con ECMO, no es de extrañar que la situación en el momento del TxC sea marcadamente peor que en la inclusión. Sin embargo, y aun detectando la comorbilidad acumulada, la presión del proceso nos arrastra a un TxC que en ocasiones, ya de antemano, sabemos que tiene muy poca probabilidad de éxito. Y es que la línea divisoria de la disfunción multiorgánica reversible en comparación con la irreversible es muy difícil de encontrar. Por eso, sería bueno ir pensando en cambiar de estrategia. Los DAV permanentes están experimentando un desarrollo clínico espectacular22, aunque el número de implantes en nuestro país es muy pequeño. Sin embargo, se debe tener presente que actualmente la supervivencia a 2 años de pacientes con un DAV implantado como puente al trasplante es del 78%23. Por lo tanto, y sin entrar a analizar el impacto de los DAV como terapia de destino, desde luego, y como puente a trasplante o una decisión, estos dispositivos son una herramienta que debemos tener muy en cuenta. Aunque el coste actual de estos dispositivos es un factor limitante, es previsible que el escenario cambie en los próximos años y que estos dispositivos ayuden a reducir la mortalidad perioperatoria tras el TxC.
ConclusionesEl TxC es un procedimiento consolidado en nuestro país, para una pequeña proporción de pacientes con IC avanzada. El escenario actual de cambio en las características de donante y receptor y de la situación en que los pacientes llegan al TxC exige un esfuerzo de todos los grupos de trasplante con vistas a mejorar el proceso. Estamos obligados a velar por mantener o aumentar la actividad preservando los buenos resultados obtenidos hasta el momento, manteniendo la mayor equidad posible en la distribución de órganos y reduciendo la mortalidad en lista de espera. Estoy convencido de que ha llegado el momento de una nueva Conferencia de Consenso de los Grupos Españoles de Trasplante Cardiaco24.
Conflicto de interesesNinguno.
AbreviaturasDAV dispositivo de asistencia ventricular ECMO membrana de oxigenación extracorpórea IC insuficiencia cardiaca pmp por millón de población TxC trasplante cardiaco
Autor para correspondencia: Unidad de Insuficiencia Cardiaca y Trasplante, Servicio de Cardiología, Hospital Universitario 12 de Octubre, Avda. Córdoba s/n, 28041 Madrid, España. Correo electrónico: (J.F. Delgado Jiménez). juan.delgado@salud.madrid.org