España es un país en continua búsqueda de la autosuficiencia en trasplante. En un entorno cambiante, con un progresivo descenso en la incidencia de muerte encefálica, el sistema ha sido capaz de desarrollar una extraordinaria actividad trasplantadora. Esta, sin embargo, no es la realidad objetivada en el ámbito del trasplante cardiaco, cuya actividad no cubre satisfactoriamente la necesidad de trasplante de nuestra población. A pesar de las evidentes dificultades, existe margen de mejora en cuanto a la disponibilidad de corazones para trasplante y su grado de utilización clínica. Es necesario un abordaje multidisciplinario a través de una serie de estrategias que se analizan en este artículo desde la perspectiva de la donación, la distribución de órganos y la del equipo trasplantador. La utilización de corazones de donantes en asistolia y el uso de dispositivos de perfusión cardiaca ex situ constituyen líneas de futuro para paliar la demanda insatisfecha de trasplante cardiaco.
Palabras clave
En marzo de 2010 se celebró en Madrid la Tercera Consulta Global de la Organización Mundial de la Salud en donación y trasplante. La consulta dio lugar a la denominada Resolución de Madrid, a través de la cual se llamaba a gobiernos y profesionales a progresar hacia el logro de la autosuficiencia en trasplantes1. España se considera un referente en la consecución de este paradigma de la autosuficiencia. La situación de nuestro país destaca en el mapa global, con unas tasas de trasplante que alcanzaron los 90 procedimientos por millón de población (pmp) en el año 2013, tasas inimaginables para la mayoría de los países del mundo2. El logro de esta actividad se sustenta en la combinación de un sistema altamente efectivo en la identificación de potenciales donantes de órganos y su conversión en donantes eficaces, con tasas de donación que se mantienen en torno a los 30-35 donantes pmp, y una extraordinaria situación desde el punto de vista técnico, con equipos de trasplante altamente cualificados e innovadores3.
La actividad de trasplante lograda es especialmente llamativa si se tiene en cuenta el contexto cambiante en el que se ha desarrollado4. En los últimos años, hemos asistido a una progresiva disminución de los eventos que pueden derivar en muerte encefálica (ME) y a mejoras sustanciales en el abordaje terapéutico del paciente neurocrítico. Esto ha determinado un dramático descenso en la incidencia de ME en nuestro país, que ha pasado de los 65 pacientes fallecidos en estas circunstancias pmp a principios de siglo a menos de 50 casos pmp5. En paralelo, se ha producido un envejecimiento del donante de órganos, de modo que en el último año más del 50% de nuestros donantes tenían una edad ≥ 60 años, y la causa más frecuente de fallecimiento fue el accidente cerebrovascular, lejos de la patología traumática cerebral. La adaptación al nuevo perfil del donante, con una utilización creciente de órganos procedentes de donantes de edad avanzada, y el desarrollo de formas de donación diferentes (donación en asistolia y donación de vivo), han permitido a nuestro sistema no solo mantener, sino incrementar, su actividad trasplantadora de todos los tipos de órganos, con algunas excepciones, como es el caso del trasplante cardiaco (TxC).
Los 30 años de vida del TxC en España constituyen una excelente oportunidad para revisar la situación actual de la donación y el TxC en nuestro país e identificar las estrategias que, desde la visión del procurador de órganos, es imperativo abordar. Pese a su contemporaneidad, estas estrategias no distan mucho de aquellas que ya se apuntaban, curioso el dato, en un editorial publicado en 2006 y que entonces titulábamos: «El trasplante cardiaco en España, ¿hemos tocado techo?»6.
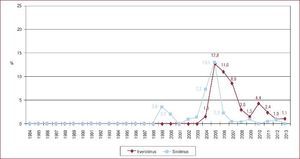
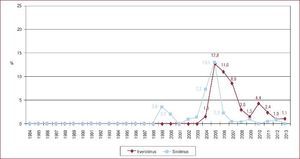
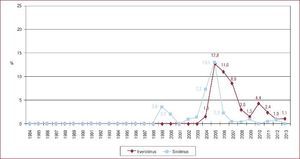
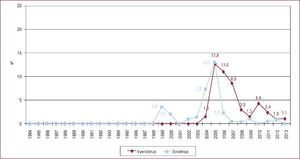
Actividad del trasplante cardiaco en españa: ¿somos autosuficientes?Durante la década de los años noventa, a medida que aumentaba la actividad de donación en nuestro país, se producía un incremento paralelo de la actividad del TxC, que alcanzó su máximo histórico a principios de este siglo. En el año 2000, en España se realizaron 353 procedimientos de TxC (8,9 pmp), para luego descender a un ritmo que nos ha situado en los últimos 3 años en torno a los 250 trasplantes anuales (5-5,3 pmp) (Figura 1).
Figura 1. Actividad de trasplante cardiaco y pacientes en lista de espera cardiaca en España, en tasas por millón de población, especificando el total de pacientes en lista y las nuevas inclusiones en lista durante los años 1993 a 2013. Fuente: Organización Nacional de Trasplantes. pmp: por millón de población; TxC: trasplante cardiaco.
La situación actual del TxC en España no deja de resultar llamativa cuando se evalúa desde el panorama internacional. Varios países de nuestro entorno, que ostentan una tasa de donación muy inferior a la española, desarrollan una actividad de TxC similar o solo ligeramente inferior a la nuestra. En la Figura 2 se presenta la correlación entre las tasas de donación en ME y las de TxC pmp para diversos países. España se desvía claramente de una línea que correlaciona perfectamente ambos parámetros. ¿Cuál es el motivo?
Figura 2. Correlación entre la actividad de donación en muerte encefálica y la actividad de trasplante cardiaco en número de procedimientos por millón de población en España y otros países, 2012. Figura elaborada con datos de Newsletter Transplant 2013 2 . pmp: por millón de población; TxC: trasplante cardiaco.
En gran medida, la actividad está determinada por el descenso objetivado en el número de indicaciones de TxC (Figura 1). Para los más optimistas, las mejoras en el manejo de la insuficiencia cardiaca (terapia farmacológica, programas de angioplastia, generalización del desfibrilador automático implantable y la terapia de resincronización cardiaca) han determinado una menor necesidad de trasplante. Sin restar importancia a esta posibilidad, también es evidente que el TxC no ha conseguido adaptarse al nuevo perfil del donante en la medida que lo han hecho otros órganos. Este es el caso incluso del trasplante pulmonar, con requisitos de donante más exigentes que los del TxC, pese a lo cual superó la actividad de este por primera vez en 2013 (285 procedimientos, 6 pmp). A su vez, esta incompleta adaptación ha podido determinar el descenso de indicaciones, por un fenómeno de autorregulación por el que se limita la inclusión de pacientes en lista. Como nada en medicina es blanco o negro, posiblemente a lo que asistimos es a una escala de grises en la que ambos factores tienen su papel. Pero el margen de aumento de indicaciones queda patente cuando simplemente se realiza una comparación entre comunidades autónomas. En 2013, las tasas de indicación oscilaban entre 4,5 y 18,7 pacientes pmp, con una media nacional de 6,9. Esta variación no es secundaria a diferencias epidemiológicas en las enfermedades cardiacas, sino más bien a la variabilidad en la práctica clínica, que tiene bastante que ver con la facilidad de acceso de la población a los centros de trasplante.
Asumiendo que las indicaciones fueran representativas de la verdadera necesidad de TxC (cosa ciertamente dudosa), distamos de cubrir de manera satisfactoria dicha necesidad. A medida que ha disminuido el número de TxC, se ha producido un descenso en la probabilidad de trasplante, del 70% en 2000 al 56% en 2013. En paralelo, los pacientes en lista de espera activa a final de año han aumentado del 16 al 27% en el mismo periodo. Curiosamente, la mortalidad en lista ha disminuido hasta situarse por debajo del 5%, si bien esta mortalidad está sesgada por las exclusiones debidas a complicaciones o al empeoramiento de la situación clínica de los pacientes en lista, cuya inclusión ofrecería una mortalidad real cercana al 10%. La demanda insatisfecha tiene también impacto en la distribución de corazones, cada vez más destinados a los pacientes en peor situación clínica (en 2013, el 49% de los TxC se efectuaron en pacientes en lista de espera urgente), lo que no favorece la utilización local de corazones para pacientes en electivo. El trasplante urgente determina un frecuente desplazamiento a distancia de equipos para la valoración de corazones, lo que puede ser la causa del incremento objetivado en los tiempos de isquemia a lo largo de los años en nuestro país7, un factor claramente determinante de la supervivencia post-TxC8.
Si bien es cierto que se ha producido un descenso progresivo en el número de corazones disponibles para trasplante, es importante señalar que el número total de corazones ofertados no ha sufrido la dramática reducción que podría esperarse en el contexto actual de descenso de potencialidad de donación en ME. Esto se debe a la cada vez más frecuente oferta de corazones que se desvían de lo que tradicionalmente se consideraba óptimo para trasplante. De estos corazones ofertados a la red trasplantadora, aproximadamente el 30% no se acepta finalmente para trasplante, porcentaje que se mantiene inalterado año tras año. Esta tasa de no aceptados se da incluso para corazones jóvenes, de manera que en 2013 los equipos no aceptaron para trasplante el 27% de los corazones ofertados de menores de 45 años (Figura 3). Un dato muy ilustrativo es que menos del 60% de los donantes en ME menores de 45 años son donantes cardiacos, con gran variabilidad entre comunidades autónomas e incluso entre hospitales de una misma región. Por lo tanto, aunque el escenario no es favorable, existe un amplio margen de mejora. Aumentar la disponibilidad de corazones para trasplante y su grado de utilización clínica requiere una combinación de estrategias, que se analizan en las siguientes secciones, desde la perspectiva de la donación (mantenimiento y evaluación del donante cardiaco), la distribución-asignación de órganos y el centro trasplantador (valoración y extracción cardiaca).
Figura 3. Número de corazones ofertados (total y por grupos de edad) y porcentaje de corazones ofertados que se extraen en España. Años 2000-2013.
Estrategias desde la perspectiva de la donaciónCualquier posible donante de órganos ha de ser considerado donante cardiaco. Su cuidado se debe iniciar precozmente, ya en el momento en que se identifica a un paciente con daño cerebral catastrófico para el que se desestima continuar tratamiento y se prevé evolución a ME, y se debe mantener en la UCI y en el quirófano hasta el pinzamiento o “clampaje” del injerto cardiaco. Existen diversas estrategias que redundarían en mejor tratamiento de los donantes y mayor aprovechamiento de sus órganos.
Formación del personalEl donante solo cardiaco no existe; es un donante multiorgánico que obliga a un equilibrio de medidas que pueden ser beneficiosas para un órgano y no ideales para otro. Aun así, el tratamiento intensivo del donante es beneficioso para todos los órganos donables9,10. El donante multiorgánico es un «paciente crítico» para el que se modifica el objetivo deseado de salvar la vida de un paciente por el de «mimar» los órganos de un fallecido para salvar la vida de otros pacientes.
La medida más eficaz para maximizar el número de injertos válidos es que la persona responsable del tratamiento del donante sea experta en el tratamiento del paciente crítico y tenga conocimientos sobre fisiología respiratoria y circulatoria y ventilación mecánica, y un amplio bagaje en cuidados intensivos. La aplicación de los principios de la medicina intensiva al tratamiento del donante se ha mostrado como la herramienta más eficaz para obtener un mayor y mejor número de injertos11. Cuando el cuidado de un donante lo realiza personal experimentado en cuidados intensivos, se incrementa el número de injertos obtenidos por donante12. Por el contrario, la dirección del proceso por personal inexperto se acompaña de errores técnicos y complicaciones que comprometen seriamente el trasplante13.
La experiencia del personal en el tratamiento del donante adquiere mayor importancia en el caso del donante de órganos torácicos, que se deterioran más fácilmente tras la ME. Es complicado adquirir esta experiencia con una actividad de donación cardiaca distribuida entre los 187 centros actualmente autorizados para la extracción de órganos. La formación continuada en este campo y una mayor profesionalización en el tratamiento del donante son una estrategia de actuación ya implementada por la Organización Nacional de Trasplantes a través de cursos específicos destinados a los profesionales de medicina intensiva desde etapas muy tempranas de su vida profesional, y la elaboración de protocolos del manejo del donante torácico con las sociedades científicas relevantes14.
Monitorización cardiacaEl corazón es un órgano muy sensible a la inestabilidad hemodinámica; las crisis hipertensivas que acompañan la liberación de catecolaminas en el momento del enclavamiento pueden producir microinfartos de miocardio que dañan un corazón previamente sano. Por su parte, la hipotensión puede derivar en disfunción ventricular e incluso en lesiones estructurales por hipoperfusión15,16. Tradicionalmente se consideraba que en un donante inestable era precisa una monitorización invasiva para un mejor control hemodinámico15. Pero, además de la monitorización sistemática, se debería exigir monitorizaciones invasivas de gasto cardiaco que permitan conocer en tiempo real la situación hemodinámica verdadera de los potenciales donantes, realizar un manejo estricto del gasto cardiaco con la dosis precisa de volumen e inotrópicos17,18 y detectar y tratar precozmente los periodos de inestabilidad hemodinámica, para minimizar el daño miocárdico.
El uso del catéter de Swan-Ganz es teóricamente muy eficaz, pero apenas se utiliza en la donación de órganos. Actualmente existen tecnologías que permiten una monitorización invasiva de pacientes críticos más sencilla, como los sistemas Picco® y Vigileo®, que aportan información relevante sobre la situación hemodinámica de los potenciales donantes y permiten minimizar el uso de inotrópicos y valorar en tiempo real el efecto de cualquier actuación sobre su estado circulatorio. La información de este tipo de monitorización invasiva abarca el gasto cardiaco, la precarga cardiaca, la existencia de vasoconstricción o vasoplejía sistémica o la medición indirecta de edema pulmonar, entre otros, lo que facilita la toma de decisiones.
La disfunción del ventrículo izquierdo valorada por ecocardiografía es una causa frecuente de rechazo de injertos cardiacos, si bien en un importante porcentaje de casos esta disfunción es una secuela reversible producida por los cambios fisiológicos de la ME19. Estos injertos con disfunción moderada, sin anomalías segmentarias, producida por un «aturdimiento miocárdico», pueden recuperar su función mediante un tratamiento óptimo del donante. Dicha optimización terapéutica consiste en generar las condiciones idóneas para ese miocardio aturdido, mediante una absoluta normalidad fisiológica que conlleva una estabilidad hemodinámica y unos parámetros circulatorios (índice cardiaco, precarga cardiaca, poscarga cardiaca, etc.) normalizados con un equilibrio ajustado de fluidoterapia e inotrópicos17,20. Este objetivo, que debiera plantearse desde el inicio del tratamiento del donante, solo puede conseguirse mediante monitorización invasiva del gasto cardiaco, como en cualquier paciente crítico. El uso de estas tecnologías está ampliamente extendido en las unidades de críticos de nuestro país. Se debe considerar al donante como paciente crítico, y como a tal se debe tratarlo, tanto en la atención como en los medios diagnósticos y terapéuticos utilizados. Por lo tanto, es injustificable no utilizar esta tecnología en los donantes multiorgánicos, dado que aporta información relevante que mejora la calidad del tratamiento aplicado y su coste es muy reducido.
Tratamientos médicos adicionalesLa utilidad de la resucitación hormonal (insulina, hormona tiroidea, vasopresina y corticoides) para los donantes multiorgánicos es controvertida. Los primeros estudios realizados con controles históricos demostraron un beneficio en la donación cardiaca21, no corroborado posteriormente en estudios aleatorizados ni en dos recientes metanálisis22,23. La hormona tiroidea es la que tradicionalmente se ha relacionado con un incremento de la donación cardiaca, por lo que algunos autores han propuesto su uso en donantes con importante inestabilidad hemodinámica24. Recientemente, un estudio de registro sobre más de 60.000 potenciales donantes ponía de manifiesto un mayor número de corazones extraídos e implantados por donante con la utilización de hormonas tiroideas, con mejoras también objetivadas en la supervivencia post-TxC. Este estudio posiblemente reavive el debate sobre la utilidad de las hormonas tiroideas en el tratamiento del donante de órganos25.
Valoración de la función cardiacaA día de hoy, ningún equipo de TxC considera la donación cardiaca sin una evaluación ecocardiográfica, exploración que requiere habilidad y experiencia. Solo 18 de los 187 centros autorizados para la extracción de órganos realizan TxC. Por ello, con frecuencia esta exploración la realizan profesionales poco familiarizados con el TxC, a los que resulta difícil una valoración que movilizará a un equipo, a veces, desde el otro extremo del país.
Dejando aparte la subjetividad del explorador y las complicaciones logísticas mencionadas, lo cierto es que el ecocardiograma que muestra una disfunción ligera-moderada sin anomalías segmentarias siempre deriva en la pregunta de si ese corazón puede recuperar la función si se repite la exploración pasado un tiempo. En este sentido, la realización de la prueba ha de alejarse lo más posible del enclavamiento y efectuarse tras al menos 1 h de estabilidad hemodinámica. En caso de ecocardiografía dudosa, puede plantearse optimizar el tratamiento del donante y reevaluar en 2-4 h si el proceso de donación y la situación familiar lo permiten, aunque siempre debiera haberse optimizado el tratamiento con anterioridad. Dicha optimización supone la utilización de vasopresores en la dosis mínima para mantener un gasto cardiaco adecuado y la administración del volumen apropiado para obtener una buena precarga sin ser excesivo, pues una disfunción moderada puede inducir edema pulmonar.
Cribado de enfermedad coronariaLa estrategia de considerar corazones subóptimos para trasplante ha derivado en el requerimiento frecuente de realizar coronariografías al potencial donante. Aunque razonable desde la visión exclusiva del trasplantador cardiaco, la realización sistemática de este procedimiento no se puede recomendar por su escasa disponibilidad, pero sobre todo por el impacto que puede tener en el proceso global de donación. Una coronariografía exige desplazar al donante fuera de la UCI, lo cual dificulta su manejo y aumenta el riesgo de parada cardiorrespiratoria, con pérdida de todos los órganos potencialmente donables. El cateterismo podría recomendarse para potenciales donantes de edad > 55 años o con importantes factores de riesgo cardiovascular, si se ha consensuado previamente con el coordinador de trasplantes para optimizar el tratamiento del donante17. En la práctica, esto es factible cuando el donante surge en un centro con TxC.
Una alternativa teórica al cateterismo es la tomografía computarizada (TC) coronaria multicorte; sin embargo, su utilidad está por comprobarse, así como su disponibilidad e interpretación adecuada. Tampoco solventa el problema de mantener al potencial donante durante un largo periodo fuera de la UCI. El uso de la ecografía cardiaca de estrés en donantes de alto riesgo cardiovascular es una posibilidad interesante26, pero precisa de altos conocimientos ecográficos que dificultan su utilización en todos los centros extractores.
Otros aspectos en la donación cardiacaAlgunos estudios han planteado que un manejo especializado del donante multiorgánico, retrasando la extracción más allá de 20 h tras la ME, incrementaría el número de injertos cardiacos27,28. Estos trabajos inciden en que dicho tratamiento especializado corrige el deterioro que han sufrido los órganos durante los primeros instantes de la ME. Este planteamiento es muy complicado de llevar a la práctica por la complejidad logística de la donación multiorgánica y el riesgo de parada cardiaca o deterioro de los demás órganos. Además, no es el tiempo lo que mejora los injertos, sino el tratamiento adecuado y precoz por personal experto.
Estrategias desde la perspectiva de la distribución de órganosLos criterios de distribución de corazones actualmente vigentes en España son un modelo combinado de asignación orientada a paciente a partir de determinado nivel de gravedad (que marca la entrada en urgencia) y de asignación orientada a centro, para pacientes en electivo. La selección del centro se basa en aspectos geográficos, con ciertas consideraciones clínicas que reducen la variabilidad en el acceso al trasplante para algunos grupos de pacientes. Si bien ningún modelo de distribución es perfecto, el adoptado en nuestro país tiene la ventaja de estimular la donación localmente, considerándose con más facilidad (al menos teóricamente) la utilización de órganos subóptimos.
Recientemente, sin embargo, se han alcanzado niveles de trasplante urgente cercanos al 50%, a expensas de una frecuente movilización de equipos a lo largo y ancho del país, con órganos no precisamente obtenidos localmente. Aunque el criterio de urgencia ha de preservarse y manejarse sobre el fundamento de la cohesión de todo el territorio nacional, requiere de una revisión continuada para evitar que un excesivo abuso de este estado repercuta negativamente en la donación local. Los criterios de distribución cardiaca han de someterse a evaluación continuada, de manera que se fomente el uso local de corazones en general y de corazones subóptimos en particular.
Estrategias desde la perspectiva del equipo de trasplanteFlexibilización de criterios de aceptación de corazones para trasplanteUno de los principales motivos de que no se acepten corazones ofertados es el perfil del donante, bien por edad avanzada, bien por la existencia de comorbilidades, incluidos los factores de riesgo cardiovascular. No sería cierto afirmar que los equipos de TxC no han flexibilizado sus criterios de aceptación de donantes cardiacos. A lo largo de los años, la edad de los donantes de corazones implantados ha ido aumentado progresivamente (Figura 4). Sin embargo, la adaptación no ha sido tan evidente como la acontecida con los demás órganos y tampoco se ha producido de manera generalizada en todos los equipos de trasplante.
Figura 4. Grupos de edad de los donantes de los corazones implantados en España. Solo receptores adultos (> 16 años). Años 2001-2013.
En la Figura 5 se representa gráficamente la edad de los corazones implantados por los diferentes equipos en España desde el año 2000 hasta la actualidad; se pone de manifiesto la enorme variabilidad en el porcentaje de corazones trasplantados de edad > 45 años. Promover la utilización de estos corazones requiere un nivel de compromiso de los centros que es difícil de alcanzar cuando las listas de espera son demasiado reducidas, lo que lógicamente permite al equipo ser exigente a la hora de seleccionar un corazón para trasplante. A finales de 2013, había 117 pacientes adultos en lista de espera para TxC, distribuidos entre 16 centros, lo que supone menos de 7 pacientes por lista, aunque con marcadas diferencias entre hospitales. La atomización de las listas de espera, con todos sus problemas asociados, es uno de los motivos para revisar de manera crítica si todos los centros han de continuar con esta actividad. En una reciente revisión del tema, se apuntaba también que el uso más frecuente de asistencias ventriculares permite a los equipos ser más selectivos en la aceptación de corazones para trasplante en los pacientes en urgencia20. Esta realidad también puede estar dándose en nuestro país, donde el uso de estos dispositivos crece año tras año7. El miedo a flexibilizar criterios de aceptación es siempre el mismo, la mortalidad postrasplante con corazones no idóneos. Pero una supervivencia reducida, como ha ocurrido en otros órganos, siempre ha de compararse con la mortalidad no deseable del paciente que necesita un trasplante, tanto el incluido en lista como el que no.
Figura 5. Grupos de edad de los donantes de los corazones implantados en España en 2001-2013, por centro de trasplante. Solo receptores adultos (> 16 años). Años 2001-2013.
Experiencia y estabilidad del equipo de trasplanteUna vez efectuada la extracción, cada año un número de corazones que oscila entre 30 y 50 se desestima finalmente para trasplante por motivos diversos, de los cuales algunos son evitables y difícilmente justificables en un momento de escasa disponibilidad de corazones. En varias ocasiones, razones relacionadas con el receptor previamente seleccionado, sin prever un contratiempo y tener previsto otro receptor, han determinado que finalmente no se utilizara un corazón idóneo. Otro motivo frecuente de desestimación es la existencia de lesiones coronarias detectadas por palpación por el cirujano extractor. Sin dudar de la validez de dicha desestimación en manos expertas, es importante asegurar que dicho nivel de experiencia está efectivamente presente en la extracción, fundamentalmente cuando se evalúan corazones subóptimos, para así evitar desestimaciones inadecuadas o al menos cuestionables. Más que nunca, contar con interlocutores estables y experimentados, que evalúen y se encarguen de realizar la extracción cardiaca, sobre todo en casos de corazones de validez dudosa, es imprescindible.
Extracción cardiaca por equipo localSi bien de escasa popularidad entre los equipos de trasplante, una medida logística que se debe considerar es organizar la extracción de corazones con los equipos de trasplante locales, con independencia de que el corazón vaya finalmente destinado al paciente de otro centro. Es entendible que un equipo muestre reticencia a embarcarse en desplazamientos a larga distancia y en mitad de la noche para extraer corazones etiquetados como dudosos. Pero la extracción organizada con el equipo local puede determinar que esos corazones al menos sean evaluados in situ y considerados para trasplante.
Otras estrategiasTrasplante cardiaco de donantes en asistoliaLa donación en asistolia (DA) se ha desarrollado en nuestro país de una manera extraordinaria en los últimos años, de manera que ya representa el 10% del total de nuestra actividad. Este aumento no es exclusivo de nuestro país, sino que también se ha dado en Australia, Canadá, Estados Unidos, Francia, Países Bajos y Reino Unido, entre otros29. Si bien en el pasado este tipo de donación en España se limitaba a personas fallecidas tras una parada cardiaca reanimada sin éxito y motivada en general por enfermedad cardiaca, actualmente la DA controlada es también una realidad. Este tipo de donación acontece a partir de personas fallecidas tras una retirada de medidas de soporte vital tras haberse alcanzado una situación de futilidad terapéutica. La utilización de órganos de estos donantes, que ya superaron los 50 casos el año pasado en España, está limitada por la isquemia caliente inherente al tipo de fallecimiento, a pesar de lo cual se han logrado excelentes resultados con el trasplante de riñones, hígados, pulmones e incluso páncreas. El trasplante de corazones de DA se abordó curiosamente en los inicios del TxC, antes de que se establecieran los criterios de Harvard para el diagnóstico de fallecimiento por criterios neurológicos30. Más recientemente, Boucek et al31 publicaron una primera experiencia de TxC pediátrico con la utilización de corazones de tres donantes infantiles en asistolia. La experiencia no estuvo exenta de controversia, por haber conseguido revertir en los receptores lo que se había considerado en los donantes como un cese irreversible del funcionamiento cardiaco; esta controversia se constituyó en uno de los motivos de elaboración del concepto de muerte circulatoria, en sustitución del concepto previo de muerte cardiaca32,33. Actualmente emerge el interés por explorar el uso clínico de estos corazones para trasplante, una línea de futuro a la que nuestro sistema ha de permanecer atento34.
Nuevas técnicas de preservación cardiaca ex situLa preservación ex situ con máquinas como el Organ Care System de Transmedics también se vislumbra como estrategia para aumentar la utilización clínica de corazones. Los resultados preliminares del ensayo clínico PROCCED II en 128 pacientes aleatorizados a preservación en frío o preservación con este dispositivo ponen de manifiesto una evolución similar en cuanto a eventos adversos, rechazo agudo y mortalidad a 30 días35. Sin embargo, sus ventajas están por demostrar. Potencialmente, además de facilitar una preservación más fisiológica del órgano, este dispositivo podría permitir evaluar corazones de forma precisa y ex situ, así como tratar y recondicionar órganos dotados con un tiempo adicional para recuperarse del aturdimiento propio de la ME. Más aún, el tiempo de isquemia, uno de los factores que frena el uso de determinados órganos, se limitaría como problema con esta estrategia, lo que permitiría utilizar corazones más allá de los límites geográficos establecidos en la actualidad.
Consideraciones finalesLa Organización Nacional de Trasplantes ha actualizado recientemente los criterios de planificación de TxC en España y considera necesario que un centro de TxC adulto desarrolle una actividad mínima de 20 procedimientos anuales, con un mínimo tolerable de 15. Esta medida obedece a varios motivos. La explosión del TxC en la década de los años noventa hizo necesario incrementar el número de equipos a cargo de esta prestación sanitaria. Con un descenso de la actividad de aproximadamente 100 procedimientos anuales en 10 años, la reducción del número de centros, si bien manteniendo la distribución geográfica, es una medida cuando menos de sentido común. La atomización ya mencionada de las listas de espera probablemente sea uno de los principales frenos a la flexibilización de los criterios de aceptación de órganos para trasplante. Los resultados del TxC se reducen de manera significativa cuando la actividad del centro se encuentra por debajo de los 20 procedimientos anuales, según datos del Registro ISHLT36. Revisando el problema desde una perspectiva diferente, la reducción en el número de centros también puede resultar en un descenso de indicaciones, pues año tras año se repite la limitada tasa de indicación en comunidades autónomas sin programa de trasplante. Si lo que finalmente nuestro sistema decide es que hemos alcanzado techo en TxC, procedamos a la integración de unidades, concentrando la actividad quirúrgica del TxC en determinados centros. Si lo que se decide es que necesitamos potenciar esta actividad para cubrir adecuadamente las necesidades de nuestros pacientes, mejoremos la estrategia de mantenimiento y evaluación del donante cardiaco, pero sobre todo revisemos críticamente las indicaciones y flexibilicemos de manera definitiva los criterios de aceptación de corazones para trasplante: son muchas las vidas que de ello dependen.
Conflicto de interesesNinguno.
AbreviaturasDA donación en asistolia ISHLT International Society for Heart and Lung Transplantation ME muerte encefálica pmp por millón de población TxC trasplante cardiaco UCI unidad de cuidados intensivos
Autor para correspondencia: Organización Nacional de Trasplantes, Sinesio Delgado 6, Pabellón 3, 28029 Madrid, España. rmatesanz@msssi.es