Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNSegún lo indicado en las actuales guías europeas1,2, la estratificación del riesgo tromboembólico en la fibrilación auricular (FA) se basa en gran parte en sistemas de puntuación del riesgo clínico, como la puntuación CHADS2 o, más recientemente, la puntuación CHA2DS2-VASc3. El beneficio clínico neto es favorable a la anticoagulación en casi todos los pacientes con FA, excepto los que tienen un riesgo muy bajo de ictus isquémico, con una puntuación CHA2DS2-VASc = 04. Si se aplica la puntuación de riesgo CHADS2, aproximadamente un 70-80% de todos los pacientes con FA serían elegibles para el empleo de anticoagulantes orales (ACO), pero si en vez de ello se aplica la puntuación CHA2DS2-VASc, los pacientes para los que estarían indicados los ACO pueden aumentar hasta casi el 94%5.
Es importante apreciar que la enfermedad coronaria está presente en alrededor de un 20-30% de los pacientes con FA6. Conviene destacar también que casi un 10% de los pacientes con síndrome coronario agudo (SCA) presentan FA7. Los pacientes con FA que sufren un SCA o una cardiopatía isquémica crónica tratados mediante intervencionismo coronario percutáneo (ICP) con implantación de stents comportan un problema terapéutico complejo8–10. Hay que señalar que estos pacientes tienen mal pronóstico11.
Las guías actuales sobre SCA e ICP recomiendan el uso de tratamiento antiagregante plaquetario combinado doble durante los 12 meses tras un SCA, con independencia del ICP, y también tras implante electivo de stent (generalmente durante 4 semanas para un stent metálico sin recubrimiento [SMSR] y hasta 12 meses para un stent liberador de fármaco [SLF])12,13. El tratamiento combinado de ácido acetilsalicílico-clopidogrel es menos eficaz que los ACO solos para la prevención del ictus, y los ACO solos son insuficientes para prevenir la trombosis del stent.
El reciente Documento de Consenso del Grupo de Trabajo sobre Trombosis de la Sociedad Europea de Cardiología, respaldado también por la European Heart Rhythm Association y la European Association of Percutaneous Cardiovascular Intervention, propone el empleo de una terapia triple (TT) en los pacientes con FA que sufren un SCA o una cardiopatía isquémica crónica y son tratados con implantación de stents. Dicha terapia incluye el uso de ACO junto con ácido acetilsalicílico en dosis de 100 mg/día y clopidogrel en dosis de 75 mg/día a corto plazo, seguido de un tratamiento más prolongado con ACO y un solo fármaco antiagregante plaquetario. Al cabo de 1 año, el empleo de ACO en monoterapia, utilizando warfarina, parece ser suficiente8. Hay muchas semejanzas evidentes con un documento de consenso norteamericano más reciente9.
Incluso en los pacientes con alto riesgo hemorrágico (puntuación de riesgo HAS-BLED > 3), los ACO mejoran el pronóstico (reduciendo la mortalidad y los eventos adversos cardiovasculares mayores), pero con un aumento significativo de las hemorragias mayores14. La combinación de ACO con un solo fármaco antiagregante plaquetario (ácido acetilsalicílico o clopidogrel) no parece ser un tratamiento óptimo por lo que respecta a la aparición de episodios de trombosis del stent, tromboembolia y hemorragia, y no se debe prescribirla como estrategia terapéutica inicial tras el empleo de ICP con implante de stents15. Sin embargo, el uso de la TT se asocia a una tasa de hemorragias muy superior16,17. Además, existen otros factores que también elevan la tasa de hemorragias. Es frecuente que en esta clase de pacientes coexistan factores de este tipo, como el uso de un inhibidor de la glucoproteína IIb/IIIa, el tronco común afectado o enfermedad de tres vasos, la edad avanzada (> 75 años), el sexo femenino, la enfermedad renal crónica y un valor elevado de la razón internacional normalizada.
En los pacientes con FA y un riesgo de ictus moderado-alto, en los que es preciso el empleo de ACO a largo plazo, es necesario alcanzar un equilibrio entre la prevención del ictus y el riesgo de trombosis del stent tras ICP con implante de stents por un lado y los efectos negativos de la hemorragia con el empleo de un tratamiento antitrombótico combinado por el otro. No obstante, el riesgo de ictus está estrechamente relacionado con el riesgo de hemorragia en los pacientes con FA18,19. Así pues, el Documento de Consenso recomienda una serie de estrategias orientadas a reducir el riesgo hemorrágico en estos pacientes8.
Vía radialPor varias razones, se recomienda la vía radial como la forma de abordaje de elección en este tipo de pacientes. La vía femoral es un factor predictivo, de carácter independiente, de complicaciones en el lugar de acceso arterial de los pacientes tratados con warfarina (razón de riesgos = 9,9)20. Además, esta vía de abordaje permite realizar la intervención de ICP en pacientes tratados con warfarina sin suspender por completo el empleo de ACO, con lo que se evita el tratamiento puente con heparina.
Razón internacional normalizada ajustada a la bajaLa intensidad de la dosis debe regularse cuidadosamente, con un objetivo de razón internacional normalizada de 2,0-2,5. De hecho, un estudio de Rossini et al21 puso de manifiesto una tasa de hemorragias en los pacientes tratados con TT similar a la de los pacientes que recibían sólo un tratamiento antiagregante plaquetario combinado doble. Por desgracia, este objetivo frecuentemente es difícil de alcanzar, sobre todo al dar de alta al paciente, que es cuando puede aportar el máximo beneficio, pero también cuando pueden producirse más interacciones con distintos fármacos.
No requiere tratamiento puente con heparinaHasta hace poco, los cardiólogos intervencionistas eran reacios a realizar un cateterismo coronario en pacientes plenamente anticoagulados. La vía de abordaje radial y los problemas cotidianos que presentan los pacientes con FA con los cambios de tratamiento anticoagulante han llevado a un uso más frecuente del ICP en pacientes en que se continúa con la anticoagulación sin utilizar un tratamiento puente con heparina, dado el aumento de riesgo tromboembólico y hemorrágico que esta comporta. La vía radial permite al operador no suspender los ACO en los pacientes inestables o, como mínimo, realizar el ICP después de sólo una breve interrupción de los ACO, con una razón internacional normalizada próxima el límite inferior de la ventana terapéutica. Esta estrategia puede reducir las hemorragias periintervención y los episodios tromboembólicos durante el tratamiento puente.
La duración de la TT está determinada principalmente por dos variables: el contexto clínico (variable no modificable) y el tipo de stent (variable modificable). Dado que el beneficio aportado por el tratamiento antiagregante plaquetario combinado doble en los pacientes con SCA se obtiene principalmente durante los primeros meses, el tipo de stent puede ser la variable que influya en la duración de la TT.
TIPO DE STENT Y TRATAMIENTO ANTITROMBÓTICOHay unanimidad respecto a que se debe evitar el uso de SLF o limitarlo estrictamente a situaciones clínicas y anatómicas concretas, como lesiones largas, vasos pequeños y pacientes diabéticos, en que cabe prever un beneficio significativo en comparación con los SMSR. La ventaja de los SMSR está en el uso de TT durante sólo 4 semanas tras el ICP. El beneficio que aportan los SLF es la reducción de la revascularización del vaso diana, pero su uso comporta muchos problemas en los pacientes con FA, como el riesgo inherente de hemorragia que implica la mayor duración del tratamiento antiagregante plaquetario22; además, la TT se ha asociado a unas tasas de hemorragias mayores de hasta un 7%/año23. La interrupción del tratamiento antiagregante plaquetario combinado doble podría comportar también una tasa más elevada de trombosis del stent24, aunque podría recomendarse la hipotética menor duración del tratamiento antiagregante plaquetario combinado doble25. Por último, la suspensión temporal de la anticoagulación se asocia a un mayor riesgo de tromboembolias26.
Se han presentado apenas unos pocos datos de estudios no aleatorizados o de series retrospectivas basadas en registros (tabla). Tras un análisis basado en propensity score, ya habíamos observado tasas de eventos adversos graves y de mortalidad por todas las causas durante el seguimiento realizado después del uso de SLF similares a las existentes tras el empleo de SMSR en esta población27. A pesar de que los SLF se utilizaron en lesiones con mayor riesgo de reestenosis, los factores predictivos de los eventos cardiacos adversos mayores y de la mortalidad fueron la edad, la insuficiencia renal crónica, la FA crónica y no emplear cumarínicos al dar de alta al paciente. En nuestra serie, la tasa de hemorragias mayores fue especialmente elevada en el grupo de SLF y mostró clara relación con la terapia doble o la TT prolongadas que exigen los SLF27.
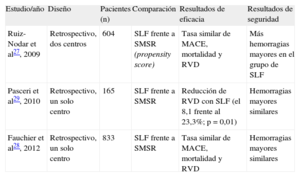
Diseño y resultados más importantes de los estudios publicados sobre pacientes con fibrilación auricular y uso de stents liberadores de fármacos
| Estudio/año | Diseño | Pacientes (n) | Comparación | Resultados de eficacia | Resultados de seguridad |
| Ruiz-Nodar et al27, 2009 | Retrospectivo, dos centros | 604 | SLF frente a SMSR (propensity score) | Tasa similar de MACE, mortalidad y RVD | Más hemorragias mayores en el grupo de SLF |
| Pasceri et al29, 2010 | Retrospectivo, un solo centro | 165 | SLF frente a SMSR | Reducción de RVD con SLF (el 8,1 frente al 23,3%; p = 0,01) | Hemorragias mayores similares |
| Fauchier et al28, 2012 | Retrospectivo, un solo centro | 833 | SLF frente a SMSR | Tasa similar de MACE, mortalidad y RVD | Hemorragias mayores similares |
MACE: eventos cardiovasculares adversos mayores; RVD: revascularización de vaso diana; SLF: stent liberador de fármaco; SMSR: stent metálico sin recubrimiento.
En otro registro se analizó la influencia del uso de SLF en pacientes con FA28. De un total de 833 pacientes consecutivos, los SLF se utilizaron solamente en el 19%, con una frecuencia de eventos adversos graves durante el seguimiento tras el uso de SLF similar que con SMSR (es decir, curvas de supervivencia similares con una tasa similar de uso de revascularización de la lesión diana: el 2,7 frente al 1,3% por año de exposición; p = 0,15), aunque el uso de SLF fue más frecuente en los pacientes diabéticos y en las lesiones más largas. Es de destacar que la implantación de SLF no se asoció de manera significativa a mayor riesgo de hemorragias mayores. En cambio, Pasceri et al29 presentaron una pequeña serie de 165 pacientes con una gran diferencia de incidencia de revascularizaciones del vaso diana (el 8,1% con los SLF frente al 23,3% con los SMSR; p = 0,01) durante un seguimiento de 12 meses, sin que hubiera diferencias en las hemorragias mayores.
En los pacientes de la práctica clínica real, la situación suele ser mucho más compleja. Estos pacientes con FA suelen ser ancianos, con elevada prevalencia de diabetes mellitus y anatomía coronaria desfavorable (enfermedad de múltiples vasos; lesiones de vasos largos, pequeños y calcificados). Lo ideal sería encontrar lesiones focales únicas en vasos grandes, en que se pudiera implantar solamente un stent convencional. Como sabe todo cardiólogo intervencionista, los pacientes con FA tienen un perfil desfavorable, y la recomendación teórica de la guía de «no utilizar SLF» no siempre es fácil de aplicar. En estas situaciones, pueden surgir discrepancias entre los cardiólogos clínicos, que saben que el uso de SLF va a requerir prolongar la TT y, por lo tanto, conllevar un aumento del riesgo hemorrágico.
Tanto los cardiólogos clínicos como los intervencionistas conocen las recomendaciones de las guías, y unos y otros tienen argumentos claros a favor de sus estrategias, es decir, que «se debe evitar los SLF» y que «el uso de los SLF debe limitarse a situaciones clínicas y anatómicas con elevado riesgo de reestenosis». Estas dos posturas contrastadas deben ser objeto de discusión en cada caso individual entre cardiólogos clínicos e intervencionistas, buscando un equilibrio entre los pros y los contras de las dos estrategias. Una variable que debe cuantificarse siempre en esta discusión es el riesgo objetivo de hemorragia (evaluado mediante la puntuación HAS-BLED)30. Aunque se debe dar prioridad al uso de SMSR en pacientes con elevado riesgo de reestenosis, múltiples vasos afectados, etc., la revascularización con un SLF puede ser una opción, aunque siempre con uno de los nuevos SLF de segunda o tercera generación (que requieren un uso más breve del tratamiento antiagregante plaquetario combinado) y adaptando la duración de la TT al riesgo hemorrágico. Este tratamiento puede prolongarse durante 6 o 12 meses en los pacientes con riesgo trombótico alto y riesgo hemorrágico bajo o, alternativamente, puede reducirse a 3 meses en los que tienen riesgo hemorrágico alto.
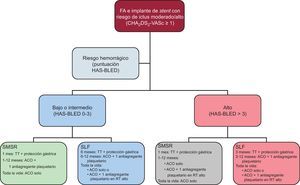
El algoritmo de tratamiento que nosotros proponemos (figura) se basa en las recomendaciones del Documento de Consenso del Grupo de Trabajo sobre Trombosis de la Sociedad Europea de Cardiología, pero da un peso sustancial al riesgo hemorrágico. El uso de SMSR se debe recomendar a los pacientes con elevado riesgo hemorrágico. No obstante, los SLF pueden tener un lugar, incluso en estos pacientes de alto riesgo hemorrágico. Para ciertos pacientes, se puede recomendar el uso de TT durante los primeros 6 meses, seguido de ACO + 1 fármaco antiagregante plaquetario durante el primer año. La duración del tratamiento antiagregante plaquetario debe tener en cuenta el riesgo trombótico (p. ej., SCA de «alto riesgo», varios SLF, tratamiento de la coronaria descendente anterior izquierda proximal o del tronco común, lesiones largas, etc.).
Recomendaciones respecto a la duración de la TT y estrategias antitrombóticas en pacientes con FA y un riesgo tromboembólico moderado a alto e implantación de stents coronarios. ACO: anticoagulantes orales; FA: fibrilación auricular; RT: riesgo trombótico; SLF: stent liberador de fármaco; SMSR: stent metálico sin recubrimiento; TT: terapia triple (anticoagulante oral + ácido acetilsalicílico [100 mg/día] + clopidogrel [75 mg/día]).
El aspecto más controvertido es el uso de SLF en pacientes con elevado riesgo hemorrágico. Esta opción no se contempla en el Documento de Consenso, pero se debe comentarla, ya que los pacientes con mayor riesgo hemorrágico son también los que tienen mayor riesgo de trombosis y/o reestenosis. En nuestra serie, se utilizaron SLF en el 47% de los pacientes con una puntuación HAS-BLED ≥ 314 y en la serie de Fauchier et al28 se emplearon en el 44%. En general, se debe dar prioridad al uso de SMSR, pero en las lesiones con una tasa de reestenosis elevada, debe existir la posibilidad de emplear SLF de segunda o tercera generación. En general, la medicación antitrombótica óptima debe ser la TT durante 3 meses seguida de ACO + 1 fármaco antiagregante plaquetario durante el primer año. En los pacientes tratados con SLF y riesgo hemorrágico alto o bajo, la estrategia de tratamiento más crónica está determinada por el riesgo hemorrágico y trombótico, de tal manera que en la mayoría de los pacientes se opta por el empleo crónico de ACO, y la opción de ACO + 1 fármaco antiagregante plaquetario se reserva sólo para los pacientes con elevado riesgo trombótico y un riesgo hemorrágico controlable.
También se puede considerar otras opciones, pero ello se basará más en la experiencia que en la evidencia. Entre estas opciones se incluye una estrategia de tratamiento conservador para los pacientes con muchas comorbilidades y riesgo de hemorragia alto, pero riesgo isquémico bajo o moderado, fundamentalmente en pacientes con infarto de miocardio secundario a la isquemia por aumento de la demanda de oxígeno o disminución de su aporte (infarto de miocardio de tipo 2)31. Este tipo de presentación es frecuente en esta población, debido al deterioro hemodinámico causado por la propia FA rápida, la anemia o incluso la embolia coronaria. Las estrategias invasivas exigirían un cambio de la pauta de medicación antitrombótica (es decir, mayor duración del tratamiento antiagregante plaquetario combinado doble), que se asocia siempre a mayor incidencia de hemorragia. Tras un examen individualizado de cada caso, se puede evaluar una estrategia conservadora para ciertos pacientes. Otras opciones posibles son una intervención de revascularización menos agresiva, tratando únicamente la arteria causal y evitando la revascularización completa, que requeriría el uso de más stents, con el consiguiente aumento del riesgo de trombosis y reestenosis. Por último, se debe considerar la posible conveniencia de un bypass arterial coronario para algunos pacientes, con objeto de evitar un tratamiento antiagregante plaquetario prolongado.
ENSAYOS ACTUALMENTE EN CURSOLa mayor parte de las recomendaciones actuales se basan en pocas pruebas obtenidas en cohortes pequeñas, de un solo centro, y analizadas retrospectivamente. Parece claro que el debate continúa y continuará bastante tiempo.
Actualmente se están realizando tres ensayos aleatorizados, además de diversos registros en curso. El ensayo Triple Therapy in Patients on Oral Anticoagulation After Drug Eluting Stent Implantation (ISAR-TRIPLE)32 está estudiando la hipótesis de que reducir la duración del tratamiento con clopidogrel de 6 meses a 6 semanas tras la implantación de un SLF se asocia a una mejora de los resultados clínicos en los pacientes tratados con ácido acetilsalicílico y ACO. El estudio What is the Optimal antiplatElet and anticoagulant therapy in patients with oral anticoagulation and coronary StenTing (WOEST)33 evaluará la hipótesis de que la combinación de warfarina con clopidogrel es superior a la TT en lo relativo a las complicaciones hemorrágicas, mientras que es igual de seguro en cuanto a la prevención de las complicaciones trombóticas en pacientes con FA tratados con stents. El tercer ensayo es un estudio español, el Anticoagulation in Stent Intervention Trial (MUSICA-2)34, que va a incluir a 304 pacientes con una puntuación CHADS2 < 2 (riesgo de ictus bajo a moderado) en la asignación aleatoria al tratamiento antiagregante plaquetario combinado doble o triple. La variable de valoración primaria es la combinada de muerte, infarto de miocardio, ictus, embolia o trombosis del stent a los 12 meses.
Estos ensayos deberán ayudar a definir algunas de las posibles opciones de tratamiento para estos pacientes, pero no aportarán en ningún caso soluciones definitivas. La complejidad de estos pacientes, el riesgo hemorrágico y la alta comorbilidad dificultarán la inclusión de pacientes con FA tratados con stents en los ensayos que intentan generalizar una estrategia.
Una cuestión importante es la disponibilidad de nuevos anticoagulantes que se utilizarán de manera creciente en lugar de la warfarina en los pacientes con FA35. Con uno de estos nuevos fármacos, apixabán, se interrumpió el ensayo de fase 3 (Apixaban for Prevention of Acute Ischemic Events 2 [APPRAISE-2]) en el SCA a causa de la ausencia de beneficio y el posible efecto negativo al añadir el tratamiento antiagregante plaquetario combinado doble a apixabán en dosis de 5 mg dos veces al día, que es la que se emplea para la prevención del ictus36. En cambio, una dosis baja (2,5 mg) de rivaroxabán administrada dos veces al día redujo la mortalidad en el ensayo Anti Xa Therapy to Lower cardiovascular events in addition to standard therapy in subjects with Acute Coronary Syndrome-Thrombolysis in Myocardial Infarction 51 (ATLAS-2), pero persiste la cuestión, difícil de resolver, de cómo tratar a un paciente con FA en tratamiento preventivo del ictus con rivaroxabán 20 mg una vez al día que sufre un SCA o una enfermedad coronaria isquémica tratada con ICP e implante de stent37, sobre todo en la era de los nuevos antiagregantes plaquetarios potentes como prasugrel y ticagrelor38,39.
CONCLUSIONESLos pacientes con FA tratados con stents constituyen una población de alto riesgo y con gran comorbilidad. En los últimos años, se han planteado varias estrategias respaldadas por documentos de consenso de expertos destinadas a intentar reducir el riesgo hemorrágico sin aumentar el riesgo trombótico. El uso de SMSR debe ser la piedra angular del tratamiento percutáneo en esta población, ya que permite acortar el periodo de uso de la TT, una combinación terapéutica más eficaz en esta población, pero que se asocia con mayor riesgo hemorrágico. El uso de SLF debe reservarse para los pacientes con un riesgo de reestenosis muy alto y un riesgo de hemorragia bajo-moderado, en los que es posible el uso de la TT. En cambio, hay que limitar los SLF únicamente a los pacientes con elevado riesgo hemorrágico y un riesgo de reestenosis inaceptable con el uso de SMSR. En tales casos se recomienda el empleo de SLF de segunda o tercera generación, por lo que la TT debe limitarse a los primeros 3 meses.
CONFLICTO DE INTERESESEl Dr. Ruiz-Nodar ha recibido subvenciones de investigación y pagos por conferencias de Medtronic, Boston Scientific y Astra-Zeneca. El Dr. Marín ha sido consultor de Bayer, BMS/Pfizer y Boehringer-Ingelheim y ha formado parte del panel de conferenciantes de Boehringer-Ingelheim, Astra-Zeneca y Boston Scientific. El Dr. Lip ha sido consultor de Bayer, Astellas, Merck, Sanofi, BMS/Pfizer, Daiichi-Sankyo, Biotronik, Portola y Boehringer-Ingelheim, y ha formado parte del panel de conferenciantes de Bayer, BMS/Pfizer, Boehringer-Ingelheim y Sanofi Aventis.

![Recomendaciones respecto a la duración de la TT y estrategias antitrombóticas en pacientes con FA y un riesgo tromboembólico moderado a alto e implantación de stents coronarios. ACO: anticoagulantes orales; FA: fibrilación auricular; RT: riesgo trombótico; SLF: stent liberador de fármaco; SMSR: stent metálico sin recubrimiento; TT: terapia triple (anticoagulante oral + ácido acetilsalicílico [100 mg/día] + clopidogrel [75 mg/día]). Recomendaciones respecto a la duración de la TT y estrategias antitrombóticas en pacientes con FA y un riesgo tromboembólico moderado a alto e implantación de stents coronarios. ACO: anticoagulantes orales; FA: fibrilación auricular; RT: riesgo trombótico; SLF: stent liberador de fármaco; SMSR: stent metálico sin recubrimiento; TT: terapia triple (anticoagulante oral + ácido acetilsalicílico [100 mg/día] + clopidogrel [75 mg/día]).](https://static.elsevier.es/multimedia/03008932/0000006600000001/v1_201307041456/S0300893212005040/v1_201307041456/es/main.assets/thumbnail/gr1.jpeg?xkr=eyJpdiI6IkNoaDc4enZYYUdXUXpTcmhFT0VScFE9PSIsInZhbHVlIjoicGs3dkZ6MURnb3krR2JyM1RsNFpXUHNRdndlb2NWdFJoYjRFV1JyTmJqST0iLCJtYWMiOiI3ZTI0M2ZiZDVkYWE1YjA3M2RiOTlhMDhhYWUxMDlhOGE5N2Q2NjFjNDhjMjU1MGU3OTcwZjYxNTk2ZmJkMWZlIiwidGFnIjoiIn0=)