La intervención coronaria percutánea multivaso (ICPm) se recomienda para pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) y enfermedad coronaria multivaso (ECMV) sin shock cardiogénico. El presente metanálisis en red investiga el momento óptimo para la ICPm en este contexto.
MétodosSe agruparon los datos agregados de ensayos aleatorizados que estudiaron a pacientes con IAMCEST estable y ECMV tratados con una estrategia de ICPm o ICP solo del vaso culpable. El objetivo primario fue la muerte por cualquier causa. Los objetivos secundarios fueron la muerte cardiovascular, el infarto de miocardio y la revascularización no planificada por isquemia.
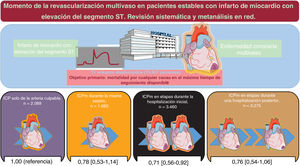
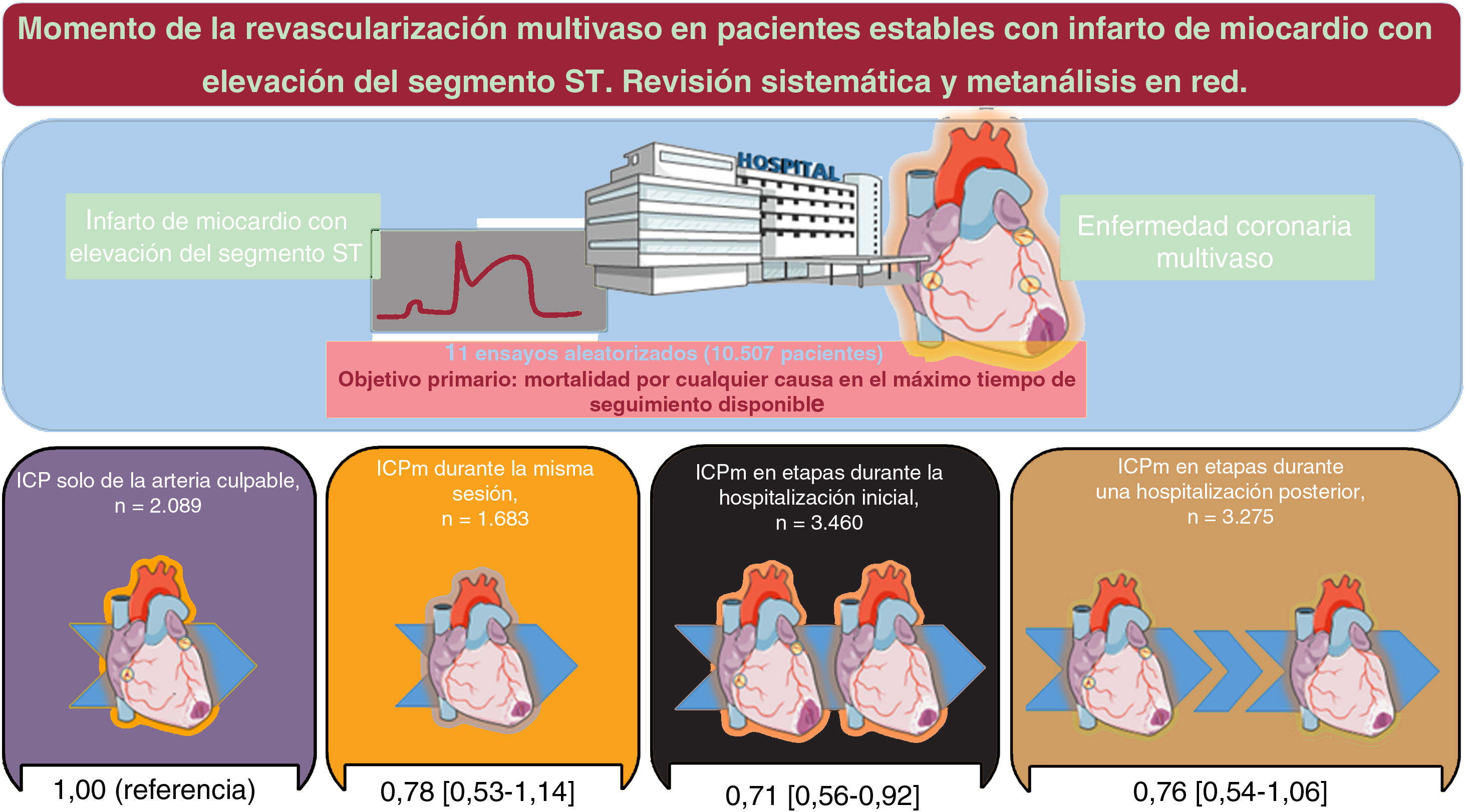
ResultadosSe aleatorizó a 10.507 pacientes de 11 ensayos a ICPm (misma sesión, n=1.683; durante la hospitalización índice, n=3.460; durante una hospitalización posterior en un plazo de 45 días, n=3.275) o a ICP solo del vaso culpable (n=2.089). La mediana de seguimiento fue de 18,6 meses. En comparación con la ICP solo del vaso culpable, la ICPm durante la hospitalización inicial redujo significativamente la mortalidad por cualquier causa (risk ratio=0,73; IC95%, 0,56-0,92; p=0,008) y se clasificó como la mejor opción de tratamiento para este resultado en comparación con todas las demás estrategias. En comparación con la ICP solo del vaso culpable, una ICPm redujo la mortalidad cardiovascular sin diferencias dependientes del momento de la revascularización. Una ICPm durante la hospitalización índice, ya fuera en un único procedimiento o escalonada, redujo significativamente los infartos de miocardio y las revascularizaciones no planificadas por isquemia y sin diferencias significativas estos.
ConclusionesEn pacientes con IAMCEST y ECMV sin shock cardiogénico, una ICPm durante la hospitalización índice, ya sea en un único procedimiento o de manera escalonada, es el abordaje más seguro y eficaz. Los distintos momentos de realización de la ICPm no mostraron diferencias significativas en muerte por todas las causas.
El estudio está registrado en PROSPERO (CRD42023457794).
Palabras clave
Aproximadamente la mitad de los pacientes con infarto de miocardio (IM) presentan una enfermedad coronaria (EC) multivaso con al menos 1 estenosis significativa adicional en una arteria coronaria no culpable1. La EC multivaso en pacientes con IM se asocia con mayor riesgo de eventos adversos cardiovasculares y de mortalidad2,3. Por esta razón, hay evidencia convincente que justifica la recomendación de intervención coronaria percutánea multivaso (ICPm) para pacientes estables (los que no están en shock cardiogénico) con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) y EC multivaso4. La guía europea para el tratamiento de los pacientes con síndrome coronario agudo (SCA), recientemente publicada, recomienda una estrategia de ICPm para pacientes con IAMCEST y EC multivaso si no hay shock cardiogénico5. Sin embargo, a diferencia de lo que se indicaba en la guía europea previa para el tratamiento de los pacientes con IAMCEST6, la guía actual indica que la ICPm puede llevarse a cabo durante la intervención inicial (en la misma sesión) o en etapas, durante una hospitalización posterior en un plazo de 45 días tras la intervención inicial5.
Los ensayos aleatorizados recientes7–9 permiten una evaluación más completa de la cronología óptima para practicar la ICPm en los pacientes con IAMCEST sin shock cardiogénico. En cambio, las observaciones previas no se centraron en ningún momento en esta cuestión específica, sino más bien en la superioridad clínica de la ICPm en comparación con una ICP aplicada solo a la lesión culpable10,11. La orientación aportada por la estrategia de tratamiento multivaso de los pacientes con IAMCEST estables tiene consecuencias importantes para la práctica clínica e incluye consideraciones logísticas y los diversos tratamientos antitrombóticos empleados en esos pacientes. En consecuencia, se diseñó el presente estudio para evaluar los resultados clínicos en pacientes con IAMCEST y EC multivaso que no presentaban shock cardiogénico, según la cronología de uso de la ICPm.
MÉTODOSOrigen de los datos y criterios de valoraciónSe buscaron en bases de datos científicos electrónicas resúmenes científicos de congresos cardiovasculares importantes y páginas web de registro de ensayos clínicos, desde la creación de cada base de datos hasta agosto de 2023, para identificar los ensayos aleatorizados en los que se hubiera incluido a pacientes con IAMCEST hemodinámicamente estables que presentaran una EC multivaso y a los que se hubiera practicado ya fuera una ICPm o una ICP solo de la arteria culpable. Con todos los estudios elegibles se buscaron otros posibles estudios de interés mediante examen de las bibliografías. Se presenta información más detallada sobre la estrategia de búsqueda, la selección de los estudios, la estratificación de los datos y la evaluación de la calidad de los estudios en el apartado «Métodos» del material adicional.
El objetivo primario fue la mortalidad por cualquier causa. Los objetivos secundarios fueron la muerte de causa cardiovascular, el IM y la revascularización no programada por causa isquémica. Otros objetivos analizados fueron la hemorragia mayor, el ictus y la lesión renal aguda. Se incluyeron todos los eventos de los objetivos producidos durante el periodo de seguimiento máximo disponible, según las definiciones indicadas en los protocolos de los ensayos originales.
Síntesis de los datos y análisis estadísticoAntes de proceder al análisis estadístico, 2 investigadores evaluaron de manera independiente la calidad de cada estudio con la herramienta Risk of Bias 2 (RoB 2)12. Los valores de media de las variables continuas y los de porcentaje de las variables discretas se presentan como análisis exploratorios para las características basales de los participantes inscritos en cada uno de los estudios incluidos. Se calculó la mediana de seguimiento ponderada en función del tamaño muestral de cada uno de los estudios. Se utilizaron los valores de razón de riesgos (RR) y sus intervalos de confianza del 95% (IC95%) y se usaron los valores de p <0,05 para comparar los objetivos de interés de los distintos grupos de tratamiento en todos los análisis.
En primer lugar, se hizo un metanálisis en red basado en frecuencias para generar evidencia directa e indirecta en la comparación de las intervenciones, según la definición de los análisis por intención de tratar de los ensayos originales. Segundo, un metanálisis exploratorio por pares, en el que se comparó una estrategia de ICPm durante la hospitalización inicial, ya fuera en la misma sesión o por etapas (grupo de ICPm durante la hospitalización inicial), con una estrategia de ICPm durante una hospitalización posterior en los siguientes 45 días o ICP solo de la arteria culpable (grupo de control). Puede consultarse información más detallada sobre el marco estadístico utilizado para los metanálisis en red y por pares en el apartado «Métodos» del material adicional.
La presentación de este estudio se realiza cumpliendo lo establecido en la declaración PRISMA (tabla 1 del material adicional)13. Para todos los análisis se emplearon los paquetes netmeta, meta y metafor del programa R versión 4.1.3 (R Foundation for Statistical Computing, Austria). No hubo financiación externa para este trabajo. Este estudio no requirió aprobación ética. El estudio está registrado en PROSPERO (CRD42023457794). Los datos en que se basan las observaciones de este estudio pueden solicitarse al autor de correspondencia en una solicitud razonada.
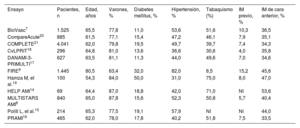
RESULTADOSEstudios elegibles e incluidosEl diagrama de flujo del proceso de selección de los ensayos se muestra en la figura 1 del material adicional. Tras la aplicación de los criterios de inclusión y exclusión, se incluyeron en el metanálisis 11 ensayos, todos ellos publicados como originales completos7–9,14–21. No hubo ninguna discrepancia que requiriera la consulta con un tercer evaluador. En los ensayos seleccionados, se asignó aleatoriamente a 10.507 pacientes con IM y EC multivaso a ICPm (en la misma sesión, n=1.683; en etapas durante la hospitalización inicial, n=3.460; en etapas durante una hospitalización posterior en un plazo de 45 días, n=3.275) o a ICP solo de la arteria culpable (n=2.089). Las características principales de los ensayos incluidos se muestran en la tabla 1. Todos los ensayos excepto 115 tenían un diseño multicéntrico e incluyeron predominantemente a pacientes estables con un IAMCEST y EC multivaso con indicación para ICP. En los ensayos BioVasc7 y FIRE9 se incluyó a pacientes con un IAMCEST o un IAMSEST. Además, en el ensayo BioVasc se incluyó a 127 pacientes con angina inestable (el 1,2% de la población total incluida en este análisis).
Características principales de los ensayos incluidos en el estudio
| Ensayo | Multicéntrico | PeriodoPeriodo de inclusión | Comparación | Criterios de inclusión principales | Definición de la EC multivaso | Objetivo primario | Seguimiento disponible (meses) | |
|---|---|---|---|---|---|---|---|---|
| BioVasc7 | Sí | Junio de 2018 a octubre de 2021 | ICPm en la misma sesión (n=764) | ICPm en etapas (posterior, n=761) | Edad 18-85 años; IAMCEST o SCASEST; EC multivaso con una lesión culpable claramente identificable | 2 o más arterias coronarias con un diámetro ≥ 2,5mm y estenosis ≥ 70% en la estimación visual o prueba de fisiología coronaria positiva | Muerte por cualquier causa, cualquier IM, revascularización no programada por causa isquémica, ictus | 12 |
| CompareAcute20 | Sí | Julio de 2011 a octubre de 2015 | ICPm en etapas (inicial, n=295)* | ICP de vaso culpable solamente (n=590) | Edad 18-85 años; IAMCEST; ≤ 12 h desde el inicio de los síntomas; indicación para ICP primaria; EC multivaso considerada apropiada para la ICP por el cardiólogo intervencionista | Arteria culpable más arteria no culpable con estenosis ≥ 50% del diámetro angiográfico | Muerte por cualquier causa, IM no mortal, cualquier revascularización, ictus | 12 |
| COMPLETE21 | Sí | Febrero de 2013 a marzo de 2017 | ICPm en etapas (inicial, n=2.016)* | ICPm en etapas (posterior, n=2.025) | IAMCEST; EC multivaso | Más de 1 arteria no culpable angiográficamente significativa (estenosis ≥ 70% del diámetro del vaso sanguíneo en la estimación visual o estenosis > 50-69% acompañada de determinación de la reserva fraccional de flujo ≤ 0,80) susceptible de tratamiento satisfactorio con ICP y situada en un vaso sanguíneo de diámetro ≥ 2,5mm en la que no se ha implantado un stent durante la ICP inicial de la arteria culpable | Muerte de causa cardiovascular o reinfarto; muertes de causa cardiovascular, reinfarto, revascularización por razones isquémicas | 36 |
| CvLPRIT18 | Sí | Mayo de 2011 a mayo de 2013 | ICPm en la misma sesión (n=150) | ICP de vaso culpable solamente (n=146) | IM sospechado o demostrado (confirmación angiográfica de oclusión de arteria culpable); <12 h del inicio de los síntomas; elegible para ICP primaria; EC multivaso | Arteria culpable y al menos 1 arteria no culpable (rama principal o secundaria) con al menos 1 lesión angiográficamente significativa (estenosis > 50% del diámetro en 2 planos o > 70% en 1 plano); diámetro ≥ 2mm, apto para el implante de stent | Muerte por cualquier causa, IM recurrente, insuficiencia cardiaca, y revascularización por isquemia mediante ICP/CABG | 66 |
| DANAMI-3-PRIMULTI17 | Sí | Marzo de 2011 a febrero de 2014 | ICPm en etapas (inicial, n=314)* | ICP de vaso culpable solamente (n=313) | Dolor torácico tras menos de 12 h del inicio de los síntomas y elevación del segmento ST > 0,1mV en al menos 2 derivaciones contiguas; éxito de ICP primaria de la lesión culpable (definida por un flujo TIMI ≥ 2 y estenosis residual <30%); EC multivaso | Al menos 1 arteria no culpable con estenosis > 50% del diámetro angiográfico | Muerte por cualquier causa, IM recurrente, revascularización de arteria no culpable por causa isquémica | 27 |
| FIRE9 | Sí | Julio de 2019 a octubre de 2021 | ICPm en etapas (inicial, n=720)* | ICP de vaso culpable solamente (n=725) | Edad ≥ 75 años; IAMCEST o IAMSEST con ICP exitosa de la lesión culpable; EC multivaso | Al menos 1 lesión no culpable, situada en un vaso de diámetro ≥ 2,5mm y una estenosis ≥ 50-99%del diámetro estimada visualmente | Muerte, IM, ictus o revascularización coronaria por isquemia | 12 |
| Hamza M, et al.19 | Sí | Junio de 2013 a febrero de 2014 | ICPm en etapas (inicial, n=50)* | ICPm en etapas (posterior, n=50) | Diabetes mellitus; IAMCEST tras menos de 12 h del inicio de los síntomas; elegible para ICP primaria; EC multivaso | Arteria culpable más arteria no culpable con estenosis ≥ 80% del diámetro angiográfico | Mortalidad por cualquier causa; revascularización recurrente y de causa isquémica | 6 |
| HELP AMI14 | Sí | NI | ICPm en la misma sesión (n=52) | ICPm en etapas (posterior, n=17) | Dolor torácico <12 h antes del ingreso hospitalario; elevación del segmento ST > 0,1mV en al menos 2 derivaciones contiguas (periféricas) o > 0,2mV en al menos 2 derivaciones precordiales contiguas; EC multivaso | Arteria culpable más 1-3 lesiones en una arteria no culpable principal | Nueva revascularización | 12 |
| MULTISTARS AMI8 | Sí | Octubre de 2016 a junio de 2022 | ICPm en la misma sesión (n=418) | ICPm en etapas (posterior, n=422) | IAMCEST menos de 24 h después del inicio de los síntomas; elegible para ICP primaria; EC multivaso | Estenosis ≥ 70% en al menos 2 proyecciones en una arteria no culpable con un diámetro luminal ≥ 2,25 y ≤ 5,75 mm | Muerte por cualquier causa, IM no mortal, ictus, revascularización no programada por causa isquémica, hospitalización por insuficiencia cardiaca | 12 |
| Politi L, et al.15 | No | Enero de 2003 a diciembre de 2007 | ICPm en la misma sesión (n=65) o ICPm en etapas (inicial, n=65) | ICP de vaso culpable solamente (n=84) | Dolor torácico de duración > 30min <12 h antes del ingreso hospitalario; elevación del segmento ST > 0,1mV en al menos 2 derivaciones contiguas (periféricas) o > 0,2mV en al menos 2 derivaciones precordiales contiguas; EC multivaso | Estenosis > 70% en al menos 2 arterias coronarias o ramas principales en la estimación visual | Muerte por cualquier causa, muerte durante la hospitalización, reinfarto, rehospitalización por SCA, nueva revascularización coronaria mediante ICP/CABG | 30 |
| PRAMI16 | Sí | Abril de 2008 a enero de 2013 | ICPm en la misma sesión (n=234) | ICP de vaso culpable solamente (n=231) | IAMCEST; EC multivaso | Al menos 1 arteria no culpable con estenosis ≥ 50% considerada tratable con ICP | Muerte por cualquier causa, cualquier IM, revascularización no programada por causa isquémica, ictus | 23 |
CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; ICPm: ICP multivaso; IM: infarto de miocardio; NI: no indicado; NP: no procede; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TIMI: Thrombolysis in Myocardial Infarction.
En el grupo de ICP multivaso, la revascularización de las lesiones no culpables se realizó mayoritariamente en etapas durante la hospitalización inicial. En el ensayo COMPLETE21, que fue el de mayor tamaño de los incluidos en el presente análisis, se pidió a los operadores que especificaran si su intención había sido la ICP de lesiones no culpables durante la hospitalización inicial o en una hospitalización posterior en el caso de que los pacientes hubieran sido asignados a la estrategia de ICPm22. Un ensayo tuvo un diseño de 3 grupos15. En 4 de los 11 ensayos9,17,20,21 la decisión de practicar ICP de lesiones no culpables en el grupo de ICPm se basó en la fisiología, mientras que en los demás ensayos se basó en criterios angiográficos de gravedad de la lesión. En 8 ensayos7–9,16–18,20,21 se utilizó prasugrel y ticagrelor en combinación con ácido acetilsalicílico como pauta de tratamiento antiagregante plaquetario doble durante un periodo de entre 6 y 12 meses.
Las características basales de los pacientes incluidos en los ensayos originales se muestran en la tabla 2. La mediana de edad fue de 64,4 [intervalo intercuartílico, 62-65] años; más de 2 tercios de los pacientes eran varones, aproximadamente un quinto presentaban diabetes tipo 2 y cerca del 50% tenían hipertensión en el momento de la inclusión en los ensayos primarios. Casi la mitad de los pacientes eran fumadores actuales o exfumadores, y se había producido un IM previo en menos del 10% de los participantes. Aproximadamente el 40% de los pacientes incluidos presentaban un IM de cara anterior. La mediana ponderada del seguimiento disponible para este análisis fue de 18,6 meses.
Características principales de los pacientes inscritos en los ensayos incluidos en el estudio
| Ensayo | Pacientes, n | Edad, años | Varones, % | Diabetes mellitus, % | Hipertensión, % | Tabaquismo (%) | IM previo, % | IM de cara anterior, % |
|---|---|---|---|---|---|---|---|---|
| BioVasc7 | 1.525 | 65,5 | 77,8 | 11,0 | 53,6 | 51,6 | 10,3 | 36,5 |
| CompareAcute20 | 885 | 61,5 | 77,1 | 15,4 | 47,2 | 46,1 | 7,9 | 35,1 |
| COMPLETE21 | 4.041 | 62,0 | 79,8 | 19,5 | 49,7 | 39,7 | 7,4 | 34,3 |
| CvLPRIT18 | 296 | 64,8 | 81,0 | 13,6 | 36,6 | 30,6 | 4,0 | 35,8 |
| DANAMI-3-PRIMULTI17 | 627 | 63,5 | 81,1 | 11,3 | 44,0 | 49,6 | 7,0 | 34,6 |
| FIRE9 | 1.445 | 80,5 | 63,4 | 32,0 | 82,0 | 8,5 | 15,2 | 45,6 |
| Hamza M, et al.19 | 100 | 54,3 | 84,0 | 50,0 | 31,0 | 75,0 | 8,0 | 47,0 |
| HELP AMI14 | 69 | 64,4 | 87,0 | 18,8 | 42,0 | 71,0 | NI | 53,6 |
| MULTISTARS AMI8 | 840 | 65,0 | 87,8 | 15,6 | 52,3 | 50,8 | 5,7 | 40,4 |
| Politi L, et al.15 | 214 | 65,3 | 77,5 | 19,1 | 57,9 | NI | NI | 44,0 |
| PRAMI16 | 465 | 62,0 | 78,0 | 17,8 | 40,2 | 51,8 | 7,5 | 33,5 |
ICP: intervención coronaria percutánea; IM: infarto de miocardio; NI: no indicado.
Se presentan las proporciones totales y las medias. La columna con el epígrafe «IM previo» presenta la proporción de pacientes con IM previo. La columna con el epígrafe «IM de cara anterior» presenta la proporción de pacientes con IM de cara anterior en el momento de la intervención inicial.
Todos los ensayos tuvieron potencia estadística suficiente para evaluar los criterios de valoración clínica combinados, que incluían en la mayor parte de los casos la muerte por cualquier causa, el IM o la revascularización no programada de causa isquémica. En 4 ensayos se dispuso de datos de los objetivos de más de 24 meses15,17,18,21. Las definiciones de los objetivos se presentan en la tabla 2 del material adicional, y el riesgo de sesgo interestudios se presenta en la figura 2 del material adicional. Se dispuso de datos de todos los pacientes para la evaluación de los objetivos de interés. En la tabla 3 del material adicional se presenta el orden completo de las estrategias de revascularización para cada objetivo de interés.
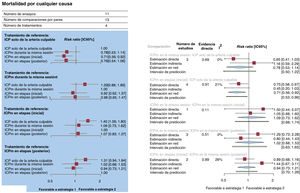
Objetivo principalLa red de estrategias de tratamiento para la muerte por cualquier causa, que fue el objetivo primario, se presenta en la figura 3 del material adicional. Se produjo la muerte por cualquier causa de 528 pacientes (5,0%). En comparación con la ICP solo de la arteria culpable, una estrategia de ICPm en etapas durante la hospitalización inicial redujo significativamente las muertes por cualquier causa (RR = 0,73; IC95%, 0,56-0,92; p=0,008), mientras que una estrategia de ICPm en la misma sesión (RR = 0,78; IC95%, 0,53-1,14) o en etapas durante una hospitalización en los siguientes 45 días no mostró esta asociación (RR = 0,76; IC95%, 0,54-1,06). Estos resultados se presentan en la figura 1 y las figura 2A,B. Los resultados se mantuvieron uniformes al considerar las diferentes duraciones de seguimiento de los estudios incluidos. Al compararlas entre sí, las estrategias de ICPm no mostraron diferencias significativas ni heterogeneidad estadística (I2=0%). La ICPm en etapas durante la hospitalización inicial fue posiblemente la mejor opción para prevenir la mortalidad por cualquier causa, en comparación con todas las demás estrategias (p=0,78). El método de división de nodo no reveló ninguna discrepancia significativa entre la evidencia directa y la indirecta (figura 2B y tabla 4 del material adicional). Se pudo rechazar un efecto de un estudio pequeño y un sesgo de publicación significativo, tanto visual (figura 4 del material adicional) como estadísticamente (p=0,41). Se presenta la liga de estimaciones de riesgo de los objetivos primario y secundarios del metanálisis en red en la tabla 5 del material adicional.
A: gráfico de bosque del metanálisis en red para la mortalidad por cualquier causa. El gráfico de bosque de los valores de risk ratio agrupada y de los IC95% para la muerte por cualquier causa se obtuvieron de un metanálisis en red. B: gráfico de bosque del análisis de modelo de división de nodo para la mortalidad por cualquier causa. Los gráficos de bosque de los valores de risk ratio agrupados y de los IC95% para la muerte por cualquier causa se obtuvieron de un análisis de división de nodo de la falta de uniformidad entre la evidencia acumulada directa y la indirecta. La cifra indicada bajo el epígrafe «evidencia directa» indica la proporción de evidencia directa dentro de la estimación en red. IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; ICPm: ICP multivaso; RR: risk ratio.
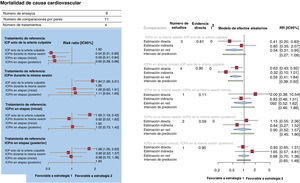
Se produjo la muerte por causa cardiovascular de 292 pacientes (3,0%, datos disponibles de 9.780 pacientes) (figura 3A,B). En comparación con la ICP solo de la arteria culpable, todas las estrategias de ICPm redujeron significativamente las muertes de causa cardiovascular en la misma sesión (RR = 0,54; IC95%, 0,31-0,95; p=0,03), en etapas durante la hospitalización inicial (RR = 0,59; IC95%, 0,41-0,84; p=0,004) y en etapas durante una nueva hospitalización en los siguientes 45 días (RR = 0,60; IC95%, 0,38-0,96; p=0,03). Al compararlas entre sí, las estrategias de ICPm no mostraron diferencias significativas ni heterogeneidad estadística (I2=0%). La ICPm durante la misma sesión (p=0,75) fue posiblemente la mejor opción para prevenir la muerte de causa cardiovascular.
A: gráfico de bosque del metanálisis en red para la mortalidad de causa cardiovascular. Los gráficos de bosque de los valores de risk ratio agrupada y de los IC95% para la muerte de causa cardiovascular se obtuvieron de un metanálisis en red. B: gráfico de bosque del análisis de modelo de división de nodo para la mortalidad de causa cardiovascular. Los gráficos de bosque de los valores de risk ratio agrupados y de los IC95% para la muerte de causa cardiovascular se obtuvieron de un análisis de división de nodo de la falta de uniformidad entre la evidencia acumulada directa y la indirecta. La cifra indicada bajo el epígrafe «evidencia directa» indica la proporción de evidencia directa dentro de la estimación en red. IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; ICPm: ICP multivaso; RR: risk ratio.
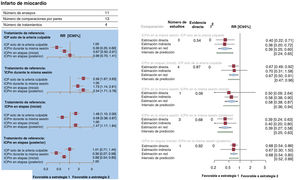
Sufrieron un IM 559 pacientes (5,3%) (figura 4A,B). En comparación con la ICP solo de la arteria culpable, una estrategia de ICPm durante la misma sesión (RR = 0,39; IC95%, 0,25-0,60; p <0,001) o en etapas durante la hospitalización inicial (RR = 0,67; IC95%, 0,50-0,91; p=0,001) redujeron significativamente los IM, mientras esto no se observó con una estrategia de ICPm en etapas en una nueva hospitalización en los siguientes 45 días (RR = 0,99; IC95%, 0,70-1,41). Al compararlas entre sí, una estrategia de ICPm durante la misma sesión fue superior a una estrategia de ICPm en etapas durante la hospitalización inicial (RR = 0,58, IC95%, 0,38-0,87; p=0,009) y a una estrategia de ICPm en etapas en una nueva hospitalización en los siguientes 45 días (RR = 0,39; IC95%, 0,27-0,58; p <0,001). No hubo heterogeneidad estadística (I2=0%). La ICPm durante la misma sesión (p=0,99) fue posiblemente la mejor opción para prevenir el IM.
A: gráfico de bosque del metanálisis en red para el infarto de miocardio. Los gráficos de bosque de los valores de risk ratio agrupada y de los IC95% para el infarto de miocardio se obtuvieron de un metanálisis en red. B: gráfico de bosque del análisis de modelo de división de nodo para el infarto de miocardio. Los gráficos de bosque de los valores de risk ratio agrupados y de los IC95% para el infarto de miocardio se obtuvieron de un análisis de división de nodo de la falta de uniformidad entre la evidencia acumulada directa y la indirecta. La cifra indicada bajo el epígrafe «evidencia directa» describe la proporción de evidencia directa dentro de la estimación en red. IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; ICPm: ICP multivaso; RR: risk ratio.
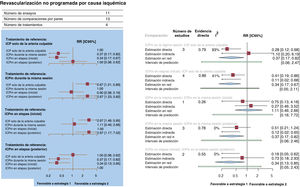
Se realizó una revascularización no programada por causa isquémica a 872 pacientes (8,3%) (figuras 5A,B). En comparación con la ICP solo de la arteria culpable, una estrategia de ICPm durante la misma sesión (RR = 0,37; IC95%, 0,17-0,82; p=0,015) o en etapas durante la hospitalización inicial (RR = 0,34; IC95%, 0,17-0,67; p=0,002) redujo significativamente las revascularizaciones no previstas por causa isquémica, lo cual no se observó con una estrategia de ICPm en etapas en una nueva hospitalización en los siguientes 45 días (RR = 1,00; IC95%, 0,38-2,62). Al compararlas entre sí, las estrategias de ICPm no mostraron diferencias significativas, pero sí heterogeneidad estadística (I2=85,3%). El análisis de división de nodo reveló que la falta de uniformidad significativa entre las estimaciones directa e indirecta era atribuible en gran parte a la comparación entre la ICPm en la misma sesión y la ICP solo de la arteria culpable. La ICPm en etapas durante la hospitalización inicial (p=0,86) fue posiblemente una de las opciones más eficaces para prevenir la revascularización no programada de causa isquémica.
A: gráfico de bosque del metanálisis en red para la revascularización no programada por causa isquémica. Los gráficos de bosque de los valores de risk ratio agrupada y de los IC95% se obtuvieron de un metanálisis en red. B: gráfico de bosque del análisis de modelo de división de nodo para la revascularización no programada por causa isquémica. Los gráficos de bosque de los valores de risk ratio agrupados y de los IC95% se obtuvieron de un análisis de división de nodo de la falta de uniformidad entre la evidencia acumulada directa y la indirecta. La cifra indicada bajo el epígrafe «evidencia directa» indica la proporción de evidencia directa dentro de la estimación en red. IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; ICPm: ICP multivaso; RR: risk ratio.
Se produjeron hemorragias mayores en 252 pacientes (2,6%; datos disponibles de 9.759 pacientes). Las estrategias de revascularización no mostraron diferencias significativas ni heterogeneidad estadística (I2=9%) para ese objetivo. La ICPm durante la misma sesión (p=0,82) fue posiblemente la opción más eficaz para prevenir las hemorragias mayores (figura 5 del material adicional).
Un total de 134 pacientes (1,4%; datos disponibles de 9.759 pacientes) sufrieron un ictus. Las estrategias de revascularización no mostraron diferencias significativas ni heterogeneidad estadística (I2=0%) para este objetivo. La ICP solo de la arteria culpable (p=0,70) y la ICPm en la misma sesión (p=0,69) fueron posiblemente las opciones más eficaces para la prevención del ictus.
Se produjo una lesión renal aguda en 353 pacientes (4,4%; datos disponibles de 8.028 pacientes). En comparación con la ICP solo de la arteria culpable, las estrategias de revascularización no mostraron diferencias significativas ni heterogeneidad estadística (I2=9%) para este objetivo. En comparación con una estrategia de ICPm en etapas durante la hospitalización inicial, cabe destacar que la ICPm en etapas en una nueva hospitalización en los siguientes 45 días redujo significativamente la lesiones renales agudas (RR = 0,58; IC95%, 0,35-0,97; p=0,040) y fueron posiblemente las opciones más eficaces para prevenirlas (p=0,84).
Análisis de sensibilidad y metanálisis por paresEl metanálisis en red se limitó a los ensayos en los que solo se utilizó la coronariografía para guiar la ICPm (figura 6A del material adicional) o se prescribieron los inhibidores de P2Y12 más potentes (figura 6B del material adicional) y aquellos con criterios más estrictos para definir la EC multivaso (figura 6C del material adicional). Estos análisis no revelaron un cambio significativo en el sentido de las estimaciones del riesgo del objetivo primario. El metanálisis en red limitado a los ensayos que incluyeron solo a pacientes con IAMCEST (figura 7A del material adicional) o con un total de participantes >500 (figura 7B del material adicional) no reveló ningún cambio significativo en cuanto al sentido de las estimaciones del riesgo del objetivo primario. Sin embargo, las diferencias observadas anteriormente en el análisis global dejaron de ser estadísticamente significativas.
En el metanálisis por pares (figura 8 del material adicional) se produjeron 236 muertes (4,6%) de pacientes asignados a la ICPm durante la hospitalización inicial y 292 (5,4%) de pacientes asignados a la estrategia de control (RR = 0,85, IC95%, 0,72-1,00; p=0,050). No hubo evidencia de heterogeneidad estadística y el intervalo de predicción incluía el valor nulo. Tiene interés señalar que se observó una reducción del riesgo absoluto de IM de cerca de un 3% y de revascularización no programada de causa isquémica del 13% en los pacientes asignados a ICPm durante la hospitalización inicial en comparación con los asignados a la estrategia de control (figura 9 del material adicional).
DISCUSIÓNEn este metanálisis se combinaron los datos de estudio de más de 10.000 pacientes con IM y EC multivaso que no presentaban shock cardiogénico a los que se aleatorizó a una estrategia de ICPm en momentos diferentes o ICP solo de la arteria culpable. Las conclusiones principales de este metanálisis son: a) una estrategia de ICPm en comparación con la ICP solo de la arteria culpable reduce la mortalidad cardiovascular, con independencia de la cronología utilizada para completar la revascularización; b) una estrategia de ICPm durante la hospitalización inicial, tanto si se lleva a cabo en una sola sesión como si se realiza en etapas, reduce de forma significativa los IM y las revascularizaciones no programadas de causa isquémica, y se observó que era la opción más favorable por lo que respecta a la seguridad y la eficacia, y c) la ICPm en momentos diferentes no produjo ninguna diferencia significativa en la mortalidad por cualquier causa.
Hasta donde sabemos, este es el primer metanálisis en el que se investiga el momento de realización de la ICPm en pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico. Al incluir los recientemente publicados ensayos BioVasc, MULTISTARS AMI y FIRE7–9, este estudio es el que ofrece una más amplia evidencia actualizada sobre el tema. A diferencia de un análisis reciente23, en el presente estudio se incluyó predominantemente a pacientes con IAMCEST, lo cual permitió una identificación más fiable de las lesiones culpables y no culpables. En general, los resultados de nuestro estudio merecen una consideración cuidadosa.
En primer lugar, el metanálisis exploró una posible diferencia de mortalidad entre distintos momentos de realización de la ICPm en pacientes con IAMCEST hemodinámicamente estables. En metanálisis anteriores se evaluó el papel de la revascularización multivaso en pacientes con IM estable y EC multivaso, pero el momento óptimo para realizar la ICPm en este contexto se han estudiado menos. En un estudio10, un análisis de subgrupos indicó una menor frecuencia de muertes de causa cardiovascular con la ICPm, independientemente de si la revascularización se llevaba a cabo durante la misma sesión o en etapas. En otro estudio se señaló una modificación significativa del efecto del tratamiento en cuanto al objetivo combinado de muerte de causa cardiovascular y reinfarto practicando la ICPm en la misma sesión24. Esta ventaja era atribuible en su mayor parte a un menor número de eventos de reinfarto. En otro subanálisis de aproximadamente 2.000 pacientes, se observó una reducción significativa del riesgo relativo de muerte con la ICPm realizada durante la hospitalización inicial11.
En cambio, en un análisis de subgrupos del ensayo COMPLETE se puso de manifiesto que la superioridad de la ICPm sobre la ICP solo de la arteria culpable en cuanto a la muertes de causa cardiovascular y el IM era independiente de que la ICP de las lesiones no culpables se realizara durante la hospitalización inicial o en una nueva hospitalización en los siguientes 45 días22. Lamentablemente, el momento de la ICP no fue un factor aleatorio y no se dispuso como comparador de la ICPm llevada a cabo en la misma sesión. En consecuencia, la interpretación de los resultados obtenidos en ese análisis está sujeta a un considerable sesgo que no se puede ajustar por completo. En cambio, en comparación con una estrategia de ICP solo de la arteria culpable, en el presente estudio se observó un menor número de muertes por cualquier causa con una estrategia de ICPm durante la hospitalización inicial y un menor número de muertes de causa cardiovascular con cualquier estrategia de ICPm, con independencia del momento elegido para completar la revascularización. Este resultado resulta tranquilizador y está menos sujeto a sesgo, dado el elevado número de pacientes disponibles y el apoyo estadístico robusto.
En segundo lugar, se halló una reducción de los IM en el grupo de pacientes asignados a ICPm en cualquier momento durante la hospitalización inicial, en comparación con la ICP de la arteria culpable solamente. Es de destacar que, si bien este resultado no es novedoso, hubo un cambio en la magnitud del efecto del tratamiento en función de la revascularización de las lesiones no culpables durante la misma sesión, debido a un incremento del 30% en la reducción del riesgo relativo de IM. Este resultado podría ser atribuible en parte a un sesgo de detección, por el hecho de que el IM relacionado con la intervención se diagnosticara con menos frecuencia en los pacientes tratados con ICPm en el contexto de unos marcadores cardiacos elevados preexistentes debidos al evento agudo de IM. Por otro lado, el concepto de SCA como enfermedad sistémica que afecta a la totalidad del árbol coronario, más allá de la arteria coronaria culpable, se ha confirmado en varios estudios con técnicas de imagen que han mostrado el carácter inestable de las lesiones no culpables, con un aumento del riesgo de rotura de placas y ulteriores eventos trombóticos25. A este respecto, una estrategia de ICPm durante la hospitalización inicial (en la misma sesión o por etapas) podría ser útil para prevenir los eventos adversos cardiovasculares debidos a lesiones no culpables vulnerables26. En apoyo de este argumento conviene mencionar que la reducción observada en los IM con una estrategia de ICPm en comparación con una estrategia de ICP solo de la arteria culpable desaparecía con una estrategia de ICPm en etapas durante una hospitalización posterior en un plazo de 45 días.
Por último, se observó una reducción del riesgo relativo clínicamente trascendente por lo que respecta a la revascularización no programada por causa isquémica en los pacientes tratados con ICPm durante la hospitalización inicial (en la misma sesión o por etapas), en comparación con los tratados con una ICP solo de la arteria culpable, mientras que una estrategia de ICPm en etapas en una nueva hospitalización en los siguientes 45 días no mostró una repercusión de interés clínico. Aunque este resultado es clínicamente plausible, se observa una amplia heterogeneidad estadística. Desde un punto de vista científico, es probable que interviniera el hecho de que los ensayos tuvieran un diseño sin enmascaramiento y los diferentes umbrales utilizados para las revascularizaciones no programadas por causa isquémica en el grupo de ICP solo de la arteria culpable. Esto respalda también la elección de la mortalidad por cualquier causa como objetivo primario en estos análisis. Es de destacar que la guía europea para el tratamiento de los pacientes con SCA recientemente publicada recomienda que la decisión de revascularizar lesiones no culpables en pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico se base en la gravedad observada en la coronariografía y desaconseja una evaluación fisiológica de las arterias no culpables durante la intervención inicial5. Cabe argumentar que el papel de las exploraciones de imagen intravascular durante la ICP inicial para evaluar el grado de estenosis acompañante y estratificar la naturaleza de las lesiones no culpables aumente en los próximos años y ello será objeto de mayor investigación, según los datos que indican que casi la mitad de los eventos trombóticos posteriores en pacientes con SCA se asocian con progresión de la enfermedad ateroesclerótica en segmentos o vasos coronarios distantes26,27.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, se trata de un metanálisis a nivel de estudio, y el patrón de referencia sigue siendo el metanálisis a nivel de participantes individuales. Aunque el análisis de subgrupos no reveló un cambio en la magnitud del efecto del tratamiento en objetivo primario, este estudio no permite explorar por completo la repercusión de pautas de tratamiento antitrombótico contemporáneas más potentes en la cronología de la ICPm. En este mismo sentido, la revascularización en momentos diferentes implica también un uso diferente de los fármacos antitrombóticos en cuanto a su momento de inicio y duración. Lamentablemente, el hecho de que no se dispusiera de los datos a nivel de paciente no permite ajustar el análisis en función de estas características.
En segundo lugar, en el metanálisis por pares, formaron el grupo de control pacientes cuyas lesiones no culpables se trataron con un tratamiento médico óptimo o con una intervención en etapas en los 45 días tras el alta hospitalaria. Se determinó que combinar a los participantes de estos 2 grupos en un solo grupo de control era apropiado clínicamente, dada la evidencia previa de que, en la fase inicial tras la aleatorización, los pacientes asignados a ICP en etapas después del alta o a tratamiento médico de las lesiones coronarias no culpables tienen un riesgo comparable de IM no mortal y de revascularización no programada de causa isquémica7,8,18.
En tercer lugar, por lo que respecta a los resultados de este análisis, debe señalarse que no son aplicables a los pacientes con unas características clínicas y anatómicas distintas de las aquí presentadas. En todos los ensayos incluidos en este análisis se excluyó a los pacientes con shock cardiogénico, y la asignación aleatoria se limitó a los pacientes cuyos vasos culpables se trataron con éxito. Las mujeres están notablemente infrarrepresentadas en todos los ensayos. Además, la presencia de una oclusión total crónica fue un criterio de exclusión principal en 7 ensayos7,8,16–20.
Por último, aproximadamente el 15% de la población incluida tenía un IAMSEST. Aunque la magnitud y el sentido del efecto del tratamiento en el objetivo primario no se modificaron en función del tipo de IM, se necesitan nuevas investigaciones para confirmar que una estrategia de ICPm en la hospitalización inicial reduce el riesgo de eventos adversos cardiovasculares en los pacientes con IAMSEST28.
CONCLUSIONESEn los pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico, una estrategia de ICPm durante la hospitalización inicial, ya sea en la misma sesión o por etapas, se asocia con una mejora general de los resultados en comparación con las demás estrategias de tratamiento. En consecuencia, la revascularización completa durante la hospitalización inicial pasa a ser el tratamiento de elección para los pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico.
FINANCIACIÓNEsta investigación no recibió ninguna subvención específica de ningún organismo financiador del sector público, privado o sin ánimo de lucro.
CONSIDERACIONES ÉTICASEl presente estudio es un metanálisis de datos agregados y no requirió aprobación ética ni inscripción de pacientes o acceso a información desagregada de los sujetos. En la elaboración de este artículo se tuvieron en cuenta los sesgos de sexo o género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALEn la elaboración de este artículo no se ha utilizado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESF. Voll, A. Kastrati y S. Cassese participaron en la concepción y el diseño del estudio. S. Cassese realizó el análisis de los datos. A. Kastrati supervisó el análisis de los datos. F. Voll, junto con G. Ndrepepa, A. Kastrati y S. Cassese redactaron la versión preliminar del manuscrito. C. Kuna, M. Scalamogna, T. Kessler, S. Kufner, T. Rheude, H.B. Sager, E. Xhepa, J. Wiebe, M. Joner, H. Schunkert, G. Ndrepepa, B.E. Stähli, A. Kastrati y S. Cassese participaron en la obtención de los datos y revisaron el manuscrito en cuanto a contenido intelectual importante. Todos los autores tuvieron pleno acceso a la totalidad de los datos, incluidos los informes estadísticos y las tablas y aprobaron el manuscrito para la presentación final.
CONFLICTO DE INTERESESC. Kuna declara haber recibido pagos por conferencias de AstraZeneca. S. Kufner declara haber recibido pagos por conferencias y por consultoría de AstraZeneca, Bristol-Myers Squibb y Translumina. T. Rheude declara haber recibido pagos por conferencias de AstraZeneca y SIS Medical AG. M. Joner declara haber recibido apoyo de subvenciones para su institución de Boston Scientific, Cardiac Dimensions, Edwards Lifesciences y Infraredx; pagos por consultoría de Biotronik, TriCares, Veryan y Shockwave; pagos por conferencias de Abbott, AstraZeneca, Biotronik, Boston Scientific, Cardiac Dimensions, Edwards Lifesciences, Recor Medical y Shockwave; participación en un Comité Directivo de Biotronik y Edwards Lifesciences; ayuda para viajes de Boston Scientific, Cardiac Dimensions, Edwards Lifesciences y SIS Medical AG. E. Xhepa ha recibido pagos por conferencias/honorarios de AstraZeneca, Boston Scientific y SIS Medical AG; y honorarios como mentor de Abbott Vascular; y apoyo de una subvención para su institución de Abbott Vascular. B.E. Stähli ha recibido apoyo de H.H. Sheikh Khalifa bin Hamad Al-Thani Research Programme, ha recibido subvenciones de investigación para su institución de Boston Scientific, la B. Braun Foundation, el German Center for Cardiovascular Research (DZHK), la German Heart Research Foundation, Edwards Lifesciences, la Iten-Kohaut Foundation y la OPO Foundation, y pagos por consultoría y conferencias de Abbott Vascular, Abiomed, Boston Scientific y SMT. S. Cassese ha recibido honorarios por conferencias o mentoría de AstraZeneca, SIS Medical AG y Translumina; y apoyo de una subvención para su institución de Abbott Vascular, Boston Scientific y SIS Medical AG. Los demás autores no declaran ningún posible conflicto de intereses.
- –
En los pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico, la ICP multivaso es superior a la ICP solo de la arteria culpable. El momento óptimo para la ICP multivaso continúa siendo una cuestión controvertida; hay quien defiende llevarla a cabo durante la intervención inicial, mientras que otros proponen programarla durante una hospitalización posterior.
- –
En los pacientes con IAMCEST y EC multivaso que no presentan shock cardiogénico, la ICP multivaso durante la hospitalización inicial, ya sea en la misma sesión o por etapas, reduce el riesgo de muerte, IM y nueva revascularización no programada y debe ser la estrategia de elección en ese contexto.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2024.06.002