En esta revisión se intenta aportar una visión práctica y resumida de las técnicas de imagen actualmente disponibles en la valoración de pacientes con fibrilación auricular, así como de sus posibilidades diagnósticas, pronósticas y de apoyo terapéutico. Se trata de un campo amplio y en constante desarrollo, en el que se apoyan muchas de las decisiones clínicas en la práctica diaria para los pacientes con fibrilación auricular.
Palabras clave
aurícula izquierda
ecocardiografía transesofágica
ecocardiografía transtorácica
fibrilación auricular
orejuela izquierda
venas pulmonares
Las técnicas de imagen cardiaca tienen un papel principal en la evaluación, el pronóstico y el manejo del paciente con fibrilación auricular (FA). Hoy se cuenta con diversas modalidades de imagen que permiten tanto evaluar con gran precisión la morfología anatómica de la aurícula izquierda (AI) y sus estructuras adyacentes como cuantificar sus dimensiones y su función. Estas técnicas se pueden aplicar tanto individualmente como combinadas.
La ecocardiografía transtorácica bidimensional (ETT 2D) es, sin duda, la técnica básica de evaluación y se debe considerar sistemáticamente para cualquier paciente con FA1. En ciertos contextos clínicos, la ecocardiografía en su modalidad transesofágica (ETE) resulta imprescindible (detección de trombos intraauriculares, antes de una cardioversión o en procedimientos de ablación de venas pulmonares [VP] o de cierre de orejuela izquierda [OI]).
En los últimos años se han ido incorporando nuevas modalidades de imagen, como la ecocardiografía en 3 dimensiones (3D), tanto ETT como ETE, la tomografía computarizada (TC) y la resonancia magnética (RM). Estas técnicas cuentan con una resolución espacial muy superior, por lo que aportan información de gran utilidad en situaciones clínicas determinadas.
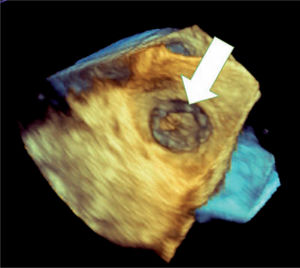
La evaluación por eco-2D básica de un paciente con FA proporciona una gran cantidad de información de aplicación clínica inmediata: se puede descartar o confirmar la presencia de una enfermedad cardiaca estructural asociada (morfología y función ventricular, presencia de valvulopatías, etc.) y asimismo es posible cuantificar el grado de dilatación auricular. Habitualmente, la información obtenida con un estudio de eco-2D estándar resulta suficiente para el tratamiento clínico del paciente. Sin embargo, en algunos casos se necesitan datos adicionales, en concreto determinar con seguridad si hay trombos intraauriculares. Dado que la mayor parte de los trombos intraauriculares se forman en la OI, resulta imprescindible observar con precisión esta estructura anatómica. Desafortunadamente, por ETT no suele ser posible observar adecuadamente la OI, y por ello se debe recurrir a la vía transesofágica. Por lo tanto, en situaciones clínicas concretas (p. ej., antes de realizar una cardioversión eléctrica o ante una ablación de VP) se hace necesario una ETE para observar con claridad la OI (figura 1).
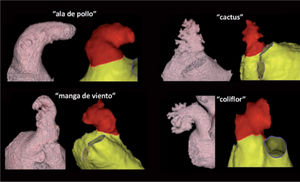
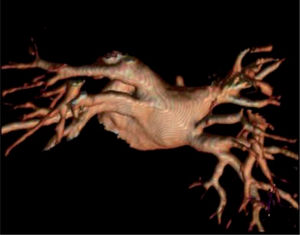
Las técnicas con capacidad de visualización-reconstrucción en 3D (tanto TC multidetectores como RM) han supuesto un importante avance en la evaluación de estructuras anatómicas relacionadas con la AI, como la OI y las VP. Estas modalidades de imagen han puesto al descubierto la extraordinaria variabilidad anatómica de la OI, que puede tener uno o varios lóbulos y se ha clasificado según su morfología: en forma de «ala de pollo» (la variedad más frecuente, aproximadamente el 50% de los casos), «cactus» (30%), «manga de viento» (20%) o «coliflor» (la menos frecuente, un 2-3%)2 (figura 2).
Las 4 configuraciones principales para la orejuela izquierda. A: tomografía computarizada. B: resonancia magnética. Modificado con permiso de Di Biase et al2.
La ETE-3D, con su capacidad de observación dinámica en tiempo real y de reconstrucción multiplanar, también permite observar con claridad las distintas morfologías de la OI descritas3. Aunque los músculos pectíneos muy desarrollados pueden confundirse con trombos, la ETE-3D suele resolver este dilema diagnóstico sin mayor dificultad4.
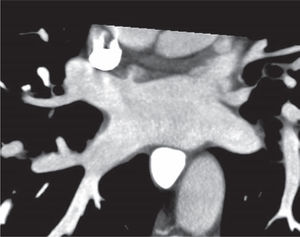
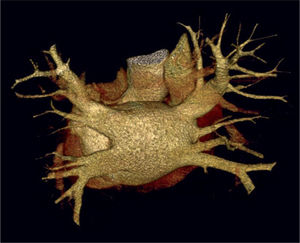
Con respecto a las VP, de nuevo la TC (figuras 3 y 4) y la RM (figura 5) consiguen definir su variabilidad anatómica con gran precisión, como la entrada común de VP izquierdas o la presencia de una VP derecha media adicional. Estas imágenes se pueden superponer e integrar con sistemas de mapeo electroanatómico, que es de gran utilidad para guiar los procedimientos de ablación de VP5.
Como es sabido, la TC y la RM son técnicas caras, de disponibilidad limitada y con problemas específicos: radiación y necesidad de contraste yodado en la TC y la incompatibilidad con determinados dispositivos ferromagnéticos de la RM. Por lo tanto, no se suele utilizarlas en la práctica diaria y se reservan para algunos contextos clínicos, específicamente para la visualización precisa de las VP antes de los procedimientos de ablación. Sin embargo, en la evaluación de la OI, la ETE-3D es la técnica de elección debido a su disponibilidad, su sencillez y la ausencia de efectos secundarios.
Normalidad y anormalidad de las aurículasCon la ETT se puede evaluar y cuantificar de manera muy sencilla el tamaño y la morfología de las aurículas. En la FA casi siempre se encuentra dilatación auricular en mayor o menor medida («remodelado auricular»)6. La extensión del remodelado depende de su presentación paroxística o permanente, del tiempo de evolución y de la presencia de enfermedad estructural.
En la práctica diaria, el tamaño de la AI se suele determinar por su diámetro anteroposterior en el plano paraesternal de eje largo, perpendicular a la raíz aórtica (valor normal máximo, 38 mm en mujeres y 40 mm en varones), aunque la precisión aumenta indexando por superficie corporal (límite máximo, 23 mm/m2). Este método es sencillo y reproducible y, por ello, el más utilizado.
Sin embargo, la dilatación auricular suele ser asimétrica, y una medición en solo un plano puede resultar equívoca. Por lo tanto, para una evaluación más precisa se debe cuantificar el volumen auricular7. Hay numerosos métodos para calcular el volumen auricular, aunque las guías de práctica clínica más recientes8 recomiendan utilizar el método de sumación de discos biplano en proyecciones apicales de 2 y 4 cámaras. Este método se prefiere por su mayor precisión, al implicar mínimas presunciones geométricas y su valor máximo es 34 ml/m2. Nuevas técnicas de ETT-3D permiten obtener los volúmenes con mayores precisión y reproducibilidad9 y facilitan el seguimiento evolutivo del remodelado auricular.
Con la TC y la RM se puede determinar el tamaño auricular con mayor precisión que con la ecocardiografía. Además, se puede observar mejor la morfología y particularmente el índice de esfericidad auricular, dato que se correlaciona con el patrón de remodelado. De todas formas, dados su menor disponibilidad y su mayor complejidad y coste, no se suele utilizar sistemáticamente. Sin embargo, en contextos de investigación, estas técnicas sirven como referencia comparativa. Utilizando la RM como referencia, se ha observado que los volúmenes auriculares obtenidos con eco-3D eran similares. Sin embargo, los volúmenes con eco-2D eran significativamente menores, lo que implica que la eco-2D subestima el volumen auricular10.
Imagen y pronóstico en la fibrilación auricularEs bien conocida la trascendencia pronóstica que conlleva la presencia de FA11. Esta arritmia se asocia no solamente a cardioembolia, sino también a mayores incidencias de insuficiencia cardiaca y mortalidad12. La presencia de cardiopatía estructural asociada es uno de los principales factores que implican un peor pronóstico. La eco-2D es la técnica de elección en este contexto, pues permite evaluar rápida y sencillamente la dilatación y la hipertrofia ventricular, la función sistólica general y segmentaria o las valvulopatías.
El tamaño auricular es uno de los principales predictores pronósticos en la FA y es independiente de la edad y otros factores de riesgo13. Además, se da una correlación inversa entre el volumen auricular y la probabilidad de éxito (mantenimiento del ritmo sinusal) tras la cardioversión eléctrica o la ablación de VP14.
En cuanto al riesgo embólico, es bien conocido desde hace tiempo que el aumento de tamaño de la OI se asocia con mayor riesgo de cardioembolia15. Recientemente se ha indicado la asociación entre la morfología anatómica de la OI y la presencia de embolia o accidente vascular transitorio. Los pacientes con morfología tipo «ala de pollo» (la más prevalente) parecen tener un riesgo embólico entre 4 y 8 veces menor que los pacientes con otras morfologías2.
Utilidad en la cardioversión eléctricaEl tamaño de la AI antes de realizar una cardioversión eléctrica es un marcador del grado de remodelado que existe en dicha cavidad y es capaz de predecir la probabilidad de mantener el ritmo sinusal normal después del procedimiento. En un estudio reciente16 con TC cardiaca se demostró la relación existente entre el tipo de FA (paroxística o permanente) y el volumen de la AI. Por otra parte, en el trabajo se demuestra que el volumen de la AI es un predictor de recurrencia de FA y que se asocia con más fuerza a la FA paroxística17. Diferentes técnicas de imagen, como la TC, la RM, la ETT y la ETE, se han empleado en múltiples estudios y, aunque hay diferencias entre ellas, tienen por nexo que, a mayor tamaño y mayor remodelado de la AI, menos probabilidades de éxito en la cardioversión y aumento de las probabilidades de recurrencia tras una cardioversión exitosa.
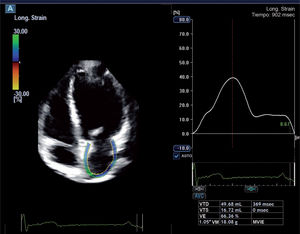
La AI regula el llenado del ventrículo izquierdo actuando como un reservorio durante la sístole ventricular y comportándose como un conducto pasivo durante el inicio de la diástole ventricular. En telediástole, actúa como una bomba y mejora el llenado del ventrículo. Se puede evaluar las diferentes funciones de la AI mediante diferentes técnicas de imagen, pero las relacionadas con la ecocardiografía generalmente son las más adecuadas debido a su alta resolución temporal. Mediante estas técnicas se puede valorar las fracciones de vaciamiento activa, pasiva y total de la AI. El estudio de la funcionalidad de la AI también es capaz de mostrar parámetros que se relacionan con la recurrencia de la FA. Se ha demostrado que el índice de expansión de la AI, que es un marcador de la función de reservorio, es un importante predictor de FA18. Esta misma función de la AI se puede estudiar mediante técnicas más avanzadas como el Doppler tisular o el speckle tracking (figura 6). Con esta técnica también se puede estudiar las funciones de bomba, reservorio y conducto de la AI, que pueden relacionarse con la recurrencia de la FA19,20.
El remodelado de la AI se asocia a la aparición de fibrosis auricular, que se puede identificar por RM a través de la captación de gadolinio21. En un estudio multicéntrico22 publicado recientemente, se ha relacionado la cuantificación de la fibrosis auricular con el éxito de la ablación. Los pacientes con fibrosis más extensa (> 30%) presentaron una tasa de recurrencia de FA del 51% a los 325 días de la ablación; en el otro extremo, los pacientes con fibrosis ligera (< 10%) solo tuvieron un 15% de recurrencias22.
Otras técnicas novedosas de RM como el mapeo de T1 han estudiado el septo interauricular como punto de partida para valorar la presencia de fibrosis difusa en la AI. Un incremento en el tiempo de relajación T1 resultó ser un predictor independiente de recurrencia de la FA a los 12 meses de una primera cardioversión eléctrica o ablación de la FA23.
También se ha intentado estudiar la presencia y la extensión de fibrosis miocárdica en el músculo auricular mediante otras técnicas no invasivas como el speckle tracking. Mediante esta técnica, se evalúa la deformación del miocardio durante el ciclo cardiaco, y se ha demostrado que unos valores de deformación inferiores a lo normal son más frecuentes en pacientes con FA persistente que en pacientes con FA paroxística. Además, la presencia de una deformación en la pared lateral de la AI disminuida se asocia a una mayor extensión de la fibrosis del músculo auricular24.
Utilidad en el intervencionismo. cierre percutá neo de la orejuela izquierdaLa evaluación anatómica y de las dimensiones de la OI resulta fundamental a la hora de indicar y guiar el cierre percutáneo de la OI. Además, se debe descartar la presencia actual de trombos en la OI. Las diferentes técnicas de imagen ya mencionadas hacen posible una evaluación morfológica precisa que permita establecer el tipo y el tamaño apropiado del dispositivo, lo que aumenta las garantías de éxito y reduce las probabilidades de complicaciones. De nuevo, por su sencillez, disponibilidad y adecuada resolución temporal y espacial, la ETE-3D es la técnica utilizada habitualmente. Esta técnica resulta también esencial a la hora de guiar el procedimiento en la sala de intervencionismo y confirmar el resultado25.
ConclusionesLas nuevas técnicas de imagen cardiaca tienen un papel fundamental en la evaluación del sustrato anatomofisiológico de la FA, así como en el pronóstico evolutivo y la indicación y guía de procedimientos terapéuticos. Están disponibles múltiples modalidades técnicas, cada una de ellas aporta diferente información específica. La integración de esta información y su aplicación en el contexto clínico apropiado hoy resulta esencial en el manejo de los pacientes con FA.
Conflicto de interesesNinguno.