Pese a ser la arritmia cardiaca sostenida más frecuente y que se describió hace más de 100 años, la fibrilación auricular es, junto con la fibrilación ventricular, prácticamente la única cuyo mecanismo aún se desconoce. Este desconocimiento tiene profundas implicaciones clínicas más allá de un mero interés académico. Así, el desconocimiento sobre el mecanismo hace que el diagnóstico de esta arritmia siga siendo básicamente electrocardiográfico. Esto origina que se planteen dudas diagnósticas con cierta frecuencia, tanto en el ECG de superficie como en registros electrofisiológicos intracavitarios. Además, el desconocimiento de su mecanismo limita el desarrollo de terapias farmacológicas e invasivas más dirigidas y medidas preventivas que la eviten o al menos la retrasen. En este artículo se revisan las teorías más aceptadas sobre el mecanismo de esta arritmia, como la de las múltiples reentradas funcionales coexistentes o la de los rotores madre, así como la de los factores que pueden influir en él, como el remodelado auricular, la presencia de fibrosis y cicatrices auriculares, la masa auricular, el papel de las venas pulmonares y los hechos que respaldan una relación con la reentrada. Asimismo, se revisan los criterios diagnósticos de esta arritmia, sus tipos y las exploraciones diagnósticas que se debe realizar a estos pacientes.
Palabras clave
fibrilación auricular
venas pulmonares
Como se comenta en otros artículos de esta monografía, la fibrilación auricular (FA) es la arritmia cardiaca sostenida más frecuente. A pesar de ello y de que Lewis la describiera hace más de 100 años, es, junto con la fibrilación ventricular, prácticamente la única cuyo mecanismo sigue siendo desconocido. Este desconocimiento tiene profundas implicaciones clínicas más allá de un mero interés académico. Así, no conocer el mecanismo hace que el diagnóstico de esta arritmia siga siendo básicamente electrocardiográfico. Esto origina que con cierta frecuencia se planteen dudas diagnósticas, tanto en el ECG de superficie como en registros electrofisiológicos intracavitarios, en los que en ocasiones se puede encontrar áreas auriculares de regularidad coexistiendo con otras de marcada irregularidad. Además, limita el desarrollo de terapias farmacológicas e invasivas más dirigidas y medidas preventivas que la eviten o al menos la retrasen.
En este artículo se revisan las teorías más aceptadas sobre el mecanismo de esta arritmia y de los factores que pueden influir en ella, así como su diagnóstico y las consideraciones que hay que tener en cuenta.
MecanismoHistoria y teoríasClásicamente, el mecanismo de la FA ha sido siempre fuente de controversia. La primera descripción relacionada con la FA la realizó Jean Baptiste Sénac en 1783 en la estenosis mitral como «palpitación indomable», lo que más adelante se conoció también como delirium cordis1. Sin embargo, la FA no se reconoció como tal hasta el inicio del siglo XX. En 1905, James Mackenzie describió la pérdida de la onda a del pulso venoso usando un polígrafo clínico y en 1906 Willem Einthoven publicó el primer ECG de FA2. Posteriormente, Arthur Cushny y Thomas Lewis establecieron la relación del pulso irregular con la FA3.
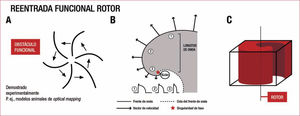
En 1914, Garrey postuló por primera vez que la FA podría deberse a un fenómeno de reentrada4. En 1962, Gordon Moe estableció la primera teoría de FA más unánimemente seguida, basada en la coexistencia de múltiples frentes de reentrada funcional, es decir, que no requerían un circuito establecido, sino que iban migrando, colisionando y autoperpetuándose por la desaparición y generación de nuevos circuitos5. Esta hipótesis se aceptó durante muchos años y diversos grupos, como el de Allessie6, la apoyaron con sus investigaciones. Posteriormente, sin embargo, el grupo de Jalife en Estados Unidos, con estudios experimentales de cartografía óptica en animales, la cuestionó y en su lugar propuso la existencia de rotores, definidos como una forma peculiar de reentrada en espirales similares a las observadas en los huracanes, en las que no existe un núcleo orgánico, sino que este lo constituye la propia rotación del rotor, rápida en su periferia y muy lenta en su interior, que no permanece fijo7,8(figura 1).
Representación esquemática de una reentrada funcional (A), una espiral en un esquema bidimensional (B) y un rotor en un esquema tridimensional (C). Reproducida con permiso de Breysse et al8.
Más recientemente, los trabajos del grupo de Narayan —también en Estados Unidos, pero ya en humanos— usando catéteres multielectrodos tipo cesta y un software especial, han permitido encontrar en la mayoría de los pacientes circuitos de movimiento circular en ambas aurículas, pero más frecuentemente en la izquierda, que los autores han denominado también rotores9. Sin embargo, estos circuitos se encuentran en una situación reproduciblemente estacionaria y pueden suprimirse con la aplicación focal de radiofrecuencia para terminar la FA, por lo que no se adaptarían tanto a una definición de rotor como la que se ha expuesto anteriormente, sino más bien a la de una reentrada circular clásica.
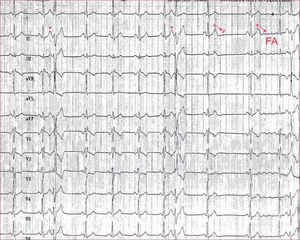
Iniciadores, mantenedores y perpetuadoresPor otro lado, con relación al mecanismo, es importante diferenciar los fenómenos que llevan al desencadenamiento de la FA (gatillos o iniciadores) de los que llevan a que se mantenga. Esto tiene importantes implicaciones ya no solo mecanísticas, sino en su presentación clínica y su manejo. Esta diferenciación, aunque clásicamente conocida, no se aceptó ampliamente hasta los trabajos de Haissaguerre et al10, que demostraron que la FA se inicia por extrasístoles (figura 2) que, en la mayoría de las ocasiones, provienen de las venas pulmonares (VP), de forma que en los tipos de FA que dependen más de los iniciadores, como la forma paroxística, el aislamiento de las VP, como se comenta en otro artículo de esta monografía, puede disminuir o incluso eliminar completamente los episodios.
ECG obtenido de un paciente con fibrilación auricular focal. Se presentan con asteriscos las extrasístoles auriculares que coinciden con la onda T precedente (fenómeno de «P en T»), se conducen con aberrancia de rama derecha y, según se van haciendo más precoces, se bloquean en el nódulo auriculoventricular e inducen fibrilación auricular.
Además, existe otro concepto a menudo no reconocido ni discutido en los foros, que es el de los mecanismos que llevan a la cronificación de la FA. Es improbable pensar que un mecanismo sencillo focal o reentrante permita que la FA se mantenga durante décadas sin periodos de ritmo sinusal intercurrente, por lo que debe de haber mecanismos adicionales que hagan que la arritmia se perpetúe establemente, como más adelante se comenta con el remodelado11.
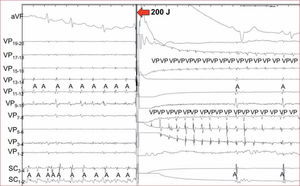
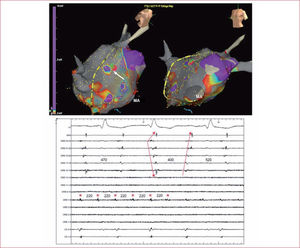
Masa auricular críticaInicialmente se consideraba que para el establecimiento de la FA era necesaria una masa auricular crítica. Esto se basaba en la hipótesis anteriormente enunciada de Gordon Moe en la que, para la coexistencia de múltiples frentes dinámicos de reentrada, se necesitaba un área muscular mínima. Esto se sustentaba además por la práctica inexistencia de la FA en niños o adultos jóvenes, salvo que presentaran cardiopatías asociadas con una gran dilatación auricular. Sin embargo, con el advenimiento de las técnicas de ablación con catéter, se empezó a describir casos de pacientes cuya FA persistía tras el aislamiento de las VP, pero ya solo dentro de la VP, mientras que el resto de la aurícula permanecía en ritmo sinusal12 (figura 3). Estas descripciones prácticamente descartan el requisito de una masa auricular critica, dada la baja masa muscular que presenta una VP.
Registros ECG y electrofisiológicos del seno coronario (SC) y de un catéter multipolo circular situado en la vena pulmonar (VP) superior izquierda tras su aislamiento con radiofrecuencia. Un choque eléctrico de 200 J (flecha) termina la fibrilación auricular en las aurículas y la induce en el interior de la VP que permanece en este ritmo coexistiendo con el sinusal auricular.
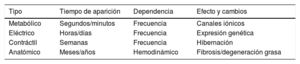
Un aspecto clave en la comprensión de los mecanismos y la fisiopatología de la FA es el remodelado auricular asociado a esta. Aunque se conocía ya que la propia FA puede producir modificaciones en el miocardio auricular, no fue hasta 1995 cuando Wijffels, del grupo de Allessie, las implicó en el propio mantenimiento de la FA13. Con el título que hoy es ya un clásico «AF begets AF» (la FA genera FA), estos investigadores demostraron en un modelo caprino que la propia FA se retroalimentaba y condicionaba su perpetuación. Utilizaron para ello cabras a las que implantaban un marcapasos auricular que liberaba trenes cortos de estimulación muy rápida a intervalos repetidos. Estos trenes generaban respuestas auriculares repetidas similares a la FA que duraban apenas unos segundos y, según pasaban las horas, se iban manteniendo más tiempo hasta que, tras 1 semana, en un elevado número de animales se establecían como FA persistente. La explicación a este fenómeno viene del remodelado que sufre el miocardio auricular ante las frecuencias altas. Así, inicialmente se produce un remodelado metabólico y eléctrico, de forma que los miocitos disminuyen su periodo refractario, lo que puede facilitar los fenómenos de reentrada. Si la situación continúa, se inician cambios ultraestructurales dentro de la célula, como la degeneración mitocondrial o la alteración del retículo sarcoplásmico, conocidos como remodelado contráctil. Posteriormente, si este remodelado se combina con sobrecargas de volumen y presión auriculares, se inician cambios ya extracelulares por muerte celular y reemplazo de los miocitos por fibrosis. Este último concepto se deriva de otros trabajos, fundamentalmente de Nattel et al14, que realizaron experimentos similares a los del grupo de Allessie pero en un modelo canino, y en esta ocasión comparando animales en los que se dejaba que los ventrículos estuvieran sometidos a una elevada respuesta ventricular por estimulación ventricular con su eventual fracaso, desarrollo de taquicardiomiopatía e IC, con la consiguiente sobrecarga de presión y volumen de las aurículas, con otro grupo de canes a los que se realizaba una ablación de la conducción auriculoventricular y se implantaba un marcapasos ventricular, sin desarrollo por tanto de elevadas frecuencias ventriculares ni insuficiencia cardiaca. En el primer grupo se observó un gran desarrollo de fibrosis auricular en comparación con el otro grupo y con uno de control, en los que apenas había fibrosis, con lo cual se demostraba que el remodelado anatómico extracelular se produce cuando se asocia a las altas frecuencias auriculares una sobrecarga hemodinámica de las aurículas, como ocurre en pacientes con hipertensión arterial o valvulopatías. En la tabla 1 se muestran las diversas características de los diferentes tipos de remodelado auricular por la FA.
Tipos de remodelado auricular por fibrilación auricular.
| Tipo | Tiempo de aparición | Dependencia | Efecto y cambios |
|---|---|---|---|
| Metabólico | Segundos/minutos | Frecuencia | Canales iónicos |
| Eléctrico | Horas/días | Frecuencia | Expresión genética |
| Contráctil | Semanas | Frecuencia | Hibernación |
| Anatómico | Meses/años | Hemodinámico | Fibrosis/degeneración grasa |
Como ya se ha comentado, las VP tienen un papel esencial en la FA. Inicialmente, se les atribuyó básicamente el papel de origen de las extrasístoles desencadenantes de FA. Sin embargo, posteriormente, descripciones de terminación de FA persistente durante el aislamiento de las VP o incluso el mantenimiento de esta dentro de una VP una vez aislada12 (figura 3) han llevado a considerar que el ostium de las VP podría estar implicado en el mantenimiento de la FA en algunos pacientes. Además de presentar una estructura anatómica que es potencial asiento de un circuito circular reentrante, las VP presentan periodos refractarios más cortos que los auriculares y discontinuidades musculares que pueden llevar a una conducción lenta, fenómenos asociados al mecanismo de reentrada.
Fibrosis y cicatrices auricularesLa importancia de la fibrosis y las áreas de escara en el mecanismo de la FA ha ido cobrando mayor relevancia en los últimos años. Inicialmente, se aceptaba que en los últimos estadios puede haber una fibrosis auricular, pero no se la relacionaba especialmente como causa directa de la FA, sino más bien como un efecto más de la dilatación auricular, en último extremo requerimiento último de la FA. Incluso se ha llegado a especular que, en grados máximos de progresión de fibrosis auricular, la propia FA se extinguiría y no podría mantenerse más por falta de masa auricular crítica. Con ello, el papel de la fibrosis se consideraba secundario y además se especulaba con que la fibrosis auricular sería más un fenómeno difuso y no tan segmentario como en el miocardio ventricular. Sin embargo, estudios recientes demuestran que la fibrosis puede ser bastante segmentaria, con predilección por determinadas áreas15, y más recientemente que el tratamiento de estas zonas de cicatriz se asociaría con una mejor evolución tras la ablación con catéter16. Esto respaldaría, sin demostrarlo, que el mecanismo último del mantenimiento de la FA sería más un fenómeno de reentrada orgánica fija que uno de reentrada funcional dinámica, dado que para el primero es requisito fundamental la presencia de obstáculos anatómicos, como los de las cicatrices, y el desarrollo de istmos de conducción lenta, frecuentemente asociados a la fibrosis.
Reentrada y fibrilación auricularComo se ha revisado, aunque el mecanismo último de la FA sigue siendo desconocido, hay algunos datos que respaldan que los fenómenos de reentrada están implicados de alguna manera. En primer lugar, y desde un punto de vista meramente estadístico, en las más frecuentes arritmias sostenidas humanas cuyo mecanismo se conoce, este está ligado a fenómenos de reentrada de circuito estable no dinámico, como en las vías accesorias, las taquicardias intranodulares, el flutter auricular o las taquicardias ventriculares. En segundo lugar, la FA es una arritmia íntimamente ligada al envejecimiento y el daño estructural auricular, situaciones ambas que llevan a fibrosis y escarificación auricular, fenómeno también íntimamente relacionado con los fenómenos de reentrada y, en menor grado, con otros mecanismos electrofisiológicos, como las reentradas funcionales, la actividad focal desencadenada o el automatismo. En tercer lugar, la frecuente asociación de la FA con el flutter auricular, modelo clásico de reentrada orgánica, plantea que ambos fenómenos arrítmicos podrían tener de base un mecanismo similar e incluso ser expresiones extremas de un espectro electrocardiográfico de la misma enfermedad. En cuarto lugar, la iniciación de la FA con estimulación eléctrica y su terminación con cardioversión eléctrica apuntan a un mecanismo de reentrada, prácticamente descartan fenómenos automáticos y hacen menos probables, sin descartarlos, los de actividad focal desencadenada. En este sentido, incluso se ha descrito recientemente la terminación e iniciación de la FA con choques eléctricos12. Finalmente, la terminación de la FA con radiofrecuencia sin compartimentar las aurículas indica que su mecanismo se basa más en fenómenos de reentrada fija que funcional tipo rotor dinámico y migratorio. Todo ello, en opinión de estos autores17, corrobora más el concepto de uno o más circuitos de reentrada orgánica fija con conducción fibrilatoria al resto de las aurículas que otros mecanismos propuestos en el pasado y más recientemente.
DiagnósticoEl diagnóstico de la FA puede parecer, en un análisis superficial, sencillo y su discusión, prácticamente irrelevante. Sin embargo, con relativa frecuencia puede plantear dudas e incluso desacuerdos. Por el comentado desconocimiento de su mecanismo último, el diagnóstico de la FA sigue siendo electrocardiográfico, y no electrofisiológico como el de otras arritmias. Al mismo tiempo, es importante conocer qué exploraciones se debe realizar para completar el diagnóstico diferencial de la FA con el de otras anomalías cardiovasculares frecuentemente asociadas o de las repercusiones que pueda tener la FA en el propio corazón.
ElectrocardiogramaEl diagnóstico se basa en el cumplimiento de los 3 criterios siguientes que se debe analizar consecutivamente18:
- 1.
Los intervalos RR deben ser absolutamente irregulares (irregularidad ventricular) y no seguir ningún patrón repetitivo. Como excepción a este criterio, está la concomitancia de FA con bloqueo auriculoventricular completo o con formas de taquicardia no dependientes de las aurículas para mantenerse, como la taquicardia ventricular.
- 2.
No hay ondas P claramente discernibles en el ECG de superficie, aunque puede haber cierta actividad auricular que genere unas ondas, conocidas como f, que van variando en morfología, amplitud, longitud de ciclo y relación con el QRS.
- 3.
La longitud de ciclo auricular, cuando es discernible, es variable (irregularidad auricular) y suele ser < 200 ms, es decir, la frecuencia auricular es > 300 lpm.
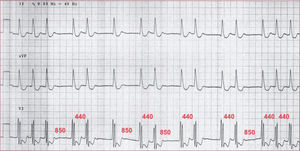
Como se ha comentado, el diagnóstico electrocardiográfico de la FA puede tener algunas limitaciones. En este sentido, es necesario reconocer que el ECG no es más que la expresión eléctrica a distancia sobre la superficie corporal de los fenómenos electrofisiológicos cardiacos. Esto puede llevar a situaciones tanto de falsos positivos como falsos negativos en el diagnóstico de esta arritmia. Así, en pacientes con extensa fibrosis auricular, la expresividad electrocardiográfica de la actividad eléctrica auricular va a ser prácticamente nula, por lo que la irregularidad que conllevan la extrasistolia auricular o las macrorreentradas auriculares con conducción auriculoventricular variable puede llevar a establecer un diagnóstico de FA sin realmente serlo (figura 4). Al mismo tiempo, en pacientes con extensa fibrosis auricular y bloqueo auriculoventricular, la irregularidad auricular de la FA no va a ser apreciable, y puede llegar a no diagnosticarse. Esto puede tener implicaciones para el manejo clínico de los pacientes en la indicación de anticoagulación, dado que actualmente se desconoce el papel que pueda tener la anticoagulación en pacientes con fibrosis auricular extensa que estén en ritmo sinusal. Además, puede haber pacientes que cumplan la definición electrocardiográfica de FA y que incluso presenten zonas auriculares de irregularidad eléctrica, pero en los que haya áreas de actividad auricular regular y que, incluso suprimiéndola, se elimine el trastorno arrítmico (figura 5). Estrictamente a estos pacientes se los debería considerar con FA, aunque su manifestación electrofisiológica sea diferente de la que suelen presentar la mayoría de los pacientes con FA.
ECG obtenido de un paciente portador de prótesis mitral y diagnosticado de fibrilación auricular permanente años antes. En una revisión se observaron datos de regularidad que indicaban una taquicardia/flutter auricular con conducción variable 1:1 (intervalos de 440 ms) y 2:1 (intervalos de 850 ms correspondientes al doble de los anteriores menos unos milisegundos por el probable acortamiento del tiempo de conducción del nódulo auriculoventricular tras el latido bloqueado) a los ventrículos.
Registros de ECG y electrofisiológicos (abajo) y mapa electroanatómico 3D con navegador Ensite Navx de la aurícula izquierda en un paciente con extensa fibrosis auricular (áreas grises) cuya actividad auricular era irregular en frecuencia y secuencia (flechas rojas), salvo en un punto de regularidad a 220 ms, donde (flecha blanca) una aplicación focal de radiofrecuencia terminó la arritmia y recuperó el ritmo sinusal.
Otro aspecto que frecuentemente plantea dudas diagnósticas es el patrón de ECG habitualmente llamado «fibrilo-flutter» auricular. Este patrón se caracteriza por unas ondas auriculares de gran amplitud que, a pesar de que van cambiando de morfología, amplitud, frecuencia y relación con el complejo QRS, pueden plantear dudas sobre si se trata de ondas de FA (ondas f) o de ondas de flutter auricular (ondas F). Sin embargo, el patrón cumple la definición actual de FA y debe definirse como tal. De hecho, hace ya décadas19 que se recomendó que se dejara de usar el término «fibrilo-futter» auricular, pese a lo cual casi 40 años más tarde sigue usándose con cierta frecuencia, como una prueba más de las dificultades diagnósticas que plantea esta arritmia. La explicación del patrón probablemente esté relacionada con las fases iniciales de la enfermedad sin tanta fibrosis auricular, la coexistencia de menos sostenedores de la FA (menos circuitos reentrantes, rotores o focos) o la alternancia de FA con fases de flutter auricular, arritmias a menudo relacionadas. Así, se ha demostrado que este patrón responde mejor a la ablación con catéter que la denominada FA «de onda fina»20.
DuraciónUn aspecto que con frecuencia no se considera en los pacientes con FA es la duración mínima para considerarla una FA propiamente dicha. Actualmente y de manera arbitraria, se aceptan 30 s como el intervalo mínimo para diagnosticar la FA como tal18. Esto tiene connotaciones clínicas, dado que no es infrecuente encontrar a pacientes con rachas de taquicardia auricular o incluso de completa desorganización auricular de breve duración que no cumplen este criterio. Al mismo tiempo, algunos marcapasos almacenan episodios de alta frecuencia auricular que no alcanzan esa duración y cuyo significado clínico es incierto, como se discute en otro artículo de esta monografía, dado que la mayoría de los estudios del efecto de la anticoagulación en estos pacientes se basan en estudios con FA de presentación clínica, es decir, demostrada en un ECG y, por lo tanto, con una duración muy superior a 30 s, cuando no persistente (el 85% de los pacientes), por lo que las conclusiones extraídas de ellos no tendrían por qué ser extrapolables a este contexto clínico. A este respecto, hay en marcha estudios como el NOAH («Non-vitamin K antagonist Oral anticoagulants inpatients with AtrialHigh rate episodes»; EudraCT 2015-00399733, NCT 02618577, ISRCTN 17309850), que pretenden evaluar el papel que puede tener la anticoagulación en estos pacientes que no cumplen la definición de FA.
TiposLa FA se diagnostica o clasifica básicamente por su condición clínica asociada y por su duración.
Por su condición clínica asociada, se debe distinguir básicamente entre FA «valvular» y «no valvular». Por consenso, se acepta como la primera únicamente la que se produce en pacientes con valvulopatía mitral reumática o prótesis valvular18, aunque la guía estadounidense incluye además las reparaciones de la válvula mitral21; es decir, en los pacientes con estenosis aórtica o estenosis/insuficiencia mitral no reumática y FA, esta última no se consideraría «valvular», lo cual tiene importantes implicaciones para el manejo de la anticoagulación, como se comenta en otras partes de esta monografía.
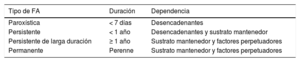
Por su duración, se debe distinguir entre FA paroxística, persistente, persistente de larga duración y permanente (tabla 2). Esta clasificación es relevante porque, aunque estrictamente no se basa en la etiología o el mecanismo, sí se corresponde bastante bien con la progresión de la enfermedad, la dependencia de determinados condicionantes mecanísticos y la respuesta al tratamiento. Así, en la FA paroxística los episodios dependen sobre todo de la presencia de desencadenantes, a menudo extrasístoles de las VP (figura 2) y no tanto del sustrato mantenedor, por lo que las terapias fundamentalmente dirigidas a los primeros, como la ablación con catéter, tienen mejores resultados que en otras formas de FA. En la FA persistente, la dependencia del sustrato mantenedor es mayor, y terapias como la cardioversión eléctrica cobran un sentido que no tiene en la FA paroxística, dado su carácter autolimitado. Recientemente se incorporó el término FA persistente de larga duración, dado que corresponde a una forma más avanzada de la enfermedad, con una respuesta al tratamiento farmacológico, con cardioversión y con ablación significativamente peor que las demás. Finalmente, la FA permanente no es más que la aceptación de su persistencia por parte del médico y el paciente, sin intentos de recuperar el ritmo sinusal. Además, en esta clasificación se puede considerar 2 tipos especiales de FA, fundamentalmente paroxística. Por un lado, estaría lo que se ha conocido como FA focal22, que es cuando un paciente presenta alta densidad de extrasistolias supraventriculares y rachas de taquicardia auricular/FA autolimitada en pocos segundos o minutos (figura 2). Cuando estas rachas duran más, incluso puede ocurrir que al paciente se le diagnostique FA persistente por no haberse registrado los periodos de ritmo sinusal intercurrentes. Este tipo de FA suele depender de un foco aislado desencadenante, que suele ser una VP, y responde muy bien a la ablación con catéter, incluso con solo el aislamiento de la VP culpable23.
Definición y dependencia principal de los diferentes tipos de fibrilación auricular clasificados por duración.
| Tipo de FA | Duración | Dependencia |
|---|---|---|
| Paroxística | < 7 días | Desencadenantes |
| Persistente | < 1 año | Desencadenantes y sustrato mantenedor |
| Persistente de larga duración | ≥ 1 año | Sustrato mantenedor y factores perpetuadores |
| Permanente | Perenne | Sustrato mantenedor y factores perpetuadores |
El otro tipo especial de FA es la denominada silente, que cursa con episodios habitualmente paroxísticos, de manera asintomática sin que el paciente sea consciente de ellos, y que está detrás de muchos de los accidentes cerebrovasculares criptogénicos, por lo que su detección es importante para iniciar el tratamiento anticoagulante. En este sentido, recientemente se ha demostrado el valor diagnóstico de los registradores de eventos y los Holter implantables24,25.
Métodos diagnósticosEn todo paciente con FA es necesario complementar el diagnóstico electrocardiográfico con otras exploraciones. Como ya se ha comentado18, en primer lugar es necesario tener un ECG de 12 derivaciones y no conformarse con una mera tira de ritmo, ya que puede ayudar a una mejor evaluación de la presencia de trastornos de conducción intraauricular y auriculoventricular y a que se sospeche cardiopatía estructural. Además, es necesario indicar un ecocardiograma transtorácico que descarte cardiopatía estructural y permita estimar los tamaños auriculares y la función ventricular, variables importantes para estimar en qué fase de progresión se encuentra la FA y la elección del tratamiento farmacológico, anticoagulante y eventualmente invasivo. Asimismo, es necesario disponer de determinaciones analíticas de hemograma, bioquímica renal y hepática, iones en sangre y hormonas tiroideas, fundamentalmente como guía del tratamiento farmacológico, antiarrítmico y antitrombótico que se pueda dar, y como basal para monitorizar después sus posibles complicaciones. Otras exploraciones, como el Holter-ECG o la ergometría, no son necesarias habitualmente, aunque hay que considerarlas ante algunas circunstancias (estimación de frecuencia cardiaca media, respuesta al ejercicio, etc.).
ConclusionesTras más de 100 años desde su descripción inicial y los enormes avances realizados, sigue sin conocerse el mecanismo último de la FA. Esto tiene implicaciones en su diagnóstico, que, a diferencia del de otras arritmias, sigue siendo electrocardiográfico. Al mismo tiempo, el desconocimiento del mecanismo limita el desarrollo de nuevos tratamientos aunque, a pesar de ello, en los últimos años el descubrimiento del papel de las VP, el remodelado o las cicatrices auriculares ha mejorado los resultados de las terapias disponibles.
Conflicto de interesesNinguno.