OBJETIVO: Determinar los resultados clínicos de la revascularización con stents intracoronarios en vasos menores de 3 mm.
PACIENTES Y MÉTODOS: El tamaño del vaso se evaluó como menor o mayor o igual de 3 mm en el momento del procedimiento y fue medido en el diámetro máximo. Estudiamos a un total de 234 pacientes consecutivos (300 stents en 279 lesiones), con un seguimiento clínico de 17,6 ± 10 meses, comprendiendo 84 stents implantados en 79 lesiones localizadas en vasos pequeños (< 3 mm). Se usó dilatación del stent a altas presiones (15,8 ± 2,2 atm) y tratamiento con aspirina y ticlopidina durante un mes.
RESULTADOS: La tasa de éxito del implante, sin eventos clínicos hospitalarios, fue del 93,7% en los vasos < 3 mm y del 93,5% en los >= 3 mm (p = NS). La trombosis subaguda del stent ocurrió en tres vasos < 3 mm, frente a ninguna oclusión trombótica en vasos >= 3 mm (el 3,8 frente al 0%; p = 0,006). A los dos años, la supervivencia libre de revascularización de la lesión diana fue inferior en vasos pequeños (el 73,6 frente al 90,3%; p < 0,001). En el análisis multivariado, un vaso < 3 mm fue predictor independiente de revascularización de la lesión diana a largo plazo (p = 0,001). A los dos años, la supervivencia libre de cualquier acontecimiento (muerte [el 4,6 frente al 3,8%; p = 0,7], infarto de miocardio [el 2,9 frente al 1,1%; p = 0,3] y revascularización de la lesión diana) para pacientes con implantes en vasos < 3 mm fue del 69,1, frente al 86,6% para implantes en vasos >= 3 mm (p < 0,001).
CONCLUSIÓN: El implante de stents en coronarias < 3 mm puede realizarse con éxito inicial similar al de los vasos mayores; sin embargo, se asocia a una mayor incidencia, tanto de trombosis subaguda como de reestenosis clínica (revascularización de la lesión diana) a largo plazo.
Palabras clave
Stent
Enfermedad coronaria
Angioplastia coronaria
INTRODUCCIÓN
El implante de stents intracoronarios fue inicialmente aprobado en vasos de diámetro mayor o igual de 3 mm 1-5. Sin embargo, los vasos menores de 3 mm suponen casi la mitad de las intervenciones coronarias y son una de las principales limitaciones a la expansión del uso del stent intracoronario 6. Estudios previos han demostrado una mayor tasa de reestenosis angiográfica para vasos pequeños 7,8. Las mejoras en las características técnicas de los stents, el uso de dilatación a altas presiones, los ultrasonidos intracoronarios y el tratamiento antiagregante han hecho que el campo de aplicación de estos dispositivos se haya ampliado progresivamente a los vasos pequeños, haciendo necesaria una revisión de esta relativa contraindicación. Aunque en un principio los seguimientos fueron angiográficos, en los últimos años, ante la disociación entre el pronóstico clínico y angiográfico, se ha hecho mayor hincapié en el estudio de los eventos clínicos tras la revascularización coronaria con stents9.
Nuestro objetivo fue comparar los resultados clínicos a corto y largo plazo del implante de stents en arterias coronarias menores de 3 mm con respecto a los obtenidos en coronarias mayores o iguales de 3 mm, sobre una población no seleccionada, con inflado a altas presiones y tratamiento antiagregante post- stent. PACIENTES Y MÉTODOS
Población de estudio
Se estudiaron 234 pacientes consecutivos, en los que se revascularizaron 279 lesiones con el implante de 300 stents, desde mayo de 1995 a mayo de 1997. Todas las características clínicas, angiográficas y del procedimiento fueron obtenidas en el momento del implante del stent. Según el protocolo, se administraron 100 μg de nitroglicerina intracoronaria con anterioridad a la filmación de los angiogramas basales. El tamaño del vaso fue medido en el segmento de máximo diámetro, mediante análisis visual, y las lesiones diana fueron clasificadas como localizadas en vasos < 3 o >= 3 mm. Un total de 79 lesiones localizadas en vasos < 3 mm, correspondientes a 67 pacientes, fueron revascularizadas con el implante de 84 stents. Los pacientes con éxito del procedimiento al alta hospitalaria fueron susceptibles de ser seguidos a largo plazo (n = 218, 93,2%). Hubo dos pérdidas para el seguimiento, con lo que 216 pacientes (268 stents en 253 lesiones) fueron seguidos durante una media de 17,6 ± 10 meses (mediana de 15,2 meses; los percentiles 25 y 75 fueron 10,0 y 25,8 meses, respectivamente).
Procedimiento de implante
Se implantaron 300 stents (un 27,7% de Palmaz-Schatz, Johnson & Johnson; un 23,6% NIR, SciMed; un 21,7% Multilink, ACS; un 13,1% de Wiktor, Medtronic; un 10,5% de Gianturco-Roubin, Cook; un 2,2% Be-stent, Medtronic, y un 1,1% de Wall-stent, Schneider). El procedimiento fue guiado por el análisis visual de los angiogramas. Antes del implante del stent se realizó una angioplastia convencional con balón de la lesión. Las indicaciones del implante fueron: electivo en el 67%; por resultado subóptimo en el 20%, y por amenaza u oclusión aguda, en el 13%. Tras la liberación inicial del stent, su expansión final fue alcanzada con el uso de dilatación a altas presiones (15,58 ± 2,25 atm). Se administró un bolo de 10.000 U tras la inserción del introductor femoral, con bolos posteriores de 5.000 U para mantener un tiempo de coagulación activado mayor de 300 s. Tras finalizar el procedimiento no se administró más heparina y el introductor fue retirado a las 6 y 8 h posteriores.
Tratamiento postimplante
Todos los pacientes recibieron tratamiento antiagregante combinado con aspirina (300 mg una vez al día) y ticlopidina (250 mg dos veces al día). La administración de aspirina se inició al menos 24 h antes del procedimiento y se continuó de manera indefinida. La ticlopidina fue administrada inmediatamente tras el procedimiento y se continuó durante 4 semanas.
Definiciones
Se definió como «éxito» del procedimiento a la consecución de un implante óptimo del stent (estenosis residual menor del 30%) junto a la ausencia de eventos clínicos mayores durante la estancia hospitalaria (muerte, infarto agudo de miocardio o necesidad de una nueva revascularización quirúrgica o percutánea de la lesión). La trombosis subaguda fue definida como la oclusión trombótica del stent, documentada angiográficamente, con flujo grado TIMI 0-I, ocurrida después de las primeras 24 h. Se produjo revascularización de la lesión diana (RLD) ante la necesidad de un nuevo procedimiento de revascularización (percutáneo o quirúrgico) del segmento coronario con stent, realizado en presencia de reestenosis angiográfica (estenosis > 50%) y síntomas o signos de isquemia miocárdica. La muerte se definió como fallecimiento por cualquier causa, y el infarto agudo de miocardio (IAM), por la presencia de al menos dos de los siguientes: síntomas compatibles, evidencia electrocardiográfica (cambios persistentes en el segmento ST y/o criterios de onda Q patológica) o cambios enzimáticos (incremento de los niveles de creatinfosfocinasa por encima del doble del valor normal asociado a un aumento en la isoenzima MB).
Eventos mayores y seguimiento clínico
A corto plazo se valoró la consecución de éxito del procedimiento en el momento del alta hospitalaria y la aparición de trombosis subaguda del stent. A largo plazo, se valoraron la necesidad de revascularización de la lesión diana y un objetivo combinado de muerte, IAM y RLD. En el análisis de los eventos a largo plazo se excluyeron los pacientes con eventos a corto plazo, dado que la fisiopatología de ambos tipos es distinta. Tras el alta hospitalaria, los pacientes fueron seguidos en revisiones periódicas en la consulta hospitalaria, incluyendo anamnesis, exploración física y electrocardiograma. El protocolo de estudio incluyó una prueba de esfuerzo para valorar la isquemia entre los primeros 6 y 12 meses, que pudo ser realizada a un 65% de pacientes. Ante la sospecha clínica de reestenosis por la presencia de síntomas o una prueba de esfuerzo positiva para isquemia, se realizó una coronariografía.
Análisis estadístico
Basalmente, las comparaciones entre ambos grupos de estudio para variables continuas se realizaron mediante el test de la t de Student y para variables discretas mediante el análisis de la χ >2. El estudio de eventos se realizó según el análisis por «lesión». En el estudio de eventos a corto plazo, la comparación entre ambos grupos se realizó mediante el análisis de χ >2. El estudio de eventos a largo plazo se llevó a cabo mediante el análisis de supervivencia de Kaplan-Meier y la comparación entre ambos grupos mediante el test de rangos logarítmicos. El valor predictivo independiente del tamaño del vaso para la aparición de RLD fue determinado mediante el análisis de regresión múltiple de Cox y el ajuste por otras variables descritas previamente como predictoras de reestenosis.
Se aceptaron con significación estadística todos los valores de p < 0,05. El análisis estadístico fue realizado con el programa informático SPSS (versión 7.0, bSPSS Inc.). RESULTADOS
Características basales
Clínicamente, las características basales fueron similares en ambos grupos (tabla 1). Según la angiografía, la mayoría de los implantes en vasos pequeños se realizaron en la arteria descendente anterior, siendo menos frecuentes en la coronaria derecha; así mismo, la localización en el ostium coronario fue más habitual que en vasos mayores, siendo el resto de características lesionales similares (tabla 2). El diámetro final alcanzado con la sobredilatación a altas presiones se situó por encima de 3 mm, reflejando una expansión agresiva asociada con menores tasas de estenosis residual visible que en los vasos mayores. El resto de características técnicas fueron similares (tabla 3).
Resultados a corto plazo
De las 79 lesiones revascularizadas en vasos pequeños, en tres (3,8%) el resultado angiográfico del procedimiento fue subóptimo y en dos (2,5%) se asoció a eventos clínicos intrahospitalarios, con una tasa de éxito del procedimiento al alta hospitalaria del 93,7%. De las 200 lesiones en vasos de diámetro >= 3 mm, en siete (3,5%) el resultado angiográfico fue sub-óptimo y en seis (3%) se asoció a eventos clínicos, con una tasa de éxito del procedimiento del 93,5%. Por tanto, la tasa de éxito del procedimiento en el momento del alta hospitalaria fue similar para ambos grupos de lesiones (p = 0,87; el 93,7 frente al 93,5%).
Sin embargo, la incidencia de trombosis subaguda fue significativamente superior en los vasos pequeños; los tres únicos episodios de trombosis subaguda ocurrieron en vasos < 3 mm, todos asociados a IAM no fatal, lo que supuso una incidencia del 3,8% frente al 0% en vasos >= 3 mm (p = 0,006).
Resultados a largo plazo
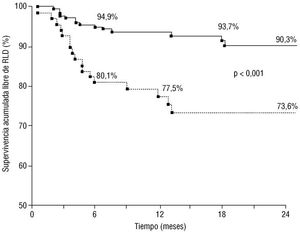
En la figura 1 se expone la curva de Kaplan-Meier de supervivencia libre de RLD para ambos tipos de vasos. A largo plazo, la supervivencia libre de RLD fue significativamente inferior para lesiones localizadas en vasos < 3 mm, diferencia que se hizo significativa al cabo de los primeros 6 meses. La supervivencia acumulada libre de RLD para vasos < 3 y >= 3 mm fue del 80,1 frente al 94,9% a los 6 meses, del 77,5 frente al 93,7% a los 12 meses y del 73,6 frente al 90,3% a los 24 meses, no ocurriendo ningún acontecimiento después de los primeros 18 meses. El análisis de regresión múltiple de Cox (tabla 4) puso de manifiesto que, tras ajustar por variables descritas como predictoras de reestenosis en otros estudios, el diámetro de referencia menor de 3 mm fue un predictor independiente de RLD a largo plazo, con una hazard ratio de 3,2 (IC del 95%, 1,6-6,7). Factores de riesgo independientes fueron también el ser una lesión reestenótica y la presencia de estenosis residual visible, cuya presencia en los vasos pequeños se asoció a supervivencias especialmente cortas (el 56 y el 43%, respectivamente). No fueron predictores ni la diabetes mellitus, ni la longitud de la lesión ni el numero de stents implantados por lesión.
Fig. 1. Curvas de Kaplan-Meier de supervivencia acumulada libre de revascularización de la lesión diana (RLD), para lesiones localizadas en vasos con diámetro de referencia < 3 mm (línea discontinua) y >= 3 mm (línea continua).
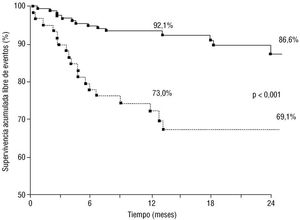
El objetivo combinado de RLD, muerte o IAM también fue significativamente mayor para pacientes con implantes en vasos menores de 3 mm (fig. 2). La supervivencia acumulada libre de eventos para vasos < 3 y >= 3 mm fue del 73,0 frente al 92,1% a un año y del 69,1 frente al 86,6% a 2 años. Dicha diferencia fue debida fundamentalmente a la mayor necesidad de revascularización de la lesión diana (RLD), sin que a los 2 años hubiese diferencias significativas en la mortalidad (el 4,6 frente al 3,8%; p = 0,7) o IAM (el 2,9 frente al 1,1%; p = 0,3).
Fig. 2. Curvas de Kaplan-Meier de supervivencia acumulada libre de eventos (muerte, infarto de miocardio y revascularización de la lesión diana), para lesiones localizadas en vasos con diámetro de referencia < 3 mm (línea discontinua) y >= 3 mm (línea continua).
DISCUSIÓN
Nuestro seguimiento demostró que, si bien el implante de stents en vasos menores de 3 mm se acompaña de un éxito inicial, en el momento del alta hospitalaria, similar al de vasos mayores, la incidencia de trombosis subaguda y la de reestenosis clínica a largo plazo, definida como necesidad de revascularización de la lesión diana, son significativamente superiores en vasos pequeños, a pesar del uso de dilatación a altas presiones y tratamiento antiagregante posterior al procedimiento.
La expansión del stent a altas presiones, junto al tratamiento combinado con ticlopidina y aspirina, han permitido reducir la incidencia de trombosis subaguda a tasas por debajo del 1,5% 10,11. Estudios llevados a cabo en la era anticoagulante pusieron de manifiesto elevadas tasas de trombosis para los implantes efectuados en vasos pequeños 12,13. Aunque existen pocos datos de predictores de trombosis en poblaciones con dilatación a altas presiones y tratamiento antiagregante, el registro francés 14 publicó una incidencia de trombosis del 10% en vasos <= 2,5 mm, frente al 1,5% en vasos >= 3 mm, mientras que Akiyama et al 15 encontraron tasas similares para vasos < 3 mm (1,5%) y >= 3 mm (1,4%), explicando esta mejora en sus resultados por una expansión agresiva del stent en vasos pequeños. En esta última línea estarían un subanálisis del estudio STARS 16 y Moussa et al 17, que no encuentran mayores tasas en vasos pequeños. Sin embargo, el análisis realizado sobre la población del estudio ISAR 18 identificó la presencia de una disección residual, de trombos intracoronarios y los vasos < 3,2 mm como predictores independientes de trombosis del stent. Finalmente, nuestro análisis evidencia una elevada incidencia de trombosis subaguda en vasos pequeños (el 3,8 frente al 0%), a pesar del uso de antiagregación con ticlopidina y aspirina y la sobredilatación con altas presiones. Al igual que en el trabajo de Akiyama 15, en nuestra población de vasos pequeños también realizamos una expansión agresiva del stent reflejada en el diámetro final de inflado alcanzado, a pesar de lo cual la trombosis subaguda fue más frecuente. Si bien las discordancias entre estudios y el reducido número de eventos dificultan las conclusiones, los vasos pequeños parecen comportarse, aun en las condiciones actuales de implante, como un estímulo protrombótico, ante el que debemos asegurar la expansión del dispositivo y el mejor flujo final posible.
Seguimientos realizados tras angioplastia con balón han demostrado una relación inversa entre el tamaño del vaso y la severidad de la reestenosis angiográfica 19,20. Tras el implante de stents, la influencia del diámetro del vaso en las tasas de reestenosis no se ha aclarado totalmente y el interés por esta circunstancia ha ido en aumento en los últimos años. En la era anticoagulante, diversos autores encontraron una mayor incidencia de reestenosis angiográfica en estos vasos 7,8,21 pero otros no hallaron diferencias 22. Elezi et al 8, en una serie amplia que incluía un único tipo de stent de Palmaz-Schatz con dilatación a bajas presiones y anticoagulación en la gran mayoría de implantes, encontraron tasas de reestenosis angiográfica del 38,6% para vasos < 2,8 mm, del 20,4% para vasos > 3,2 mm y del 28,4% para el grupo con diámetro intermedio. Akiyama et al 15, usando antiagregación y altas presiones, también hallaron tasas de reestenosis angiográfica a los 6 meses significativamente superiores: del 32,6% para vasos < 3 mm y del 19,9% para vasos >= 3 mm. Frente a este trabajo, nosotros estudiamos una definición puramente clínica del proceso de reestenosis y las posibles diferencias entre ambos grupos de implantes, encontrando una tasa acumulada de RLD diana casi 3 veces superior en vasos < 3 mm (el 26,4 frente al 9,7% a 2 años). Además, el tamaño del vaso fue un predictor independiente de reestenosis clínica, junto a la estenosis residual y el ser una lesión reestenótica. Serruys et al 23 demostraron, tras un análisis multivariado, que el tamaño del vaso y la estenosis residual aportan más información como predictores de reestenosis que el diámetro mínimo luminal por sí solo, cuya inclusión como variable puede explicar la pérdida de significación independiente del tamaño del vaso en algunos trabajos.
A pesar de ello, debemos ser cuidadosos en la extracción de conclusiones sobre estos peores resultados clínicos y angiográficos en vasos pequeños. El grupo STRESS 24, tras aleatorizar a 331 pacientes con lesiones en vasos menores de 3 mm a implantación de stent frente a angioplastia con balón, encontró que el stent se asociaba de forma significativa a mayores tasas de éxito del procedimiento y a una reducción relativa del 38% en la reestenosis angiográfica y de 39% en la RLD. Por tanto, el beneficio del stent frente a la angioplastia con balón es aplicable también a vasos menores de 3 mm, aunque de nuestro trabajo se desprende que también debemos esperar mayores tasas de trombosis subaguda y RLD que en vasos mayores. Si tenemos en cuenta la elevada expansión del intervencionismo hacia este tipo de vasos, hay que pensar que cualquier intervención que nos ayude a prevenir los fenómenos de trombosis o reestenosis pueden tener su máximo impacto sobre vasos pequeños. Así, la optimización del implante, la adecuada expansión del stent con la menor estenosis residual posible, el apoyo de ultrasonidos intracoronarios e, inclusive, las nuevas estrategias farmacológicas asociadas pueden encontrar un mayor campo de aplicación en vasos pequeños.
Limitaciones
La principal limitación del estudio es la falta de cuantificación angiográfica del tamaño del vaso, ya que su apreciación visual puede dar lugar a la inclusión de algunos vasos considerados pequeños que pudieran no serlo tanto, con lo que los resultados podrían quedar artefactados. Sin embargo, la mayoría de procedimientos intervencionistas en la rutina diaria se guían primordialmente por el análisis visual de los angiogramas durante dichos procedimientos, como se realizó en este estudio, y con ello aportamos datos más fácilmente extrapolables a otros centros que todavía no disponen de cuantificación angiográfica. Aunque la no cuantificación, junto al diseño observacional, pudieran haber supuesto una merma de poder estadístico para encontrar diferencias significativas entre subgrupos, esto no ocurrió, y no fue una limitación a la hora de concluir la existencia de un peor pronóstico en términos de mayor necesidad de RLD a largo plazo para los vasos pequeños, establecidos por esta práctica rutinaria de valoración visual. El establecimiento de una valoración cualitativa con el punto de corte en vasos >= 3 o < 3 mm se debió a que esta división ha sido la más estudiada y controvertida en la bibliografía previa 1-4,6,11,15,23. CONCLUSIÓN
En las condiciones actuales, el procedimiento de implante de stents en vasos menores de 3 mm puede ser realizado con similares tasas de éxito inicial que en vasos mayores; sin embargo, debemos esperar tasas más altas de trombosis subaguda y reestenosis clínica en el seguimiento, por lo que se hace necesario un esfuerzo por optimizar al máximo dichos implantes.
El implante de stents intracoronarios fue inicialmente aprobado en vasos de diámetro mayor o igual de 3 mm 1-5. Sin embargo, los vasos menores de 3 mm suponen casi la mitad de las intervenciones coronarias y son una de las principales limitaciones a la expansión del uso del stent intracoronario 6. Estudios previos han demostrado una mayor tasa de reestenosis angiográfica para vasos pequeños 7,8. Las mejoras en las características técnicas de los stents, el uso de dilatación a altas presiones, los ultrasonidos intracoronarios y el tratamiento antiagregante han hecho que el campo de aplicación de estos dispositivos se haya ampliado progresivamente a los vasos pequeños, haciendo necesaria una revisión de esta relativa contraindicación. Aunque en un principio los seguimientos fueron angiográficos, en los últimos años, ante la disociación entre el pronóstico clínico y angiográfico, se ha hecho mayor hincapié en el estudio de los eventos clínicos tras la revascularización coronaria con stents9.
Nuestro objetivo fue comparar los resultados clínicos a corto y largo plazo del implante de stents en arterias coronarias menores de 3 mm con respecto a los obtenidos en coronarias mayores o iguales de 3 mm, sobre una población no seleccionada, con inflado a altas presiones y tratamiento antiagregante post- stent. PACIENTES Y MÉTODOS
Población de estudio
Se estudiaron 234 pacientes consecutivos, en los que se revascularizaron 279 lesiones con el implante de 300 stents, desde mayo de 1995 a mayo de 1997. Todas las características clínicas, angiográficas y del procedimiento fueron obtenidas en el momento del implante del stent. Según el protocolo, se administraron 100 μg de nitroglicerina intracoronaria con anterioridad a la filmación de los angiogramas basales. El tamaño del vaso fue medido en el segmento de máximo diámetro, mediante análisis visual, y las lesiones diana fueron clasificadas como localizadas en vasos < 3 o >= 3 mm. Un total de 79 lesiones localizadas en vasos < 3 mm, correspondientes a 67 pacientes, fueron revascularizadas con el implante de 84 stents. Los pacientes con éxito del procedimiento al alta hospitalaria fueron susceptibles de ser seguidos a largo plazo (n = 218, 93,2%). Hubo dos pérdidas para el seguimiento, con lo que 216 pacientes (268 stents en 253 lesiones) fueron seguidos durante una media de 17,6 ± 10 meses (mediana de 15,2 meses; los percentiles 25 y 75 fueron 10,0 y 25,8 meses, respectivamente).
Procedimiento de implante
Se implantaron 300 stents (un 27,7% de Palmaz-Schatz, Johnson & Johnson; un 23,6% NIR, SciMed; un 21,7% Multilink, ACS; un 13,1% de Wiktor, Medtronic; un 10,5% de Gianturco-Roubin, Cook; un 2,2% Be-stent, Medtronic, y un 1,1% de Wall-stent, Schneider). El procedimiento fue guiado por el análisis visual de los angiogramas. Antes del implante del stent se realizó una angioplastia convencional con balón de la lesión. Las indicaciones del implante fueron: electivo en el 67%; por resultado subóptimo en el 20%, y por amenaza u oclusión aguda, en el 13%. Tras la liberación inicial del stent, su expansión final fue alcanzada con el uso de dilatación a altas presiones (15,58 ± 2,25 atm). Se administró un bolo de 10.000 U tras la inserción del introductor femoral, con bolos posteriores de 5.000 U para mantener un tiempo de coagulación activado mayor de 300 s. Tras finalizar el procedimiento no se administró más heparina y el introductor fue retirado a las 6 y 8 h posteriores.
Tratamiento postimplante
Todos los pacientes recibieron tratamiento antiagregante combinado con aspirina (300 mg una vez al día) y ticlopidina (250 mg dos veces al día). La administración de aspirina se inició al menos 24 h antes del procedimiento y se continuó de manera indefinida. La ticlopidina fue administrada inmediatamente tras el procedimiento y se continuó durante 4 semanas.
Definiciones
Se definió como «éxito» del procedimiento a la consecución de un implante óptimo del stent (estenosis residual menor del 30%) junto a la ausencia de eventos clínicos mayores durante la estancia hospitalaria (muerte, infarto agudo de miocardio o necesidad de una nueva revascularización quirúrgica o percutánea de la lesión). La trombosis subaguda fue definida como la oclusión trombótica del stent, documentada angiográficamente, con flujo grado TIMI 0-I, ocurrida después de las primeras 24 h. Se produjo revascularización de la lesión diana (RLD) ante la necesidad de un nuevo procedimiento de revascularización (percutáneo o quirúrgico) del segmento coronario con stent, realizado en presencia de reestenosis angiográfica (estenosis > 50%) y síntomas o signos de isquemia miocárdica. La muerte se definió como fallecimiento por cualquier causa, y el infarto agudo de miocardio (IAM), por la presencia de al menos dos de los siguientes: síntomas compatibles, evidencia electrocardiográfica (cambios persistentes en el segmento ST y/o criterios de onda Q patológica) o cambios enzimáticos (incremento de los niveles de creatinfosfocinasa por encima del doble del valor normal asociado a un aumento en la isoenzima MB).
Eventos mayores y seguimiento clínico
A corto plazo se valoró la consecución de éxito del procedimiento en el momento del alta hospitalaria y la aparición de trombosis subaguda del stent. A largo plazo, se valoraron la necesidad de revascularización de la lesión diana y un objetivo combinado de muerte, IAM y RLD. En el análisis de los eventos a largo plazo se excluyeron los pacientes con eventos a corto plazo, dado que la fisiopatología de ambos tipos es distinta. Tras el alta hospitalaria, los pacientes fueron seguidos en revisiones periódicas en la consulta hospitalaria, incluyendo anamnesis, exploración física y electrocardiograma. El protocolo de estudio incluyó una prueba de esfuerzo para valorar la isquemia entre los primeros 6 y 12 meses, que pudo ser realizada a un 65% de pacientes. Ante la sospecha clínica de reestenosis por la presencia de síntomas o una prueba de esfuerzo positiva para isquemia, se realizó una coronariografía.
Análisis estadístico
Basalmente, las comparaciones entre ambos grupos de estudio para variables continuas se realizaron mediante el test de la t de Student y para variables discretas mediante el análisis de la χ >2. El estudio de eventos se realizó según el análisis por «lesión». En el estudio de eventos a corto plazo, la comparación entre ambos grupos se realizó mediante el análisis de χ >2. El estudio de eventos a largo plazo se llevó a cabo mediante el análisis de supervivencia de Kaplan-Meier y la comparación entre ambos grupos mediante el test de rangos logarítmicos. El valor predictivo independiente del tamaño del vaso para la aparición de RLD fue determinado mediante el análisis de regresión múltiple de Cox y el ajuste por otras variables descritas previamente como predictoras de reestenosis.
Se aceptaron con significación estadística todos los valores de p < 0,05. El análisis estadístico fue realizado con el programa informático SPSS (versión 7.0, bSPSS Inc.). RESULTADOS
Características basales
Clínicamente, las características basales fueron similares en ambos grupos (tabla 1). Según la angiografía, la mayoría de los implantes en vasos pequeños se realizaron en la arteria descendente anterior, siendo menos frecuentes en la coronaria derecha; así mismo, la localización en el ostium coronario fue más habitual que en vasos mayores, siendo el resto de características lesionales similares (tabla 2). El diámetro final alcanzado con la sobredilatación a altas presiones se situó por encima de 3 mm, reflejando una expansión agresiva asociada con menores tasas de estenosis residual visible que en los vasos mayores. El resto de características técnicas fueron similares (tabla 3).
Resultados a corto plazo
De las 79 lesiones revascularizadas en vasos pequeños, en tres (3,8%) el resultado angiográfico del procedimiento fue subóptimo y en dos (2,5%) se asoció a eventos clínicos intrahospitalarios, con una tasa de éxito del procedimiento al alta hospitalaria del 93,7%. De las 200 lesiones en vasos de diámetro >= 3 mm, en siete (3,5%) el resultado angiográfico fue sub-óptimo y en seis (3%) se asoció a eventos clínicos, con una tasa de éxito del procedimiento del 93,5%. Por tanto, la tasa de éxito del procedimiento en el momento del alta hospitalaria fue similar para ambos grupos de lesiones (p = 0,87; el 93,7 frente al 93,5%).
Sin embargo, la incidencia de trombosis subaguda fue significativamente superior en los vasos pequeños; los tres únicos episodios de trombosis subaguda ocurrieron en vasos < 3 mm, todos asociados a IAM no fatal, lo que supuso una incidencia del 3,8% frente al 0% en vasos >= 3 mm (p = 0,006).
Resultados a largo plazo
En la figura 1 se expone la curva de Kaplan-Meier de supervivencia libre de RLD para ambos tipos de vasos. A largo plazo, la supervivencia libre de RLD fue significativamente inferior para lesiones localizadas en vasos < 3 mm, diferencia que se hizo significativa al cabo de los primeros 6 meses. La supervivencia acumulada libre de RLD para vasos < 3 y >= 3 mm fue del 80,1 frente al 94,9% a los 6 meses, del 77,5 frente al 93,7% a los 12 meses y del 73,6 frente al 90,3% a los 24 meses, no ocurriendo ningún acontecimiento después de los primeros 18 meses. El análisis de regresión múltiple de Cox (tabla 4) puso de manifiesto que, tras ajustar por variables descritas como predictoras de reestenosis en otros estudios, el diámetro de referencia menor de 3 mm fue un predictor independiente de RLD a largo plazo, con una hazard ratio de 3,2 (IC del 95%, 1,6-6,7). Factores de riesgo independientes fueron también el ser una lesión reestenótica y la presencia de estenosis residual visible, cuya presencia en los vasos pequeños se asoció a supervivencias especialmente cortas (el 56 y el 43%, respectivamente). No fueron predictores ni la diabetes mellitus, ni la longitud de la lesión ni el numero de stents implantados por lesión.
Fig. 1. Curvas de Kaplan-Meier de supervivencia acumulada libre de revascularización de la lesión diana (RLD), para lesiones localizadas en vasos con diámetro de referencia < 3 mm (línea discontinua) y >= 3 mm (línea continua).
El objetivo combinado de RLD, muerte o IAM también fue significativamente mayor para pacientes con implantes en vasos menores de 3 mm (fig. 2). La supervivencia acumulada libre de eventos para vasos < 3 y >= 3 mm fue del 73,0 frente al 92,1% a un año y del 69,1 frente al 86,6% a 2 años. Dicha diferencia fue debida fundamentalmente a la mayor necesidad de revascularización de la lesión diana (RLD), sin que a los 2 años hubiese diferencias significativas en la mortalidad (el 4,6 frente al 3,8%; p = 0,7) o IAM (el 2,9 frente al 1,1%; p = 0,3).
Fig. 2. Curvas de Kaplan-Meier de supervivencia acumulada libre de eventos (muerte, infarto de miocardio y revascularización de la lesión diana), para lesiones localizadas en vasos con diámetro de referencia < 3 mm (línea discontinua) y >= 3 mm (línea continua).
DISCUSIÓN
Nuestro seguimiento demostró que, si bien el implante de stents en vasos menores de 3 mm se acompaña de un éxito inicial, en el momento del alta hospitalaria, similar al de vasos mayores, la incidencia de trombosis subaguda y la de reestenosis clínica a largo plazo, definida como necesidad de revascularización de la lesión diana, son significativamente superiores en vasos pequeños, a pesar del uso de dilatación a altas presiones y tratamiento antiagregante posterior al procedimiento.
La expansión del stent a altas presiones, junto al tratamiento combinado con ticlopidina y aspirina, han permitido reducir la incidencia de trombosis subaguda a tasas por debajo del 1,5% 10,11. Estudios llevados a cabo en la era anticoagulante pusieron de manifiesto elevadas tasas de trombosis para los implantes efectuados en vasos pequeños 12,13. Aunque existen pocos datos de predictores de trombosis en poblaciones con dilatación a altas presiones y tratamiento antiagregante, el registro francés 14 publicó una incidencia de trombosis del 10% en vasos <= 2,5 mm, frente al 1,5% en vasos >= 3 mm, mientras que Akiyama et al 15 encontraron tasas similares para vasos < 3 mm (1,5%) y >= 3 mm (1,4%), explicando esta mejora en sus resultados por una expansión agresiva del stent en vasos pequeños. En esta última línea estarían un subanálisis del estudio STARS 16 y Moussa et al 17, que no encuentran mayores tasas en vasos pequeños. Sin embargo, el análisis realizado sobre la población del estudio ISAR 18 identificó la presencia de una disección residual, de trombos intracoronarios y los vasos < 3,2 mm como predictores independientes de trombosis del stent. Finalmente, nuestro análisis evidencia una elevada incidencia de trombosis subaguda en vasos pequeños (el 3,8 frente al 0%), a pesar del uso de antiagregación con ticlopidina y aspirina y la sobredilatación con altas presiones. Al igual que en el trabajo de Akiyama 15, en nuestra población de vasos pequeños también realizamos una expansión agresiva del stent reflejada en el diámetro final de inflado alcanzado, a pesar de lo cual la trombosis subaguda fue más frecuente. Si bien las discordancias entre estudios y el reducido número de eventos dificultan las conclusiones, los vasos pequeños parecen comportarse, aun en las condiciones actuales de implante, como un estímulo protrombótico, ante el que debemos asegurar la expansión del dispositivo y el mejor flujo final posible.
Seguimientos realizados tras angioplastia con balón han demostrado una relación inversa entre el tamaño del vaso y la severidad de la reestenosis angiográfica 19,20. Tras el implante de stents, la influencia del diámetro del vaso en las tasas de reestenosis no se ha aclarado totalmente y el interés por esta circunstancia ha ido en aumento en los últimos años. En la era anticoagulante, diversos autores encontraron una mayor incidencia de reestenosis angiográfica en estos vasos 7,8,21 pero otros no hallaron diferencias 22. Elezi et al 8, en una serie amplia que incluía un único tipo de stent de Palmaz-Schatz con dilatación a bajas presiones y anticoagulación en la gran mayoría de implantes, encontraron tasas de reestenosis angiográfica del 38,6% para vasos < 2,8 mm, del 20,4% para vasos > 3,2 mm y del 28,4% para el grupo con diámetro intermedio. Akiyama et al 15, usando antiagregación y altas presiones, también hallaron tasas de reestenosis angiográfica a los 6 meses significativamente superiores: del 32,6% para vasos < 3 mm y del 19,9% para vasos >= 3 mm. Frente a este trabajo, nosotros estudiamos una definición puramente clínica del proceso de reestenosis y las posibles diferencias entre ambos grupos de implantes, encontrando una tasa acumulada de RLD diana casi 3 veces superior en vasos < 3 mm (el 26,4 frente al 9,7% a 2 años). Además, el tamaño del vaso fue un predictor independiente de reestenosis clínica, junto a la estenosis residual y el ser una lesión reestenótica. Serruys et al 23 demostraron, tras un análisis multivariado, que el tamaño del vaso y la estenosis residual aportan más información como predictores de reestenosis que el diámetro mínimo luminal por sí solo, cuya inclusión como variable puede explicar la pérdida de significación independiente del tamaño del vaso en algunos trabajos.
A pesar de ello, debemos ser cuidadosos en la extracción de conclusiones sobre estos peores resultados clínicos y angiográficos en vasos pequeños. El grupo STRESS 24, tras aleatorizar a 331 pacientes con lesiones en vasos menores de 3 mm a implantación de stent frente a angioplastia con balón, encontró que el stent se asociaba de forma significativa a mayores tasas de éxito del procedimiento y a una reducción relativa del 38% en la reestenosis angiográfica y de 39% en la RLD. Por tanto, el beneficio del stent frente a la angioplastia con balón es aplicable también a vasos menores de 3 mm, aunque de nuestro trabajo se desprende que también debemos esperar mayores tasas de trombosis subaguda y RLD que en vasos mayores. Si tenemos en cuenta la elevada expansión del intervencionismo hacia este tipo de vasos, hay que pensar que cualquier intervención que nos ayude a prevenir los fenómenos de trombosis o reestenosis pueden tener su máximo impacto sobre vasos pequeños. Así, la optimización del implante, la adecuada expansión del stent con la menor estenosis residual posible, el apoyo de ultrasonidos intracoronarios e, inclusive, las nuevas estrategias farmacológicas asociadas pueden encontrar un mayor campo de aplicación en vasos pequeños.
Limitaciones
La principal limitación del estudio es la falta de cuantificación angiográfica del tamaño del vaso, ya que su apreciación visual puede dar lugar a la inclusión de algunos vasos considerados pequeños que pudieran no serlo tanto, con lo que los resultados podrían quedar artefactados. Sin embargo, la mayoría de procedimientos intervencionistas en la rutina diaria se guían primordialmente por el análisis visual de los angiogramas durante dichos procedimientos, como se realizó en este estudio, y con ello aportamos datos más fácilmente extrapolables a otros centros que todavía no disponen de cuantificación angiográfica. Aunque la no cuantificación, junto al diseño observacional, pudieran haber supuesto una merma de poder estadístico para encontrar diferencias significativas entre subgrupos, esto no ocurrió, y no fue una limitación a la hora de concluir la existencia de un peor pronóstico en términos de mayor necesidad de RLD a largo plazo para los vasos pequeños, establecidos por esta práctica rutinaria de valoración visual. El establecimiento de una valoración cualitativa con el punto de corte en vasos >= 3 o < 3 mm se debió a que esta división ha sido la más estudiada y controvertida en la bibliografía previa 1-4,6,11,15,23. CONCLUSIÓN
En las condiciones actuales, el procedimiento de implante de stents en vasos menores de 3 mm puede ser realizado con similares tasas de éxito inicial que en vasos mayores; sin embargo, debemos esperar tasas más altas de trombosis subaguda y reestenosis clínica en el seguimiento, por lo que se hace necesario un esfuerzo por optimizar al máximo dichos implantes.
Bibliografía
[1]
A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. N Engl J Med 1994; 331: 489-495.
[2]
A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. N Engl J Med 1994; 331: 496-501.
[3]
Coronary artery stents: a new era in interventional cardiology. En: Topol EJ, editor. Textbook of interventional cardiology (2.
[4]
ACC Expert Consensus Document: coronary artery stents. J Am Coll Cardiol 1996; 28: 782-794.
[5]
Coronary angioplasty: always a stent in arteries larger than 2.5 mm? The arguments against. Rev Esp Cardiol 1999; 52: 79-84.
[6]
Clinical and angiographic determinants of primary coronary angioplasty success. J Am Coll Cardiol 1991; 17: 22-28.
[7]
Clinical and angiographic outcome of elective stent implantation in small coronary vessels: an analysis of the BENESTENT trial. Semin Interv Cardiol 1996; 1: 255-262.
[8]
Vessel size and long-term outcome after coronary stent placement. Circulation 1998; 98: 1875-1880.
[9]
Our preoccupation with coronary luminology. Circulation 1995; 92: 1333-1342.
[10]
A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary artery stents. N Engl J Med 1996; 334: 1084-1089.
[11]
A clinical trial comparing three antithrombotic-drug regimens after coronary-artery stenting. N Engl J Med 1998; 339: 1665-1671.
[12]
Coronary stent thrombosis. En: Hermann HC, Hirshfeld JW, editores. Clinical use of the Palmaz-Schatz intracoronary stent. Mount Kisco (NY): Futura, 1993; 125-136.
[13]
Predictors of thrombotic complications after placement of the flexible coil stent. Am J Cardiol 1994; 73: 1216-1221.
[14]
Intracoronary stent implantation without ultrasound guidance and with replacement of conventional anticoagulation by antiplatelet therapy: 30-day clinical outcome of the French Registry Study. Circulation 1996; 94: 1519-1527.
[15]
Angiographic and clinical outcome following coronary stenting of small vessels. J Am Coll Cardiol 1998; 32: 1610-1618.
[16]
Subacute stent thrombosis in the era of intravascular ultrasound-guided coronary stenting without anticoagulation: frequency, predictors and clinical outcome. J Am Coll Cardiol 1997; 29: 6-12.
[17]
Characteristics and predictors of stent thrombosis from the stent anticoagulation regimen study (STARS) [resumen]. Circulation 1997; 96: 3655.
[18]
Major benefit from antiplatelet therapy for patients at high risk for adverse cardiac events after coronary Palmaz-Schatz stent placement. Analysis of a prospective Risk stratification protocol in the Intracoronary Stenting and Antithrombotic Regimen (ISAR) Trial. Circulation 1997; 95: 2015-2021.
[19]
Restenosis after coronary angioplasty: a multivariate statistical model to relate lesion and procedure variables to restenosis. J Am Coll Cardiol 1991; 18: 647-656.
[20]
Influence of coronary vessel size on renarrowing process and late angiographic outcome after successful balloon angioplasty. Circulation 1994; 90: 1239-1251.
[21]
Predictors of restenosis after coronary stent implantation. J Am Coll Cardiol 1998; 31: 1291-1298.
[22]
Predictive factors of restenosis after coronary stent placement. J Am Coll Cardiol 1997; 30: 1428-1436.
[23]
Periprocedural quantitative coronary angiography following Palmaz-Schatz stent implantation predicts restenosis rate at 6 months: result of a meta-analysis of BENESTENT-I, BENESTENT-II and MUSIC [resumen]. J Am Coll Cardiol 1998; 31 (Supl A): 64.
[24]
Efficacy of coronary stenting versus balloon angioplasty in small coronary arteries. J Am Coll Cardiol 1998; 31: 307-311.