Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNLa estenosis aórtica (EA) es la valvulopatía cardiaca más frecuente en los países desarrollados. Su prevalencia aumenta progresivamente con la edad, desde el 0,2% a los 50-59 años al 1,3% a los 60-69, el 3,9% a los 70-79 y hasta el 9,8% a los 80-89 años1. Se estima que en 2025 hasta 1,3 millones de pacientes en Europa y casi 1 millón en Estados Unidos sufrirán una EA sintomática grave, y que estas cifras se habrán doblado en 2050. El implante percutáneo de válvula aórtica (TAVI) ha revolucionado el tratamiento de la EA. Actualmente está disponible en 65 países y se han realizado más de 250.000 implantes, 70.000 de ellos en 2015, aunque se estima que esta cifra se cuadriplicará hasta superar los 280.000 en 2025. En Europa, la adopción del TAVI no está siendo uniforme en todos los países y el número de implantes oscila entre 10 y 160 por millón de habitantes. Esta diferencia está determinada principalmente por la política sanitaria y los criterios de financiación diferentes en cada país2. El TAVI actualmente es el tratamiento de elección para los pacientes con EA inoperable y la opción terapéutica preferida para los pacientes de alto riesgo.
En este artículo se comenta el estado actual de esta técnica y se presenta una predicción de lo que el TAVI puede deparar en el futuro.
INDICACIONES TERAPÉUTICAS BASADAS EN EL RIESGOSegún las guías de la American Heart Association/American College of Cardiology y la Sociedad Europea de Cardiología3,4, el TAVI tiene una indicación de clase I para los pacientes con EA grave que no sean candidatos a cirugía. La evidencia clínica procede de 2 estudios. En el ensayo PARTNER 1B, se observó una reducción absoluta del 20% en la mortalidad por cualquier causa, que pasó del 50,7% con el tratamiento médico estándar, incluida la valvuloplastia, al 30,7% con TAVI5. Es importante señalar que el efecto persistía tras 5 años de seguimiento, sin que hubiera indicio alguno de deterioro de la válvula. El Medtronic CoreValve US Extreme Risk Pivotal Trial obtuvo una tasa de mortalidad o ictus a 1 año en los pacientes tratados con la válvula CoreValve significativamente menor que la observada en el grupo tratado de manera conservadora en el ensayo PARTNER 1B y 5 series contemporáneas de valvuloplastia aórtica con balón6. Estos resultados condujeron a una rápida autorización de la Food and Drug Administration de Estados Unidos para el TAVI en este contexto clínico.
En los pacientes con EA grave y alto riesgo de muerte o complicaciones tras la cirugía, las guías recomiendan que el TAVI sea una alternativa a la sustitución valvular quirúrgica convencional (indicación de clase IIa). La evidencia clínica en la que se basa esta recomendación procede principalmente de 2 ensayos clínicos: el PARTNER 1A7 y el CoreValve High-Risk Study8. En el ensayo PARTNER 1A, el TAVI fue no inferior a la cirugía al cabo de 1 año, sin que se observaran diferencias en la mortalidad por cualquier causa. Nuevamente, estos resultados se mantuvieron los 5 años siguientes. Los resultados del CoreValve High-Risk Study demostraron, al cabo de 1 año, una menor mortalidad con TAVI que con cirugía. Durante el periodo de seguimiento de 3 años, se mantuvo el beneficio clínico y en los tratados con CoreValve se observó un gradiente aórtico medio inferior que con la cirugía, sin que hubiera datos de deterioro estructural de la válvula. Estos hallazgos indican que el TAVI autoexpandible podría ser el tratamiento de elección para los pacientes con EA grave y alto riesgo quirúrgico9.
Recientemente se han publicado 2 estudios sobre pacientes con riesgo intermedio (riesgo de mortalidad predicho por la escala de la Society of Thoracic Surgeons [STS] > 4%). En el ensayo PARTNER 2, el TAVI fue similar al reemplazo quirúrgico de válvula aórtica (RQVA) en lo que respecta al objetivo principal de muerte o ictus invalidante10. A los 2 años, la tasa de eventos fue del 19,3% en el grupo de TAVI y del 21,1% en el grupo de cirugía. Cuando se estudió por separado la cohorte de acceso transfemoral, el TAVI mostró una tasa de mortalidad por cualquier causa o ictus invalidante inferior a la de la cirugía. Sin embargo, no hubo diferencias significativas entre los grupos cuando el acceso era transtorácico. Recientemente se ha publicado un estudio con la válvula SAPIEN 3. En él se compara, por puntuación de propensión, a los pacientes de riesgo intermedio a los que se implantó una SAPIEN 3 con pacientes sometidos a RQVA11. Por lo que se refiere al objetivo principal combinado de mortalidad, ictus e insuficiencia aórtica moderada o grave, el TAVI fue no inferior (p < 0,0001) y también cumplió el criterio de superioridad (p < 0,0001) respecto al RQVA. Los autores indican que el TAVI podría ser la alternativa de tratamiento preferida para los pacientes en riesgo intermedio. Finalmente, está pendiente la publicación de los resultados del estudio SURTAVI (del que recientemente se ha completado la inclusión). Este estudio compara la seguridad y la eficacia de la válvula CoreValve con las del RQVA en pacientes con EA sintomática grave y riesgo quirúrgico intermedio, entendido como STS ≥ 3 y < 10. Además de la escala STS, se ha tenido en cuenta el estado clínico general del paciente y las comorbilidades no evaluadas por esa escala.
Teniendo en cuenta los datos ya publicados sobre los pacientes de riesgo intermedio y los esperables resultados positivos del estudio SURTAVI, se entiende que la recomendación favorable al uso de TAVI para los pacientes de riesgo intermedio dispondrá de más evidencia y aparecerá próximamente en futuras guías.
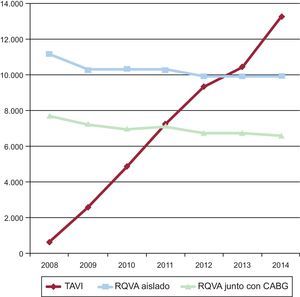
Un poco más allá de las indicaciones basadas en el riego, se sabe que el desempeño del TAVI fuera de las actuales indicaciones para pacientes de bajo riesgo constituye una parte significativa de la práctica clínica de hoy. La práctica clínica diaria ha superado al mundo académico y en el mundo se ha producido un documentado desplazamiento desde el tratamiento quirúrgico al tratamiento con TAVI de los pacientes con EA grave sintomática y edad avanzada. Así, por ejemplo, en Alemania (que tiene la tasa de penetración del TAVI más alta de Europa)12, se ha producido un aumento de 20 veces en la utilización de TAVI entre 2008 y 2014, y el número anual de intervenciones de TAVI ya había sobrepasado el de intervenciones solo de RQVA en 2013 (figura). La edad avanzada fue el motivo más frecuente (70,2%) de que se optara por TAVI en vez de RQVA, seguido del alto riesgo quirúrgico (53,9%). Tiene interés que la fragilidad del paciente (46,5%) y sus deseos (27,6%) fueran 2 motivos importantes para optar por la TAVI. De máxima importancia es el hecho de que la mortalidad intrahospitalaria después de TAVI se redujo del 10,4% en 2008 al 4,2% en 2014, y los pacientes de menor riesgo prequirúrgico fueron los que tuvieron la mortalidad más baja (2%). La estancia hospitalaria media se mantuvo inalterada por lo que respecta al RQVA, pero se redujo en el caso del TAVI con el paso del tiempo. En algunas series, más de una tercera parte de los pacientes tratados de manera programada con TAVI presentaban un riesgo intermedio o bajo, definido como STS ≤ 8%.
Tendencias en el implante percutáneo de válvula aórtica, el reemplazo quirúrgico de la válvula aórtica aislado y el realizado junto con CBAG en Alemania entre 2008 y 2014. CABG: cirugía de revascularización aortocoronaria; RQVA: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica. Adaptado de Eggebrecht et al12. con permiso de Europa Digital & Publishing.
El NOTION es un ensayo clínico aleatorizado en el que se comparó el TAVI con el RQVA en una cohorte de pacientes no seleccionados (all-comers)13. Se aleatorizó a 280 pacientes con EA grave y riesgo quirúrgico bajo o intermedio a tratamiento con TAVI autoexpandible o RQVA. Se consideró en bajo riesgo a la mayoría de los pacientes (81,8%) y la media del riesgo de mortalidad predicho fue del 3%. El objetivo principal combinado (muerte por cualquier causa, ictus o infarto de miocardio en el plazo de 1 año) y cada uno de sus componentes no mostraron diferencias estadísticamente significativas entre los 2 grupos (el 13,1 frente al 16,3% por lo que respecta al objetivo combinado). Los pacientes tratados con TAVI presentaron mejorías superiores del área efectiva del orificio valvular, pero necesitaron con mayor frecuencia el implante de marcapasos, sufrieron insuficiencia valvular aórtica en mayor medida y al año estaban en peor clase funcional de la New York Heart Association. Los pacientes tratados con RQVA sufrieron más hemorragias mayores o con peligro para la vida, así como shock cardiogénico, lesión renal aguda y fibrilación auricular de novo o agravamiento de la ya existente.
Actualmente, 2 estudios están analizando el papel del TAVI en comparación con el RQVA en el tratamiento de pacientes sintomáticos con EA grave y riesgo quirúrgico bajo. El ensayo sobre la seguridad y la eficacia de la válvula cardiaca percutánea SAPIEN 3 en pacientes con EA de bajo riesgo (PARTNER 3) se diseñó para establecer la seguridad y la eficacia de la válvula cardiaca percutánea Edwards-SAPIEN 3 en pacientes con EA grave sintomática que tienen un riesgo operatorio bajo para el RQVA. El equipo cardiaco debe acordar que el paciente tiene un riesgo de mortalidad operatoria < 2% (p. ej., riesgo de mortalidad predicho por STS < 4%). Este ensayo incluirá en la aleatorización a un total de 1.300 pacientes para TAVI o RQVA. En el ensayo Medtronic Transcatheter Aortic Valve Replacement in Low-Risk Patients se incluirá a 1.200 pacientes aleatorizados 1:1 al sistema CoreValve Evolut RR o RQVA. El objetivo del estudio es demostrar que la seguridad y la eficacia del sistema de TAVI de Medtronic, evaluadas mediante las tasas de mortalidad por cualquier causa o ictus invalidante a 2 años, son no inferiores a las del RQVA convencional en el tratamiento de la EA grave de pacientes con riesgo de mortalidad operatoria bajo para el RQVA. Entre los criterios de inclusión, está el acuerdo documentado del equipo cardiaco en cuanto a que el RQVA es de bajo riesgo, definido como un riesgo de mortalidad < 3% a los 30 días.
COMPLICACIONES DE LA INTERVENCIÓNPara que pueda ampliarse la indicación de TAVI a los pacientes de menos riesgo (generalmente más jóvenes), las tasas de complicaciones de la intervención deben ser las más bajas posibles. En este sentido, los posicionamientos del Valve Academic Research Consortium (VARC) constituyen un verdadero hito y se han convertido en el patrón empleado para referirse de modo uniforme a las complicaciones del procedimiento, lo que facilita su análisis. Las complicaciones más importantes de la intervención de TAVI son cerebrovasculares, vasculares, las anomalías de la conducción cardiaca y la insuficiencia aórtica (IA) residual.
Complicaciones cerebrovascularesAunque inicialmente el ictus o el accidente isquémico transitorio relacionados con el procedimiento y a los 30 días fueron más frecuentes tras TAVI que tras RQVA (el 5,5 frente al 2,4%; p = 0,04), esta diferencia se fue reduciendo gradualmente hasta desaparecer a los 5 años (el 14,7 frente al 15,9%). En los resultados más contemporáneos, obtenidos a los 2 años en el Registro de CoreValve de Estados Unidos (cohorte de alto riesgo), la incidencia de ictus a los 2 años tendió a ser inferior en el grupo de TAVI que en el de tratamiento quirúrgico (el 10,9 frente al 16,6%; p = 0,05)8.
Complicaciones vascularesSon una complicación temprana del TAVI. En la cohorte B del ensayo PARTNER5, las complicaciones vasculares fueron significativamente más frecuentes en el grupo de TAVI que en el de tratamiento estándar (incluida la valvuloplastia percutánea) (el 30,7 frente al 5%) y en la cohorte A, las complicaciones vasculares fueron más frecuentes en el grupo de TAVI que en el de RQVA (el 17 frente al 3,8%). El riesgo total de que se produzca un daño vascular significativo se ha reducido con los sistemas de aplicación valvular de menor perfil, pero sigue siendo > 8%10.
Defectos de la conducción auriculoventricular e implante de marcapasosLa incidencia de implante de marcapasos debido a las alteraciones de la conducción auriculoventricular derivadas del TAVI es variable y depende del tipo de válvula; no obstante, los datos referidos a su repercusión en forma de cardiopatía inducida por marcapasos son contradictorios14.
La esperanza de vida observada en los pacientes portadores de un marcapasos permanente, incluidos los pacientes quirúrgicos sin comorbilidades significativas, fue comparable a la de la población general. Sin embargo, hay estudios que indican que los marcapasos cardiacos inducen disincronía ventricular electromecánica, anomalías de la perfusión miocárdica y un remodelado adverso ventricular izquierdo crónico, lo que da lugar a resultados cardiovasculares adversos a largo plazo.
Insuficiencia aórticaEstá claramente establecido que la IA moderada o grave tras el TAVI tiene efectos adversos en la mortalidad. Este es el motivo de que se hayan hecho grandes esfuerzos para reducir esta grave complicación, como determinar el tamaño del anillo valvular siempre por tomografía computarizada, usar dispositivos valvulares reposicionables y totalmente recapturables y utilizar válvulas que dispongan de mecanismos de sellado perivalvular. La adopción de todas estas medidas ha llevado a que se alcance una tasa de IA moderada o grave tras el implante muy baja. Una cuestión importante pendiente de resolver es cómo cuantificar el grado de regurgitación paravalvular tras el TAVI. Generalmente se emplea la angiografía durante el implante de la válvula, pero la coincidencia entre la angiografía y la ecocardiografía transtorácica (con el uso de los criterios VARC-II) para establecer el grado de IA tras la TAVI es moderada15. Se observa igualmente mala correlación entre la angiografía y la resonancia magnética. Así pues, es necesario establecer un consenso sobre la mejor forma de detectar y cuantificar la insuficiencia valvular tras el TAVI. Se debe considerar el empleo de técnicas de imagen multimodales y un análisis hemodinámico para la evaluación de la IA durante el implante y para guiar el TAVI si hubiera dudas respecto al grado de IA16.
RETOS FUTUROSLa expansión futura de las indicaciones del TAVI incluirá no solo a los pacientes que actualmente se trata con RQVA, sino también indicaciones aún no aprobadas para otros trastornos clínicos (tabla). A este respecto, hay varias cuestiones pendientes que conviene considerar.
Implante percutáneo de válvula aórtica y uso fuera de las indicaciones aprobadas
| Pacientes de bajo riesgo |
| Válvula aórtica bicúspide |
| Degeneración de válvulas aórticas bioprotésicas quirúrgicas |
| Estenosis aórtica asintomática grave |
| Estenosis aórtica de bajo flujo y bajo gradiente |
| Estenosis aórtica con cardiopatía concomitante grave (enfermedad coronaria extensa, insuficiencia mitral) |
| Insuficiencia aórtica en pacientes de alto riesgo |
La durabilidad a largo plazo de las bioprótesis valvulares es una cuestión de especial importancia cuando se trate a pacientes de bajo riesgo, puesto que en tales casos generalmente se prevé que sobrevivan más tiempo que los del grupo de riesgo alto. En comparación, las tasas descritas de fallos de las bioprótesis quirúrgicas son muy bajas, < 1% antes de los 5 años y del 10% a los 10 años en pacientes de más de 65 años. Según los primeros estudios realizados en pacientes tratados con TAVI, las tasas de degeneración a los 5 años oscilan entre el 3,5 y el 5%17. Las variables consideradas factores independientes predictores de la degeneración valvular son la ausencia de anticoagulación, el índice de masa corporal, la intervención valve-in-valve y el implante de válvulas de pequeño tamaño.
Los resultados del primer estudio en que se investigó específicamente la durabilidad a largo plazo en pacientes tratados con TAVI (con los dispositivos expandibles con balón de primera generación) se han presentado recientemente en EuroPCR 2016. Dvir et al18. evaluaron a 704 pacientes (media de edad, 83 años) tratados con TAVI en 2 hospitales (Canadá y Francia) hace más de 5 años. Se siguió a un total de 378 pacientes con exploraciones ecocardiográficas repetidas durante un periodo de hasta 10 años. Se excluyó del análisis a los pacientes que fallecieron en los 30 días tras el TAVI, los que sufrieron mal funcionamiento del dispositivo inmediatamente después de la intervención de TAVI y los tratados con intervenciones valve-in-valve. Se estudió a los 100 pacientes que sobrevivieron al menos 5 años después del TAVI para evaluar la posible degeneración valvular. Esta se definió mediante los siguientes criterios (validados en un laboratorio centralizado): reflujo intravalvular moderado o grave o EA con gradiente medio > 20 mmHg no presentes en los 30 días posteriores al procedimiento. Durante el periodo de seguimiento, los investigadores identificaron 35 casos de degeneración de la válvula (23 pacientes con reflujo valvular y 12 con estenosis/mixtos). La insuficiencia renal fue el factor que mostró mayor correlación con la degeneración valvular. La estimación de Kaplan-Meier de la tasa de degeneración valvular estructural a los 8 años fue de aproximadamente un 50%. Este estudio recomienda que se tenga en cuenta el riesgo de degeneración valvular estructural tras el TAVI, sobre todo al tratar a pacientes relativamente jóvenes o con menor riesgo quirúrgico.
Tratamiento antitrombótico adyuvanteNo hay evidencia concluyente que respalde o rechace el empleo del tratamiento antiagregante plaquetario tras el TAVI. Informes recientes de trombosis subclínica de valvas protésicas19,20 han motivado un renovado interés por conocer el tratamiento antitrombótico más apropiado durante y tras el TAVI. Están en marcha múltiples ensayos que intentan dar respuesta a estas preguntas probando diferentes fármacos y pautas de administración: bivalirudina frente a heparina no fraccionada (ensayo BRAVO), ácido acetilsalicílico frente a ácido acetilsalicílico + clopidogrel (ensayo ARTE), ácido acetilsalicílico + clopidogrel frente a acenocumarol (ensayo AUREA), ácido acetilsalicílico frente a ácido acetilsalicílico + clopidogrel frente a anticoagulación oral + clopidogrel (ensayo POPular-TAVI), rivaroxabán + ácido acetilsalicílico frente a ácido acetilsalicílico + clopidogrel (ensayo GALILEO) y apixabán frente a ácido acetilsalicílico + clopidogrel o anticoagulación oral (ensayo ATLANTIS).
CONCLUSIONESEl TAVI está revolucionando el tratamiento de la EA grave sintomática. Ya se ha convertido en el tratamiento de elección para los pacientes con EA grave inoperables o con alto riesgo quirúrgico. Según los resultados de los ensayos clínicos más recientes, pasará a ser una alternativa a la cirugía como tratamiento de los pacientes con riesgo quirúrgico intermedio. Los análisis de subgrupos indican que el TAVI podría ser una opción terapéutica también para los pacientes de bajo riesgo, pero tan solo ensayos específicos podrían demostrar la validez de esta hipótesis. La durabilidad de las válvulas de TAVI es una cuestión crucial en la toma de decisiones respecto al tratamiento de los pacientes de menos edad. Por último, la evaluación de la relación coste-efectividad resulta imprescindible antes de la adopción generalizada de esta opción de tratamiento, sobre todo en una época de continuo crecimiento del gasto en la asistencia sanitaria.
Durante la elaboración de este artículo y la aplicación a pacientes con EA grave y riesgo quirúrgico intermedio, las válvulas CoreValve (1 de agosto de 2016) y XT y SAPIEN 3 (23 de septiembre de 2016) han conseguido la aprobación de la marca CE. Además, la Food and Drug Administration ha aprobado el uso de las válvulas XT y SAPIEN 3 (18 de agosto de 2016).
CONFLICTO DE INTERESESC. Morís es proctor de Medtronic para la válvula EVOLUT R.