Los pacientes portadores de desfibrilador automático implantable precisan un seguimiento ambulatorio periódico en el que se evalúen todos los parámetros y se revisen los eventuales episodios arrítmicos. Este seguimiento permitirá modificar o no la programación antitaquicardia y antibradicardia en función de las terapias liberadas por el dispositivo. Se ha establecido que una periodicidad entre 3 y 6 meses es suficiente para detectar eventos potencialmente graves. Durante el seguimiento los pacientes pueden presentar arritmias cardiacas que deberán ser tratadas con fármacos o mediante ablación con catéter. La tolerancia clínica de las arritmias y la historia de síncope previo al implante son dos de los principales factores a la hora de restringir o no la conducción de vehículos. Los conductores profesionales no podrán seguir ejerciendo su profesión. Los fallos de fabricación, con consecuencias potencialmente letales, no son predecibles; el fabricante tiene la obligación de notificar su presentación.
Palabras clave
Los pacientes portadores de un desfibrilador automático implantable (DAI) requieren un seguimiento periódico que debería realizarse en una unidad integrada por personal (facultativo y no facultativo) adecuadamente formado para la interrogación y utilización de estos dispositivos1.
Seguimiento previo al altaEn ausencia de complicaciones, el alta médica del enfermo puede realizarse a las 48h del implante. Previamente, deberemos interrogar el dispositivo para comprobar que los valores de umbral de estimulación, las impedancias (tanto de estimulación como de desfibrilación) y los valores de amplitud de las ondas P y R son similares a los obtenidos durante el implante2. Programaremos entonces los parámetros de estimulación y de terapia antitaquicardia más adecuados para nuestro paciente3. En dicha revisión conviene comprobar la posición radiográfica de los electrodos, así como el buen estado de la herida quirúrgica y la bolsa del dispositivo. Aprovecharemos esta ocasión para dar las explicaciones pertinentes al paciente y su familia acerca del funcionamiento del DAI, las sensaciones que cabe esperar en caso de choque, los motivos de alarma y los cuidados que requiere la herida, así como solucionar las dudas que nos planteen y realizar los trámites para obtener el carné de portador del dispositivo3. No es necesario rea-
Seguimientos posteriores al altaLos pacientes con DAI requieren un control periódico y sistemático. Es imprescindible efectuar un seguimiento más estrecho en los primeros 3 meses postimplante (se recomienza realizar una primera visita entre la semanas 2 y 12)3, dado que en este período se observan con más frecuencia las dislocaciones del electrodo y las complicaciones infecciosas4. Sin embargo, no hay un consenso general sobre la periodicidad recomendada de las visitas posteriores. Algunos autores señalan que una periodicidad de 6 meses resulta bastante segura, sin que con esta pauta se haya encontrado un retraso significativo en la detección de complicaciones serias4. Dichos intervalos deberían acortarse en el caso de acercarse la batería al ERI (elective replacement indicator) y en las situaciones que lo requieran5. Hasta el momento, las guías actuales publicadas por diferentes sociedades de cardiología señalan intervalos de 3 a 6 meses.
El seguimiento debe iniciarse con una pequeña historia clínica con preguntas relativas a las descargas, los síntomas de palpitaciones, la presencia de presíncope o síncope, la situación funcional y la medicación actual. Debería explorarse el lugar en el que se localiza el DAI con el fin de descartar una infección o un hematoma tras la implantación, así como la erosión durante el seguimiento.
Se realizará un electrocardiograma (ECG) en cada visita y algunos autores recomiendan realizar estudios radiográficos periódicos en los que confirmar la normoposición y la integridad del electrodo3,4.
Después se procede a la interrogación del dispositivo. En ella se obtiene información diagnóstica de forma sistemática, entre la que se incluye el voltaje de la batería y el tiempo de carga, que refleja la expectativa de vida del dispositivo. Una vez alcanzado el ERI, el reemplazo debe realizarse en un breve plazo, si bien los fabricantes aseguran 2-3 meses de funcionamiento correcto.
La comprobación de la integridad del electrodo se realiza mediante la determinación de la impedancia, el sensado de la onda y el umbral de estimulación. Una disminución en la impedancia significativa o valores inferiores a 200-250 ohmios indican un defecto del aislamiento, mientras que valores superiores a 2.000 ohmios implican rotura del electrodo4. Una disminución significativa de la amplitud de la onda R y el aumento del umbral de estimulación indican una dislocación del electrodo en seguimientos precoces, una fibrosis exagerada en disminuciones más tardías, roturas del electrodo o, incluso, la presencia de conectores sueltos1,2,4.
La integridad del circuito de alta energía se puede comprobar en los modelos actuales midiendo la impedancia del circuito sin necesidad de aplicar un choque de baja energía1. En los pacientes que han recibido alguna descarga se deben comprobar la impedancia y el tiempo de carga. Los valores habituales de impedancia varían entre 30 y 60 ohmios. Una impedancia anómala puede indicar una alteración de la bobina de desfibrilación, como rotura o mala conexión con el generador.
Se deben analizar también los electrogramas intracardiacos en tiempo real con el fin de descartar ruido en la señal, que nos alertaría precozmente de un problema de los electrodos. El infrasensado no es un hallazgo frecuente, dado que el dispositivo trabaja con valores de sensibilidad muy bajos y autoajustables.
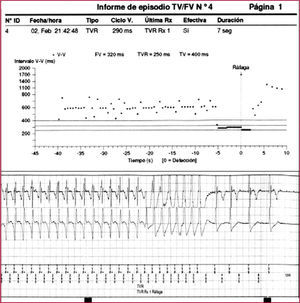
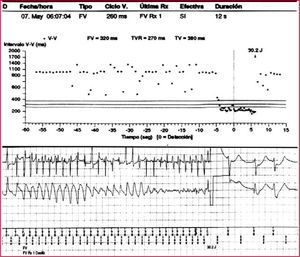
Se analizan a continuación los datos de los episodios almacenados, que comprenden la frecuencia de la taquicardia detectada, su comienzo y finalización, la morfología del electrograma intracardiaco, los canales de marcas y la terapia administrada (figs. 1 y 2). Estas prestaciones incluyen los criterios de«estabilidad», «inicio súbito»y«morfología»de la taquiarritmia. La irregularidad de los intervalos RR antes del tratamiento sugiere fibrilación auricular (FA). Los intervalos RR muy cortos (menos de 150ms) y variables indican un sensado de señales extracardiacas, como miopotenciales, o pueden indicar rotura o defecto del aislamiento. Los criterios de comienzo súbito ayudan a diferenciar la taquicardia sinusal de la taquicardia ventricular (TV) lenta. Los criterios de morfología comparan el patrón de activación intracavitario durante taquicardia con el de ritmo sinusal; en caso de taquicardia supraventricular (TSV), dicho patrón será similar y en caso de TV, distinto. En los dispositivos bicamerales, la disociación auriculoventricular con una frecuencia ventricular mayor a la auricular suele indicar taquicardia ventricular4.
Ejemplo del resultado de la estimulación antitaquicardia (EAT) por sobreestimulación de una taquicardia ventricular rápida. En la parte superior de la figura se observa el gráfico de intervalos y en la parte inferior, el registro de los electrogramas (EGM) intracavitarios.
FV: fibrilación ventricular; RX: terapia; TV: taquicardia ventricular; TVR: taquicardia ventricular rápida: V: ventricular.
Fibrilación ventricular tratada correctamente mediante un choque bifásico de 30,2 julios. En la parte superior de la figura se observa el gráfico de intervalos y en la parte inferior, el registro de los electrogramas (EGM) intracavitarios.
FV: fibrilación ventricular; RX: radiografía; TV: taquicardia ventricular; TVR: taquicardia ventricular rápida; V: ventricular.
En cuanto a la terapia administrada, hay que comprobar su efectividad y tener en cuenta los fenómenos de proarritmia del DAI, que podrían requerir una modificación de las terapias. En los dispositivos actuales pueden programarse de una a 3 zonas para la detección de una taquiarritmia. En la zona de TV lenta se pueden programar criterios adicionales que ayudan al diagnóstico diferencial entre TSV y TV, lo que disminuye la posibilidad de recibir una terapia inapropiada del 20 al 5%, dado que gran parte corresponde a episodios FA y TSV. En función de la arritmia que motive los episodios, junto con otras variables clínicas, se podrá optar por diferentes actitudes terapéuticas (cambio en la programación del dispositivo, inicio o cambio en el tratamiento farmacológico antiarrítmico, realización de estudio electrofisiológico y ablación de la taquicardia o del sustrato arrítmico, etc.).
Los hallazgos anómalos en el seguimiento ambulatorio sistemático pueden instar en ocasiones a realizar pruebas más exhaustivas, como la evaluación del DAI en el laboratorio de electrofisiología1.
Otros aspectos que cabe tener en cuenta en el seguimiento del DAI serían los siguientes:
- —
La respuesta al imán: de manera general se anula la programación antitaquicardia sin que se afecte la programación antibradicardia. Con la retirada del imán el desfibrilador recupera su modo de funcionamiento previo.
- —
La función Optivol®, disponible de forma exclusiva en el sistema Insync Sentry® de terapia de resincronización cardiaca/DAI Medtronic: consiste en el control de la retención de líquidos del paciente a través de la medición diaria de la impedancia intratorácica. Este valor de impedancia presenta una correlación inversa con la acumulación de líquido pulmonar5.
- —
Sistemas de seguimiento a distancia: debido al progresivo aumento del número de desfibriladores implantados, se están desarrollando nuevas opciones de seguimiento a distancia (Home Monitoring®, Biotronik; CareLink®, Medtronic; Housecall Plus®, St. Jude Medical; Latitude Patient Management system®, Boston Scientific). Esta tecnología es capaz de transmitir información relevante al médico, entre la que se incluyen datos sobre la integridad del sistema, los episodios relevantes y las terapias administradas. Los datos son enviados telefónicamente a un centro, donde son procesados y enviados al médico responsable, que puede disponer de ellos con un acceso seguro a Internet. No permite la programación del dispositivo. Este sistema de seguimiento no debe sustituir la primera visita tras la implantación ni debería sustituir los seguimientos sistemáticos en pacientes que ya han presentado problemas con el desfibrilador6. Es una herramienta diagnóstica que puede centrarse en los pacientes y situaciones que lo requieran, así como un sistema de ahorro que puede permitir espaciar los seguimientos sistemáticos en un gran número de pacientes.
Los pacientes portadores de un DAI pueden experimentar síntomas severos o incluso colapso hemodinámico relacionado con la tolerancia hemodinámica de las arritmias ventriculares, dependiendo de la duración y la longitud de ciclo de ésta y de la función miocárdica subyacente7. En este sentido, desde 1991 se están realizando estudios sobre la capacidad de conducción, comenzando con análisis observacionales sobre la incidencia de accidentes de tráfico en estos pacientes y siguiendo por el consejo médico que reciben y lo que ocurre en la vida real. La tasa estimada de mortalidad en carretera para los pacientes portadores de un DAI es de 7,5/100.000 paciente-año y la tasa estimada de heridos estaría en torno a 17,6/100.000 pacientesaño, cifras inferiores a las de la población global8.
En este contexto, el papel del cardiólogo es de importancia capital para el asesoramiento del paciente, teniendo en cuenta que será la ausencia de recurrencia de síntomas o de descargas del DAI lo que determinará las restricciones en la conducción a más largo plazo. En un cuestionario realizado a 46 representantes de distintos países del Grupo de Marcapasos de la Sociedad Europea de Cardiología en 1991 encontramos que el 56% aconsejó a sus pacientes restringir en algún grado la conducción: el 33% de ellos de forma permanente y el 67% de forma temporal. Los criterios para prohibir la conducción fueron tanto la recurrencia sintomática (presíncope en el 38% de los casos, síncope en el 33%) como las descargas múltiples del DAI (5%). En contra del consejo médico, la mitad de los pacientes volvió a conducir desde el sexto mes postimplante y la mayoría lo hacía al año del implante9. Las recomendaciones vigentes en la actualidad proceden de un documento de consenso de la Sociedad Europea de Cardiología. En él se recomienda la prohibición de conducir vehículos comerciales a todos los pacientes con DAI, hayan tenido o no historia de arritmias ventriculares. En cuanto a los vehículos no comerciales, se recomienda dejar de conducir los primeros 6 meses postimplante si no hay descargas en este período. Si hay recurrencia sintomática, ya sea síncope o presíncope, se prolongará la prohibición otros 6 meses antes de reevaluar la situación. En cuanto a la aparición de episodios múltiples de terapias antitaquicardia, se recomienda realizar una valoración individual10. Posteriormente, en un artículo avalado por la Sociedad Canadiense de Cardiología, la American Heart Association, la North American Society of Pacing and Electrophysiology y la Sociedad Europea de Cardiología se indica que en pacientes con una buena función ventricular y sin taquicardias recurrentes ni necesidad de tratamiento farmacológico antiarrítmico podría ser suficiente una restricción de 3 meses postimplante11. En el año 2007 surgieron nuevas recomendaciones respecto a la conducción de vehículos privados en los pacientes portadores de un DAI para prevención primaria, en los que no se contempla ninguna restricción12.
PROBLEMAS DURANTE EL SEGUIMIENTOLos DAI no están exentos de presentar errores de fabricación que pueden alterar su funcionamiento, con mayor o menor repercusión para el paciente. Estos errores no suelen ser predecibles y, cuando son detectados por los fabricantes, deben ser comunicados a los organismos reguladores correspondientes, lo que da lugar a las llamadas alertas de seguridad o recalls. No todos estos errores pueden ser detectados, ya que no todos los dispositivos son explantados una vez el paciente ha fallecido, ya sea por muerte súbita o no13.
El aumento en la complejidad tecnológica del DAI (terapias antitaquicardia y antibradicardia, algoritmos diagnósticos, choques de alta energía, etc.), junto con la progresiva reducción del tamaño del dispositivo, conlleva un mayor porcentaje de disfunciones que los marcapasos14. La detección de una disfunción en una serie de DAI motiva que todos los dispositivos implantados sean alertados, con independencia de que la probabilidad de fallo real sea mínima (< 1/10.000 dispositivos). Esta alerta de seguridad provoca una situación de alarma en los médicos y, por supuesto, en los pacientes afectados15,16. La evolución temporal de los recalls ha tenido en los últimos 15 años una distribución bimodal, y a principios de la décadas de 1990 y 2000 hubo un aumento en el número de recalls11. Los dispositivos afectados superan los centenares de miles y afectan a todas las compañías fabricantes de DAI.
Recientemente, la Heart Rhythm Society ha publicado unas recomendaciones de actuación en caso de detectar un fallo en un DAI concreto que afectan tanto a los fabricantes como a los médicos14. Los fabricantes quedan emplazados a comunicar pertinentemente a todos los médicos relacionados con el DAI la naturaleza de la disfunción, la probabilidad de presentación, las consecuencias para el funcionamiento del DAI y las terapias programadas, y las posibles consecuencias clínicas para el paciente en caso de que el fallo afecte a su DAI. El médico debe actuar en consecuencia, recomendando al paciente el recambio profiláctico electivo o un seguimiento estrecho del DAI, y la posibilidad de recambio en caso de presentación del fallo. En nuestro país, el Grupo de Trabajo de DAI de la Sección de Electrofisiología y Arritmias de la Sociedad Española de Cardiología ha elaborado recomendaciones concretas en relación con recalls concretos, comunicados por las compañías responsables (www.arritmias.org).
Las disfunciones han sido categorizadas en 3 niveles en función de la consecuencia clínica que tendría para el paciente portador del DAI afectado14,18:
- —
Nivel I: se refiere a que la consecuencia puede ser seria para la salud, incluso podría producir la muerte del paciente.
- —
Nivel II: identifica una disfunción que produciría una consecuencia adversa temporal o reversible.
- —
Nivel III: se refiere a que la disfunción raramente producirá consecuencias adversas para el paciente.
Las disfunciones más frecuentes en el DAI afectan al hardware del dispositivo, en concreto, al sistema de electricidad/circuitería, batería/condensadores y sellado hermético; la batería y los condensadores son las partes del DAI afectas con más frecuencia19. Estos defectos pueden dar lugar a que no se libere la terapia antitaquicardia en caso de arritmia ventricular, lo que puede tener un resultado fatal.
En caso de recambio profiláctico hemos de valorar las posibles complicaciones que afectan a todo recambio en nuestro medio frente a las probabilidades de afectación del dispositivo. Las indicaciones de recambio profiláctico, publicadas por la Heart Rhythm Society, son las siguientes14: pacientes marcapaso-dependientes, indicación del DAI por prevención secundaria, indicación por prevención primaria si el paciente ha recibido más de una terapia apropiada, nivel I del recall, agotamiento próximo de la batería y probabilidad de afectación superior al 1%. En otros casos se recomienda el seguimiento estrecho y proceder al recambio cuando el dispositivo se vea afectado o se llegue al período de recambio electivo (ERI). Si la disfunción ha podido ser corregida mediante la reprogramación, es posible continuar con el seguimiento sistemático. Por último, se recomienda realizar un seguimiento estrecho en aquellos casos con nivel I siempre y cuando el riesgo inherente al procedimiento del recambio exceda la probabilidad de afectación.
En un estudio multicéntrico canadiense se observó una tasa de complicaciones mayores del 5,8%, en los procedimientos de recambio por recall, porcentaje que no resultó superior a las complicaciones producidas en los primoimplantes20, aunque es necesario individualizar cada caso y los resultados en nuestro medio.
FÁRMACOS ANTIARRÍTMICOS Y DESFIBRILADOR AUTOMÁTICO IMPLANTABLEHoy día, los fármacos antiarrítmicos (FAA) en pacientes portadores de DAI se utilizan principalmente como terapia sinérgica, mientras que el DAI es superior en la prevención de la muerte súbita pero carece de la capacidad preventiva de nuevos episodios que sí tienen los fármacos.
Indicaciones de los fármacos antiarrítmicos en pacientes con desfibrilador automático implantable (tabla 1)Tasa de empleo de los fármacos en pacientes con desfibrilador automático implantable y tendencia evolutivaEntre el 20 y el 69% de los pacientes con DAI termina recibiendo tratamiento con FAA. El porcentaje de pacientes incluidos en el grupo de DAI y tratados con FAA era mayor en los ensayos de prevención secundaria (el 46% en MADITI y el 27% en AVID) que en los de prevención primaria (el 14% en SCD-HeFT, el 3,1% en DEFINITE y el 8,1% en DINAMIT). Las razones son diversas: mayor incidencia de descargas en los casos de prevención secundaria, reducción de las terapias inapropiadas con los dispositivos más recientes y la creciente difusión de las limitaciones y efectos secundarios cardiacos y extracardiacos de los FAA, junto con la disponibilidad de la ablación con catéter21.
Indicaciones potenciales de tratamiento con fármacos antiarrítmicos en portadores de desfibrilador automático implantable
|
FV: fibrilación ventricular; TV: taquicardia ventricular.
Las descargas frecuentes constituyen la causa más habitual para prescribir FAA. En el estudio AVID22 suponía el 64% de las indicaciones, seguida de las arritmias ventriculares recurrentes en el 26%, las taquicardias supraventriculares en el 2% y motivos diversos en el 8%. El número de choques se redujo de forma significativa tras instaurar tratamiento antiarrítmico, principalmente amiodarona, no así el número de terapias antitaquicardia. Algunas características iniciales predecían de forma independiente la necesidad de añadir antiarrítmicos: la fracción de eyección más baja, la presencia de arritmias más frecuentes antes del implante y la indicación por taquicardia ventricular frente a fibrilación ventricular. Estos mismos indicadores, junto con un grado más avanzado de insuficiencia cardiaca y el sexo masculino, han sido corroborados en otros estudios como predictores de descargas1,23,24.
Terapia empírica preventiva con antiarrítmicosEl efecto de la terapia antiarrítmica preventiva, aquella instaurada antes de que aparezca la primera descarga, ha sido analizado en varios estudios aleatorizados frente a placebo o betabloqueantes, y recientemente ha sido valorado en una revisión sistemática25. Así, en la reducción del número de descargas del DAI, los datos indican la superioridad de la amiodarona frente a los betabloqueantes, la del sotalol frente al placebo, la ausencia de beneficio del sotalol comparado con otros betabloqueantes y un posible beneficio del azimilide comparado con placebo. Atendiendo a los resultados del estudio OPTIC26, la combinación de amiodarona con betabloqueantes es superior al sotalol, y a los betabloqueantes, en la prevención de descargas.
Interacciones de los fármacos con el desfibrilador automático implantableDebido a que no son una rareza y a sus efectos potencialmente muy graves, es obligado reevaluar el paciente y el dispositivo siempre que se inicie terapia antiarrítmica.
Efecto sobre el umbral de desfibrilaciónLos resultados de los estudios que han analizado el efecto de los antiarrítmicos sobre los umbrales de desfibrilación son contradictorios. El modelo experimental, el tipo de cardiopatía, las dosis del fármaco y la vía de administración, la forma de onda de choque e incluso el anestésico empleado varían de una serie a otra. Por otra parte, el umbral de desfibrilación no es un valor absoluto, sino una función probabilística cuya exactitud de cálculo requiere un elevado número de pruebas, algo inviable fuera del laboratorio de experimentación27.
En el estudio OPTIC28, en el que se valoró el umbral de desfibrilación en el momento del implante y a las 8-12 semanas de iniciar tratamiento con betabloqueantes, amiodarona más betabloqueantes o sotalol, se encontraron cambios significativos pero de cuantía escasa (media 1 julio) y se confirmó el aumento del umbral con amiodarona y la disminución con sotalol y betabloqueantes. La conclusión es que, aunque la amiodarona aumenta el umbral de desfibrilación, no era necesario revaluar el umbral tras instaurar tratamiento antiarrítmico con sotalol o amiodarona, salvo cuando el margen de seguridad no fuera adecuado previamente.
Efecto sobre el umbral de estimulaciónAunque tanto los umbrales de estimulación antibradicardia como antitaquicardia pueden verse modificados por los FAA, es improbable que esto represente un problema, salvo cuando coincidan otros factores concomitantes, como un choque previo o una alteración electrolítica. Se ha estimado un incremento medio del umbral de estimulación tras choque bifásico con DAI de 2,8 veces el umbral por lo que sería necesario programar la salida poschoque 4 veces por encima del umbral29. Por tanto, si se tiene la precaución de reevaluar el umbral tras iniciar el tratamiento farmacológico para programar la estimulación poschoque con un margen de seguridad amplio, esta interferencia no debe constituir un problema en la actualiad.
ProarritmiaDebido a que el mecanismo fisiológico que media la acción terapéutica de los fármacos antiarrítmicos es el mismo que el de la proarritmia, esta complicación es, en general, difícil de prevenir. Los principales síndromes proarrítmicos en el paciente con DAI son los siguientes:
- —
Bradicardia sinusal o bloqueo auriculoventricular que deriven en un mayor grado de estimulación ventricular derecha, con el consiguiente aumento del consumo de energía y efectos hemodinámicos deletéreos. Pueden causarlo casi todos los antiarrítmicos, especialmente los combinados con betabloqueantes.
- —
La prolongación del intervalo QT ligada sobre todo al tratamiento con sotalol, puede causar taquicardia ventricular polimórfica —torsade de pointes— en sujetos susceptibles o que tomen otros fármacos bloqueantes de los canales de potasio o diuréticos. En nuestra experiencia, la mayoría de los casos observados han sido secundarios a hipopotasemia inducida por el aumento de la dosis de diuréticos o a la combinación de diuréticos tiacídicos y del asa.
- —
Los fármacos con efecto de clase I (quinidina, flecainida, propafenona, amiodarona) pueden favorecer la aparición de taquicardias ventriculares monomórficas no clínicas, enlentecer las clínicas a una frecuencia por debajo del umbral programado, o hacerlas más frecuentes o incesantes. Igualmente, pueden transformar la fibrilación auricular en aleteo, con una respuesta ventricular más rápida y regular que es más fácilmente inductora de choques inapropiados.
Los pacientes con DAI que reciben terapias tienen una mayor mortalidad, pero ninguno de los FAA que redujeron la tasa de choques ha disminuido la mortalidad. Al contrario, en algunas series el uso de antiarrítmicos predecía una mayor mortalidad30.
En ausencia de información concluyente sobre un beneficio en la morbimortalidad, en el momento actual posiblemente todos los pacientes deberían recibir un betabloqueante y los que tienen disfunción ventricular, además, un inhibidor de la enzima de conversión de la angiotensina (IECA) o un antagonista de los receptores de la angiotensina II (ARA-II), no sólo por su efecto positivo en la supervivencia, sino también porque reducen los choques31. La decisión de añadir amiodarona o sotalol debe contemplarse en cada caso y no puede recomendarse en prevención primaria.
ABLACIÓN CON CATÉTER EN PACIENTES CON DESFIBRILADOR AUTOMÁTICO IMPLANTABLELos choques frecuentes consumen batería, son en general mal tolerados y empeoran la calidad de vida y la capacidad física32. La peor de las situaciones es aquella en la que la taquicardia ventricular recurrente o incesante causa múltiples choques apropiados en un corto período, situación conocida como tormenta arrítmica, que supone una amenaza directa para la supervivencia33. Cuando los FAA junto con las medidas generales no consiguen controlar el problema, la ablación con catéter es una opción con eficacia demostrada para rescatar al paciente de esta situación crítica34,35.
Las descargas repetidas y la tormenta eléctrica se asocian con malos ventrículos y frecuentemente son causadas por taquicardias ventriculares pleomórficas mal toleradas más que por taquicardias monomórficas toleradas, lo que obliga a aplicar técnicas no convencionales de ablación con catéter. Han demostrado utilidad en este contexto la ablación convencional con soporte cardiopulmonar percutáneo, la cartografía con sistema de mapeo sin contacto mediante catéter con balón multielectrodo que permite con un único latido la reconstrucción eléctrica y anatómica de los ventrículos36, y la ablación de sustrato mediante mapeo electroanatómico37,38. Esta última es, probablemente, la más utilizada.
Seguridad de la ablación en pacientes con desfibrilador automático implantableLa aplicación de energía de radiofrecuencia puede provocar disfunción del desfibrilador: cambios en el umbral de detección y estimulación, en la impedancia, bloqueo de salida o cambio del generador a power rest mode39. Por suerte, la disfunción es casi siempre transitoria o solucionable con reprogramación sin que afecte al funcionamiento a largo plazo. Es recomendable disponer de un electrodo en el ventrículo derecho para la estimulación transitoria en los pacientes dependientes del marcapasos. Hay que extremar el cuidado al manipular los catéteres y las vainas durante la ablación de la fibrilación auricular para evitar la dislocación de los electrodos auriculares, especialmente si llevan implantados menos de 6 meses40.
Terapia empírica preventiva con ablaciónHa despertado gran interés la comunicación preliminar de los resultados del estudio SMASH VT41, en el que 127 pacientes con infarto previo e indicación de desfibrilador por prevención secundaria fueron aleatorizados a realizar o no ablación del sustrato de la taquicardia antes del implante. No se permitió el uso de antiarrítmicos. A los 2 años de seguimiento la ablación redujo a la mitad el porcentaje de pacientes que recibieron choques y de forma llamativa mostró una clara tendencia a mejorar la supervivencia.
Indicaciones de la ablación con catéter en pacientes con desfibrilador automático implantableEn la tabla 2 se concretan las principales indicaciones de la ablación con catéter en portadores de DAI, algunas contempladas en las guías de práctica clínica42. En el Registro Español de Ablación con Catéter de 2005 se informó que el 1,2% de los pacientes a los que se les realizó una ablación con catéter era portador de DAI, el sustrato abordado con más frecuencia fue la TV, seguido de la ablación del nódulo auriculoventricular43.
Indicaciones potenciales de tratamiento mediante ablación con catéter en portadores de desfibrilador automático implantable
|
AV: auriculoventricular; DAI: desfibrilador automático implantable; EEF: estudio electrofisiológico; TV: taquicardia ventricular.
*Indicaciones contempladas en las guías de práctica clínica42.
El seguimiento ambulatorio de un paciente portador de un DAI es complejo, por lo que debe realizarse en una unidad especializada. Debe hacerse de forma periódica para ajustar los parámetros del dispositivo a la evolución clínica del paciente y para detectar posibles anomalías en el funcionamiento del DAI, que no son predecibles en la mayoría de las ocasiones. La autorización para conducir vehículos vendrá dada, en el caso de conductores privados, por la recurrencia arrítmica, y estará prohibida en los conductores profesionales. La frecuencia y la severidad de las recurrencias arrítmicas determinarán el uso de fármacos antiarrítmicos; no obstante, los avances tecnológicos producidos en la ablación con catéter hacen de ésta una más que aceptable opción terapéutica.