Palabras clave
INTRODUCCIÓN
El empleo de la arteria mamaria interna (AMI) anastomosada a la descendente anterior se ha convertido en el objetivo fundamental de la cirugía de revascularización miocárdica debido a su mayor permeabilidad1-3, menor recurrencia de acontecimientos en el seguimiento y mejora de la supervivencia4-9. Aunque parece lógico pensar que el empleo concomitante de la AMI derecha debería mejorar aún más los resultados, existen datos discrepantes en la bibliografía y hasta el momento no se ha publicado ningún estudio aleatorizado y prospectivo que compare los resultados de las dos estrategias. Inicialmente se señaló un incremento de la morbilidad operatoria asociada al empleo de ambas mamarias. Este hecho, junto a la falta de resultados concluyentes, han contribuido a que esta estrategia de revascularización no se haya generalizado.
Recientemente se ha incrementado el interés de la comunidad cardiológica y cardioquirúrgica por la revascularización miocárdica con el uso exclusivo de injertos arteriales, al encontrarse éstos más protegidos frente al desarrollo de enfermedad arteriosclerótica, en un intento de reducir la recurrencia de acontecimientos secundaria al desarrollo de ateromatosis precoz en los injertos venosos10.
Nuestro grupo comenzó a utilizar AMI izquierda como injerto coronario en el año 1983 y el de ambas mamarias un año más tarde. El presente estudio analiza de forma retrospectiva los resultados de nuestra experiencia con el uso de ambas arterias mamarias, los cuales se comparan con un grupo control en el que únicamente se empleó AMI izquierda. En ambos casos se emplearon injertos venosos de forma concomitante.
PACIENTES Y MÉTODO
Población de estudio
Entre los años 1984 y 1998, un total de 3.031 pacientes fueron sometidos a revascularización coronaria sin procedimientos asociados. De ellos, en el 75% se empleó al menos una AMI asociada con injertos venosos. En el 3,6% (108 pacientes) se utilizaron ambas arterias mamarias con o sin injertos venosos. El 25% de los pacientes fueron revascularizados exclusivamente con injertos venosos. Las indicaciones para elegir ambas arterias mamarias fueron diferentes en función de la edad. En los pacientes jóvenes (fundamentalmente menores de 50 años) se buscó el posible beneficio de una revascularización arterial extensa, mientras que la indicación fundamental para su uso en pacientes mayores de 65 años fue la ausencia de suficiente vena safena autóloga para conseguir una revascularización completa, por una patología venosa o por safenectomía previa (secundaria a varices o revascularización miocárdica).
El grupo a estudio estaba formado por los 108 pacientes consecutivos, en los que se emplearon las dos arterias mamarias y un grupo control de 108 pacientes tomado de forma aleatoria del grupo revascularizado con una arteria mamaria y emparejados por año de intervención, sexo y edad (± 5 años). El motivo por el que el grupo control fue emparejado por estas variables fue la eliminación de los posibles sesgos derivados de la mejora de la técnica y experiencia de los cirujanos a lo largo de los años, así como la menor edad y número de mujeres en el grupo de doble mamaria respecto al de mamaria única. No se tuvieron en cuenta otros factores (diabetes mellitus, cirugía urgente, etc.) a la hora de seleccionar el grupo control por no disponer de una única base de datos con estas variables, aunque se comprobó la homogeneidad de ambos grupos antes de iniciar el seguimiento. Este tamaño muestral es aproximadamente el necesario para demostrar diferencias en la recurrencia de angina entre ambos grupos (estimado a partir de un pilotaje de 10 enfermos de cada grupo). Se excluyeron los pacientes con enfermedad de un solo vaso, procedimientos asociados y aquellos en los que se emplearon injertos diferentes a la arteria mamaria y la vena safena. Todos los enfermos fueron intervenidos por el mismo grupo de cirujanos de una única institución.
Se recogieron las siguientes variables: demográficas (edad y sexo), factores de riesgo (diabetes mellitus, hipertensión, tabaquismo, hipercolesterolemia, historia familiar, enfermedad vascular periférica, enfermedad pulmonar obstructiva crónica y obesidad), preoperatorias (infarto de miocardio [IM] previo, insuficiencia cardíaca, clase para la angina de la Canadian Cardiovascular Society, número de vasos [referido a los tres sistemas coronarios mayores: descendente anterior, circunfleja y coronaria derecha], enfermedad del tronco de la coronaria izquierda [lesión superior al 50%], fracción de eyección ventricular izquierda [normal > 0,60; ligeramente deprimida 0,60-0,46; moderadamente deprimida 0,45-0,31; severamente deprimida < 0,30], revascularización iterativa, angioplastia coronaria transluminal percutánea [ACPT] previa y cirugía urgente) (tabla 1), operatorias (número de anastomosis, revascularización completa, tiempo de circulación extracorpórea y pinzado aórtico, reintervención por sangrado, necesidad de balón de contrapulsación y/o inotrópicos, IM y accidente cerebrovascular perioperatorio, mediastinitis e infección superficial de la herida [definiciones de la CDC de infecciones nosocomiales]11, complicaciones respiratorias [necesidad de intubación superior a 48 h], estancia hospitalaria postoperatoria y muerte hospitalaria) (tabla 2).
Procedimiento quirúrgico
Durante los 14 años que comprende la serie, la técnica quirúrgica apenas sufrió modificaciones. Todas las intervenciones se realizaron mediante esternotomía media. Las arterias mamarias se disecaron de forma pediculada con la ayuda de bisturí eléctrico y colocando clips en las ramas principales. Tras la disección la arteria fue tratada tópicamente mediante papaverina o nitroprusiato. La circulación extracorpórea se llevó a cabo mediante hipotermia moderada (28-32 ºC). La cardioplejía fue cristaloide hasta el año 1990, en que comenzó a emplearse hemática fría intermitente con reperfusión caliente. La vía de administración fue anterógrada y/o retrógrada. Las anastomosis distales se realizaron durante un único pinzado aórtico con monofilamento de polipropileno de 7-0 y las proximales mediante pinzado aórtico parcial (excepto en los casos de aortas ateromatosas, en que se realizaron durante el mismo único pinzado) con monofilamento de polipropileno de 6-0.
En los pacientes que recibieron una única AMI, ésta se empleó preferentemente pediculada (99%) y anastomosada a la descendente anterior (91%) (tabla 3). En el grupo de doble mamaria, la AMI izquierda se empleó pediculada en el 97% de los pacientes y anastomosada a la descendente anterior (67%), diagonales (6%), bisectriz (4%), ramas de la circunfleja (22%) y coronaria derecha (2%). La AMI derecha se empleó pediculada en el 70% de los casos y anastomosada al territorio izquierdo en el 76% de los pacientes (descendente anterior 31%; diagonales 6%; bisectriz 4% y ramas de la circunfleja 36%) (tabla 3), en posición retroaórtica (a través del seno transverso) cuando se empleó para revascularizar la circunfleja o bisectriz y anterior a la aorta cuando se anastomosó a la descendente anterior y las ramas diagonales. Ambas mamarias se emplearon para revascularizar el territorio izquierdo en el 74% de los casos. Las indicaciones para emplear la AMI libre fueron lesión proximal de la arteria durante su disección o longitud insuficiente del pedículo de la mamaria derecha para alcanzar la interventricular posterior o las ramas marginales. Se emplearon anastomosis secuenciales con AMI en el 11,6% y con vena en el 8,8% de los pacientes.
Seguimiento
El seguimiento se realizó mediante entrevista telefónica y/o personal, y los datos se obtuvieron de las revisiones periódicas (ergometría, ecocardiograma, etc.) realizadas en nuestro centro o en su lugar de origen y enviadas por correo por el paciente. Se recogió el status (vivo/muerto), recurrencia de la angina y clase de la Canadian Cardiovascular Society, infarto de miocardio, insuficiencia cardíaca y clase de la New York eart Association, cirugía de revascularización iterativa y ACTP, existencia de acontecimiento cardiológico (muerte de causa cardiológica, angina, revascularización quirúrgica o ACTP, insuficiencia cardíaca e IM) y medicación prescrita al paciente en el momento del seguimiento. Para cada uno de estos hechos se registró el intervalo en meses entre la intervención y el momento de recurrencia. Se obtuvo información de la ergometría o tests farmacológicos en el 85,4% de los pacientes del grupo de doble mamaria y en el 81,6% del grupo de mamaria única. Se consideró que existía recurrencia de la angina cuando ésta había persistido o reaparecido y/o alguna de las pruebas de provocación había sido positiva.
El seguimiento fue completo para el status, y del 95 y 94% en los grupos de D-AMI y U-AMI, respectivamente, para el resto de variables (hubo pacientes a los que no se pudo entrevistar). El seguimiento medio de los pacientes dados de alta fue de 8,9 ± 4,2 años (mediana: 10,0; rango: 0,45-15,33 años) en el grupo de dos mamarias y de 9,0 ± 4,2 años (mediana: 9,9; rango: 0,25-15,45 años) en el grupo de mamaria única.
Análisis estadístico
Se empleó el programa SPSS (versión 9.0, SPSS Inc., Chicago) para el manejo estadístico. Las variables cualitativas se describieron mediante porcentajes y frecuencias y las cuantitativas mediante la media y su desviación estándar. Las variables cualitativas se compararon entre ambos grupos con el test de la χ2 y las cuantitativas con el ANOVA. Para la obtención de las curvas de supervivencia y tiempo libre de angina, IM, cirugía iterativa, ACTP y acontecimiento cardiológico se empleó el método de Kaplan-Meier, y los resultados se expresaron con el intervalo de confianza (IC) del 95%. La influencia de las variables cualitativas y cuantitativas en la supervivencia se investigó con el test de rangos logarítmicos y el método de Cox, respectivamente.
Se construyó un modelo de Cox que incluía las variables significativas en el análisis univariante y las clínicamente relevantes para cada uno de los puntos finales. Con anterioridad se investigó la proporcionalidad de los riesgos y la existencia de interacciones entre las diferentes variables.
Para todos los análisis estadísticos se consideró significativa una p < 0,05.
RESULTADOS
Ambos grupos fueron homogénos en lo referente a factores de riesgo cardiovascular, extensión de la enfermedad y función ventricular izquierda (tabla 1).
Los tiempos de circulación extracorpórea y pinzado aórtico fueron ligeramente superiores en el grupo de la doble mamaria, aunque sólo el segundo alcanzó significación (tabla 2). El número de anastomosis y la revascularización completa fueron similares en ambos grupos (tabla 2). La mortalidad operatoria fue del 1,8% (2 pacientes) en el grupo D-AMI y del 0,9% (un paciente) en el de U-AMI. Durante los primeros 30 días fallecieron un paciente en cada grupo, en el caso de doble mamaria por fallo multiorgánico y en el caso de mamaria única por mediastinitis, por lo que la mor- talidad hospitalaria de la serie es del 2,8 y 1,9%, respectivamente. No hubo diferencias significativas entre ambos grupos en las complicaciones postoperatorias y estancia media hospitalaria posquirúrgica (tabla 2). Los pacientes con complicaciones de la herida quirúrgica presentaron una estancia hospitalaria (47,1 ± 18,6 días) significativamente superior al resto del grupo (11,7 ± 7,2 días) (p < 0,001).
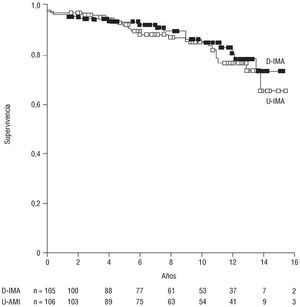
Hubo 14 muertes durante el seguimiento en el grupo de la doble mamaria y 18 en el de la mamaria única; de éstas, fueron muertes de causa cardíaca 8 y 10, res pectivamente. La supervivencia a los 5, 10 y 15 años fue del 93,33 ± 2,4%, 84,61 ± 4% y 73,28 ± 6,8% en el grupo de la doble mamaria y del 91,71 ± 2,8%, 85,18 ± 3,8% y 65,26 ± 9,2% en el de mamaria única, sin que se alcanzaran diferencias significativas entre ambos grupos (fig. 1). El análisis de regresión de Cox puso de manifiesto que la edad (RR = 1,06) fue el único factor de riesgo independiente de mortalidad (ta bla 4). La revascularización completa y el empleo de dos AMI resultaron protectores, pero no alcanzaron significación estadística.
Fig. 1. Supervivencia en el seguimiento de los pacientes revascularizados con doble mamaria (D-AMI) respecto a los de mamaria única (U-AMI). Método de Kaplan-Meier.
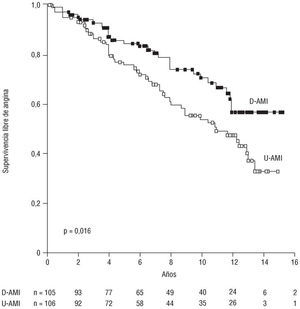
El porcentaje de pacientes libres de angina en el seguimiento a los 5, 10 y 15 años fue del 84,59 ± 3,8%, 70,37 ± 5,4% y 56,76 ± 6,7% en el grupo de la doble mamaria y del 74,44 ± 4,6%, 52,45 ± 5,6% y 35,31 ± 6,5% en el grupo de la mamaria única (p = 0,016) (fig. 2). En el análisis multivariante (tabla 5) la FEVI severamente deprimida (RR = 2,7) y la hipercolesterolemia (RR = 2,1) fueron predictores de angina, mientras que la revascularización con doble mamaria se comportó como factor protector (RR = 0,54).
Fig. 2. Tiempo libre de angina de los pacientes que recibieron doble mamaria (D-AMI) respecto a los de mamaria única (U-AMI). Método de Kaplan-Meier.
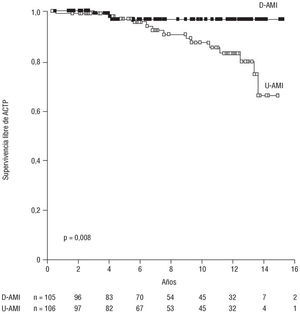
La necesidad de ACTP durante el seguimiento a los 5 y 10 años fue del 3,58 ± 2% y 3,98 ± 2% en el grupo de la doble mamaria y del 3,44 ± 1,9% y 12,99 ± 4,1% en el grupo de mamaria única (p = 0,008). A los 15 años, el porcentaje de pacientes libres de ACTP fue del 96,42 ± 2,0% en el grupo de D-AMI y del 65,94 ± 1,0% en el grupo de U-AMI (fig. 3). En el análisis multivariante (tabla 6), la hipercolesterolemia (RR = 3,45) resultó ser un factor de riesgo, mientras que el empleo de doble mamaria (RR = 0,18) se comportó como un factor protector independiente. La revascularización completa, aunque aparece como un factor protector, no alcanzó significación.
Fig. 3. Tiempo libre de angioplastia coronaria transluminal percutánea (ACTP) en los pacientes del grupo de doble mamaria (D-AMI) respecto a los de mamaria única (U-AMI). Método de Kaplan-Meier.
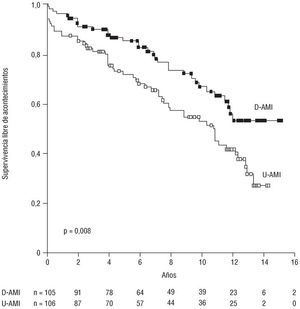
La recurrencia de acontecimientos cardiológicos en el seguimiento a los 5 y 10 años fue del 15 ± 3,7% y 33,48 ± 5,5% para los pacientes con doble mamaria y del 29,58 ± 4,7% y 48,48 ± 5,5% para los de una ma maria (p = 0,008) (fig. 4). A los 15 años, el porcentaje de pacientes libres de acontecimientos fue del 52,96 ± 6,7% y 26,88 ± 6,8%, respectivamente. En el análisis multivariante (tabla 7), la edad (RR = 1,08) y la fracción de eyección severamente deprimida (RR = 3,38) resultaron factores de riesgo, mientras que el empleo de ambas mamarias resultó ser un factor protector (RR = 0,60) para dicho acontecimiento.
Fig. 4. Tiempo libre de acontecimientos cardiológicos en los pacientes con doble mamaria (D-AMI) respecto a los de mamaria única (U-AMI). Método de Kaplan-Meier.
No hubo diferencias significativas en la recurrencia de IM (D-AMI: 9,2%; U-AMI: 19,8%) y cirugía iterativa (D-AMI: 3,1%; U-AMI: 10,5%) a los 15 años, aunque ambos acontecimientos fueron menos frecuentes en el grupo de pacientes revascularizados con dos mamarias.
Durante el segu imiento (media 6,57 años) 39 pacientes fueron revaluados mediante coronariografía por recurrencia de angina, IM u otro acontecimiento. Se estudiaron 56 arterias mamarias con una permeabilidad global del 83,6%, ligeramente superior para la mamaria izquierda (84,6%) que para la derecha (81,3%), y 53 injertos venosos con una permeabilidad del 53%.
En lo referente a la medicación prescrita al paciente en el momento del seguimiento, el 91% de los enfermos tomaba antiagregantes y/o hipolipemiantes. No hubo diferencias significativas en el número de pacientes que tomaban uno (D-AMI 32,7%; U-AMI 34,4%) o dos (D-AMI 13,4%; U-AMI 19,4%) antianginosos en ambos grupos, mientras que los que tenían prescritos tres antianginosos fueron superiores en el grupo de mamaria única (D-AMI 6,1%; U-AMI 15,1%) (p = 0,02). Por otro lado, el porcentaje de pacientes sin medicación antianginosa fue significativamente superior (p = 0,006) en el grupo de doble AMI (47,8%) respecto al de una mamaria (31,2%).
DISCUSIÓN
La supervivencia y la ausencia de acontecimientos cardiológicos en la evolución a largo plazo tras la revascularización coronaria está en relación con la revascularización completa, progresión de la enfermedad y permeabilidad de los injertos, aunque el empleo de la AMI para revascularizar la descendente anterior es el principal determinante de la supervivencia4,5.
La AMI presenta una excelente permeabilidad a largo plazo debido a su resistencia a la arteriosclerosis1,12,13, lo que, junto a su capacidad de regulación del flujo14,15, su reducida vasorreactividad y su diámetro16, hacen, de ella el injerto de elección. La AMI izquierda anastomosada a la descendente anterior se asocia a una menor mortalidad operatoria17-19, menor recurrencia de acontecimientos cardiológicos y mayor supervivencia en el seguimiento 4-9,20 , constituyendo el objetivo primordial en la revascularización coronaria.
Animados por los buenos resultados obtenidos con la AMI izquierda, pronto se inició el uso de ambas AMI21,22. Inicialmente se describió un incremento en los tiempos quirúrgicos y en la mortalidad operatoria23,24, incidencia de mediastinitis (sobre todo cuando se asociaban diabetes mellitus, obesidad o intubación prolongada)18,23,25,26, necesidad de transfusiones27, reintervenciones por sangrado23,28 y problemas respiratorios22 en relación al empleo de ambas mamarias, no corroborado en estudios más recientes29,30, lo que condujo a reservar esta estrategia de revascularización a varones jóvenes, no diabéticos ni obesos25,31.
Se han descrito diferentes técnicas32 para la revascularización miocárdica con las dos arterias mamarias. Aunque la estrategia de revascularización con la segunda AMI varía en los diferentes grupos, ésta debería anastomosarse a la segunda coronaria lesionada en importancia (tras la descendente anterior) en relación al tamaño del vaso y a la masa de miocardio perfundido por la coronaria a pontar33. La AMI derecha pediculada puede emplearse para revascularizar el territorio izquierdo, anterior a la aorta, para anastomosarse a la descendente anterior y las ramas diagonales, o a través del seno transverso34, para alcanzar las ramas de la circunfleja. Cuando se emplea anterior a la aorta, la arteria mamaria puede lesionarse en una segunda intervención, y si se emplea a través del seno transverso pueden producirse torsiones del pedículo, el sangrado de colaterales de la AMI es difícil de controlar y el pinzado aórtico en la cirugía iterativa puede lesionar el injerto31. El empleo de la AMI derecha pediculada para revascularizar la coronaria derecha puede plantear diversos problemas. La zona próxima a la bifurcación de la coronaria derecha desarrolla arteriosclerosis con gran frecuencia24,35, por lo que la AMI debe anastomosarse a la interventricular posterior o ramas posterolaterales36, con lo que se pueden producir tensiones en la anastomosis. En nuestra serie, cuando se empleó la AMI derecha para revascularizar el territorio derecho (24% de los pacientes) se usó preferentemente pediculada y anastomosada a la coronaria derecha distal, realizándose, si era necesario, una incisión en el pericardio a la altura de la cava superior para evitar tensiones en la anastomosis. Cuando se anastomosó al territorio izquierdo se empleó pediculada en la mayoría de las ocasiones, anterior a la aorta en 25 pacientes y a través del seno transverso en 29. El empleo de la AMI derecha libre para revascularizar el territorio de la circunfleja se generalizó en los últimos años de la serie para evitar los inconvenientes de la disposición retroaórtica, preservando la mamaria izquierda para revascularizar la descendente anterior. Los tiempos de circulación extracorpórea y pinzado aórtico fueron ligeramente superiores en el grupo de la doble mamaria respecto al de mamaria única, pero sin llegar a alcanzar trascendencia clínica, puesto que la morbimortalidad operatoria fue similar en ambos grupos. Pick et al30 obtienen resultados similares en este punto.
La incidencia de complicaciones infecciosas en nuestra serie es similar en ambos grupos y sensiblemente superior a la comunicada por otros autores27,28,30, aunque se concentra en los primeros 4 años (1984-1988) del empleo de la AMI (8 casos en el grupo U-AMI y nueve en el D-AMI durante este período, frente a 4 y 3, respectivamente, durante el resto del estudio). Este hecho puede tener relación con la curva de aprendizaje (uso abusivo del bisturí eléctrico inicialmente) y una epidemia de infecciones quirúrgicas por Serratia marcescens transmitida por la rasuradora del peluquero.
Nuestra mortalidad hospitalaria, aunque sensiblemente superior a la de series más recientes (0,6-0,7%)30,37, es similar a la hallada en estudios previos (1,2-2,7%)24,31,35,38,39.
La existencia de resultados contradictorios en la bibliografía sobre el beneficio del empleo de ambas mamarias responde a varios factores. Existen con frecuencia, por lo señalado anteriormente, sesgos en la selección de los pacientes en los que se emplean las dos mamarias, se trata de estudios retrospectivos y en algunas series los resultados no están ajustados a otros factores de riesgo. Por otro lado, el beneficio en la supervivencia derivado del uso de ambas mamarias resulta difícil de demostrar, puesto que la importancia pronóstica de la enfermedad de la descendente anterior es superior al resto de vasos (mayor miocardio en riesgo)4,5,40-42 y se requieren seguimientos prolongados y en un número importante de pacientes37. Además, la configuración anatómica de los injertos, especialmente la localización de la segunda mamaria, puede tener importancia; así, Schmidt et al35 obtienen una mayor supervivencia a los 8 años en los pacientes en los que ambas AMI se anastomosan al territorio izquierdo.
En cuanto a la reducción de acontecimientos isquémicos, los resultados de la bibliografía, aunque no son uniformes, son más constantes que los obtenidos con la supervivencia. Fiore24 (100 D-AMI frente a 100 U-AMI) encuentra una reducción en la recurrencia de angina (el 64 frente al 73%), infarto de miocardio (el 25 frente al 41%) y acontecimientos isquémicos (el 68 frente al 82%) a los 15 años en el grupo revascularizado con doble mamaria. No hubo diferencias entre ambos grupos en la cirugía iterativa y recurrencia de ACTP, aunque ambos acontecimientos fueron menos frecuentes en el grupo en que se usaron dos mamarias. Pick30 (160 D-AMI frente a 161 U-AMI) observó a los 10 años una recurrencia de la angina dos veces superior en el grupo de mamaria única (el 33% en D-AMI frente al 63% en U-AMI). La recurrencia de infarto (el 7% en D-AMI frente al 19% en U-AMI) y acontecimiento cardiológico (el 34% en D-AMI frente al 62% en U-AMI) fueron también menores en el grupo revascularizado con dos mamarias. Buxton43 (1.269 D-AMI frente a 1.557 U-AMI) obtiene un mayor tiempo libre de infarto y cirugía iterativa en el grupo de dos mamarias, aunque el empleo de una única mamaria se comportó como un predictor débil (RR = 1,3) en relación a otros factores (disfunción ventricular [RR = 3,1], edad [RR = 3,4], etc.). Sergeant44 encontró una menor recurrencia de angina en los pacientes con una revascularización arterial más extensa, aunque el beneficio clínico era escaso (del 5% a los 10 años). Lytle37 (2.001 D-AMI frente a 8.123 U-AMI) observó una menor recurrencia de angioplastias e incidencia de cirugía iterativa a los 10 años en los pacientes con dos mamarias, incluso en el grupo de más riesgo. El subgrupo en el que la segunda AMI se anastomosó al territorio derecho presentó un mayor riesgo de reintervención. El beneficio para cada uno de los acontecimientos a los 12 años de seguimiento era del 2% una vez eliminado, mediante el análisis de riesgos competitivos, el efecto de la reducción de pacientes en riesgo por la mortalidad45. Existen, sin embargo, diversos estudios que no encuentran ventajas en la reducción de acontecimientos isquémicos con el empleo de ambas mamarias. Farinas46 (200 D-AMI frente a 200 U-AMI) no observó diferencias entre ambos grupos en la recurrencia de angina, infarto y cirugía iterativa a los 8 años. La ACTP fue más frecuente en los pacientes en los que se emplearon dos mamarias, aunque este grupo era más desfavorable. Berreklouw38 (143 D-AMI frente a 143 U-AMI) y Carrel47 (80 D-AMI frente a 80 U-AMI) con 8 años, Dewar48 (377 D-AMI frente a 765 U-AMI) y Morris49 (643 D-AMI frente a 420 U-AMI) con 7 y 4 años de seguimiento, respectivamente, tampoco hallaron diferencias en la reducción de acontecimientos isquémicos cuando compararon el uso de una y dos mamarias. Sergeant50, con un seguimiento medio de 6,4 años, no observó diferencias en la recurrencia de infarto entre ambas estrategias.
En lo que a supervivencia se refiere, Pick30 halló una reducción significativa de las muertes cardíacas a los 10 años en los pacientes en los que se emplearon dos mamarias, aunque la supervivencia global fue similar en ambos grupos. Buxton43 obtuvo una mayor supervivencia en el grupo de dos mamarias (un 86% en D-AMI frente a un 71% en U-AMI). La serie más amplia y con un mayor seguimiento es la de Lytle37,45 (2.001 D-AMI frente a 8.120 U-AMI), con un seguimiento medio de 10 años, en la que se observó en el grupo de doble mamaria una mayor supervivencia, aunque pequeña (un 0,5% por año de seguimiento), en todos los subgrupos, incluidos los de mayor edad y riesgo, diferencias que se mantuvieron en el tiempo. Ningún otro estudio ha encontrado diferencias significativas en la supervivencia, aunque la reducción en los acontecimientos isquémicos con el empleo de ambas arterias mamarias refuerza la idea de que su uso puede disminuir la mortalidad a largo plazo30.
En nuestra serie, los pacientes revascularizados con doble mamaria presentaron menor recurrencia de angina, necesidad de ACTP y acontecimientos cardiológicos en su evolución. El empleo de dos AMI se comportó como un factor protector independiente en el análisis multivariante. El menor uso de antianginosos en el grupo de la doble mamaria apoya estos hallazgos. Los resultados del análisis multivariante son congruentes con otras series5,47,51. Sorprende que la revascularización incompleta resulte ser un factor de riesgo independiente para la recurrencia de angina, pero no para la necesidad de angioplastia en el seguimiento. No se obtuvieron diferencias en la supervivencia entre ambos grupos, aunque las curvas divergen a partir de los 14 años. La edad fue el único predictor de mortalidad a largo plazo en el análisis multivariante. Otros factores clásicos de mal pronóstico, como el deterioro de la función ventricular, no alcanzaron significación. La revascularización completa y el empleo de las dos mamarias se comportaron como protectores, pero sin alcanzar significación.
Algunos autores recomiendan el uso de ambas AMI en pacientes con una expectativa de vida superior a 10 años24, puesto que los beneficios en la supervivencia derivados del empleo de una segunda mamaria no aparecerían con anterioridad. Lytle et al hallaron, sin embargo, que incluso los grupos de mayor edad se beneficiaban de la mejora en la supervivencia37 y en la menor tasa de reintervenciones45 con el uso de ambas AMI.
La permeabilidad de la AMI derecha es similar a la de la izquierda y está en función del calibre del vaso anastomosado36. En nuestra serie, aunque el número de pacientes revaluados fue reducido, la permeabilidad fue similar en ambas arterias mamarias (81 en AMI derecha frente a 85 en AMI izquierda) y similar a la encontrada por otros autores30. Los pacientes revaluados lo fueron por recidiva de síntomas, por lo que es de esperar una permeabilidad superior en la población asintomática.
Diversos autores han encontrado mejores resultados en la supervivencia35,46 y una menor incidencia de cirugía iterativa37 cuando se emplean ambas mamarias para revascularil territorio izquierdo. En nuestra serie no hubo diferencias en la supervivencia entre los pacientes en los que la segunda mamaria se empleó para revascularizar el territorio derecho y aquellos en los que se usó anastomosada al territorio izquierdo.
CONCLUSIONES
Mediante el empleo de ambas arterias mamarias para la revascularización miocárdica se consigue una mayor reducción de acontecimientos en el seguimiento (recurrencia de angina, necesidad de ACTP y aparición de acontecimientos cardiológicos), sin que se incremente la morbilidad operatoria, por lo que su uso parece justificado.
Limitaciones del estudio
Nuestro estudio es retrospectivo, aunque realizamos un análisis multivariante en un intento de eliminar los posibles sesgos de selección.
Aunque ambos grupos fueron homogéneos en relación a los factores de riesgo cardiovascular y extensión de la enfermedad, dado que el empleo de dos mamarias para la revascularización miocárdica se hizo en función de las preferencias del cirujano, el grupo a estudio podría tener características diferentes a las de la población general de pacientes sometidos a pontaje coronario.
AGRADECIMIENTO
A Pilar y Sonia, secretarias del Servicio de Cirugía Cardiovascular, por su inestimable colaboración en la localización de los pacientes.
Correspondencia: Dr. F.J. López Rodríguez. Servicio de Cirugía Cardíaca. Hospital General Universitario Gregorio Marañón. Dr. Esquerdo, 46. 28007 Madrid. Correo electrónico: jlopezro@wanadoo.es Recibido el 19 de octubre del 2000. Aceptado para su publicación el 25 del enero del 2001.