Palabras clave
INTRODUCCION
La utilización de antagonistas del receptor GP IIb/IIIa es actualmente frecuente en el laboratorio de cateterismo, ya que han conseguido reducir de forma muy importante las complicaciones isquémicas tras revascularización coronaria percutánea1-5. La posibilidad de valorar la función de las plaquetas en el laboratorio de cateterismo contribuiría a optimizar la terapia antiplaquetaria para cada paciente con objeto de obtener el máximo beneficio con el mínimo riesgo. Por distintos mecanismos según su naturaleza, estos agentes bloquean la unión del fibrinógeno plasmático al receptor de las plaquetas, activado por el contacto con las sustancias trombogénicas subendoteliales que se exponen a la circulación tras la rotura mecánica de la placa de ateroma y la introducción de material exógeno durante el procedimiento6-8. Esto impide que se establezcan puentes de fibrinógeno entre las plaquetas y, por tanto, que se formen agregados, que son la base estructural y bioquímica para el desarrollo de un trombo, el cual puede ocluir total o parcialmente la luz del vaso y microembolizar distalmente, comprometiendo los resultados de la intervención9-11.
Estudios realizados con muestras reducidas de pacientes basándose en el bloqueo del receptor GP IIb/IIIa, la inhibición de la agregación plaquetaria, el desarrollo de trombos y las características farmacológicas de cada antagonista, han establecido pautas estandarizadas de tratamiento para cada uno de ellos12-16.
No obstante, a pesar de los buenos resultados generales conseguidos como grupo terapéutico se ha observado que existen no sólo diferencias farmacológicas entre ellos, sino variaciones interindividuales en su acción biológica sobre las plaquetas, cuya repercusión clínica no se conoce con exactitud17-19.
Por otro lado, la utilización actual de los antagonistas del receptor GP IIb/IIIa en períodos de tiempo más largos que el de la angioplastia, como es el síndrome coronario agudo, y su empleo por vía oral o transdermal en la prevención secundaria de las complicaciones isquémicas a largo plazo en la enfermedad aterosclerótica, actualmente en ensayos en fase III y IV, ha hecho plantearse si estas variaciones interindividuales en la inhibición funcional de las plaquetas pueden hacer necesario un control analítico para establecer un nivel óptimo de eficacia y seguridad con estos agentes20-22.
El objetivo de este trabajo ha sido valorar, en pacientes sometidos a procedimientos de revascularización percutánea y tratados con fragmento quimérico del anticuerpo monoclonal 7E3 contra el receptor GPIIb/IIIa (abciximab)23, su acción sobre algunos aspectos biológicos de las plaquetas. Por un lado, la reactividad de éstas a la acción de distintos agonistas y, por otro, el estado de activación de las plaquetas circulantes para así poder tener un mejor conocimiento en la utilización de estos nuevos agentes antiplaquetarios.
PACIENTES Y MÉTODOS
Pacientes
Diseñamos entre el laboratorio de cateterismo y el servicio de hematología de nuestro hospital un estudio biológico, prospectivo, en el que se incluyeron 15 pacientes, 14 varones y una mujer, con una edad media de 67 años (rango, 40-77). La indicación de angioplastia fue angina inestable en ocho, IAM sin onda Q en dos e IAM con onda Q en cinco. Todos los pacientes antes del procedimiento estaban en tratamiento habitual con ácido acetilsalicílico (AAS), excepto uno que estaba siendo tratado con ticlopidina por intolerancia a la aspirina. Ningún paciente había sido tratado previamente con inhibidores GP IIb/IIIa o con heparina. Se excluyeron del estudio aquellos pacientes que tenían antecedentes de sangrado o intervención quirúrgica reciente.
El procedimiento consistió en angioplastia con stent y se realizó de manera estándar por punción percutánea femoral derecha. Todos los pacientes, antes de comenzar el procedimiento recibieron 500 mg de AAS intravenoso, 70 U/kg de heparina sódica intravenosa y abciximab en bolo de 0,25 mg/kg seguido de infusión de 0,125 mg/kg/min durante 12 h. Todos los pacientes, al finalizar el procedimiento, recibieron ticlopidina, 500 mg vía oral, que se continuó durante un mes, junto a AAS, 200 mg. Los introductores fueron retirados a las 5 h previa comprobación de normalización del tiempo de cefalina.
Métodos
Se recogieron muestras de sangre arterial basalmente antes de administrar la medicación, a los 15 min de administrada la heparina y el bolo de abciximab y al finalizar el procedimiento. Por último se realizó la última extracción de sangre venosa a las 24 h del procedimiento.
De cada muestra se recogieron 10 ml de sangre en tubos con citrato sódico 0,129 mol/l, equivalente a 3,8% de citrato sódico (Vacutainer, Becton-Dickinson) para la agregación plaquetaria y el análisis de la capacidad hemostática global de las plaquetas (analizador PFA-100®). Otros 4 ml de sangre recogidos en tubos con EDTA tripotásico se destinaron al hemograma y, finalmente, 2 ml de sangre recogida sobre citrato sódico 0,129 mol/l fueron inmediatamente mezclados con un volumen equivalente de paraformaldehído al 1% para el estudio de citometría de flujo24.
En cada muestra de sangre se analizaron los siguientes parámetros:
1. Recuento de plaquetas, leucocitos y hemoglobina en un autoanalizador hematológico CellDynn-4000 (Abbott Diagnósticos).
2. Para valorar la función de las plaquetas y estudiar su capacidad hemostática global se utilizó el analizador PFA-100® (Dade-Boehring). Este sistema está diseñado para medir la adhesión y la agregación plaquetaria en sangre total con unas condiciones determinadas de flujo. Se basa en la medida del tiempo que tarda en ocluirse (TO), por la acción de 10 µg de bitartrato de adrenalina (TO Col-E) o 50 µg de ADP (TO Col-ADP), un poro de 150 µm de diámetro que se ha practicado en una membrana impregnada con 2 µg de colágeno tipo I al pasar a su través sangre total anticoagulada a altas fuerzas de cizallamiento (5.000-6.000 s- 1)25,26. Dado que la membrana con adrenalina está diseñada para ser sensible a los pacientes que toman AAS, mientras que la de ADP no lo está, en este trabajo se empleó sólo la membrana con ADP para no enmascarar los resultados. Esta determinación se realizó en un período de tiempo inferior a 2 h desde la extracción de la sangre.
3. La agregación plaquetaria se realizó en plasma rico en plaquetas (PRP) según el método clásico de Born27 en un agregómetro Bio Dade PAP4. El PRP se preparó centrifugando sangre total citratada a 200 g durante 10 min a temperatura ambiente. El número de plaquetas se ajustó entre 200-300 x 109 l con su propio plasma pobre (PPP) obtenido al centrifugar parte del plasma a 2.000 g durante 15 min. Como agente activador se utilizó ADP a las concentraciones finales de 5 y 20 µmol/l porque la relación de su receptor en la membrana de las plaquetas con el complejo IIb/IIIa28,29 ha hecho que sea el agente activador predominantemente empleado en los estudios para valorar la acción antiagregante de los antagonistas de este complejo. Se registró el porcentaje máximo de agregación a los 4 min de añadir el agonista. Los cambios en las distintas determinaciones se expresaron como porcentajes de inhibición según la fórmula:
% inhibición = (%A0 - %A1,2,3)/%A0 x 100
en donde A0 es la agregación basal y A1,2,3 es la agregación realizada en cada determinación. Con el fin de eliminar en la expresión de los resultados los efectos de la toma habitual de cualquier medicación antiagregante se consideró arbitrariamente que la inhibición en la determinación basal era 0; de esta manera, los incrementos de inhibición de la agregación que se produjesen serían debidos exclusivamente a los agentes antiplaquetarios que se utilizasen en la intervención.
4. Para el estudio de la activación plaquetaria por citometría de flujo se emplearon anticuerpos monoclonales (AcMo) comerciales de ratón con especificidad contra las plaquetas humanas, conjugados con fluorocromos adecuados. Los AcMo usados fueron glucoforina (marcador eritrocitario), CD45 (marcador panleucocitario), CD61 (marcador panplaquetario) y CD62-p (P-selectina). Como controles negativos se usaron AcMo irrelevantes específicos de isotipo (todos los AcMo usados fueron suministrados por Becton & Dickinson). Se utilizó el citómetro de flujo FACScan® (Becton-Dickinson) para medir las plaquetas marcadas con los AcMo, utilizando amplificación logarítmica y una velocidad lenta de adquisición. Antes de las medidas de citometría, el aparato fue alineado ópticamente con el programa de calibración Cafibrite® (Becton-Dickinson). La velocidad de adquisición fue de 1.300 partículas/s y se registraron 15.000 acontecimientos para cada marcaje. Las plaquetas se identificaron como las partículas marcadas glucoforina-/CD45-/CD61+ 30.
Método estadístico
Debido a que los datos analizados no seguían una distribución normal se emplearon ensayos no paramétricos como el test de Friedman para medidas repetidas y la U de Mann Whitney para las comparaciones entre grupos, mientras que las correlaciones se establecieron con el test de Spearman. Los valores de TO Col-ADP superiores a 300 s y que el sistema PFA-100® no determinaba cuantitativamente por estar fuera de su escala se consideraron de manera arbitraria como iguales a 301 s para su manejo estadístico. Se consideraron como significativos los valores con una p < 0,05.
RESULTADOS
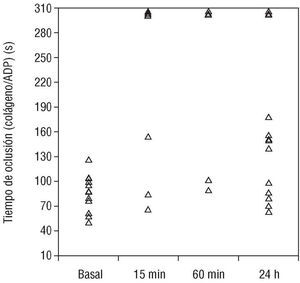
En la determinación basal, el tiempo de oclusión con ADP (TO Col-ADP) de los pacientes estaba dentro de los límites de la normalidad (mediana, 91; rango, 52-118 s) aunque todos ellos llevaban un tratamiento antiagregante de forma habitual. En las determinaciones a los 15 min de administrado el bolo de abciximab y al finalizar la intervención, 13 de los 15 pacientes presentaron valores de TO Col-ADP por encima de 300 s (mediana, 301 s; rango, 67-301 s y mediana, 301 s; rango, 91-301 s, respectivamente). A las 24 h, 6 pacientes tenían ya valores dentro de los rangos normales y la mediana del grupo estaba en 155 s (rango, 64-301 s). En 2 pacientes los valores de TO Col-ADP se mantuvieron dentro del rango normal a lo largo de todo el estudio. Los cambios de este parámetro en el tiempo fueron significativos (p < 0,05) (fig. l).
Fig. 1. Tiempo de oclusión colágeno/ADP en segundos en las 4 determinaciones del estudio.
Los resultados de la agregación plaquetaria inducida por ADP 5 y 20 µmol/l ponen de manifiesto también cambios significativos en el grupo total de pacientes (p < 0,05). A los 15 min de administrado el bolo de abciximab y al finalizar la intervención, la inhibición de la agregación inducida por ADP 5 µmol/l presentó una mediana del 88% (rango, 5-100%) y de 100% (rango, 12-100%), respectivamente, disminuyendo a las 24 h hasta una mediana del 75% (rango, 27-100%) (fig. 2). Cuando se utilizó ADP 20 µmol/l, los valores de la mediana fueron de 84% (2-97%), 83% (4-100%) y 59% (0-87%) a los 15 min, al finalizar la intervención y a las 24 h, respectivamente (fig. 2). Los 2 pacientes cuyo tiempo de oclusión se mantuvo siempre dentro de valores normales no mostraron cambios significativos en la agregación plaquetaria. El TO Col-ADP y la inhibición de la agregación plaquetaria inducida por ADP 5 y 20 µmol/l presentaron una correlación significativa (p = 0,02) en las muestras extraídas a los 15 min tras el bolo de abciximab, pero no se correlacionaron (p = 0,092) al finalizar la intervención. A las 24 h tampoco había correlación entre estos dos parámetros.
Fig. 2. Porcentaje de inhibición de la agregación plaquetaria. Los cuadrados representan el porcentaje de inhibición usando como agonista ADP 5 µmol/l y los círculos ADP 20 µmol/l.
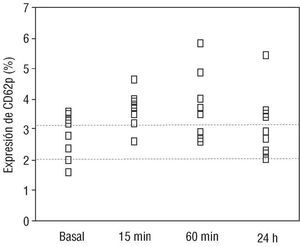
Los valores basales de P-selectina aumentaron a los 15 min de administrado el bolo de abciximab y al finalizar el procedimiento, para descender a valores casi normales a las 24 h. Estos cambios presentaron significación estadística (p < 0,05) (fig. 3).
Fig. 3. Porcentaje de expresión del marcador de activación plaquetaria P-selectina.
Los valores numéricos de estos parámetros se exponen en la tabla 1.
En el hemograma no se detectaron cambios significativos después del tratamiento con abciximab.
En todos los pacientes la angioplastia se completó con éxito, excepto en uno, que pasó a cirugía urgente de revascularización por quedarse un stent no expandido dentro del árbol coronario. Perintervención y antes del alta hospitalaria ninguno de los pacientes presentó episodios hemorrágicos o trombóticos. Uno de los pacientes en los que no se consiguió un adecuado nivel de inhibición de la agregación plaquetaria continuó con episodios de dolor torácico después del procedimiento, decidiéndose heparinización intravenosa y controlándose los síntomas.
DISCUSION
La introducción de antagonistas GP IIb/IIIa como agentes terapéuticos en el laboratorio de cateterismo y en el tratamiento de síndromes coronarios agudos ha demostrado un claro beneficio clínico. Sin embargo, hay varias cuestiones que todavía no están bien aclaradas. Entre otras, si hay variabilidad interindividual en respuesta a las dosis estandarizadas de estos agentes o si esta variabilidad persiste a lo largo del tiempo de infusión. Respecto a los controles biológicos, todavía hay dudas respecto al parámetro que mejor nos indicaría la efectividad de estos tratamientos (concentraciones del fármaco en plasma, número de receptores IIb/IIIa ocupados, porcentaje de receptores bloqueados), cuál sería el mejor agonista (colágeno, ADP, otros) para la valoración de la agregación plaquetaria y a qué concentración (5 o 20 µmol/l) y si en el futuro se pudiese monitorizar estos tratamientos en el laboratorio de hemodinámica o en la unidad coronaria de una manera rápida, barata y sencilla. En este trabajo hemos estudiado algunos aspectos biológicos de la acción del abciximab sobre las plaquetas en pacientes sometidos a intevencionismo coronario.
Abciximab (C7E3 Fab) es un anticuerpo monoclonal quimérico dirigido contra el receptor GP IIb/IIIa y es el primer antagonista de dicho receptor desarrollado y utilizado en clínica23,31. Se trata de una molécula grande (50 kDa) que bloquea de manera no específica, quizá por impedimento estérico, pero con gran afinidad32,33, la unión del fibrinógeno al receptor GP IIb/IIIa y también la de otros ligandos, como la fibronectina, la vitronectina y el factor von Willebrand (vW)34.
Se ha demostrado la existencia de una importante correlación entre el bloqueo de los receptores GP IIb/IIIa por parte de este agente y la inhibición de la agregación de las plaquetas35, estableciéndose que la eficacia antitrombótica en los procedimientos de revascularización coronaria percutánea se consigue cuando se alcanza más del 80% de bloqueo de los receptores GP IIb/IIIa por el antagonista29,36-39.
El análisis de nuestros resultados demuestra que la mayoría de los pacientes tratados tienen una inhibición del 80% de la agregación de las plaquetas después del bolo de abciximab y al finalizar la intervención, tanto cuando se induce con ADP 5 o 20 µmol/l. Sin embargo, a las 24 h sólo el 20 y el 15%, respectivamente, de los pacientes presentaron este grado de inhibición y dos de ellos (13%) no presentaron ninguna a lo largo de todo el estudio. Esta importante variabilidad interindividual indicaría que en un determinado número de pacientes no habríamos conseguido el objetivo biológico de inhibir la agregación plaquetaria a concentraciones eficaces a las 24 h y en dos en ningún momento. La variación en la respuesta al bloqueo de los receptores por parte de los antagonistas del complejo GP IIb/IIIa ha sido atribuida a diferencias en el número de plaquetas, densidad de receptores, competencia intrínseca funcional, valores de cofactores plasmáticos y características de la propia intervención coronaria40-43, sin que todavía esté definida la importancia de cada uno de estos factores. Aunque ninguno de ellos ha sido estudiado en este trabajo, dada la complejidad técnica de algunos, sí consideramos que deben ser el objetivo de otros en el futuro.
En cuanto a la acción de abciximab sobre la interacción de las plaquetas en el sistema PFA-100®, encontramos que se produce una gran prolongación del TO Col-ADP mayor de 300 s a los 15 min y al finalizar la intervención en el 86% de nuestros pacientes, y a las 24 h todavía el 66% tenía valores anormales de este parámetro. Los 2 pacientes que no presentaron cambios en la agregación plaquetaria mantuvieron valores normales del TO Col-ADP en todo el estudio.
Estos resultados reflejan la inhibición que produce abciximab no sólo sobre la activación de las plaquetas por el colágeno y el ADP de la membrana, sino por las altas fuerzas de cizalla del sistema PFA-100®. De algún modo se reproducen las condiciones de flujo de una arteria estenosada, siendo por sí solas potentes agonistas de la agregación plaquetaria44,45. En estas condiciones hemodinámicas, el factor vW se une al receptor GP IIb/IIIa y es el que establece los puentes interplaquetarios46,47, a diferencia del fibrinógeno, que los establece con fuerzas de cizalla bajas48. Por tanto, las variaciones encon tradas en este parámetro en nuestros pacientes tratados con abciximab pueden deberse no sólo a factores plaquetarios, sino al factor vW plasmático que está considerado como un factor de riesgo trombótico49. Aunque es necesario estudiar un mayor número de pacientes para establecer conclusiones prácticas, estos resultados podrían justificar la necesidad de monitorización intraoperatoria en el laboratorio de hemodinámica para conocer el grado de efectividad biológica del tratamiento. Además, la posibilidad de saber el grado de inhibición de la agregación de las plaquetas una vez terminada la infusión de abciximab ayudaría a determinar el riesgo hemorrágico sabiendo que por debajo del 50% de inhibición éste es bajo. En nuestro grupo de pacientes todavía el 20% tenía más del 80% de inhibición 12 h después de suspendida la infusión.
La inhibición de la agregación de las plaquetas y el aumento del TO Col-ADP se correlacionan en los momentos del procedimiento donde hay la mayor concentración de abciximab en sangre, indicando que, aunque explorando distintos aspectos del funcionalismo de las plaquetas, ambas técnicas pueden valorar la acción de este antagonista cuando se produce un bloqueo importante de los receptores IIb/IIIa50. A las 24 h se encontró una recuperación menor en el tiempo de oclusión que en la inhibición de la agregación plaquetaria, con pérdida de la correlación entre ambas técnicas. Esto podría explicarse por el diferente tipo de muestra utilizado, sangre total o PRP, y su manipulación51 y/o por la poca capacidad discriminativa del sistema PFA-100® cuando se reduce el bloqueo de receptores por debajo del 60%52.
Otro aspecto estudiado en nuestros pacientes ha sido la activación de las plaquetas circulantes reflejada por la expresión de P-selectina, glucoproteína de 140 kDa localizada en los gránulos de las plaquetas que tiene la propiedad de translocarse a la membrana plasmática celular cuando la plaqueta se activa53. Se han encontrado concentraciones elevadas de expresión de P-selectina de las plaquetas en diversas situaciones clínicas asociadas a trombosis arterial54-58. Su acción, además de indicar activación, es la de mediar en la interacción de las plaquetas activadas con las células endoteliales asimismo activadas, los neutrófilos y los monocitos, contribuyendo a la relación de las células hemáticas con la pared del vaso59. Recientemente se ha señalado el papel que tendría la P-selectina en la agregación de las plaquetas producida por grandes fuerzas de cizalla60, que es independiente de la agregación asociada a cambios en el receptor IIb/IIIa. Nuestros pacientes no tenían basalmente aumentada la expresión de la P-selectina, como refieren otros investigadores57, lo que podría deberse al escaso número de pacientes diagnosticados de IAM con onda Q en nuestro grupo (5/15), a diferencia de lo que ocurre con dichos autores. Sin embargo, a los 15 min de la intervención y al final de ésta se produjo un aumento significativo de este marcador de activación plaquetario que descendió a las 24 h pero sin alcanzar los valores iniciales. Esto parece indicar que el tratamiento con abciximab no inhibe completamente el funcionalismo plaquetario en este tipo de intervención y, como refieren Gawaz et al43, en algunos pacientes la rotura de la placa y la colocación de los stents endovasculares pueden ser muy trombogénicos y la acción de la trombina liberada sobre las plaquetas puede sobrepasar la de los antagonistas del receptor GP IIb/IIIa.
LIMITACIONES DEL ESTUDIO
Aunque este estudio no fue diseñado para evaluar las consecuencias clínicas de no alcanzar un 80% de inhibición de la agregación plaquetaria, entre otras razones por el limitado número de pacientes, otros estudios17 han señalado el aumento de acontecimientos coronarios en estos enfermos.
CONCLUSIONES
Existe una importante variabilidad interindividual en la respuesta a la inhibición plaquetaria de nuestros pacientes tratados con abciximab, tanto expresada como inhibición de la agregación residual como por el aumento del tiempo de obturación medido por el analizador PFA-100® y, como se indica en el estudio GOLD61, esta variabilidad plantea la necesidad de establecer e identificar por algún método el límite inferior efectivo de inhibición plaquetaria en cada individuo, para optimizar su uso en las intervenciones de revascularización coronaria. El sistema PFA-100® detecta de una manera sencilla y rápida las concentraciones elevadas de inhibición funcional de las plaquetas por abciximab, así como las «resistencias» biológicas a este agente antiplaquetario.
El aumento en la expresión de la P-selectina durante el procedimiento hace pensar que en algunas de estas intervenciones, en las que se presuponga un riesgo trombótico sobreañadido (IAM con fibrinólisis, dificultad y prolongación de la intervención, factores protrombóticos en el paciente, etc.), habría que considerar la utilización, junto con los antagonistas del receptor GPIIb/IIIa, de otros agentes antitrombóticos, como los inhibidores directos de la trombina y los antagonistas de la P-selectina57.
Correspondencia: Dra. A. López Pastor. Servicio de Hematología analítica. Hospital Universitario la Paz. P.o de la Castellana, 261. 28046 Madrid.
Correo electrónico: guigaleote@teleline.es Recibido el 3 de enero de 2001. Aceptado para su publicación el 27 de marzo de 2001.