Palabras clave
INTRODUCCIÓN
El síndrome aórtico agudo (SAA) es un proceso agudo de la pared aórtica que se asocia a una alta morbilidad y mortalidad. Está constituido esencialmente por tres entidades: la disección aórtica, el hematoma intramural y la úlcera penetrante1. El SAA afecta aproximadamente a 20-40 casos/millón de habitantes/año2,3, de los cuales el 80% son disecciones; el 15%, hematomas intramurales, y el 5%, úlceras penetrantes. El avance de las técnicas de imagen combinado con el progreso en las técnicas quirúrgicas y endovasculares ha modificado el diagnóstico y el tratamiento de esta enfermedad en los últimos años4-9. Varios estudios han publicado información actualizada sobre el diagnóstico, el tratamiento y el pronóstico de la enfermedad10-18. No obtante, la mayoría aporta datos obtenidos de un solo centro, con series retrospectivas recogidas durante muchos años que no reflejan la realidad actual en el manejo de este trastorno13-16. Por otra parte, otros estudios multicéntricos tienen el sesgo de incluir a pacientes atendidos en centros de excelencia10-12, lo que no permite extrapolar los resultados a la asistencia general.
El objetivo del Registro Español del Síndrome Aórtico fue analizar el diagnóstico, tratamiento y mortalidad del SAA en nuestro país y de ello derivar posibles mejoras en el manejo.
MÉTODOS
Estudio prospectivo, observacional y descriptivo en centros de tercer nivel con disponibilidad de técnicas de imagen, hemodinámica y cirugía cardiaca las 24 h del día. Veinticuatro hospitales terciarios de los 34 propuestos aceptaron participar en el Registro
Español del Síndrome Aórtico. Los centros participantes aceptaron el compromiso de incluir a todos los pacientes atendidos con SAA de forma prospectiva y consecutiva, fueran referidos de otros centros o diagnosticados en el mismo hospital. El periodo de inclusión fue del 1 de enero de 2005 al 31 de diciembre de 2006. Se incluyó a 519 pacientes con SAA, 349 con afección de aorta ascendente (tipo A) y 170 (32,7%) con sólo afección en la aorta descendente (tipo B). En 430 casos (82,9%) se diagnosticó disección aórtica (312 de tipo A y 118 de tipo B); en 72 (13,9%), hematoma intramural (32 de tipo A y 40 de tipo B), y en 17, úlcera penetrante (5 de tipo A y 12 de tipo B). En 8 pacientes con disección de tipo B se evidenció una reextensión retrógrada de la disección a la parte más superior de la aorta ascendente en los primeros días de hospitalización, por lo que finalmente se los consideró 357 SAA de tipo A y 162 de tipo B. El 47,6% de los pacientes fueron referidos de hospitales comarcales o de otros centros hospitalarios sin cirugía cardiaca.
Recogida de datos
Se solicitó a los servicios de cardiología y cirugía cardiaca de cada hospital que participaran, ambos, en la recolección y validación de datos y que seleccionaran a un único coordinador por centro para enviar la información. Los pacientes fueron identificados en el servicio de urgencias, departamentos de imagen y por los informes de alta hospitalarios. El diagnóstico se basó en datos clínicos, información de las técnicas de imagen, hallazgos de la cirugía y/o examen post mórtem. La hoja de recogida de datos incluyó 140 variables con información demográfica, historia clínica, examen físico, técnicas de imagen, tratamiento, mortalidad y complicaciones hospitalarias. Las variables fueron definidas de forma concordante con el Registro IRAD (International Registry of Aortic Dissection)10 para facilitar una posible comparación posterior. El IRAD es un registro internacional que se inició en 1996 con la participación de 24 centros de diferentes países de Europa, Estados Unidos y Japón. Se consideró el antecedente de arteriosclerosis si el paciente había sido diagnosticado previamente de cardiopatía isquémica, arteriopatía obliterente o accidente vascular cerebral. Se definió shock si la presión arterial sistólica era < 80 mmHg y alteración de la función renal si la creatinina era > 1,5 mg/100 ml. Si la información era escasa, se debía rellenar los datos de que se dispusiera, pero siempre se debía incluir el caso. Cualquier duda se solucionó comunicando telefónicamente con el responsable de cada hospital. No se incluyeron en el estudio 14 casos por tratarse de una afección aórtica crónica o de causa postraumática o iatrogénica.
Análisis de datos
Los datos fueron analizados usando el paquete estadístico SPSS 13. Las variables cuantitativas se expresaron como media ± desviación estándar y las cualitativas, en porcentaje. La comparación de variables cuantitativas entre grupos se realizó mediante el test de la t de Student y entre variables cualitativas, mediante el test de la χ2. Un valor de p < 0,05 se consideró significativo.
RESULTADOS
Datos demográficos
Se incluyó a 519 pacientes con SAA, 402 varones (77,4%) y 117 mujeres (22,5%), con una media de edad de 61 ± 13 (intervalo, 20-92) años. Los datos demográficos y los antecedentes patológicos cardiovasculares se recogen en la tabla 1. Respecto a los SAA de tipo A, los pacientes con SAA de tipo B tenían mayor incidencia de factores de riesgo cardiovascular como hipertensión arterial (el 67,5 frente al 79%; p = 0,009), tabaquismo (el 41,5 frente al 52,5%; p = 0,02), dislipemia (el 19,9 frente al 27,8%; p = 0,05) o antecedentes de enfermedad arteriosclerótica (el 14 frente al 29%; p < 0,001). Por el contrario, en los SAA de tipo A fue más frecuente el síndrome de Marfan (el 8,1 frente al 2,5%; p < 0,01) y la valvulopatía aórtica (el 11,5 frente al 3,1%; p < 0,001).
Síntomas, signos exploratorios y pruebas complementarias
El dolor torácico fue el síntoma más frecuente en la presentación (95,9%). En los SAA de tipo A el dolor se localizó más frecuentemente en la parte anterior del tórax que en los tipos B (el 70,8 frente al 43,8%; p < 0,001) y en los SAA de tipo B el dolor se localizó más frecuentemente en la espalda (el 33,9 frente al 56,8%; p < 0,001) o en el abdomen (el 19,6 frente al 28,4%; p < 0,03). Tanto el síncope como el déficit neurológico fueron síntomas más frecuentes en la presentación del SAA de tipo A (el 18,2 y el 11,8%, respectivamente) (tabla 2). La hipertensión arterial en la fase aguda fue más frecuente en el SAA de tipo B (el 31,3 frente al 63%; p < 0,001). Por el contrario, la hipotensión/shock y la insuficiencia cardiaca congestiva lo fueron en los SAA de tipo A. La radiografía de tórax fue estrictamente normal en el 16,6% de los casos. Se observó ensanchamiento mediastínico más frecuentemente en el SAA de tipo A (el 57,7 frente al 43,2%; p = 0,002) y el derrame pleural, más frecuentemente en el SAA de tipo B (el 5,9 frente al 13%; p = 0,006). El electrocardiograma fue normal en el 37,6% de los pacientes, y se evidenciaron cambios de repolarización reversible compatibles con isquemia/lesión en el 13,1% de los casos (tabla 2).
Diagnóstico por técnicas de imagen
La tomografía computarizada fue la primera técnica utilizada en el 77,1% de los casos; la ecocardiografía transesofágica, en el 18,7%; la aortografía, en el 2,9% y la resonancia magnética, en el 0,4%. Se realizó más de una técnica de imagen en el 53,2% de los casos, el 58,5% de los SAA de tipo A y el 46,2% de los SAA de tipo B. El intervalo entre los síntomas y el diagnóstico fue < 24 h en el 70,3% de los casos (mediana [p25-p75], 5 [3-10] h), en el 18,7% el intervalo fue < 72 h y en el 11%, > 72 h.
Complicaciones agudas
Se diagnosticó derrame pericárdico en el 37,3% de los SAA de tipo A y taponamiento cardiaco en el 16,2%; el hematoma periaórtico fue igual de frecuente en el tipo A y en el tipo B (el 24,4 frente al 25,9% de los SAA de tipo B; diferencia no significativa). No hubo diferencias significativas entre ambos tipos de SAA en la frecuencia de isquemia periférica (el 10,1 frente al 6,2%) o isquemia mesentérica (el 6,4 frente al 6,2%).
Tratamiento
En 284 (79,6%) de los 357 pacientes con SAA de tipo A se realizó tratamiento quirúrgico. En el 20,4% de los pacientes en los que no se realizó tratamiento quirúrgico, se debió a edad avanzada (> 75 años) en 17 (4,8%), comorbilidad en 8 (2,2%), hematoma intramural estable en 6 (1,7%), rechazo del paciente en 8 (2,2%) o fallecimiento antes de ser aceptada la cirugía en 25 (7%). El intervalo entre el diagnóstico y la cirugía fue < 24 h en el 90% de los casos (mediana, 4 [3-7] h). En los pacientes con SAA tipo B el tratamiento fue médico en 107 (66%) casos, endovascular en 37 (22,8%) y quirúrgico en 18 (11,1%). La necesidad de tratamiento endovascular o quirúrgico se debió a dolor persistente en 15 casos, reextensión de la disección en 2, hipertensión no controlada en 6, rotura aórtica inminente en 9, isquemia visceral en 5, isquemia periférica en 4 y dilatación aórtica severa en 6. Tres pacientes precisaron fenestración percutánea y en 3 pacientes con SAA de tipo A se realizó también tratamiento endovascular en aorta descendente.
Mortalidad
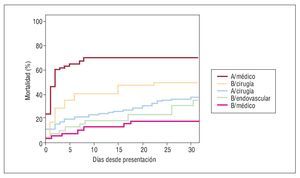
La mortalidad hospitalaria total fue del 35,4% (184/519) (tabla 3). La mortalidad del SAA de tipo A durante la hospitalización fue del 41,1% (147/357), el 33,4% (95/284) de los tratados quirúrgicamente y el 71,2% (52/73) de los tratados médicamente (p = 0,002). La mortalidad total del tipo B fue del 22,8% (37/162), menor en los pacientes que recibieron tratamiento médico (16,8% [18/107]; p < 0,05) que en los que recibieron tratamiento endovascular (27% [10/37]) o fueron tratados quirúrgicamente (50% [9/18]) (fig. 1).
Fig. 1. Mortalidad a los 30 días del síndrome aórtico agudo dependiendo del tipo A o B y del tratamiento recibido.
DISCUSIÓN
Los resultados del presente registro evidencian un avance importante en el diagnóstico del SAA, ya que más del 70% fueron diagnosticados en las primeras 24 h desde el inicio de los síntomas. No obstante, la mortalidad total es alta tanto en el tipo A como en el tipo B, lo que obligaría a optimizar el manejo terapéutico.
Es conocido clásicamente que la mortalidad del SAA supera el 1% por hora si no se inicia el tratamiento adecuado rápidamente19,20. Para mejorar el pronóstico de estos pacientes es fundamental tener una sospecha clínica alta en presencia de síntomas o signos clínicos de SAA, especialmente en pacientes hipertensos, con síndrome de Marfan o con aneurismas arterioscleróticos. Ante la sospecha de un SAA, debe realizarse lo antes posible una técnica de imagen para confirmar o descartar el diagnóstico e iniciar el tratamiento de forma inmediata.
Diversos estudios han descrito las variables demográficas, los síntomas y los signos que se asocian al SAA10,21, pero no tenemos información de una serie extensa y multicéntrica en nuestro país. Comparando los resultados con los descritos en el IRAD10, se evidencia que la población es algo más joven (60,9 frente a 63,1 años), hay una mayor proporción de varones (el 77,5 frente al 65,3%) y una menor incidencia de pacientes previamente intervenidos de cirugía cardiaca (el 6,6 frente al 17,9%). En los síntomas y signos de la presentación clínica destaca en el presente registro una mayor frecuencia de síncope (el 14,3 frente al 9,4%) y de déficit de pulsos (el 22,2 frente al 15,1%). Clásicamente se ha considerado el valor de las alteraciones de la radiografía de tórax de gran utilidad en el diagnóstico de disección aórtica21. No obstante, coincidiendo con otras series10,22, en más del 30% de los casos no se evidencia ensanchamiento mediastínico o anormalidades en el contorno aórtico. Por lo tanto, en el estudio de las causas del dolor torácico agudo, una radiografía de tórax normal no debe descartar la sospecha de SAA. No es excepcional confundir un SAA con un síndrome coronario agudo, lo que puede condicionar importantes complicaciones secundarias al tratamiento trombolítico23. Aunque la presencia de un electrocardiograma normal puede aumentar la sospecha de un SAA3,10, nuestros resultados evidencian que el electrocardiograma es estrictamente normal sólo en el 38% de los casos, presenta signos de isquemia/lesión en el 15% y ondas de necrosis en el 4% de los casos.
Uno de los principales retos para mejorar el diagnóstico del SAA es tener un adecuado nivel de sospecha clínica. En algunas series se reporta que los clínicos sospechan el diagnóstico en menos del 50% de los casos evaluados con SAA24,25. Por otra parte, el retraso diagnóstico después de la hospitalización puede superar las 24 h en el 39% de los pacientes21,26. Un dato destacable del presente registro es que más del 70% de los SAA fueron diagnosticados en las primeras 24 h. Esta información, que pasa inadvertida en la mayoría de las series publicadas, influye en las características de la población incluida, ya que a más precocidad en el diagnóstico peor pronóstico tiene la población estudiada27. La elección de la técnica de imagen más adecuada para el diagnóstico del SAA ha sido ampliamente debatida3-5. Algunos grupos consideran que la ecocardiografía transesofágica es la técnica más indicada28,29, pero cada vez hay mayor consenso en aceptar que lo más aconsejable es realizar la técnica disponible con mayor experiencia en cada centro. En el RESA, la utilización de la tomografía computarizada como primera técnica diagnóstica fue superior a la del IRAD10 (el 77 frente al 61%). Llamativamente, en la presente serie sólo se utilizó el ecocardiografía transesofágica para el diagnóstico inicial de SAA en el 19%, frente al 33% del IRAD. Mientras la mayoría de los centros IRAD son centros de referencia en patología aórtica con disponibilidad de ecocardiografistas las 24 h del día, en el RESA no se ha seleccionado el tipo de centro terciario. En este contexto la tomografía computarizada, por su disponibilidad y excelente información, es la técnica de imagen más útil en el diagnóstico de SAA.
En los pacientes con SAA de tipo A de la serie del IRAD, el intervalo medio entre los síntomas y el tratamiento quirúrgico fue de 79 h27, y entre los síntomas y el diagnóstico del SAA de tipo B, de 39 h30. Es probable que la importante divulgación del conocimiento de esta enfermedad realizado en nuestro país en los últimos años31-33 haya facilitado que se tenga una alta sospecha clínica y se indique rápidamente una técnica de imagen. Otro aspecto que confirma la mejoría en el diagnóstico de esta enfermedad se evidencia en el diagnóstico de IMH en el 15% de los SAA, cuando en el IRAD representó sólo el 5%17. Nuestros resultados coinciden con la mayoría de las series asiáticas en las que se utiliza con mucha más frecuencia la tomografía computarizada para el diagnóstico del dolor torácico34,35.
La precocidad en el tratamiento quirúrgico se ha considerado fundamental para mejorar la supervivencia del SAA tipo A. En el presente registro, el tiempo entre el diagnóstico y el tratamiento quirúrgico fue aceptable y no superó las 24 h en el 90% de los casos. No obstante, la mortalidad fue alta (33%), aunque no muy superior a la obtenida en el registro transversal36 realizado recientemente en Estados Unidos, que incluyó 3.013 disecciones tipo A con una mortalidad del 26%, idéntica a la del IRAD10. Esta mayor mortalidad del RESA puede deberse a la inclusión de pacientes más inestables. Así, en la presente serie hubo una mayor frecuencia de taponamiento o shock (el 18,7 frente al 8,4%), déficit neurológico (el 9,4 frente al 4,7%) e insuficiencia cardiaca (el 10 frente al 6,6%) que en el IRAD. La mayor precocidad en el diagnóstico, aunque positiva para el pronóstico del paciente, condiciona que se incluyan casos más inestables que con mayor demora en el diagnóstico no habrían llegado al hospital y no se los habría incluido en la serie. Por otra parte, la inclusión sólo de centros de referencia con alta experiencia en cirugía de la aorta incrementa el número de pacientes transferidos desde otros centros, lo que condiciona un cierto sesgo en la inclusión. Mientras en este registro los pacientes transferidos de hospitales comarcales son el 47%, en el IRAD29,30 superaron el 65%. Finalmente, en el IRAD10 el 28% de los SAA de tipo A fueron tratados médicamente, frente a un 20% en la presente serie, lo que hace sospechar una mayor selección de los pacientes tratados quirúrgicamente en los centros del IRAD.
Varias de las razones comentadas previamente también pueden haber influido en la mayor mortalidad del SAA de tipo B, ya que en el presente registro fue del 23% y en el IRAD10, del 15%. Un 33% de los pacientes con SAA tipo B precisaron tratamiento quirúrgico o endovascular en la presente serie, frente al 20% del IRAD10. El 23% de los SAA de tipo B recibieron tratamiento endovascular por complicaciones, con una mortalidad del 27%. Estos resultados deben tomarse con cautela por la inicial experiencia de algunos centros en este tipo de modalidad terapéutica, lo que puede afectar tanto a la indicación como a los resultados del tratamiento.
Asumiendo las limitaciones inherentes a todo registro, los resultados del presente estudio son especialmente importantes porque se obtienen de una amplia cohorte de hospitales terciarios de nuestro país. Todos los centros se comprometieron a incluir consecutivamente a todos los pacientes afectos de SAA y la inclusión de casos fue validada por los responsables de los servicios de cardiología y cirugía cardiaca. La información de los datos referentes a síntomas, diagnóstico, manejo terapéutico y mortalidad fue completada en todos los casos.
La información general que se deriva de este registro puede ser más real y se contrapone con los resultados registrados en series retrospectivas de un solo centro o de estudios multicéntricos que incluyeron sólo centros de excelencia que reciben pacientes trasladados desde otros centros con mayor demora desde el inicio de los síntomas.
CONCLUSIONES
A pesar de los importantes avances en el diagnóstico del SAA, la mortalidad hospitalaria es alta. La precocidad en el diagnóstico, el menor número de pacientes trasladados desde otros centros y no seleccionar los hospitales participantes son razones que pueden haber condicionado la inclusión de pacientes más inestables y con peor pronóstico. Nuestros resultados confirman la necesidad de continuar en el esfuerzo de mejorar el manejo terapéutico del SAA. La mayor especialización de los equipos quirúrgicos y la mejora de la logística sanitaria en tiempos de cirugía no reglada pueden favorecer este objetivo. Son necesarios nuevos registros para valorar la realidad cambiante en el manejo de esta enfermedad.
APÉNDICE 1
ABREVIATURAS
SAA: síndrome aórtico agudo.
Véase editorial en págs. 239-41
Full English text available from: www.revespcardiol.org
*Al final del artículo se relacionan los hospitales participantes en el Registro Español del Síndrome Aórtico Agudo.
Estudio financiado en parte por RECAVA: Red temática de Investigación en Enfermedad Cardiovascular y por la Sociedad Española de Cardiología.