Palabras clave
La fibrilación auricular (FA) crónica está con frecuencia asociada a la enfermedad valvular mitral, especialmente cuando la aurícula izquierda (AI) está aumentada en tamaño. La cirugía mitral per se no es suficiente para la eliminación de la FA en la gran mayoría de los casos. Aunque se han descrito diversas técnicas para la eliminación de la FA crónica1-6, la mayoría de ellas son muy laboriosas y consumen mucho tiempo quirúrgico. Sankar et al7 han descrito la reducción auricular izquierda como tratamiento quirúrgico para la FA crónica. Esta técnica consiste en el aislamiento del casquete de las venas pulmonares (VP) y la extirpación de una banda circunferencial de tejido de la AI, incluyendo la base de la orejuela izquierda (OI). El resultado obtenido es el aislamiento de los probables macrocircuitos de reentrada de la FA en la AI, así como una importante reducción en el tamaño de la aurícula. Sin embargo, es necesario señalar que la parte fundamental de esta técnica quirúrgica la constituye el aislamiento de las VP. Nosotros hemos utilizado esta técnica en 23 casos, con excelentes resultados, logrando una remisión completa de la FA crónica en todos los pacientes.
PACIENTES Y MÉTODO
Entre agosto de 1998 y junio de 2001 se intervino quirúrgicamente a 23 pacientes, 18 mujeres y 5 varones. La edad media fue de 44,9 ± 15,2 años (desviación estándar) en el momento de la cirugía. Un total de 18 pacientes (78%) tenía doble lesión mitral y 5 (22%), insuficiencia mitral. La etiología fue reumática en 18 casos (78%), degenerativa en 4 pacientes (17%) y congénita en uno (5%). Un total de 18 pacientes (78%) se encontraba en clase funcional II de la New York Heart Association (NYHA) y cinco (22%) en clase funcional III. Todos los pacientes tenían FA de más de 3 meses de evolución. La duración de la FA fue de 3,9 ± 2,9 años (rango, 1-14 años). Los datos ecocardiográficos obtenidos en cada paciente fueron los diámetros superoinferior y transversal en eje apical de 4 cámaras, y el diámetro anteroposterior en eje paraesternal. Las valoraciones ecocardiográficas en cada paciente se realizaron en forma preoperatoria, en el momento transoperatorio y al primer y sexto meses postoperatorios. La función de transporte de la AI se estudió mediante eco-Doppler de flujo transmitral midiendo la reaparición de la onda «a» de contracción auricular. Todos los pacientes tenían ausencia de onda «a» auricular durante el estudio Doppler de flujo transmitral en el momento preoperatorio. Todos los pacientes tomaban uno o más fármacos antiarrítmicos (1,7 ± 0,9; rango, 1-4). El tratamiento farmacológico antiarrítmico se mantuvo hasta el tercer mes postoperatorio. Todos los pacientes recibían tratamiento anticoagulante previo a la cirugía. El tratamiento anticoagulante oral se utilizó durante 6 semanas postoperatorias; más tarde, éste fue suspendido en los casos de plastia mitral o prótesis biológica mitral en ritmo sinusal y onda «a» por eco-Doppler de flujo transmitral. En todos los pacientes se llevó a cabo cirugía de la válvula mitral y reducción auricular izquierda.
Análisis estadístico
Los valores se expresan en porcentajes, media y desviación estándar. Para la comparación de los valores de la AI pre y postoperatorios se utilizó la prueba de la t de Student para variables cuantitativas. Se consideró una diferencia estadísticamente significativa con un valor de p < 0,01.
Técnica quirúrgica
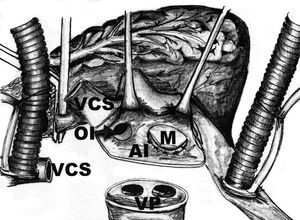
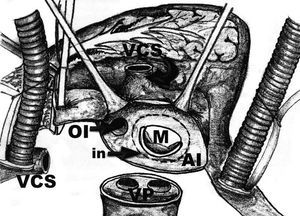
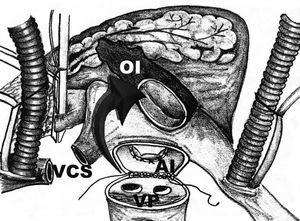
La cirugía se realizó por esternotomía media. La aorta ascendente y la vena cava se canularon de manera habitual. Una cánula angulada se colocó en la vena cava superior (VCS), cerca de su unión con la vena inominada y el tronco venoso braquicefálico derecho y se instituyó la derivación cardiopulmonar. Una vez realizado el pinzamiento de la raíz aórtica, se utilizó cardioplejía retrógrada, continua, caliente e hiperpotasémica, a través del seno coronario. La VCS se seccionó totalmente alrededor de 3 cm por arriba de su desembocadura en la aurícula derecha, con la finalidad de exponer el techo de la AI. Se efectuaron 2 incisiones en la AI. La primera se llevó a cabo de manera convencional paralela al surco interauricular, prolongando ésta alrededor de las VP, seccionando totalmente la AI (fig. 1). La segunda incisión se realizó de 1 a 3 cm más interiormente, en dirección hacia la válvula mitral, rodeando toda la AI (fig. 2). Se obtuvo una banda circunferencial de tejido de AI con la base de la OI incluida. Se realizó una valvuloplastia mitral en 11 casos (47,8%) y un reemplazo valvular mitral en 12 (52,2%). Se realizó una anastomosis entre la AI y la VCS con sutura continua de polipropileno 3-0 y 5-0, respectivamente (fig. 3). Los tiempos de derivación cardiopulmonar y pinzamiento aórtico fueron de 156,6 ± 24,4 y 98,6 ± 13,2 min, respectivamente.
Fig. 1. En esta ilustración esquemática se observa la primera incisión en la AI, la cual rodea totalmente el casquete de las VP.
Fig. 2. En esta figura la flecha señala la línea interrumpida que, a su vez, representa la segunda incisión en la AI.
Fig. 3. Una vez efectuadas ambas incisiones quirúrgicas, se obtiene una banda circunferencial de tejido auricular izquierdo con la OI incluida (la cual se señala por la flecha). El paso final en esta técnica quirúrgica lo constituye la reanastomosis de la AI.
RESULTADOS
No hubo mortalidad operatoria. Tres casos (3/23; 13%) presentaron recidiva de la FA en las primeras horas postoperatorias, revirtiendo con terapia medicamentosa entre el sexto y el octavo día postoperatorio. Ningún paciente fue reintervenido por sangrado. No se observaron problemas en la conducción atrioventricular en ningún caso. Todos los pacientes fueron extubados en las primeras 12 h postoperatorias. La estancia en la unidad de cuidados intensivos posquirúrgicos fue de 1,7 ± 0,5 días, y la estancia intrahospitalaria postoperatoria fue de 6,8 ± 0,8 días. Se realizó un estudio ecocardiográfico intraoperatorio al primer y sexto meses postoperatorios para evaluar el tamaño de la AI, así como la recuperación de la onda «a» auricular. Se observó una importante reducción en el diámetro superoinferior de la AI por ecocardiografía desde el momento operatorio (4,8 ± 0,77 frente a 8,1 ± 1,47 cm; p < 0,01). También se demostró la reaparición de la onda «a» auricular en el estudio eco-Doppler de flujo transmitral en 20 de los 23 casos operados (87%) (tabla 1). En un seguimiento de 3 a 36 meses (13,9 ± 11 meses) posteriores a la cirugía, 22 pacientes (96%) se encontraban en clase funcional I de la NYHA, y uno (4%) en clase II; además, se encontró que todos los pacientes mantenían el ritmo sinusal. En todos los enfermos se eliminó el tratamiento antiarrítmico después del tercer mes postoperatorio. De los 23 casos operados, el tratamiento anticoagulante oral se suprimió en todos los casos donde se realizó una valvuloplastia mitral o implante de prótesis biológica mitral (14/23; 61%).
DISCUSIÓN
La FA crónica suele acompañar a la mayor parte de los casos con enfermedad valvular mitral en el momento de la cirugía, especialmente cuando la AI está aumentada en tamaño, lo que representa el principal factor determinante en la aparición y mantenimiento de la FA crónica8,9. El tamaño de la AI mayor de 45 mm es uno de las factores predictivos independientes para la aparición y recurrencia de la FA. La FA es rara en AI con diámetro menor a 40 mm10. La habilidad de la AI para fibrilar se encuentra determinada por la relación entre el período refractario efectivo del miocardio auricular y el área disponible de la aurícula para el desarrollo de un macrocircuito de reentrada11. Es decir, se necesita una masa crítica o área crítica de músculo auricular para la aparición de la FA. De esta manera, parece lógico que una parte estratégica de la cirugía para eliminar la FA deba incluir la reducción en tamaño de la AI12.
Se han descrito varios procedimientos para eliminar la FA crónica, desde aquellos dirigidos a controlar la respuesta ventricular con digitálicos13, la ablación del haz de His con la subsiguiente colocación de marcapaso ventricular quirúrgico14, o con catéter transvenoso15, aislamiento de la AI5, el procedimiento quirúrgico del corredor4, hasta el procedimiento de maze de Cox con sus modificaciones1,2,6,16-18.
El procedimiento descrito por Cox1 ha demostrado resultados exitosos. Aunque se ha notificado una tasa de éxito del 98% con este procedimiento, se involucraban muchas incisiones quirúrgicas en ambas aurículas, sobre todo en el plano posterior de la AI, siendo técnicamente muy demandante y con el riesgo elevado de potenciales complicaciones letales por sangrado. Al mismo tiempo, esta técnica implica el uso de la crioablación en dos puntos del seno coronario, lo cual restringe su uso a centros hospitalarios que posean dicha tecnología. Hioki et al6 han modificado el procedimiento de maze de Cox tratando de hacerlo más simple mediante una incisión entre las VP derechas e izquierdas, en lugar de alrededor de las mismas. Sin embargo, el porcentaje de recidivas de la FA podría ser muy elevado debido a que no se logra el aislamiento total de las VP del resto de la AI y permite el desarrollo de macrocircuitos de reentrada desde las VP. El uso deliberado de la criolesión con la finalidad de eliminar la necesidad de incisiones quirúrgicas16 no ha demostrado tener una efectividad adecuada, ya que el 51,8% de los pacientes tuvo la necesidad de fármacos antiarrítmicos durante el período postoperatorio debido a FA recidivante. El procedimiento del corredor19 tiene el inconveniente de controlar sólo la frecuencia del estímulo eléctrico atrioventricular, pero el resto de las aurículas sigue fibrilando, perdiéndose la función de transporte de las aurículas. Además, no se elimina el riesgo de tromboembolismo e implica el uso de anticoagulación oral permanente4. Sankar et al7 han realizado 6 casos de reducción auricular izquierda para eliminar la FA crónica concomitante con cirugía valvular mitral, con un éxito del 100%.
Nosotros hemos tomado el modelo de Sankar et al7 para la eliminación de la FA crónica asociada a enfermedad valvular mitral en 23 pacientes, con una tasa de éxito del 100%. Hemos encontrado esta técnica sumamente satisfactoria debido a que maneja varias circunstancias de forma simultánea: a) la reducción del tamaño de la AI como una parte crucial del procedimiento, eliminando masa crítica para la FA; b) el aislamiento de las VP junto con la amputación incluida de la OI, eliminando así tres de los 6 macrocircuitos de reentrada principales para el origen de la FA (dos de ellos en las VP, y otro más en la base de la OI; c) la amputación de la OI suprime la fuente de embolias más importante de la AI, ya que se ha demostrado que el 57% de los pacientes reumáticos con FA presenta trombos en la OI con extensión a la AI, y el 9% de los casos de FA no reumática presenta trombo aislado u originado en la OI20; además, dado que la OI tiene una base estrecha, definida y con un cuerpo hueco que está localizado periféricamente al flujo de la sangre principal en la AI, es lógico pensar que la escisión de dicha orejuela disminuye la amenaza subsiguiente de la formación de trombos intracavitarios en la AI; no obstante, si se considera el hecho de que, en los pacientes tratados con warfarina, aproximadamente el 50% de los acontecimientos embólicos ocurre en individuos que tuvieron un lapso terapéutico inadvertido o requirieron la interrupción parcial o permanente de la terapéutica con anticoagulantes orales, y que la mayoría de estos trombos tiene su origen en la OI21, se hace imperativo amputar esta estructura anatómica durante este tipo de procedimientos, y d) la excelente exposición de la válvula mitral, lo cual es imprescindible cuando uno de los objetivos es realizar una reconstrucción de la misma, asociada a la cura de la FA.
El aislamiento de las VP es la parte fundamental en la cirugía para la eliminación de la FA. Haïseguerre et al han demostrado que el origen más frecuente de los estímulos eléctricos ectópicos que originan los macrocircuitos de reentrada de FA son las VP hasta en el 96% de los casos22-25, sobre todo en las VP superiores23. De hecho, existe una relación directa entre el aumento de tamaño de las VP superiores y la aparición de la FA, así como también de la existencia de anillos musculares derivados del miocardio de la AI que penetran en grado variable en el ostium y la porción más proximal de las VP superiores. Cambios estructurales en estas porciones de miocardio auricular que invade a las VP, quizá debido a la distensión del mismo, pueden originar el ritmo caótico que desencadena la FA26, que también puede ser debido al hecho de que la duración del período refractario en el interior de estas VP es muy corto y que pueden servir como sitios de activación de alta frecuencia debido a la activación reentrante con pequeñas ondas27. Esto ha motivado estrategias de ablación mediante el uso de radiofrecuencia directamente sobre los focos ectópicos en las VP, con una tasa de éxito de hasta el 69% en un seguimiento de 8 ± 4 meses26,28. Sin embargo, estas técnicas tienen el inconveniente de las elevadas tasas de recidiva de la FA debido a la aparición subsiguiente de nuevos focos arritmogénicos en las mismas VP. La terapéutica debe incluir incisiones lineales mediante radiofrecuencia o quirúrgicas para reducir el tejido auricular y prevenir en número requerido de ondas de reentrada29,30.
Otro aspecto importante es la profundidad y la uniformidad tisular de la quemadura con radiofrecuencia, ya que pequeños istmos residuales de tejido auricular, que podrían permanecer sin ser lesionados por la radiofrecuencia, permiten la conducción de estímulos eléctricos caóticos desde las VP al interior de la AI, con la reaparición de la FA. Esto ha sido observado en istmos tisulares a partir de 0,8 mm de extensión31. La discontinuidad en las incisiones lineales utilizadas en la radiofrecuencia puede ser un factor proarrítmico. Es obvio que el aislamiento de las VP mediante incisiones quirúrgicas continuas y completas ofrece la máxima seguridad para aislar totalmente las VP.
Nosotros hemos utilizado esta última premisa aislando quirúrgicamente la cámara que contiene las 4 VP, con sólo 3 casos (13%) de recidiva de la FA que cedieron bajo terapia medicamentosa dentro de los primeros 8 días postoperatorios. El resto de los pacientes recobraron el ritmo sinusal normal desde el momento mismo del despinzamiento aórtico. Actualmente, la totalidad de los 23 pacientes mantiene el ritmo sinusal, libres de terapia medicamentosa antiarrítmica.
El estudio ecocardiográfico realizado en esta serie de pacientes demostró una reducción importante en el tamaño de la AI en el diámetro superoinferior de la misma, ya que este diámetro es el más directamente afectado con este tipo de técnica quirúrgica, en comparación con los diámetros anteroposterior y transverso. Además, se observó la reaparición de la onda «a» auricular en la mayor parte de los casos (20/23), indicando la restauración de la función de transporte de la AI.
Asimismo, hemos encontrado que esta técnica puede ser de fácil aplicación cuando el diámetro superoinferior de la AI (por ecocardiografía) es mayor a 7 cm, dada la distancia que existe entre el plano de las VP y el seno coronario, que es la pauta a seguir para obtener el tamaño de la reducción de la AI12.
CONCLUSIONES
La técnica de reducción auricular izquierda aquí propuesta es una técnica quirúrgica segura, de fácil realización, que se puede implementar en todo paciente que cumpla con las condiciones siguientes: a) ser sometido a cirugía valvular mitral; b) tener una AI mayor de 7 cm de diámetro superoinferior (por ecocardiografía), y c) FA de más de 3 meses de evolución preoperatoria32,33.
Más aún, si el procedimiento mitral de elección asociado es la valvuloplastia o el implante de prótesis biológica mitral, se podrá lograr el objetivo final: mantener al paciente libre del uso de anticoagulación34,35.
AGRADECIMIENTO
A la Sra. María del Carmen Colomer por su experta asistencia en la redacción de este doc umento.
Correspondencia: Dr. O.A. García-Villarreal.
Vista Florida 460, Col. Linda Vista, 67130; Guadalupe,
Nuevo León, México.
Correo electrónico: ovidio@voila.fr