El síndrome de COVID persistente (SCP) es frecuente tras la infección aguda por SARS-CoV-2, y la intolerancia al ejercicio (IE) uno de los síntomas más frecuentes y limitantes. La evidencia reciente indica que el origen de los síntomas es periférico (muscular), por lo que el ejercicio físico podría ser un tratamiento eficaz. Este estudio evalúa la eficacia de un programa de ejercicio físico terapéutico (PEFT) en la mejora de la capacidad funcional de los pacientes con SCP e IE.
MétodosEstudio aleatorizado, unicéntrico, controlado y abierto que compara un PEFT (grupo de intervención) con recomendaciones de actividad física estándar (grupo de control) en pacientes con SCP con IE. El grupo de intervención recibió 8 semanas de PEFT. El objetivo principal fue el cambio en la capacidad funcional medido mediante el consumo pico de oxígeno (VO2 pico).
ResultadosSe incluyó a un total de 50 pacientes con SCP (el 73% mujeres; media de edad, 47±7,1 años). El grupo de intervención presentó una mejora en el VO2 pico del 15% (VO2 pico inicial y final: 25,5±7,7 y 29,3±4,7ml/kg/min; p <0,001) y del 13,2% en valores del %VO2 máximo predicho (el 92,1±14,3% y el 108,4±13,4%; p <0,001), sin cambios significativos en el grupo de control. Todos los objetivos secundarios también mejoraron exclusivamente en el grupo de intervención: escalas de calidad de vida, potencia muscular desarrollada, potencia inspiratoria máxima, flexibilidad metabólica y porcentaje de grasa corporal.
ConclusionesEl PEFT mejora la capacidad funcional de los pacientes con SCP e IE.
Palabras clave
Desde el inicio de la pandemia por COVID-19, en España se han infectado más de 13.500.000 personas1. Se estima que un 10-30% presentan síntomas persistentes tras la fase aguda2–4. Se ha definido el síndrome de COVID persistente (SCP) como la persistencia de síntomas pasadas las primeras 12 semanas de la infección5. Su aparición es independiente de la gravedad del cuadro. La intolerancia al ejercicio (IE), referida como disnea de esfuerzo o astenia marcada, es uno de los síntomas más frecuentes y se relaciona con disminución de la calidad de vida6.
Desde el inicio de la pandemia, se registró un impacto cardiorrespiratorio heterogéneo, desde cuadros leves a graves, como tromboembolia pulmonar, miocarditis o fibrosis pulmonar7. Sin embargo, excluyendo a aquellos con cuadros graves, la amplia mayoría de los pacientes con SCP e IE no presentan alteraciones cardiorrespiratorias en el seguimiento8–11.
La ergoespirometría (EE) es la prueba de referencia para la valoración funcional y el estudio de la disnea y la IE. Mediante la EE, nuestro grupo fue pionero al apuntar a un origen periférico de la IE en el SCP11. Recientemente, un metanálisis que agrupa este y otros 37 estudios con EE e incluye a más de 2.000 pacientes con SCP refuerza la hipótesis de la deficiente utilización periférica de oxígeno como posibles mecanismos causales de la IE9. Uno de estos estudios8 utilizó la medición invasiva del O2.
Se ha demostrado que el entrenamiento físico es la medida más eficaz para mejorar la utilización periférica del oxígeno gracias a una mejora en las funciones metabólica y neuromuscular. Además, diferentes estudios observacionales han demostrado que la rehabilitación mediante ejercicio en el SCP mejora el VO2 pico y la fuerza12. Sin embargo, hasta hoy, ningún estudio aleatorizado había evaluado mediante EE el impacto de un programa de entrenamiento físico terapéutico (PEFT) en pacientes con SCP e IE. El objetivo del estudio Readaptación funcional basada en ejercicio físico en pacientes con COVID persistente (RECOVER) es evaluar la eficacia de un PEFT en pacientes con SCP e IE.
MÉTODOSDiseño del estudioEstudio aleatorizado, unicéntrico, controlado y abierto que compara un PEFT (grupo de intervención [GI]) con recomendaciones de ejercicio según la guía de práctica clínica vigente13 (grupo de control [GC]). El protocolo fue aprobado por el comité de ética del centro. Todos los pacientes otorgaron su consentimiento.
Selección de pacientesCriterios de inclusión: a) adultos entre 18 y 65 años con antecedentes de COVID-19; b) síntomas compatibles con SCP pasadas 12 semanas tras la infección, entre ellos astenia o disnea de esfuerzo; c) asintomáticos previamente; d) ausencia de otra enfermedad que justifique los síntomas, y e) firma del consentimiento informado. Criterios de exclusión: a) limitación física o psíquica que impidiera participar en un PEFT, y b) ausencia de impedimentos para cumplir el PEFT.
Valoración basal, aleatorización y análisis estadísticoSe realizó una aleatorización 1:1 al GI o el GC. Después se practicaron a todos EE, medición de la presión inspiratoria máxima, análisis de composición corporal mediante bioimpedancia, valoración neuromuscular con perfiles de carga-velocidad utilizando transductores lineales (encoders) para diversos grupos musculares y evaluación mediante las siguientes escalas: Post-COVID-19 Functional Status (PCFS), EuroQol scale (EQ-5D-5L) y Patient Health Questionnaire 9 (PHQ9).
El tamaño de la muestra se calculó según estudios previos en SCP que mostraban disminución del VO2 y otros que demuestran mejora aproximada del 12% del VO2 pico tras un PEFT en otro tipo de poblaciones, mediante EE14, utilizando la prueba de la t de Student con un nivel de significación de 2 colas del 5%. Se necesitó a 18 pacientes en cada grupo (potencia> 80%).
Se hizo un análisis descriptivo utilizando como variables cuantitativas la media±desviación típica o la mediana [intervalo intercuartílico], según el tipo de distribución. Las variables cualitativas se describen mediante frecuencia y porcentaje. Se aplicó la prueba de Kolmogorov-Smirnov para garantizar la normalidad de la distribución. Las variables continuas se compararon mediante la prueba de la t de Student o la de la U de Mann-Whitney. Para las variables cualitativas se utilizó la prueba de la χ2 o la de Fisher. Para todos los análisis, se utilizó un valor p de 2 colas <0,05 como criterio de significación estadística. El análisis de datos se realizó por el método de intención de tratar, según la aleatorización. El software empleado fue STATA (V14.0, StataCorp, Estados Unidos).
IntervenciónLa descripción de la intervención de cada grupo se resume a continuación y en la figura 1. Los pormenores del programa de entrenamiento se describen con detalle en el apartado «Protocolo de entrenamiento» del material adicional.
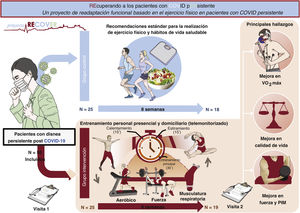
Figura central. Pacientes con síndrome post-COVID (SCP) con astenia o disnea con el ejercicio, sin alteración aparente del aparato cardiovascular o respiratorio. Se los aleatorizó a recomendaciones de estilo de vida y ejercicio estándar (grupo de control) o a un programa de ejercicio físico terapéutico (grupo de intervención) durante 8 semanas. Como resultado, se registraron exclusivamente en el grupo de intervención un aumento en el consumo de oxígeno (VO2) pico y mejoras en las escalas de calidad de vida, las variables de fuerza y la musculatura respiratoria (PIM), así como en los parámetros de función mitocondrial. Las variables se mantuvieron estables en el grupo de control.
Los pacientes del GI realizaron un PEFT de 8 semanas que constaba de una parte presencial y otra, llevada a cabo por el paciente en el domicilio con monitorización a distancia (mediante pulsómetros), que correspondía a los bloques de entrenamiento aeróbico extensivo (creciente intensidad y volumen del 40 al 65% de intensidad repecto al VO2 pico y de 30 a 60 minutos) y de la musculatura respiratoria (2 sesiones diarias, 6 días de la semana). El ejercicio presencial incluía 3 aspectos:
- •
Entrenamiento neuromuscular guiado por velocidad (EGV). Se basa en hacer cada repetición a la máxima velocidad posible, que se evalúa mediante transductores lineales. En cada serie se permitió una pérdida de velocidad objetivo del 20% y hacia el final del programa, del 15%. La carga utilizada se incrementó progresivamente entre el 60 y el 80%.
- •
Entrenamiento interválico de alta intensidad. Se incluyó en una segunda fase del programa de intervención (semanas 4-8).
- •
Programa de ejercicios de la musculatura estabilizadora del tronco.
Recibieron recomendaciones de ejercicio físico y hábitos saludables con base en las recomendaciones para la población general13. Tras 8 semanas de entrenamiento, todos los pacientes pasaron por una evaluación similar a la de la visita 1.
ObjetivosEl objetivo primario fue el cambio del VO2 pico en ml/kg/min y en porcentaje respecto al predicho. Los objetivos secundarios fueron: a) cambio en las escalas de calidad de vida (PCFS, EQ-5D-5L y PHQ9); b) cambio en la presión inspiratoria máxima, c) cambio en la capacidad neuromuscular evaluada mediante los perfiles carga-velocidad en los ejercicios de squad y press banca; d) cambio en el porcentaje de grasa corporal, y e) cambio en los parámetros de función mitocondrial: máxima oxidación de lípidos e hidratos de carbono y tiempo-carga al punto de agotamiento mitocondrial.
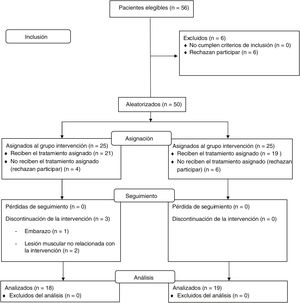
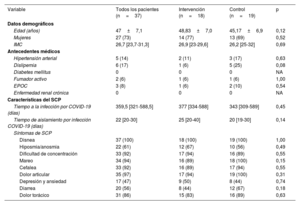
RESULTADOSCaracterísticas basalesAl inicio se valoró a 56 pacientes con SCP; finalmente se aleatorizó a 50 (25 por grupo). De estos, 18 del GI y 19 del GC completaron el protocolo (el 73% mujeres; media de edad, 47±7,1 años) (figura 2). Ambos grupos estaban equilibrados respecto a las características basales (tabla 1).
Características basales
| Variable | Todos los pacientes (n=37) | Intervención (n=18) | Control (n=19) | p |
|---|---|---|---|---|
| Datos demográficos | ||||
| Edad (años) | 47±7,1 | 48,83±7,0 | 45,17±6,9 | 0,12 |
| Mujeres | 27 (73) | 14 (77) | 13 (69) | 0,52 |
| IMC | 26,7 [23,7-31,3] | 26,9 [23-29,6] | 26,2 [25-32] | 0,69 |
| Antecedentes médicos | ||||
| Hipertensión arterial | 5 (14) | 2 (11) | 3 (17) | 0,63 |
| Dislipemia | 6 (17) | 1 (6) | 5 (25) | 0,08 |
| Diabetes mellitus | 0 | 0 | 0 | NA |
| Fumador activo | 2 (6) | 1 (6) | 1 (6) | 1,00 |
| EPOC | 3 (8) | 1 (6) | 2 (10) | 0,54 |
| Enfermedad renal crónica | 0 | 0 | 0 | NA |
| Características del SCP | ||||
| Tiempo a la infección por COVID-19 (días) | 359,5 [321-588,5] | 377 [334-588] | 343 [309-589] | 0,45 |
| Tiempo de aislamiento por infección COVID-19 (días) | 22 [20-30] | 25 [20-40] | 20 [19-30] | 0,14 |
| Síntomas de SCP | ||||
| Disnea | 37 (100) | 18 (100) | 19 (100) | 1,00 |
| Hiposmia/anosmia | 22 (61) | 12 (67) | 10 (56) | 0,49 |
| Dificultad de concentración | 33 (92) | 17 (94) | 16 (89) | 0,55 |
| Mareo | 34 (94) | 16 (89) | 18 (100) | 0,15 |
| Cefalea | 33 (92) | 16 (89) | 17 (94) | 0,55 |
| Dolor articular | 35 (97) | 17 (94) | 19 (100) | 0,31 |
| Depresión y ansiedad | 17 (47) | 9 (50) | 8 (44) | 0,74 |
| Diarrea | 20 (56) | 8 (44) | 12 (67) | 0,18 |
| Dolor torácico | 31 (86) | 15 (83) | 16 (89) | 0,63 |
EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; NA: no aplicable; SCP: síndrome de COVID persistente.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
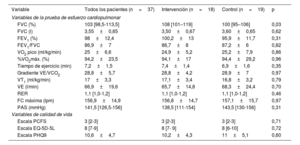
La tabla 2 muestra los resultados de las variables obtenidas en la EE, así como las derivadas de las escalas de calidad de vida.
Calidad de vida y datos de la prueba de esfuerzo cardiopulmonar
| Variable | Todos los pacientes (n=37) | Intervención (n=18) | Control (n=19) | p |
|---|---|---|---|---|
| Variables de la prueba de esfuerzo cardiopulmonar | ||||
| FVC (%) | 103 [98,5-113,5] | 108 [101–119] | 100 [95–106] | 0,03 |
| FVC (l) | 3,55±0,65 | 3,50±0,67 | 3,60±0,65 | 0,62 |
| FEV1 (%) | 98±12,4 | 100,2±13 | 95,9±11,7 | 0,31 |
| FEV1/FVC | 86,9±7 | 86,7±8 | 87,2±6 | 0,82 |
| VO2 pico (ml/kg/min) | 25±6,6 | 24,9±5,2 | 25,2±7,9 | 0,86 |
| %VO2máx. (%) | 94,2±23,5 | 94,1±17 | 94,4±29,2 | 0,96 |
| Tiempo de ejercicio (min) | 7,2±1,5 | 7,4±1,4 | 6,9±1,6 | 0,35 |
| Gradiente VE/VCO2 | 28,8±5,7 | 28,8±4,2 | 28,9±7 | 0,97 |
| VT1 (ml/kg/min) | 17±3,3 | 17,1±3,4 | 16,8±3,2 | 0,79 |
| VE (l/min) | 66,9±19,6 | 65,7±14,8 | 68,3±24,4 | 0,70 |
| RER | 1,1 [1,0-1,2] | 1,1 [1,0-1,2] | 1,1 [1,0-1,2] | 0,46 |
| FC máxima (lpm) | 156,9±14,9 | 156,8±14,7 | 157,1±15,7 | 0,97 |
| PAS (mmHg) | 141,5 [126,5-156] | 138,5 [111-154] | 143,5 [130-156] | 0,31 |
| Variables de calidad de vida | ||||
| Escala PCFS | 3 [2-3] | 3 [2-3] | 3 [2-3] | 0,71 |
| Escala EQ-5D-5L | 8 [7-9] | 8 [7- 9] | 8 [6-10] | 0,72 |
| Escala PHQ9 | 10,6±4,7 | 10,2±4,3 | 11±5,1 | 0,60 |
EQ-5D-5L: EuroQol scale; FC: frecuencia cardiaca; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; PAS: presión arterial sistólica; PCFS: Post-COVID-19 Functional Status; PHQ9: Patient Health Questionnaire 9; RER: cociente respiratorio; VE: ventilación por minuto; Gradiente VE/VCO2: eficiencia ventilatoria; VCO2: producción de dióxido de carbono; VO2 pico: consumo de oxígeno máximo durante la prueba; VT1: umbral ventilatorio 1; %VO2máx.: porcentaje del consumo de oxígeno pico alcanzado con respecto al consumo de oxígeno máximo predicho.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
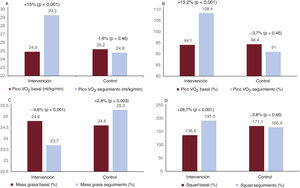
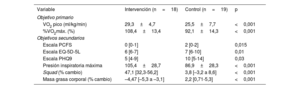
El cambio del VO2 pico tras el PEFT en el GI mostró una mejora significativa del 15% (VO2 pico basal frente a final, 24,9 frente a 29,3ml/kg/min; p <0,001). En valores predichos, se objetivó una mejora del %VO2 máx. del 13,2% (%VO2 máx. basal frente a final, el 94,1 frente al 108,4%; p <0,001). Por su parte, el VO2 pico en el GC se mantuvo sin cambios significativos (VO2 pico basal y final, 25,2 frente al 24,8ml/kg/min; p = 0,46; %VO2 máx. predicho basal y final, el 94,4 frente al 91%; p=0,46) (figura 1 y figura 3).
Resultados del objetivo primario (A y B) y ejemplos de objetivos secundarios (C, porcentaje de masas grasa; D, cambio en la curva carga-velocidad en la realización de squad). Los paneles muestran el cambio entre las visitas 1 y 2 de los grupos de intervención y de control. El panel A muestra el cambio en el consumo de oxígeno (VO2) pico. El panel B, la evolución del VO2 con respecto al porcentaje del VO2 máximo predicho para su población según las ecuaciones de Wasserman/Hansen.
La mejora funcional representada por el VO2 se correlacionó con mejoras en las escalas de calidad de vida (tabla 3). Otros objetivos secundarios como la presión inspiratoria máxima, la capacidad neuromuscular (squad y press de banca) y el porcentaje de grasa mejoraron tras la intervención en el GI con respecto al GC (tabla 4).
Objetivos
| Variable | Intervención (n=18) | Control (n=19) | p |
|---|---|---|---|
| Objetivo primario | |||
| VO2 pico (ml/kg/min) | 29,3±4,7 | 25,5±7,7 | <0,001 |
| %VO2máx. (%) | 108,4±13,4 | 92,1±14,3 | <0,001 |
| Objetivos secundarios | |||
| Escala PCFS | 0 [0-1] | 2 [0-2] | 0,015 |
| Escala EQ-5D-5L | 6 [6-7] | 7 [6-10] | 0,01 |
| Escala PHQ9 | 5 [4-9] | 10 [5-14] | 0,03 |
| Presión inspiratoria máxima | 105,4±28,7 | 86,9±28,3 | <0,001 |
| Squad (% cambio) | 47,1 [32,3-56,2] | 3,8 [–3,2 a 8,6] | <0,001 |
| Masa grasa corporal (% cambio) | –4,47 [–5,3 a –3,1] | 2,2 [0,71-5,3] | <0,001 |
EQ-5D-5L: escala EuroQol; PCFS: Post-COVID-19 Functional Status; PHQ9: Patient Health Questionnaire 9; VO2: consumo de oxígeno.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
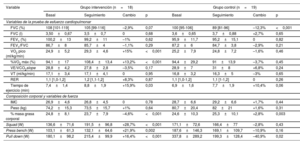
Cambio de las variables de la prueba de esfuerzo cardiopulmonar, composición corporal y fuerza
| Variable | Grupo intervención (n=18) | Grupo control (n=19) | ||||||
|---|---|---|---|---|---|---|---|---|
| Basal | Seguimiento | Cambio | p | Basal | Seguimiento | Cambio | p | |
| Variables de la prueba de esfuerzo cardiopulmonar | ||||||||
| FVC (%) | 108 [101-119] | 105 [99-116] | –2,9% | 0,07 | 100 [95-106] | 89 [81-96] | –12,3% | <0,001 |
| FVC (l) | 3,50±0,67 | 3,5±0,7 | 0 | 0,68 | 3,6±0,65 | 3,7±0,88 | +2,7% | 0,65 |
| FEV1 (%) | 100,2±13 | 99,2±11 | –1% | 0,62 | 95,9±11,7 | 95,2±15,1 | 0 | 0,82 |
| FEV1/FVC | 86,7±8 | 85,7±4 | –1,1% | 0,29 | 87,2±6 | 84,7±3,8 | –2,9% | 0,21 |
| VO2 pico (ml/kg/min) | 24,9±5,2 | 29,3±4,6 | +15% | <0,001 | 25,2±7,9 | 24,8±7,2 | –1,6% | 0,46 |
| %VO2 máx (%) | 94,1±17 | 108,4±13,4 | +13,2% | <0,001 | 94,4±29,2 | 91±13,9 | –3,7% | 0,45 |
| VE/VCO2slope | 28,8±4,2 | 27,8±2,8 | –3,5% | 0,17 | 28,9±7 | 31±8 | +6,8% | 0,24 |
| VT (ml/kg/min) | 17,1±3,4 | 17,1±4,1 | 0 | 0,95 | 16,8±3,2 | 16,3±5 | –3% | 0,65 |
| RER | 1,1 [1,0-1,2] | 1,2 [1,1-1,2] | +8,3% | 0,87 | 1,1 [1,0-1,2] | 1,1 [1-1,2] | 0 | 0,26 |
| Tiempo de ejercicio (min) | 7,4±1,4 | 8,8±1,9 | +15,9% | 0,03 | 6,9±1,6 | 7,7±1,9 | +10,4% | 0,06 |
| Composición corporal y variables de fuerza | ||||||||
| IMC | 26,9±4,6 | 26,8±4,5 | 0 | 0,78 | 28,7±6,6 | 29,2±6,6 | +1,7% | 0,44 |
| Peso (kg) | 74,2±15,3 | 73,5±15,7 | +1% | 0,64 | 80,7±20,4 | 82±21 | +1,6% | 0,31 |
| % masa grasa corporal | 24,8±8,1 | 23,7±7,9 | –4,6% | <0,001 | 24,6±10,3 | 25,3±10,1 | +2,8% | 0,003 |
| Squad (W) | 136,6±71,6 | 191,5±96,8 | +28,7% | <0,001 | 171,1±72,6 | 166,4±77 | –2,8% | 0,43 |
| Press bench (W) | 103,1±61,3 | 132,1±64,6 | +21,9% | 0,002 | 187,6±146,3 | 169,1±109,7 | –10,9% | 0,16 |
| Pull down (W) | 180,1±98,2 | 215,4±99,9 | +16,4% | <0,001 | 337,8±289,2 | 199,3±128,4 | –40,9% | 0,02 |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; RER: cociente respiratorio; VE: ventilación por minuto; VE/VCO2slope: eficiencia ventilatoria; VCO2: producción de dióxido de carbono; VO2 pico: consumo de oxígeno máximo durante la prueba; %VO2 máx (%): porcentaje del consumo de oxígeno pico alcanzado con respecto al consumo de oxígeno máximo predicho.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
El GI alcanzó el punto de agotamiento mitocondrial a mayores carga y frecuencia cardiaca (p <0,001), sin cambios significativos en el valor del MFO (tabla 1 del material adicional), lo que implica un mayor tiempo de utilización de grasas como sustrato durante el ejercicio, e incremento del área bajo la curva de oxidación de lípidos (oxFAT), lo que demuestra mayor eficiencia energética. Por su parte, se incrementó también la máxima oxidación de hidratos de carbono (p <0,001). Mientras, ambos parámetros se mantuvieron estables en el GC. Estos resultados apuntan a la mejora de la flexibilidad metabólica en el GI.
DISCUSIÓNEl estudio RECOVER es el primer ensayo clínico aleatorizado que evalúa mediante EE el papel de un PEFT en pacientes con SCP e IE. Los hallazgos más relevantes son: a) el PEFT mejora la capacidad funcional evaluada mediante VO2 pico en pacientes con SCP e IE; b) esta mejora se asocia con mejora de la calidad de vida; c) el PEFT mejora la fuerza y la composición corporal (porcentaje de grasa), y d) el PEFT se asocia con mejoras de la flexibilidad metabólica y la función mitocondrial estimada de manera indirecta mediante EE.
En nuestro estudio, se observó en el GI una mejora del 15% del VO2 pico y el 13,2% del %VO2máx. predicho, sin cambios significativos en el GC. Dicha mejoría en la capacidad funcional puede ser la causa de las mejoras en las escalas de calidad de vida.
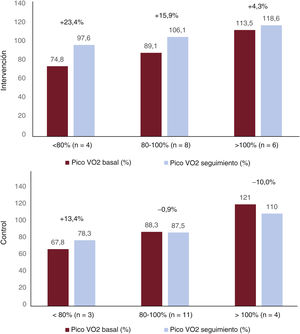
El VO2 basal fue del 94%, similar al descrito en casos leves y moderados tras 1 año de evolución11,14–17. Dicho VO2, superior al 80%, no excluye una limitación clínica significativa. Están descritas en la literatura diferencias entre los VO2 predichos entre pacientes sintomáticos y asintomáticos (el 92 frente al 107,3%), lo que pone de manifiesto la relación entre los síntomas del SCP y el VO217. Además, la mejoría de los síntomas se relaciona con la mejora del VO2 pico, que pone de manifiesto una mejora de la condición física probablemente deteriorada por el virus18. Sin embargo, con frecuencia el VO2 pico persiste reducido 12 meses después de la infección17. El VO2 basal de nuestra muestra, cercano a la normalidad, refuerza la eficacia del PEFT, ya que, atendiendo al principio de Wilder, es más difícil encontrar diferencias significativas cuanto mejores sean los valores iniciales19. Asimismo, estratificando la muestra por el VO2 basal (figura 4), se observa un gradiente de en las mejoras, pues mejoran más los pacientes con VO2 basal más bajo.
Cambio en el consumo de oxígeno (VO2) pico en el seguimiento en función del VO2 pico basal. Se muestra el cambio en el VO2 basal y en el seguimiento de los grupos de control e intervención (en negrita, la diferencia porcentual). Existe un gradiente de mejora en función del VO2 basal en el grupo de intervención, y obtienen mayor beneficio del programa de entrenamiento físico terapéutico los pacientes con menor VO2 basal, aunque persiste la mejoría en todo el grupo de intervención.
En consonancia con otros estudios20,21, se observan síntomas ansiosodepresivos, que se evaluaron mediante la escala PHQ-9, en la que se obtuvo una puntuación de 12,1 (depresión moderada). La funcionalidad se cuantificó con la escala PCFS, específica del SCP22, que comprende desde el 0 (ausencia de limitación) al 4 (limitación funcional grave). Ambos grupos presentaban una limitación de leve a moderada al inicio. El PEFT se asoció con una disminución de la ansiedad-depresión en el GI, mientras que se mantuvo en el GC. En cuanto a la funcionalidad, el PEFT consiguió una mejora significativa en la escala PCFS solo en el GI, probablemente debido al efecto del ejercicio en la plasticidad cerebral, al reducir la carga alostática derivada del periodo de convalecencia23.
La afección periférica-neuromuscular es una de las principales hipótesis que explican el origen de la IE en pacientes con SCP9,24. Distintas teorías tratan de dar respuesta a la etiopatogenia de la disfunción periférica, y nuestro grupo propone, con base en la evidencia actual y los hallazgos exploratorios que aquí se describen, la disfunción metabólica-mitocondrial como eje principal de la IE. Los pacientes con SCP presentan disfunción mitocondrial demostrada indirectamente mediante la tasa de oxFAT y la utilización del lactato (método descrito y validado por San Millán y Brooks25) y, también recientemente, estudios de metabolómica26. Esta disfunción mitocondrial está presente incluso cuando se compara a los pacientes con SCP con enfermos con síndrome metabólico, pues presentan una menor tasa de oxFAT y una mayor acumulación de lactato a cargas menores de ejercicio24. Se ha propuesto que el CD147, una glucoproteína mitocondrial transmembrana de la superfamilia de las inmunoglobulinas, puede servir de puerta de entrada para el SARS-CoV-2 al ejercer como receptor en las células huéspedes para la spike protein del virus27. A su vez, la CD147 está implicada en la expresión en la superficie mitocondrial de los transportadores monocarboxilatos MCT1 y MCT4, encargados de transportar el lactato acumulado en el citosol al interior de la mitocondria o a otras células adyacentes para su posterior aprovechamiento como fuente de energía. Un bloqueo o saturación de la CD147 por parte del virus podría suponer una menor expresión de los transportadores MCT1 y MCT4, lo cual conduciría indefectiblemente a la incapacidad mitocondrial de interiorizar y utilizar el lactato producido28. Por lo tanto, un pobre aclaramiento del lactato en las células, sumado a la menor capacidad oxidativa de las grasas, conduciría a la disfunción mitocondrial, origen de los síntomas de IE y la incapacidad funcional.
Es conocido el efecto beneficioso del ejercicio físico en la dinámica mitocondrial, estimulando, por un lado, los procesos de fusión mitocondrial, mitofagia y biogénesis mitocondrial, y por otro la transformación de fibras musculares rápidas (tipo IIa), de metabolismo fundamentalmente glucolítico, en fibras lentas (tipo I), con una mayor capacidad oxidativa de los ácidos grasos. En nuestro estudio, si bien no se disponía de la determinación de lactato, se utilizó la oxCHO (oxidación de hidratos de carbono) como parámetro indirecto de la función glucolítica, que en su conjunto pusieron de manifiesto una mayor flexibilidad metabólica tras la intervención. A pesar de que no se modificó significativamente la máxima oxidación de lípidos, la mejora en la flexibilidad metabólica viene determinada por una utilización más eficiente de los lípidos durante el ejercicio, mediante la mejora del tiempo y la carga a la que se alcanza el punto de agotamiento mitocondrial (el área bajo la curva de oxFAT se incrementa en el ejercicio). La utilización preferente de los lípidos permite reservar la utilización de hidratos de carbono para ejercicios de mayor intensidad, lo cual demuestra una mayor eficiencia energética.
Sobre los aspectos metodológicos del entrenamiento, cabe destacar la utilización de un método de entrenamiento de fuerza novedoso en la clínica29, proveniente del campo del rendimiento. En el campo del rendimiento físico, se está produciendo un cambio de paradigma en las últimas 2 décadas desde los entrenamientos de fuerza guiados por la carga (EGC), con base en una máxima repetición voluntaria, hacia métodos guiados por velocidad (EGV). Para ello, se emplean transductores lineales específicos que permiten medir en tiempo real la velocidad de cada repetición. La base de esta metodología consiste en que el individuo haga cada repetición a la máxima velocidad voluntaria posible. El número de repeticiones no está prefijado, sino que se ajusta a un porcentaje de pérdida de velocidad, es decir, al grado de fatiga que experimenta el paciente. Esto permite individualizar la carga en cada sesión en función del grado de mejora de la fuerza (pudiendo aplicar cargas mayores) y de la fatiga acumulada (reduciendo la carga); sin embargo, en el EGC la referencia es una RM estimada o de realización determinada al inicio de la programación del entrenamiento, fija e invariable durante este. Ya a finales de los años noventa se describía que, para mejorar la fuerza, es crítico realizar estos ejercicios a una velocidad determinada, de modo que el EGV, si se prescribe adecuadamente, consigue mayor ganancia de fuerza que el EGC29. Más allá de su mayor eficacia, uno de los aspectos más relevantes para su implementación es la posibilidad de individualizar y evaluar la fatiga en el EGV, lo que mejora la seguridad y evita el sobrentrenamiento, tan relevante no solo para la mejora en la fuerza, sino para la consecución de la adherencia (aspecto vital en este contexto clínico).
El umbral ventilatorio 1 no cambió significativamente tras la intervención, en parte debido al diseño del PEFT, enfocado a la mejora del objetivo primario (VO2 pico) y no tanto al trabajo en la zona 2, que repercute más directamente sobre él. Además, el umbral ventilatorio 1 estaba en un valores normales, hallazgo frecuente en el SCP, sobre todo si no se ha precisado hospitalización30,31, por lo que es más difícil inducir cambios relevantes.
Además del entrenamiento de fuerza, el de la musculatura respiratoria ha demostrado una mejoría sintomática significativa en los pacientes con SCP32. En nuestro estudio, el PEFT incluyó entrenamiento de la musculatura respiratoria, y se observó una mejora significativa de la presión inspiratoria máxima de los pacientes del GI, lo que ayudó a su recuperación funcional y sintomática.
Además de las posibles causas de la IE en el SCP ya comentadas, la compleja y todavía desconocida fisiopatología del SCP puede incluir disfunción autonómica, hiperventilación desproporcionada para el grado de ejercicio, insuficiencia cronotrópica o desregulación inmunitaria, entre otras33-36. Que se trate de las entidades propuestas u otros mecanismos fisiopatológicos está aún por dilucidar, así como si se trata realmente de un mecanismo exclusivo de la COVID-19 o común a una serie de enfermedades. Entender la fisiopatogenia de la IE en los pacientes con SCP permitiría encontrar tratamientos apropiados, pero por el momento los PEFT estructurados pueden ser el tratamiento de elección, dados los resultados esperanzadores de nuestro estudio.
Debido a la prevalencia del SCP, ofrecer PEFT en unidades específicas a todos los pacientes es imposible. Las unidades de rehabilitación cardiaca, dada su experiencia en la prescripción de PEFT, deberían tener un papel protagonista en el tratamiento del SCP. Para los pacientes sin acceso a estas unidades, el reto será estandarizar un PEFT domiciliario que incluya entrenamientos aeróbicos polarizados (baja y alta intensidad), de fuerza (sin maquinaria específica) y respiratorios, de manera que cualquier paciente pueda beneficiarse de nuestros hallazgos. La ausencia de ciertas tecnologías o de un entrenador se verá aminorada por la ventaja de mantener el programa más allá de las 8 semanas que duró nuestra intervención.
LimitacionesEste estudio tiene algunas limitaciones que es necesario reconocer. Aun potenciado para encontrar diferencias con significación estadística, el tamaño de nuestra muestra es pequeño. En segundo lugar, inherente al tipo de ensayo clínico, existe el sesgo de voluntariedad. Por el último, tras el inicio del estudio se agregaron los parámetros de función mitocondrial como objetivo secundario.
CONCLUSIONESLos PEFT en pacientes con SCP e IE mejoran la capacidad funcional evaluada mediante el VO2. Se acompañan de una mejora en la percepción de calidad de vida, la fuerza, el porcentaje de masa grasa y los parámetros de función metabólica-mitocondrial (flexibilidad metabólica).
FINANCIACIÓNBeca no condicionada de la Fundación Soliss.
CONTRIBUCIÓN DE LOS AUTORESLos autores del manuscrito aceptan la plena responsabilidad de su contenido, tal como lo define el Comité Internacional de Editores de Revistas Médicas. J. Godoy López y M. Gallango Brejano se encargaron del diseño y la aplicación del programa de entrenamiento. A. Berenguel Senén, A. Gadella Fernández, J. Borrego Rodríguez, P. Cepas Guillén, J. Godoy López y M. Gallango Brejano participaron en la escritura y la revisión del manuscrito. El resto de los autores contribuyeron en el diseño o el desarrollo del estudio.
- –
El SCP es una enfermedad frecuente tras la infección aguda por COVID-19, cuyo síntoma más frecuente es la intolerancia al ejercicio. Los trabajos publicados demuestran que existe afección neuromuscular periférica.
- –
El estudio RECOVER es el primer ensayo clínico aleatorizado que evalúa mediante ergoespirometría el papel de un PEFT en pacientes con SCP. Se observa que es eficaz en la mejora de la capacidad funcional (medida mediante el cambio de VO2), así como en la calidad de vida, la fuerza, los parámetros de función mitocondrial y la composición corporal.
Los autores declaran no tener conflictos de intereses.