Gracias a la prevención secundaria que se lleva a cabo en la actualidad, se ha reducido el impacto de los eventos cardiovasculares. Sin embargo, siguen siendo demasiado importantes y dejan al paciente con un riesgo residual que se debe neutralizar. Las relaciones entre los lípidos, el riesgo cardiovascular y la inflamación no han cambiado en los últimos años, en gran medida, debido a la falta de mecanismos de intervención en la inflamación.
Aunque los actuales tratamientos agresivos para la ateroesclerosis mediante la reducción de los lípidos se abordan con nuevas vías y mecanismos de acción, podrían resultar insuficientes para atacar las complejas interrelaciones que contribuyen a la ocurrencia de eventos clínicos cardiovasculares y reducir al mínimo el riesgo residual no controlado. Futuros abordajes mediante mejor reducción de las lipoproteínas de baja densidad, control de otras especies lípidicas e inhibición de la inflamación podrían brindar soluciones, en forma de futuros tratamientos combinados, para modular las vías que contribuyen a que los pacientes sufran eventos cardiovasculares mayores.
Palabras clave
El riesgo residual es el que permanece después de que se hayan realizado intervenciones dirigidas a reducir y/o eliminar variables conocidas y abordables que confieren riesgo. El riesgo residual permanece después de aplicar los mecanismos que salvan el riesgo inherente a un proceso. Esto significa que el riesgo residual es algo que podría reducirse mejorando el conocimiento de los procesos patológicos que tienen relación con el proceso final y, por lo tanto, capaces de mitigar el riesgo.
En la enfermedad cardiovascular, el control de la dislipemia, con la reducción de las lipoproteínas de baja densidad (LDL) transportadoras de colesterol circulantes, ha sido una de las grandes oportunidades para reducir el riesgo de eventos cardiovasculares mayores (MACE). Además, la evolución del conocimiento sobre las LDL ha permitido desarrollar fármacos potentes y seguros para reducir los MACE en pacientes en riesgo.
Las directrices, guías y consensos sobre el control de la dislipemia han cambiado significativamente en los últimos años debido a dichos avances terapéuticos en el área de los lípidos. La guía del American College of Cardiology (ACC)/American Heart Association (AHA) de 2018 sobre el tratamiento del colesterol recomienda la terapia primaria con estatinas con un objetivo de colesterol unido a lipoproteínas de baja densidad (cLDL) < 70 mg/dl para pacientes con ateroesclerosis o alto riesgo de MACE1. Como el uso único de estatinas comporta algún problema para los pacientes que no pueden tolerar las dosis máximas de estatinas adecuadas para lograr estos objetivos e incluso con dichas dosis no se alcanzan los objetivos terapéuticos, con el consiguiente riesgo residual, la guía recomienda medicamentos adicionales para reducir el riesgo asociado con las altas concentraciones de cLDL, como la ezetimiba y los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9), y llegar a objetivos terapéuticos de LDL más bajos2. Existe suficiente evidencia de que el tratamiento combinado reduce significativamente el cLDL y los eventos cardiovasculares, lo que indica que este tratamiento sea el nuevo estándar. Las guías incorporan estas nuevas directrices terapéuticas con el objetivo de reducir el riesgo cardiovascular asociado con los lípidos3,4. Sin embargo, los estudios demuestran que existe todavía un riesgo residual no abordado con la terapia hipolipemiante. Incluso con una mediana de 7 años de exposición a los iPCSK9, reportado en FOURIER-OLE5, las estrategias actuales son solo parcialmente efectivas para mitigar el riesgo de sufrir eventos cardiovasculares, ya que las tasas de eventos recurrentes siguen siendo altas porque el riesgo residual solo es parcialmente modificable una vez que se ha desarrollado la ateroesclerosis. Sin duda, los hallazgos de este estudio representan un gran avance si se aplican al cuidado del paciente; sin embargo, si bien los participantes en ese estudio ciertamente se beneficiaron de la adición de un iPCSK9 y el inicio más temprano se asoció con un mayor beneficio, las tasas de eventos fueron altas6. Las curvas de Kaplan-Meier para el criterio principal de valoración (compuesto de muerte cardiovascular, infarto, accidente cerebrovascular, hospitalización por angina inestable o revascularización coronaria) indican que la incidencia acumulada de eventos durante el programa FOURIER (FOURIER + FOURIER-OLE combinados) fue del 26,9% de los asignados a placebo-evolocumab frente al 24,4% de los que recibieron evolocumab durante todo el periodo. Incluso cuando solo se considera el periodo de estudio del FOURIER-OLE, que esencialmente comparó 2 grupos en el mejor régimen de reducción de lípidos actual posible pero con 2 años de diferencia, la incidencia acumulada fue del 17,5% de los aleatorizados inicialmente a placebo y el 15,4% de los aleatorizados a evolocumab. Si bien la extrapolación de las tasas de eventos a 10 años todavía no es posible, estos pacientes continúan claramente con un riesgo muy alto a pesar de haber casi eliminado la contribución del cLDL a la ecuación del factor de riesgo. Aunque hubo una reducción estadísticamente significativa de los MACE, esta disminución está lejos de ser completa, incluso con una mediana de exposición de 7 años al inhibidor del cLDL más potente actualmente disponible.
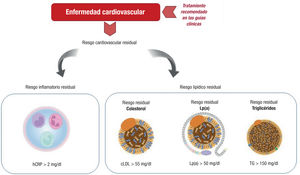
Estos estudios reflejan que los tratamientos disponibles y las estrategias actuales son solo parcialmente efectivas para mitigar el riesgo cardiovascular. Nuevos fármacos que se encuentran en fases avanzadas de desarrollo podrán mejorar el control de factores asociados con los lípidos, en un abordaje de tratamiento combinado con estatinas. Así, se ha demostrado que el inclisirán, un inhibidor inyectable de la producción de PCSK9 en el hígado (siRNA), proporciona reducciones drásticas y sostenidas del cLDL con una frecuencia de administración reducida y con un desarrollo farmacéutico ejemplar en diversos ensayos clínicos en grupos de pacientes seleccionados7 y a la espera de los resultados del ensayo de eventos cardiovasculares (ORION-4). Las guías todavía no recomiendan tratamientos que reduzcan el cLDL por un mecanismo distinto de eliminar las partículas de LDL a través del receptor de LDL (LDLR), puesto que su beneficio clínico es todavía incierto (figura 1).
NUEVOS ABORDAJES DEL RIESGO RESIDUAL CON ESTRATEGIAS DIRIGIDAS A LÍPIDOSLos avances en el tratamiento con estatinas, ezetimiba, y la inhibición de PCSK9 han sido importantes, pero el objetivo son los lípidos del eje de riesgo —LDL que se metabolizan por el LDLR— clásico. Los triglicéridos aumentados identifican a grupos de pacientes con riesgo cardiovascular, ya que participan patológicamente en la vía causal de la ateroesclerosis. La reducción de triglicéridos se abordó con anterioridad en estudios clínicos con fibratos, niacina e inhibidores de la proteína de transferencia de ésteres de colesterol, pero la evidencia fue inconcluyente en la reducción de eventos en pacientes con cifras de LDL ya óptimas. Asimismo, un ensayo clínico reciente con pemafibrato ha demostrado también su inutilidad8. No obstante, los estudios epidemiológicos siguen demostrando la importancia de los triglicéridos en el riesgo residual de pacientes con enfermedad ateroesclerótica tratados con estatinas, y por ello se investigan nuevas estrategias con nuevos fármacos. Estos datos con fármacos no relacionados con fibratos resultan más alentadores; entre ellos, los derivados de ácidos grasos poliinsaturados omega-3 a dosis altas (etiléster), inhibidores de la apoC-III (APOC3), inhibidores de la proteína similar a la angiopoyetina 3 (ANGPTL3), inhibidores de la diacilglicerol aciltransferasa intestinal (pradigastat) y tratamientos dirigidos a ApoC-II y A-V, y proteína similar a la angiopoyetina 49. De hecho, los triglicéridos son en este momento dianas de nuevos fármacos porque son marcadores de riesgo residual. Los estudios en marcha informarán de su eficacia y su seguridad.
La reducción del riesgo residual después de la inhibición del eje del LDLR pasa por el avance, la caracterización y la eventual incorporación a la clínica de esos nuevos fármacos que, aun centrados en la dislipemia, abordan distintas vías de inhibición10. La ANGPTL3, que inhibe la lipoproteinlipasa (LPL) y la lipasa endotelial (EL), enzimas que participan en el metabolismo de los triglicéridos, está en fase de ensayo clínico con distintas formas terapéuticas11. Los inhibidores de APOC3 (pequeña glucoproteína que aumenta los triglicéridos circulantes al inhibir tanto la LPL como el aclaramiento hepático de los remanentes) son también candidatos para reducir el riesgo residual tras la inhibición del eje del LDLR12.
La lipoproteína (a) [Lp(a)] afecta a la aterotrombosis por distintas vías (unión a proteoglicanos y fibronectina del subendotelio, efectos proinflamatorios por unión a fosfolípidos oxidados e inhibición de la conversión de plasminógeno en plasmina). El tratamiento para la reducción de Lp(a) está en una fase muy activa de investigación en ensayos clínicos13.
La capacidad de reducir las LDL con una combinación de fármacos disminuirá el riesgo residual asociado con la dislipemia, pero es biológicamente plausible que el riesgo residual asociado con otros factores contribuyentes a la presentación de enfermedad cardiovascular quede todavía no cubierto. De hecho, ese riesgo residual se mantendrá si los fármacos utilizados solo son una de las estrategias destinadas a reducir el riesgo cardiovascular. La enfermedad cardiovascular es compleja, pues en ella participan muchas vías de activación y es multigénica (figura 1).
NUEVOS ABORDAJES DEL RIESGO RESIDUAL CON ESTRATEGIAS DIRIGIDAS A LA INFLAMACIÓNLos estrechos vínculos entre la inflamación, la aterotrombosis y los síndromes coronarios se conocen desde hace mucho tiempo. Estudios experimentales y clínicos lo han demostrado, aunque su transformación en objetivo de la práctica clínica, por la poca disponibilidad de fármacos de utilidad clínica, ha sido y es lenta y controvertida. La ateroesclerosis es un proceso inflamatorio vascular crónico, iniciado por la internalización de lípidos y complicado por la infiltración de células de la inmunidad innata y adquirida que liberan moléculas inflamatorias14,15. Las placas con alto riesgo de producir síntomas clínicos son las ricas en lípidos, macrófagos y neutrófilos en comparación con las placas de bajo riesgo de complicación clínica, que son fibrosas. La aterotrombosis, como causa mayor de los síntomas clínicos agudos, se produce por la agregación plaquetaria, la fibrina, los eritrocitos y la captación de células inflamatorias circulantes16. La caracterización del trombo intracoronario de pacientes con infarto agudo de miocardio con elevación del ST (IAMCEST) entre las primeras horas después del inicio del dolor y la intervención coronaria percutánea (ICP) reveló una inclusión rápida (3 h) de neutrófilos y monocitos y una aparición tardía (6 h) de linfocitos T y B junto con células progenitoras. El contenido de fibrina aumentó con el tiempo, al contrario del patrón observado en el contenido de plaquetas (debido al tratamiento antiplaquetario de los pacientes), y el alto contenido de células inflamatorias en los trombos antiguos indicó el importante papel de las células de la inmunidad innata en la dinámica del crecimiento del trombo16. Muchos factores protrombóticos (fibrinógeno, PAI, vWF, etc.) son reactantes de fase aguda, y muchos factores antiinflamatorios con efectos en la ateroesclerosis y la trombosis, como la colchicina, y la inhibición de la interleucina (IL) 6 reducen la síntesis de fibrinógeno, entre otros efectos como reducción de la proteína C reactiva (PCR) y las citocinas proinflamatorias17,18.
Además, se ha estimado que los factores de riesgo clásicos (hipertensión, diabetes, dislipemia, tabaquismo, obesidad, sedentarismo) se asocian con inflamación sistémica de bajo grado19. Dicha inflamación subclínica de bajo grado aumenta el riesgo de MACE entre las personas aún sin evidencia clínica de enfermedad cardiovascular. Concentraciones elevadas de fibrinógeno20 y el número de leucocitos son predictores de MACE. Además los marcadores inflamatorios comunes pueden predecir el riesgo de MACE en pacientes tanto agudos como crónicos21.
El concepto de tromboinflamación se ha propuesto como un vínculo para incluir los diferentes sistemas que tienen un papel en el desencadenamiento de la trombosis, incluidos los mediadores inflamatorios humorales, la respuesta inmunitaria innata, la coagulación y la fibrinolisis y el sistema del complemento. La activación de estos sistemas posteriormente induce la activación —o resulta de ella— de células endoteliales, leucocitos y plaquetas, y desencadena finalmente reacciones trombóticas e inflamatorias18. Estas evidencias reflejan un riesgo residual no cubierto y relacionado con la inflamación en la presentación de MACE.
En resumen, lípidos, inflamación y tromboinflamación contribuyen a que ocurran eventos del tipo de los MACE en pacientes con enfermedad cardiovascular. La prevención secundaria recomendada por las guías de práctica clínica ha reducido el impacto de los eventos cardiovasculares. Sin embargo, su importancia se mantiene, lo que da lugar a un riesgo residual para el paciente que se debería mitigar o reducir al mínimo de manera eficiente. Las relaciones entre los lípidos, el riesgo cardiovascular y la inflamación no han avanzado en los últimos años debido en gran medida a la falta de fármacos seguros, eficaces, dirigidos a dianas clave en el proceso y que no conlleven efectos no deseados.
Aunque los actuales tratamientos agresivos para la ateroesclerosis mediante la reducción de los lípidos se complementan con la apertura de nuevos mecanismos y vías de acción, el solo control del riesgo asociado con especies lipídicas podría ser insuficiente para abordar las complejas interrelaciones que contribuyen a que se produzcan primeros eventos clínicos cardiovasculares y la progresión de la enfermedad con recurrencia de eventos y para reducir al mínimo el riesgo residual no controlado (figura 1). Futuros abordajes con reducción de las LDL, control de otras especies lipídicas e inhibición de la inflamación podrían brindar soluciones en forma de futuros tratamientos combinados para eliminar el riesgo residual tanto como sea posible en los pacientes con riesgo cardiovascular.
CONTRIBUCIÓN DE LOS AUTORESLos autores han participado en la redacción del manuscrito y la revisión de forma proporcional y aceptan su publicación.
INFORMACIÓN SOBRE EL SUPLEMENTOEste artículo forma parte del suplemento titulado “Riesgo cardiovascular residual: nuevos enfoques”, el cual ha sido financiado por la sección de Riesgo Vascular y Rehabilitación Cardiaca de la Sociedad Española de Cardiología.