El implante percutáneo de válvula aórtica (TAVI) autoexpandible (AE) es particularmente útil para pacientes con estenosis aórtica y accesos vasculares pequeños, anillo pequeño y ostium coronario bajo. Sin embargo, aún no está claro si el resultado clínico y hemodinámico es comparable entre los distintos dispositivos AE. Nuestro objetivo es determinar diferencias clínicas y hemodinámicas entre dispositivos, ajustando por características basales.
MétodosSe analizaron los casos tratados con TAVI-AE en 4 instituciones. Se incluyeron características basales y al seguimiento, y el análisis de los ecocardiogramas fue centralizado y ciego. Se compararon los 4 dispositivos tras emparejar 1:1 por grado de calcificación, dimensiones del anillo, superficie corporal y función ventricular.
ResultadosSe incluyó a 514 pacientes (Evolut R/PRO, 217; ACURATE neo, 107; ALLEGRA, 102; Portico: 88). No hubo diferencias en las escalas de riesgo. No se detectaron diferencias en insuficiencia aórtica tras el TAVI ni en las tasas de mortalidad hospitalaria (2,7%). La tasa de implante de marcapasos mostró diferencias significativas (p=0,049), con la mayor tasa tras Portico (23%) y la menor tras ACURATE neo (9,5%). La Evolut R/PRO y la ALLEGRA presentaron tasas del 15,9 y el 21,2%. Tras el ajuste, la comparación mostró mayor gradiente residual y menor área valvular aórtica indexada con ACURATE neo que con ALLEGRA (p=0,001), pero con esta se produjo la mayor tasa de embolización del dispositivo y una tendencia estadística a mayor tasa de eventos cerebrovasculares.
ConclusionesLa comparación de 4 TAVI-AE tras ajustar por diferencias basales no demostró diferencias en las tasas de insuficiencia aórtica periprotésica ni en la mortalidad hospitalaria.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) es una alternativa terapéutica importante para los pacientes con estenosis aórtica grave y riesgo quirúrgico alto, intermedio o bajo1–4. El diseño de los dispositivos percutáneos más comercializados incluye prótesis expandibles mediante un balón y prótesis autoexpandibles (TAVI-AE). Concretamente, las válvulas de tipo TAVI-AE son la alternativa preferida para determinadas situaciones clínicas, como alto grado de calcificación5, anillos pequeños6, ostium coronario bajo7, tortuosidad intensa de la aorta ascendente8, acceso transvascular no transfemoral9 y menor tamaño del vaso. Sin embargo, los dispositivos TAVI-AE se han asociado con mayores tasas de fugas paravalvulares (FPV) moderada a grave, lo cual podría implicar un aumento de hasta el triple de la mortalidad en el seguimiento a 1 año10,11. Aunque la posdilatación de la prótesis podría reducir la incidencia de FPV, este método no está exento de riesgos, ya que se ha asociado mayor tasa de trastornos de la conducción de nueva aparición (que también son un importante motivo de preocupación con la mayoría de dispositivos TAVI-AE), migración de la válvula, rotura del anillo e ictus12.
Se han aplicado varias medidas para reducir estas complicaciones, entre ellas el empleo de faldones de sellado, una expansión de la fuerza radial más homogénea y capacidad de reposicionamiento13. Continúa sin estar claro si la cada vez más amplia gama de nuevas iteraciones de dispositivos de tipo TAVI-AE se comporta igual en lo que respecta a los resultados de hemodinámica, trastornos de la conducción y evolución clínica. En consecuencia, se han comparado los principales datos de evolución clínica y los resultados hemodinámicos (evaluados mediante un análisis ecocardiográfico centralizado y con enmascaramiento) de los 4 dispositivos TAVI-AE existentes en nuestro medio: Evolut R/PRO (Medtronic, Estados Unidos), ACURATE neo (Boston Scientific, Estados Unidos), ALLEGRA (New Valve Technology AG, Suiza) y Portico (Abbott, Estados Unidos).
MÉTODOSPoblación en estudioEn este estudio retrospectivo se incluyó a los 514 pacientes sintomáticos consecutivos con estenosis aórtica grave de la válvula nativa tratados con TAVI con dispositivos TAVI-AE en algunos de los 4 centros participantes. Se registraron los datos y las imágenes de todas las intervenciones realizadas entre enero de 2017 y enero de 2019 en una base de datos específica para ello, tras obtener el consentimiento informado firmado de los pacientes y la aprobación de los comités de ética locales.
En todos los casos, el equipo médico-quirúrgico de cada centro determinó la indicación y la elegibilidad para la intervención y el tipo de válvula. Para ser incluidos en el estudio, los pacientes debían tener imágenes de ecocardiografía basales, durante la hospitalización y a los 30 días. También debían tener datos de tomografía computarizada con multidetectores y debía disponerse de los principales resultados clínicos, de la intervención y de la evolución a largo plazo.
El objetivo primario fue el resultado hemodinámico valvular evaluado mediante parámetros ecocardiográficos, de modo que se realizaron comparaciones emparejadas con pares de dispositivos alternativos. Los objetivos secundarios se basaron en el consenso VARC-2 e incluyeron los siguientes: mortalidad cardiovascular, infarto de miocardio, eventos cerebrovasculares, complicaciones hemorrágicas, daño renal agudo, complicaciones vasculares, trastornos de la conducción y arritmia, rehospitalización y clase funcional de la New York Heart Association (NYHA).
Análisis de imágenes diagnósticasLas ecocardiografías se realizaron según lo establecido en la guía de la American Society of Echocardiography antes de la intervención, al alta y en el seguimiento a los 30 días. Se determinaron los siguientes parámetros: diámetro del tracto de salida del ventrículo izquierdo; fracción de eyección del ventrículo izquierdo (FEVI) evaluada con el método de biplano de Simpson; gradientes transvalvulares medio y máximo; área determinada mediante la ecuación de continuidad, y presencia, grado y tipo (transvalvular, paravalvular, global) de la insuficiencia aórtica (IA). La gravedad de la IA se evaluó con un método multiparamétrico y se clasificó según las recomendaciones del consenso VARC-214 de la siguiente forma: 0, ninguna/trazas; 1, leve; 2, de leve a moderada; 3, moderada, y 4, grave. Los grados 3 y 4 se consideraron una IA significativa. Se evaluó también la localización y la extensión circunferencial de la IA paravalvular. La extensión circunferencial del chorro paravalvular se midió en proyecciones paraesternales de eje corto mediante imágenes de Doppler color15. Las imágenes se analizaron de manera centralizada16 por 2 evaluadores independientes (SVV y SSM) que no conocían el tipo de prótesis empleado, y se determinó la ausencia de diferencias significativas en un 10% de las exploraciones. Se evaluó la calidad inicial de las imágenes para determinar el porcentaje de pacientes con información disponible sobre los principales objetivos de las exploraciones de imagen, incluido el valor basal de la FEVI (disponible en el 91,6% de los casos), los gradientes aórticos máximo y medio (92,8%), el área valvular aórtica estimada (83,3%), la presencia y el grado general de IA (90,6%), el grado de insuficiencia mitral (93,6%) y la insuficiencia tricuspídea (69,2%). En el seguimiento realizado a los 30 días, se dispuso de los valores de la FEVI de un 91,6% de las exploraciones; el gradiente aórtico máximo y medio, un 88%; el área valvular aórtica, el 81,5%; el área valvular aórtica indexada, el 81,3%, y la presencia, el grado general y la localización de la IA (periprotésica o intraprotésica), el 99,2%.
Se realizaron exploraciones de tomografía computarizada con multidetectores según lo establecido en la guía de la Society of Cardiovascular Computed Tomography17 y se dispuso de exploraciones de buena calidad de 479 pacientes (el 93,5% de la población del estudio). Los principales parámetros evaluados fueron: dimensiones del anillo aórtico (diámetros, perímetro y área), perímetro y diámetros derivados del área, índice de excentricidad y calcificación de la válvula aórtica evaluada según la puntuación de calcio (unidades Agatston).
Análisis estadísticoLas variables cualitativas se presentan en forma de frecuencias, y las comparaciones de los grupos se realizaron con la prueba de la χ2 o la prueba exacta de Fisher. Las variables continuas se presentan en forma de media±desviación estándar o mediana [intervalo intercuartílico] y se analizó su distribución normal mediante la prueba de Kolmogorov-Smirnov. Las comparaciones de los grupos se realizaron con la prueba de la t o la prueba de la U de Mann-Whitney en función de la distribución de la variable. Se utilizó un ANOVA para las comparaciones de múltiples grupos. Las diferencias se consideraron estadísticamente significativas con p < 0,05.
Se utilizaron 7 puntuaciones de propensión para realizar comparaciones por pares (1:1) de los 4 tipos de válvulas, para lo que se incluyeron las siguientes variables: FEVI (margen del 10%, evaluada mediante ecocardiografía transtorácica), diámetro (margen de 0,5mm) y área del anillo aórtico (margen de 50mm2) (medidos en la tomografía computarizada), área de superficie corporal (margen de 0,4 m2), índice de masa corporal (margen de 5 puntos) y grado de calcificación (margen de 500 UA), a pesar de la ausencia de diferencias basales. Los pares de pacientes se establecieron con el método del vecino más próximo (nearest neighbor) con un algoritmo de emparejamiento avaro en relación 1:1, con una quinta parte del logit de la puntuación de propensión como calibrador en el programa MatchIt18. Tras el emparejamiento, las comparaciones de los grupos se realizaron con la prueba de McNemar para variables cualitativas y la prueba de la t para los datos emparejados de las variables continuas. Se utilizó un análisis de Kaplan-Meier con log-rank test para comparar las tasas de supervivencia de los grupos.
Todos los análisis se llevaron a cabo con el programa IBM SPSS Statistics versión 24 (IBM, Estados Unidos).
RESULTADOSDe un total de 826 pacientes sometidos a TAVI en el periodo de estudio, en 514 (62,2%) se utilizó 1 de los 4 dispositivos TAVI-AE: en el 42,2% (n=217), una válvula Evolut R/PRO; en el 20,8% (n=107), una válvula ACURATE neo; en el 19,8% (n=102), una válvula ALLEGRA y en el 17,1% (n=88), una válvula Portico. Los 4 centros participantes utilizaron los 4 dispositivos comparados en esta investigación y no hubo diferencias significativas en sus principales resultados.
Características basales clínicas y de diagnóstico por la imagenEn la tabla 1 se resumen las principales características basales de los pacientes. La media de edad de la población fue 81,4±6,8 años y el 54,7% eran mujeres; hubo una mayor proporción de mujeres tratadas con las válvulas ACURATE neo y Portico (el 64,5 y el 65,9% respectivamente; p=0,003). En la situación inicial había más pacientes con un marcapasos permanente considerados candidatos al tratamiento y tratados con las válvulas Evolut R/PRO (16,2%) y Portico (17%), frente a menos del 10% de los tratados con los demás dispositivos TAVI-AE (p=0,049). Por lo que respecta al nivel de riesgo basal, no se observaron diferencias en cuanto a la puntuación STS o el EuroSCORE, pero los pacientes del grupo de la válvula Portico tenían una puntuación de fragilidad superior (2,18±1,3) a las de los demás grupos (p=0,001).
Principales características basales de la población total del estudio y según el tipo de válvula
| Población totaln=514 | Evolut R/PROn=217 (42,2%) | ACURATE neon=107 (20,8%) | ALLEGRAn=102 (19,8%) | Porticon=88 (17,1%) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 81,4±6,8 | 81,4±6,9 | 81,5±6,2 | 80,7±7,5 | 82,4±5,87 | 0,426 |
| Mujeres | 281/514 (54,7) | 105/217 (48,4) | 69/107 (64,5) | 49/102 (48) | 58/88 (65,9) | 0,003* |
| ASC (m2) | 1,75±0,19 | 1,75±0,19 | 1,75±0,18 | 1,76±0,18 | 1,72±0,21 | 0,67 |
| IMC | 27,91±4,56 | 27,35±4,4 | 28,34±4,4 | 28,7±4,9 | 27,7±4,5 | 0,051 |
| Diabetes mellitus | 190/514 (37) | 83/217 (38,2) | 37/107 (34,6) | 39/102 (38,2) | 31/88 (35,2) | 0,897 |
| Hipertensión | 409/514 (79,6) | 165/217 (76) | 87/107 (81,3) | 80/102 (78,4) | 77/88 (87,5) | 0,148 |
| Dislipemia | 310/514 (60,3) | 120/217 (55,3) | 66/107 (61,7) | 64/102 (62,7) | 60/88 (68,2) | 0,180 |
| Tabaquismo | 99/514 (19,3) | 46/217 (21,2) | 14/107 (13) | 22/102 (21,6) | 17/88 (19,3) | 0,001* |
| Marcapasos permanente | 67/513 (13) | 35/216 (16,2) | 10/107 (9,3) | 7/102 (6,9) | 15/88 (17) | 0,049* |
| Enfermedad renal crónica | 181/514 (35,2) | 73/217 (33,6) | 39/107 (36,4) | 43/102 (42,2) | 26/88 (29,5) | 0,296 |
| Hemodiálisis | 5/513 (1,0) | 3/217 (1,4) | 1/106 (0,9) | 1/102 (1) | 0/88 (0) | 0,743 |
| EPOC | 78/513 (15,2) | 46/217 (21,2) | 11/106 (10,4) | 15/102 (14,7) | 6/88 (6,8) | 0,005* |
| Enfermedad arterial periférica | 36/506 (7,0) | 22/214 (10,3) | 4/106 (3,8) | 7/102 (6,9) | 3/84 (3,6) | 0,084 |
| Ictus/AIT previo | 45/514 (8,8) | 16/217 (7,4) | 10/107 (9,3) | 9/102 (8,8) | 10/88 (11,4) | 0,725 |
| Aorta de porcelana | 22/513 (4,3) | 13/216 (6) | 1/107 (0,9) | 3/102 (2,9) | 5/88 (5,7) | 0,146 |
| Enfermedad coronaria | 182/514 (35,4) | 98/217 (45,2) | 34/107 (31,8) | 26/102 (25,5) | 24/88 (27,3) | 0,001* |
| Cirugía cardiaca previa | 55/436 (12,6) | 32/217 (14,7) | 9/73 (12,3) | 7/58 (12,1) | 7/88 (8) | 0,449 |
| CABG previa | 29/510 (5,6) | 18/213 (8,5) | 4/107 (3,7) | 4/102 (3,9) | 3/88 (3,4) | 0,155 |
| Cirugía valvular previa | 39/510 (7,6) | 22/213 (10,3) | 6/107 (5,6) | 6/102 (5,9) | 5/88 (5,7) | 0,292 |
| Fibrilación auricular | 205/514 (39,9) | 90/217 (41,5) | 34/107 (31,8) | 38/102 (37,3) | 43/88 (48,9) | 0,093 |
| Medicación (n=506) | ||||||
| Ácido acetilsalicílico | 242/506 (47,8) | 104/212 (49,1) | 54/105 (51,4) | 44/101 (43,6) | 40/88 (45,5) | 0,658 |
| Clopidogrel | 151/506 (29,8) | 64/212 (30,2) | 30/105 (28,6) | 23/101 (22,8) | 34/88 (38,6) | 0,124 |
| AVK | 165/506 (32,6) | 76/212 (35,8) | 20/105 (19) | 32/101 (31,7) | 37/88 (42) | 0,004* |
| NACO | 37/406 | 8/116 (6,9) | 13/102 (12,7) | 8/100 (8) | 8/88 (9,1) | 0,482 |
| NYHA III-IV | 258/504 (51,2) | 122/213 (57,3) | 42/102 (41,2) | 53/102 (52) | 41/87 (57,1) | 0,049* |
| Puntuación de fragilidad | 0,95±1,2 (n=500) | 0,75±1,1 (n=216) | 0,81±1 (n=99) | 0,42±0,6 (n=102) | 2,18±1,3 (n=88) | 0,001* |
| Puntuación TAVI (del ACC) | 4,1±3,2 | 4,2±3,9 | 4±3,5 | 4,6±4,2 | 4,3±3,8 | 0,999 |
| Puntuación STS | 4,9±4,33 | 5±4,1 | 4,4±1,4 | 5±5,5 | 4,9±2,7 | 0,920 |
| EuroSCORE logístico | 15,5±10,84 | 15,9±11,4 | 13,4±8,3 | 16,1±14,1 | 15,2±9,0 | 0,71 |
ACC: American College of Cardiology; AIT: accidente isquémico transitorio; ASC: área de superficie corporal; AVK: antagonistas de la vitamina K; CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica.
Los valores expresan n/N (%) o media±desviación estándar.
En la tabla 2 se presentan los resultados de ecocardiografía y de tomografía computarizada con multidetectores en la situación inicial, según el tipo de válvula utilizado. No hubo diferencias significativas entre los grupos en cuanto a la gravedad de la estenosis aórtica (p> 0,50 en el gradiente transvalvular medio) o la FEVI. Tal como se muestra en la tabla 2, el tamaño medio del anillo aórtico, determinado mediante tomografía computarizada, fue significativamente mayor en los pacientes tratados con el dispositivo Evolut R/PRO, pero el grado de calcificación fue similar en los grupos de los distintos dispositivos.
Principales hallazgos ecocardiográficos y de tomografía computarizada basales de la población total y según el tipo de válvula
| Población totaln=514 | Evolut R/PROn=217 (42,2%) | ACURATE neon=107 (20,8%) | ALLEGRAn=102 (19,8%) | Porticon=88 (17,1%) | p | |
|---|---|---|---|---|---|---|
| Datos de tomografía computarizada | ||||||
| Diámetro máximo del anillo aórtico (mm) | 26±3,1 | 26,6±3,6 | 25,8±2,3 | 26,7±2,6 | 25,6±2,6 | 0,003b |
| Diámetro mínimo del anillo aórtico (mm) | 21,3±2,9 | 21,8±3,2 | 20,9±2,4 | 21,3±2,7 | 20,4±2,4 | 0,002b |
| Índice de excentricidada | 0,182±0,093 | 0,174±0,098 | 1,184±0,089 | 0,202±0,087 | 0,189±0,086 | 0,203 |
| Diámetro medio del anillo aórtico (mm) | 23,7±2,6 | 24,1±3,2 | 23,3±2,0 | 23,8±2,3 | 22,8±1,9 | 0,001b |
| Área del anillo aórtico (mm2) | 432,71±92 | 451±113 | 417±64 | 431±82 | 410±68 | 0,001b |
| Perímetro del anillo aórtico (mm) | 75,3±11,7 | 76,8±11,7 | 73,3±10 | 80,1±9,7 | 69,4±11 | 0,001b |
| Puntuación de calcio (UA) | 2285 (1531-3216) | 2402 (1474-3276) | 2145 (1650-3114) | 2313 (1604-3435) | 2148 (1581-2811) | 0,553 |
| Datos ecocardiográficos | ||||||
| FEVI (%) | 57±12 | 56±12 | 59±10 | 56±11 | 58±11 | 0,198 |
| Gradiente aórtico máximo (mmHg) | 74,4±22 | 74±23 | 74,5±23 | 80±21 | 74±21 | 0,190 |
| Gradiente aórtico medio (mmHg) | 44,4±15 | 44,5±15 | 45,1±14 | 44,6±12 | 45,3±13 | 0,970 |
| Área de válvula aórtica (cm2) | 0,7±0,2 | 0,74±0,2 | 0,72±0,2 | 0,71±0,2 | 0,68±0,1 | 0,271 |
| Insuficiencia aórtica | ||||||
| Ninguna/trazas (grado 0) | 182/466 (39,1) | 62/182 (34,1) | 41/97 (42,3) | 48/99 (48,5) | 31/88 (35,2) | |
| Leve (grado 1) | 170/466 (36,5) | 71/182 (39) | 34/97 (38,1) | 34/99 (34,3) | 28/88 (31,8) | |
| Moderada (grado 2) | 84/466 (18) | 32/182 (17,6) | 13/97 (13,4) | 12/99 (12) | 27/88 (30,7) | |
| Moderada-grave (grado 3) | 23/466 (4,9) | 13/182 (7,1) | 5/97 (5,2) | 3/99 (3,0) | 2/88 (2,3) | |
| Grave (grado 4) | 7/466 (1,5) | 4/182 (2,2) | 1/97 (1) | 2/99 (2) | 0 | |
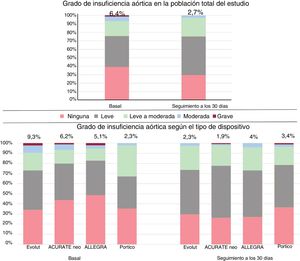
| Insuficiencia aórtica (3-4) | 30/466 (6,4) | 17/182 (9,3) | 6/97 (6,2) | 5/99 (5,1) | 2/88 (2,3) | 0,144 |
| Insuficiencia mitral | ||||||
| Ninguna/trazas (grado 0) | 152/483 (31,5) | 50/199 (25,1) | 39/98 (39,8) | 42/98 (42,9) | 21/88 (23,9) | |
| Leve (grado 1) | 216/483 (44,7) | 87/199 (43,7) | 39/98 (39,8) | 39/98 (39,8) | 51/88 (58) | |
| Moderada (grado 2) | 98/483 (20,3) | 53/199 (26,6) | 19/98 (19,4) | 15/98 (15,3) | 11/88 (12,5) | |
| Moderada-grave (grado 3) | 15/483 (3,1) | 7/199 (3,5) | 1/98 (1) | 2/98 (2) | 5/88 (5,7) | |
| Grave (grado 4) | 2/483 (0,4) | 2/199 (1) | 0 | 0 | 0 | |
| Insuficiencia mitral (3-4) | 17/483 (3,5) | 9/199 (4,5) | 1/98 (1) | 2/98 (2) | 5/88 (5,7) | 0,237 |
| Insuficiencia tricuspídea (3-4) | 18/356 (5,1) | 7/104 (6,7) | 1/64 (1,6) | 5/100 (5) | 5/88 (5,7) | 0,419 |
FEVI: fracción de eyección del ventrículo izquierdo.
Los valores expresan n/N (%) o media±desviación estándar.
En la tabla 3 se resumen los principales eventos durante la intervención y la estancia hospitalaria después del TAVI. El acceso transfemoral fue la vía utilizada con más frecuencia para el implante (93%) en todos los grupos, seguida del transubclavio. Aunque no hubo diferencias en el gradiente aórtico medio invasivo previo al implante, el valor fue significativamente inferior con la válvula ALLEGRA que con los demás dispositivos (p=0,049). La tasa de predilatación mostró grandes diferencias entre los dispositivos, entre el 43% con la válvula Evolut R/POR y el 95,5% con la válvula Portico (p ≤0,001). Además, la posdilatación se utilizó con menos frecuencia tras el implante de la válvula Evolut R/PRO (24,9%) y la válvula ACURATE neo (24,3%) que después de implantar la válvula ALLEGRA (41,2%) o la Portico (42,4%) (p=0,001). En la población sin emparejar, no se observaron diferencias en el grado de IA tras el implante valvular. Las complicaciones de carácter mayor y menor fueron similares en todos los grupos, y no se observaron diferencias significativas.
Principales resultados de la intervención y hospitalarios de la población total del estudio y según el tipo de válvula
| Población totalN=514 | Evolut R/PROn=217 (42,2%) | ACURATE neon=107 (20,8%) | ALLEGRAn=102 (19,8%) | Porticon=88 (17,1%) | p | |
|---|---|---|---|---|---|---|
| Resultados de la intervención | ||||||
| Acceso transfemoral | 478/514 (93) | 195/217 (89,9) | 102/107 (95,3) | 93/102 (91,2) | (88/88) 100 | 0,01* |
| Requiere más de 1 prótesis | 12/481 (2,5) | 7/217 (3,3) | 0 | 4/102 (3,9) | 1/88 (1,1) | 0,273 |
| Valvuloplastia con balón | 318/481 (66,1) | 80/186 (43) | 92/105 (87,6) | 62/102 (60,8) | 84/88 (95,5) | ≤0,001* |
| Posdilatación | 157/507 (30,5) | 53/213 (24,9) | 26/107 (24,3) | 42/102 (41,2) | 36/85 (42,4) | 0,001* |
| Insuficiencia aórtica al alta (2-3-4) | 127/510 (24,9) | 57/215 (26,5) | 24/107 (22,4) | 27/100 (27) | 19/88 (21,6) | 0,706 |
| Insuficiencia aórtica al alta (3-4) | 14/510 (2,7) | 5/215 (2,3) | 2/107 (1,9) | 4/100 (4) | 3/88 (3,4) | 0,757 |
| Complicaciones de la intervención | ||||||
| Embolización de la válvula | 16/512 (3,1) | 9/215 (4,2) | 1/107 (0,9) | 5/102 (4,9) | 1/87 (1,1) | 0,194 |
| Rotura del anillo | 1/514 (0,2) | 1/217 (0,5) | 0 | 0 | 0 | 0,712 |
| Oclusión de arteria coronaria | 9/502 (1,8) | 7/209 (3,3) | 1/107 (0,9) | 0 | 1/88 (1,1) | 0,149 |
| Taponamiento | 4/512 (0,8) | 0 | 1/107 (0,9) | 1/101 (1) | 2/88 (2,3) | 0,229 |
| Muerte en la intervención | 4/512 (0,8) | 3/217 (1,4) | 0 | 1/101 (1) | 0 | 0,458 |
| Éxito de la intervención | 495/510 (97,1) | 210/217 (96,8) | 102/105 (97,1) | 97/100 (97) | 86/88 (97,7) | 0,977 |
| Resultados clínicos hospitalarios | ||||||
| Implante de marcapasos permanente | 84/499 (16,8) | 33/208 (15,9) | 10/105 (9,5) | 21/99 (21,2) | 20/87 (23) | 0,049* |
| Fibrilación auricular de nueva aparición | 34/506 (6,6) | 16/212 (7,5) | 6/105 (5,7) | 8/102 (7,8) | 4/87 (4,6) | 0,745 |
| Eventos cerebrovasculares | 13/506 (2,6) | 4/212 (1,9) | 3/105 (2,9) | 6/102 (5,9) | 0 | 0,066 |
| Insuficiencia renal aguda | 21/510 (4,1) | 8/216 (3,7) | 2/105 (1,9) | 8/102 (7,8) | 3/87 (3,4) | 0,166 |
| Complicación vascular menor | 56/508 (11) | 23/212 (10,8) | 12/107 (11,2) | 10/102 (9,8) | 11/87 (12,6) | 0,941 |
| Complicación vascular mayor | 37/508 (7,3) | 18/212 (8,5) | 5/107 (4,7) | 11/102 (10,8) | 3/87 (3,4) | 0,152 |
| Hemorragia menor | 42/507 (8,3) | 24/213 (11,3) | 5/107 (4,7) | 7/102 (6,9) | 6/85 (7,1) | 0,189 |
| Hemorragia mayor | 23/507 (4,5) | 12/213 (5,6) | 2/107 (1,9) | 7/102 (6,9) | 2/85 (2,4) | 0,207 |
| Hemorragia con peligro para la vida | 7/505 (1,4) | 3/213 (1,4) | 1/105 (1) | 2/102 (2) | 1/85 (1,2) | 0,936 |
| Días en la unidad de cuidados intensivos | 1,9±1,9 | 2,2±2 (199) | 1,3±0,8 (72) | 2,6±2,7 (46) | 1,4±1,2 (86) | ≤0,001* |
| Duración de la hospitalización (días) | 10±9,8 (512) | 10,8±9,4 (217) | 9,5±10,5 (106) | 12±12 (101) | 8±5,7 (88) | 0,028 |
| Muerte hospitalaria | 14/511 (2,7) | 7/217 (3,2) | 2/105 (1,9) | 3/101 (3,0) | 2/88 (2,3) | 0,096 |
| Resultados ecocardiográficos a los 30 días | ||||||
| FEVI (%) | 57,3±9,2 (471) | 56,7±10 (193) | 57±7,3 (98) | 55±7,3 (92) | 59±9,8 (88) | 0,077 |
| Área de válvula aórtica (cm2) | 1,9±0,57 (265) | 1,9±0,56 (85) | 1,8±0,54 (60) | 2,1±0,57 (63) | 1,9±0,57 (57) | 0,052 |
| Área valvular aórtica indexada (cm2) | 1,1±0,34 (264) | 1,1±0,3 (85) | 1±0,3 (60) | 1,2±0,36 (62) | 1,1±0,33 (57) | 0,070 |
| Gradiente aórtico máximo (mmHg) | 15±9,6 (455) | 15±8 (181) | 18±13 (97) | 14±6,5 (93) | 15±8,6 (84) | 0,009* |
| Gradiente aórtico medio (mmHg) | 8±6 (455) | 7,8±4,4 (182) | 9,9±9,6 (96) | 6,9±3 (94) | 7,9±5,5 (83) | 0,004* |
| Insuficiencia aórtica (periprotésica) | ||||||
| Ninguna/trazas (grado 0) | 132/496 (26,6) | 55/217 (25,3) | 27/106 (25,5) | 24/97 (24,7) | 26/76 (34,2) | |
| Leve (grado 1) | 236/496 (47,6) | 102/217 (47) | 57/106 (53,8) | 46/97 (47,4) | 31/76 (40,8) | |
| Moderada (grado 2) | 112/496 (22,6) | 50/217 (23) | 20/106 (18,9) | 25/97 (25,8) | 17/76 (22,4) | |
| Moderada a grave (grado 3) | 14/496 (2,8) | 10/217 (4,6) | 1/106 (0,9) | 2/97 (2,1) | 1/76 (1,3) | |
| Grave (grado 4) | 2/496 (0,4) | 0 | 1/106 (0,9) | 0 | 1/76 (1,3) | |
| Insuficiencia aórtica (intraprotésica) | ||||||
| Ninguna/trazas (grado 0) | 466/496 (94) | 209/217 (96,3) | 95/106 (89,6) | 90/97 (92,8) | 72/76 (94,7) | |
| Leve (grado 1) | 28/496 (5,6) | 8/217 (3,7) | 11/106 (10,4) | 5/97 (5,2) | 4/76 (5,3) | |
| Moderada (grado 2) | 1/496 (0,2) | 0 | 0 | 1/97 (1) | 0 | |
| Moderada a grave (grado 3) | 1/496 (0,2) | 0 | 0 | 1/97 (1) | 0 | |
| Grave (grado 4) | 0 | 0 | 0 | 0 | 0 | |
| Insuficiencia aórtica (en general) | ||||||
| Ninguna/trazas (grado 0) | 150/510 (29,4) | 63/215 (29,3) | 28/107 (26,2) | 27/100 (27) | 32/88 (36,4) | |
| Leve (grado 1) | 233/510 (45,7) | 95/215 (44,2) | 55/107 (51,4) | 46/100 (46) | 37/88 (42) | |
| Moderada (grado 2) | 113/510 (22,2) | 52/215 (24,2) | 22/107 (20,6) | 23/100 (23) | 16/88 (18,2) | |
| Moderada a grave (grado 3) | 12/510 (2,3) | 5/215 (2,3) | 1/107 (0,9) | 4/100 (4) | 2/88 (2,3) | |
| Grave (grado 4) | 2/510 (0,4) | 0 | 1/107 (0,9) | 0 | 1/88 (1,1) | |
| Insuficiencia aórtica (en general), grados 2-3-4 | 127/510 (24,9) | 57/215 (26,5) | 24/107 (22,4) | 27/100 (27) | 19/88 (21,6) | 0,706 |
| Insuficiencia aórtica (en general), grados 3-4 | 14/510 (2,7) | 5/215 (2,3) | 2/107 (1,9) | 4/100 (4) | 3/88 (3,4) | 0,757 |
FEVI: fracción de eyección del ventrículo izquierdo.
Los valores expresan n/N (%) o media±desviación estándar.
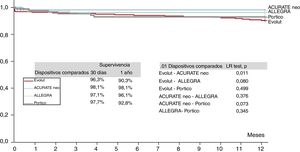
La tasa de implante de marcapasos al alta fue significativamente diferente entre los grupos de dispositivos (en general, p = 0,049), de tal manera que el porcentaje más alto fue el observado con la válvula Portico (23%) y el más bajo, con ACURATE neo (9,5%); los dispositivos Evolut R/PRO y ALLEGRA presentaron tasas del 15,9 y el 21,2%. La necesidad de implante de un marcapasos permanente no estuvo relacionada con el grado de calcificación de la válvula aórtica, ya que no hubo diferencias de calcificación entre los grupos de los distintos dispositivos, ni siquiera antes de realizar el emparejamiento. No se observaron diferencias en la mortalidad a 30 días entre los distintos grupos (p=0,096), y la tasa general fue del 2,7%, pero la mortalidad a 1 año sin ajustar (6,4%) fue significativamente diferente entre los pacientes tratados con los distintos dispositivos: el 9,7% con la válvula Evolut R/PRO, el 1,9% con la ACURATE neo, el 3,9% con la ALLEGRA y el 6,8% con la Portico (p=0,035), tal como se muestra en las curvas de supervivencia de la figura 1. Hubo una tendencia similar por lo que respecta a la mortalidad de causa cardiovascular a 1 año: el 4,7% con la válvula Evolut R/PRO, el 0,7% con la ACURATE neo, el 1,9% con la ALLEGRA y el 3,8% con la Portico (p=0,079). Los principales factores asociados con la mortalidad a 1 año se resumen en la tabla 1 del material adicional: hemodiálisis previa, fibrilación auricular previa, peor clase NYHA basal, embolización de la válvula, taponamiento cardiaco e IA residual moderada o grave. La necesidad de un marcapasos permanente no se asoció con mayor mortalidad.
Las tasas específicas de las principales complicaciones en los pacientes tratados con cada dispositivo se resumen en la tabla 4, y los resultados de la intervención y hospitalarios en la población con emparejamiento se presentan detalladamente en las tablas 2-7 del material adicional. En resumen, la válvula ALLEGRA tuvo un gradiente medio transvalvular mejor que el de las válvulas ACURATE neo, Evolut y Portico, pero la tasa absoluta de embolizaciones de la válvula fue superior con el dispositivo ALLEGRA que con las demás válvulas y este dispositivo se asoció con mayor frecuencia de eventos cerebrovasculares que con las válvulas Portico (p=0,032) y Evolut (p=0,083).
Principales resultados clínicos y hemodinámicos de diferentes dispositivos para TAVI autoexpandibles en la población sin emparejamiento
| Principales características | Evolut/ACURATEn=217/107 | Evolut/ALLEGRAn=217/102 | Evolut/Porticon=217/88 | ACURATE/ALLEGRAn=107/102 | ACURATE/Porticon=107/88 | ALLEGRA/Porticon=102/88 |
|---|---|---|---|---|---|---|
| IA ≥ 3 | 2,3%/1,9%p = 0,999 | 2,3%/4,0%p=0,472 | 2,3%/3,4%p=0,695 | 1,9%/4,0%p=0,432 | 1,9%/3,4%p=0,659 | 4,0%/3,4%p= 0,999 |
| IA ≥ 2 | 26,5%/22,4%p=0,427 | 26,5%/27,0%p=0,927 | 26,5%/21,6%p=0,370 | 22,4%/27,0%p=0,446 | 22,4%/21,6%p=0,888 | 27,0%/21,6%p=0,389 |
| Gradiente aórtico medio al alta | 7,8±4,4/9,9±9,7p=0,041* | 7,8±4,4/6,9±3,1p=0,083 | 7,8±4,4/7,9±5,5p=0,846 | 9,9±9,7/6,9±3,1p=0,004* | 9,9±9,7/7,9±5,5p=0,093 | 6,9±3,1/7,9±5,5p=0,142 |
| Implante de marcapasos permanente | 15,9%/9,5%p=0,124 | 15,9%/21,2%p=0,250 | 15,9%/23%p=0,146 | 9,5%/21,2%p=0,020* | 9,5%/23%p=0,011* | 21,2%/23%p=0,771 |
| Embolización de la válvula | 4,5%/0,9%p=0,113 | 4,5%/4,9%p=0,772 | 4,5%/1,1%p=0,182 | 0,9%/4,9%p=0,086 | 0,9%/1,1%p=0,883 | 4,9%/1,1%p=0,142 |
| Evento cerebrovascular | 1,9%/2,9%p=0,689 | 1,9%/5,9%p=0,083 | 1,9%/0%p=0,326 | 2,9%/5,9%p=0,253 | 2,9%/3,4%p= 0,999 | 5,9%/0%p=0,032* |
| Mortalidad hospitalaria | 3,2%/1,9%p=0,723 | 3,2%/3,0%p= 0,999 | 3,2%/2,3%p= 0,999 | 1,9%/3,0%p=0,678 | 1,9%/2,3%p= 0,999 | 3,0%/2,3%p= 0,999 |
IA: insuficiencia aórtica; TAVI: implante percutáneo de válvula aórtica.
En la tabla 3 se resume la evaluación ecocardiográfica de la población sin emparejamiento. Se observó una tendencia a mejores valores del área valvular y los gradientes transaórticos en el grupo del dispositivo ALLEGRA (figura 2), sin que hubiera diferencias significativas en la FEVI. Después del emparejamiento (tabla 5), no se observaron diferencias en la presencia o el grado de IA tras el implante de la válvula en ninguna de las comparaciones de pares de válvulas (figura 3). Sin embargo, los pacientes tratados con el dispositivo ACURATE neo presentaron un mayor gradiente aórtico medio (8,5±4mmHg) que el de los pacientes tratados con la válvula ALLEGRA (6,7±2,8; p=0,001). En las tablas 2-7 del material adicional se presentan los gradientes medios y los valores del área valvular aórtica. En el análisis con emparejamiento no se incluyó el centro donde se había tratado al paciente, pero un análisis univariante no mostró influencia alguna de esta variable en la mortalidad hospitalaria (p=0,37) o la tasa de IA de cualquier grado (p=0,54).
Resultados hemodinámicos y necesidad de implante de marcapasos permanente en diferentes pares de dispositivos para TAVI autoexpandibles después del emparejamientoa
| Evolut | Acurate neo | Portico | |
|---|---|---|---|
| ACURATE neo | 72 paresIA ≥ 3: el 1,4 frente al 1,4%; p= 0,999IA ≥ 2: el 22,5 frente al 23,9%; p= 0,999GrteMed: 8,4±5,5 frente a 8,3±4,3; p=0,926Tasa de marcapasos: el 13,2 frente al 5,9%; p=0,267 | ||
| Portico | 56 paresIA ≥ 3: el 1,8 frente al 1,8%; p= 0,999IA ≥ 2: el 23,6 frente al 23,6%; p= 0,999GrteMed: 8,2±6,1 frente a 7±3,8; p=0,299Tasa de marcapasos: el 11,5 frente al 26,9%; p=0,096 | 71 paresIA ≥ 3: el 1,4 frente al 2,8%; p= 0,999IA ≥ 2: el 19,7 frente al 21,1%; p= 0,999GrteMed: 8,8±5 frente a 7,5±5; p=0,151Tasa de marcapasos: el 7 frente al 25,4%; p=0,007b | |
| ALLEGRA | 65 paresIA ≥ 3: el 3,1 frente al 6,3%; p=0,687IA ≥ 2: el 20,3 frente al 23,4%; p=0,839GrteMed: 7,7±4,3 frente a 6,7±2,9; p=0,130Tasa de marcapasos: el 15,3 frente al 15,3%; p= 0,999 | 74 paresIA ≥ 3: el 1,4 frente al 5,4%; p=0,375IA ≥ 2: el 28,4 frente al 24,3%; p=0,690GrteMed: 8,5±4 frente a 6,7±2,8; p=0,001bTasa de marcapasos: el 9,9 frente al 16,9%; p=0,332 | 56 paresIA ≥ 3: el 5,4 frente al 3,6%; p= 0,999IA ≥ 2: el 32,1 frente al 26,6%; p=0,690GrteMed: 7,6±4 frente a 6,6±2,9; p=0,114Tasa de marcapasos: el 22,6 frente al 20,8%; p= 0,999 |
GrteMed: gradiente medio; IA: insuficiencia aórtica; TAVI: implante percutáneo de válvula aórtica.
Los resultados muestran en primer lugar los valores de los dispositivos en la primera línea y luego los valores de los dispositivos en la primera columna.
Las variables de emparejamiento fueron: fracción de eyección del ventrículo izquierdo (margen de un 10%, evaluada mediante ecocardiografía transtorácica), diámetro (margen de 0,5mm) y área del anillo aórtico (margen de 50mm2) (medidos en la tomografía computarizada), área de superficie corporal (margen de 0,4 m2), índice de masa corporal (margen de 5 puntos) y grado de calcificación (margen de 500 UA, medido en la tomografía computarizada).
Grado de insuficiencia aórtica tras el implante valvular en la población total del estudio y según el tipo de válvula en la población sin emparejamiento. Se presenta el porcentaje de insuficiencia aórtica moderada o grave tras la intervención de toda la población y de los pacientes tratados con cada dispositivo.
Aunque en algunas comparaciones recientes de dispositivos expandibles con balón y autoexpandibles se han descrito unos resultados generales mejores, como consecuencia principalmente de una menor tasa de FPV con los dispositivos expandibles con balón19-22, la práctica clínica actual no sigue este método de inclusión de todos los pacientes, sino una indicación personalizada del dispositivo que parece mejor para cada paciente. Los dispositivos de tipo TAVI-AE se suelen preferir para los pacientes con vasos más pequeños o más tortuosos y específicamente cuando estas características conllevan la necesidad de un acceso transubclavio, debido al mejor perfil de sus sistemas de aplicación. Además, se utilizan también con mayor frecuencia en los pacientes con anillos aórticos pequeños y cuando hay gran riesgo de oclusión coronaria, rotura del anillo aórtico o embolización de la válvula por cualquier motivo. El precio que hay que pagar parece ser un mayor riesgo de FPV y de necesidad de implantar un marcapasos23. Sin embargo, no todos los dispositivos de tipo TAVI-AE se comportan de manera similar con respecto a los trastornos de la conducción y, concretamente, no se ha realizado ninguna comparación sistemática para examinar su efecto crítico en la insuficiencia paravalvular y los gradientes residuales. Los dispositivos Evolut R/PRO y Portico permiten en parte una reintroducción de la vaina, a diferencia de los dispositivos ALLEGRA y ACURATE neo. La Portico es la única válvula intraanular, y la ACURATE neo es el único dispositivo que se libera de arriba abajo. Todas estas diferencias técnicas podrían tener repercusiones clínicas importantes en la evolución de los pacientes.
Los principales resultados de nuestra investigación son los siguientes: a) no hubo diferencias respecto a la IA residual en el seguimiento a los 30 días entre los 4 dispositivos de tipo TAVI-AE en un análisis ecocardiográfico centralizado cuidadoso y un proceso de emparejamiento que tuvo en cuenta las características anatómicas, con una tasa general baja (2,7%) de IA mayor que moderada; b) a pesar del similar grado de calcificación valvular y en un análisis por pares de válvulas con emparejamiento, el dispositivo ACURATE neo mostró un gradiente medio superior al de la válvula de TAVI ALLEGRA (no en comparación con los demás), pero mostró una tasa de marcapasos permanente que es la mitad que la de cualquier otro dispositivo, lo cual, pese a no estar relacionado con la tasa de mortalidad, tiene consecuencias importantes para los pacientes y la relación coste-efectividad de la intervención; c) la embolización de la válvula se produjo con más frecuencia con el dispositivo ALLEGRA, y ello podría explicar en parte la tendencia a una mayor tasa de eventos cerebrovasculares, y d) aunque no se ajustó por el riesgo basal, las tasas de mortalidad en la intervención y a los 30 días fueron comparables.
Comparaciones previas de dispositivos autoexpandiblesEn un metanálisis de Barbanti et al.24, en el que se compararon los dispositivos Sapien-3, Lotus, Portico, JenaValve, ACURATE neo y Evolut R, la mortalidad a 30 días (2,2%) y la IA residual mayor que leve (1,6%) fueron comparables a las descritas aquí. Sin embargo, los autores resaltaron también el problema no resuelto de la elevada necesidad de implante de marcapasos permanente (16,2%). Se han descrito resultados similares en el registro NEOPRO más reciente25 (Evolut PrO frente a ACURATE neo), excepto por una tasa muy inferior y comparable de implantes de marcapasos (el 12,8 frente al 11,0%; p=0,565) que no concuerda con lo indicado en estudios contemporáneos. Costa et al.26 identificaron unas tasas de marcapasos del 8,3% con la válvula SAPIEN 3, del 16,7% con la Evolut R y del 2,1% con la ACURATE neo (p < 0,05). El mismo registro indicó unos gradientes inferiores con la válvula Evolut R que con la ACURATE neo (6,1±2,4 frente a 8,4±3,5mmHg; p < 0,01) pero con una IA residual y una mortalidad comparables. Además, un registro italiano27 observó también una tasa de marcapasos inferior tras el empleo del dispositivo ACURATE neo en una comparación con emparejamiento de los dispositivos Evolut, Portico, Lotus y Sapien-3. Por lo que respecta a la válvula Portico, una comparación con emparejamiento con la válvula Sapien-328 indicó una mortalidad a 30 días comparable y unas tasas similares (> 20%) de implante de marcapasos permanente y de FPV, pero una comparación con el dispositivo Evolut-R29 reveló una tasa de FPV con la válvula Portico (0%) inferior que con la Evolut R (15,2%) en pacientes con un anillo elíptico (p=0,034).
A pesar de la variabilidad en estos importantes resultados, al menos se han realizado algunos estudios comparativos de los dispositivos Evolut, Portico y ACURATE neo. En cambio, solo existe una serie de casos de la válvula ALLEGRA30. Los resultados hemodinámicos con este dispositivo más reciente han mostrado un gradiente medio de 7,2±3,5mmHg con un área del orificio valvular efectiva de 2,06±0,3cm2. Se observaron FPV mayores que leves en un 5,1% de los pacientes antes del alta y la tasa de implante de marcapasos fue del 13,5% a los 30 días, lo cual concuerda con nuestras observaciones. Los gradientes positivos tras el TAVI descritos con la válvula ALLEGRA indican que la posición de la valva supraanular y la fuerza radial de este dispositivo podrían ser de especial utilidad en los casos de anillo aórtico calcificado pequeño. Sin embargo, el hecho de que este dispositivo no permita actualmente una reintroducción de la vaina aumenta el riesgo y podría contrarrestar sus beneficios, ya que fue el que mostró la mayor tasa de embolizaciones de la válvula en nuestro análisis, así como una elevada tasa de eventos cerebrovasculares. Será necesario obtener una mayor perspectiva sobre los mecanismos subyacentes en futuras investigaciones.
Consecuencias clínicas para la elección de dispositivos específica para cada pacienteCuando se elige un dispositivo de tipo TAVI-AE para tratar a un paciente con estenosis aórtica, no todas las opciones son óptimas, sino que dependen de las características del paciente. Los dispositivos que permiten en parte una reintroducción de la vaina (Evolut/Portico) probablemente deban elegirse para los pacientes con alto riesgo de obstrucción coronaria. En cambio, estos dispositivos deben evitarse en los pacientes con alto riesgo de trastornos de la conducción, en especial los que tienen una larga esperanza de vida, con objeto de reducir la necesidad de marcapasos permanentes, y en estos casos es probable que el dispositivo ACURATE neo sea una alternativa mejor. Por otra parte, la generación actual de la válvula Portico es el dispositivo que muestra la mayor tasa de trastornos de la conducción, a pesar de su comportamiento hemodinámico apropiado. El nuevo sistema de aplicación FlexNav que se ha introducido en la iteración más reciente de la válvula Portico probablemente aumente la estabilidad del dispositivo y es probable que reduzca la tasa de implantes de marcapasos permanentes. Además, el desarrollo de nuevas técnicas de implante, como la «cusp overlap view» (imagen de solapamiento de cúspides), podría modificar la situación actual por lo que respecta a los trastornos de la conducción tras el TAVI31. Por último, el dispositivo ALLEGRA podría ser útil para los pacientes sometidos a implante de válvula intravalvular (valve-in-valve) con una bioprótesis pequeña, ya que el despliegue de la válvula suele ser muy estable y podría aportar unos gradientes residuales mejores que los obtenidos con otros dispositivos, como la válvula ACURATE neo32, con un riesgo bajo de embolización de la válvula.
LimitacionesEste es un estudio retrospectivo; esta limitación se abordó mediante la obtención prospectiva de los datos basales de una base de datos similar en todos los centros participantes y a través de un análisis ecocardiográfico anonimizado y realizado en un laboratorio central. El menor número de pacientes en los que se utilizaron ciertos dispositivos puede reflejar una fase más inicial de la curva de aprendizaje y podría haber afectado a los resultados. Sin embargo, la ausencia de diferencias por lo que respecta a los principales resultados clínicos o el grado de IA indica un posible «efecto de clase» con todos los dispositivos de tipo TAVI-AE, con una influencia favorable en la curva de aprendizaje de los dispositivos TAVI-AE más recientes en los centros que disponen ya de experiencia con otros dispositivos AE. Por otro lado, la mayor tasa de mortalidad a 1 año observada en los pacientes tratados con el dispositivo Evolut R/PRO indicaría que estos pacientes tienen unas características anatómicas o clínicas (que no se reflejan en las puntuaciones de riesgo quirúrgico) que afectan a su pronóstico a medio plazo y que esta válvula puede ser el dispositivo para TAVI preferido en situaciones que plantean más dificultades, dada la mayor experiencia de los centros participantes con dicho sistema. Las 2 iteraciones de la válvula Evolut se analizaron conjuntamente y no mostraron diferencias por lo que respecta a sus resultados. Por último, el número ligeramente inferior de pares en la comparación emparejada limita la potencia estadística del análisis pero, dados los resultados concordantes en la muestra sin emparejar, confirma de todos modos el reducido riesgo de sesgo en la población total del estudio.
CONCLUSIONESUna comparación con emparejamiento de 4 dispositivos de tipo TAVI-AE no mostró diferencias en la IA residual ni en la mortalidad a los 30 días, y la tasa de IA residual significativa fue baja (2,7%). La válvula ACURATE neo se asoció con unos gradientes transvalvulares residuales peores que los de la válvula ALLEGRA, pero fue la que proporcionó la menor tasa de necesidad de marcapasos permanente.
FINANCIACIÓNNinguna que declarar.
CONFLICTO DE INTERESESL. Nombela-Franco es mentor de Abbott; R. Moreno es mentor de Boston y NVT; J.A. Baz es mentor de NVT, y I.J. Amat-Santos es mentor de Boston. No hay conflictos de intereses en relación con este manuscrito.
- –
Los dispositivos de implante percutáneo de válvula aórtica (TAVI) autoexpandibles (TAVI-AE) son de especial utilidad en los pacientes con estenosis aórtica que tienen vasos pequeños o tortuosos, anillos aórticos pequeños o un ostium coronario bajo.
- –
Sin embargo, la gama cada vez más amplia de dispositivos de tipo TAVI-AE existentes plantea dudas acerca de la comparabilidad de sus resultados hemodinámicos y clínicos.
- –
Una comparación con emparejamiento de 4 dispositivos de tipo TAVI-AE no mostró diferencias respecto a la IA residual ni respecto a la mortalidad a los 30 días.
- –
El dispositivo ACURATE neo fue superior por lo que respecta a la necesidad absoluta de implante de marcapasos permanente.
- –
En las nuevas iteraciones de dispositivos de TAVI-AE deberá abordarse la excesiva tasa de marcapasos que actualmente tienen la mayoría de los dispositivos de tipo TAVI-AE mediante una colocación más exacta, y sin aumentar el riesgo de fuga paravalvular.