Inevitablemente cada vez es mayor el número de personas en riesgo de sufrir una infección relacionada con dispositivos intracardiacos. Según el registro de la Sociedad Española de Cardiología, el número de primoimplantes no ha dejado de aumentar en los últimos 10 años1. Al riesgo acumulado de los pacientes portadores de dispositivos, se debe sumar el riesgo de infección asociado con nuevos procedimientos como, por ejemplo, el recambio de generador o electrodos o la actualización de marcapasos o desfibriladores a terapia de resincronización. Mientras tanto, los pacientes no dejan de cumplir años y sumar comorbilidades.
La infección de los dispositivos intracardiacos se puede producir por diversos mecanismos: el más frecuente es la colonización del material protésico por inoculación directa en el momento de su inserción o en manipulaciones sucesivas; el segundo es la implantación de microorganismos en el sistema por vía bacteriémica a partir de un foco distante, por ejemplo, una infección de un catéter vascular; otros mecanismos, como la infección por contigüidad, son anecdóticos.
Los factores de riesgo de la infección en dispositivos intracardiacos son conocidos: unos se relacionan con las características basales del sujeto, como la obesidad, la diabetes mellitus o la insuficiencia renal; otros, con el tipo de dispositivo, como el tamaño del generador y el número de electrodos, y finalmente otros, con la técnica quirúrgica, como el control de la hemostasia, el número de procedimientos previos y el abandono de electrodos sin uso. Algunos de estos factores son modificables y otros, desgraciadamente la mayoría, no lo son. En este contexto, una evaluación rigurosa de los riesgos de cada paciente puede ser útil a la hora de tomar decisiones previas al procedimiento (por ejemplo, administrar una pauta antibiótica y antiséptica para disminuir el riesgo de infección de la herida en pacientes colonizados por Staphylococcus aureus resistente a la meticilina) o decidir un control clínico más estrecho posteriormente (piénsese en un paciente que presenta un hematoma importante tras el implante).
En un artículo recientemente publicado en Revista Española de Cardiología, Calderón-Parra et al. proponen una puntuación con el objetivo de identificar a los pacientes con alto riesgo de infección del dispositivo que serían potenciales candidatos a medidas de prevención especiales2. Si bien el objeto de estudio está plenamente justificado, en mi opinión este trabajo tiene 2 características importantes que hay que tener en cuenta a la hora de interpretar los resultados.
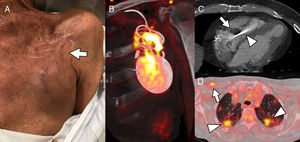
La primera es la definición de infección. Debido a la diversidad en los mecanismos de infección descritos previamente y a los microorganismos frecuentemente implicados (generalmente, cocos Gram positivos), el espectro clínico de la infección de dispositivos intracardiacos es muy amplio (figura 1)3. La retracción de la piel alrededor del generador puede ser la única manifestación de una infección de bajo grado causada por estafilococos coagulasa negativos o Propionibacterium acnes. En el otro extremo se halla una endocarditis sobre electrodos y válvulas cardiacas causada por S. aureus, con embolias pulmonares e insuficiencia respiratoria secundarias. A diferencia de lo afirmado por los autores, no existen unos criterios modificados de Duke específicos para el diagnóstico de la infección relacionada con dispositivos intracardiacos4. La falta de estandarización de la definición de infección local (de la porción extravascular del sistema), el diseño retrospectivo del estudio y las características del centro en el que se ha realizado, con amplia experiencia en el tratamiento de la endocarditis infecciosa, hacen que muy probablemente estén sobrerrepresentadas las infecciones intravasculares5. Este hecho justificaría la mortalidad relativamente alta de la serie, comparable con las de estudios previos sobre endocarditis relacionadas con dispositivos6.
A: caso 1; paciente con desfibrilador automático implantable (DAI) implantado 7 meses antes que indicaba dolor en la bolsa del generador, sin fiebre ni otros síntomas; los hemocultivos fueron negativos; la imagen muestra ligera retracción cutánea en la región superior de bolsillo del generador (flecha), sin claros signos flogóticos. B: reconstrucción en el plano coronal oblicuo de tomografía por emisión de positrones/tomografía computarizada (PET/TC) cardiaca con 18-fluorodesoxiglucosa (18F-FDG) que muestra captación heterogénea del trazador alrededor del generador y el segmento proximal de los electrodos a nivel del bolsillo, compatible con infección del DAI; los cultivos del dispositivo fueron positivos para Staphylococcus caprae. C: caso 2; TC cardiaca que muestra voluminosa vegetación (flecha) en el segmento intraventricular de un electrodo de marcapasos abandonado (cabeza de flecha). D: caso 3; infección de marcapasos visualizada por PET/TC que muestra captación de 18F-FDG en los electrodos del dispositivo (flecha), junto con presencia de émbolos sépticos pulmonares bilaterales (cabezas de flecha).
En el estudio de Calderón-Parra et al.2, el objetivo de crear la puntuación de riesgo fue identificar a los pacientes que pueden beneficiarse de medidas preventivas extraordinarias, como el uso de mallas impregnadas de antibióticos en el momento de implantarse el sistema. Siendo así, el riesgo de infección que se pretende evaluar debería ser únicamente el asociado con el procedimiento, es decir, no se debería incluir a pacientes con infecciones intravasculares originadas primariamente en otro foco. Sin embargo, este aspecto no se ha tenido en cuenta al diseñar el estudio. Dado el alto porcentaje de endocarditis, surgen dudas razonables sobre la idoneidad del objetivo escogido.
La segunda característica del estudio es la presunción de que implantar el dispositivo envuelto en una malla impregnada de antibióticos es una medida coste-efectiva en pacientes con alto riesgo de infección. Si bien la administración de antibióticos locales con fines profilácticos es una estrategia atractiva y utilizada en otros contextos, no se dispone de evidencia sólida que avale su uso en este. En el momento en que Revista Española de Cardiología evaluó el artículo de Calderón-Parra et al.2, todavía no se habían publicado los resultados del estudio WRAP-IT7. Este estudio multicéntrico, aleatorizado y controlado ha demostrado una reducción estadísticamente significativa del número de infecciones del dispositivo durante el primer año (25/3.495 en el grupo que recibió la malla antibiótica frente a 42/3.488 en el grupo de control; hazard ratio [HR]=0,60; intervalo de confianza del 95% [IC95%], 0,36-0,98; p=0,04). Sin embargo, hay que tomar estos datos con cautela. En primer lugar, la inclusión de pacientes se realizó en función del tipo de procedimiento sin considerar sus características basales, por lo que esta estrategia no representa las inquietudes reflejadas en el artículo de Calderón-Parra et al.2, más acordes con la práctica clínica diaria. Aun así, si se aplicaran los supuestos del ensayo clínico, se necesitaría insertar 205 mallas para evitar 1 único episodio de infección y, si se tiene en cuenta el coste de cada unidad (1.150 €), esta estrategia no debería implementarse sistemáticamente. En segundo lugar, los 2 grupos estuvieron bien balanceados en cuanto a las comorbilidades, exceptuando la inmunosupresión, que fue más frecuente en los controles (el 2,4 frente al 1,4%; p<0,05). La inmunosupresión es un conocido factor de riesgo de infección, por lo que esta diferencia entre los grupos podría favorecer a los pacientes a los que se implantó la malla. Finalmente, si bien el número de infecciones fue inferior en el grupo de intervención, esto fue a expensas de infecciones de la bolsa del generador, ya que el número de infecciones bacteriémicas y endocarditis fue superior que en el grupo de control, dato especialmente preocupante y sin una explicación aparente. Es decir, es necesario un análisis más detallado antes de esclarecer qué pacientes pueden beneficiarse de esta medida, si es el caso. Sea como fuere, es importante resaltar que la implementación de una nueva estrategia preventiva nunca debe sustituir ni relajar las demás medidas estándar.
La profilaxis utilizada en el centro de estudio fue teicoplanina 400mg más gentamicina 80mg administradas por vía intravenosa en dosis única durante la hora previa a la incisión quirúrgica. A ello se añadió 2g de cefazolina irrigada localmente en la herida. En general, más del 75% de las infecciones en dispositivos intracardiacos son monomicrobianas y están causadas por cocos Gram positivos y menos del 10% están causadas por bacilos Gram negativos7. En consecuencia, aunque teicoplanina más gentamicina es una pauta recomendada en las guías de práctica clínica3, a no ser que el contexto sea de multirresistencia o de altas tasas de infecciones por bacilos Gram negativos, una dosis única de una cefalosporina (usualmente cefazolina 2 g) sería suficiente. En caso de procedimientos prolongados o pérdida importante de volumen de sangre, estaría justificado administrar una segunda dosis de antibiótico, no así alargar la profilaxis más allá de 24 h. La falta de evidencia científica desaconsejaría la irrigación local de antibióticos.
El tratamiento de los pacientes portadores de dispositivos intracardiacos es complejo y requiere de personal altamente especializado. Si nos centramos únicamente en el aspecto técnico, el dominio de la asepsia y el control de la hemostasia solo se consigue con mucha experiencia, y la extracción de los dispositivos infectados requiere el uso de vainas y estiletes que no están al alcance de todos los profesionales. Desde el punto de vista del tratamiento, los escenarios pueden ser muy diversos, en función de la localización de la infección (intravascular o extravascular, con o sin endocarditis asociada), el grado de dependencia del dispositivo y su indicación, así como el microorganismo causante de la infección. Por todo ello, convendría centralizar todas las actuaciones en hospitales de referencia, que dispongan de equipos multidisciplinarios con experiencia en el tratamiento de infecciones intravasculares.
Las condiciones basales de nuestros pacientes difícilmente mejorarán en los próximos años y los recursos del sistema sanitario son limitados. Si al coste de implantar un dispositivo se suma el de una eventual infección, se impone una reflexión sobre qué pacientes se benefician realmente de estas terapias. En este sentido, los modelos de evaluación económica pueden proporcionar elementos para esta reflexión si se utilizan no solamente con fines de regulación, sino también como un instrumento para la investigación traslacional, entendiendo esta como la aplicación del conocimiento generado en ensayos clínicos o estudios epidemiológicos a la práctica clínica diaria y la toma de decisiones. Por ejemplo, la actualización del análisis realizado en 2011 por el Servicio de Evaluación y Planificación del Servicio Canario de la Salud (actualmente en curso) permitirá evaluar mediante análisis de sensibilidad el valor potencial de la incorporación de nuevas estrategias preventivas como la que plantea el estudio WRAP-IT7 y el volumen y el riesgo de los pacientes que se debe tratar para que el beneficio potencial y el coste de la estrategia preventiva compensen el daño y el coste asociados con las infecciones producidas por dispositivos8.
CONFLICTO DE INTERESESNo se declara ninguno.
La figura 1 ha sido realizada por el Dr. Albert Roque, miembro de la Unidad de Imagen Cardiovascular del Departamento de Radiodiagnóstico del Hospital Universitari Vall d’Hebron.