Los nuevos métodos de tratamiento percutáneo de las cardiopatías congénitas y valvulares han aumentado de forma exponencial en los últimos años. Paralelamente a esta tendencia, ha surgido la necesidad de técnicas de imagen multimodales en la planificación, la guía y la evaluación de los resultados y las complicaciones que se producen con estas intervenciones. La ecocardiografía desempeña un papel clave en el laboratorio de hemodinámica. Las técnicas de imagen invasivas periintervención, como la ecocardiografía transesofágica (ETE) y en particular la ETE tridimensional (3D), y más recientemente la ecocardiografía intracardiaca (EIC), proporcionan imágenes de alta resolución en tiempo real de la anatomía y la fisiología cardiacas que son necesarias para guiar las intervenciones en multitud de cardiopatías estructurales (CPE). Con los nuevos avances en la EIC, esta técnica de imagen es una alternativa atractiva a la ETE, con un mayor potencial de crecimiento.
Durante la última década, la ecocardiografía ha servido de guía para un número cada vez mayor de intervenciones en pacientes con CPE y ha aumentado sus tasas de éxito. La evaluación ecocardiográfica de los pacientes a los que se realizan tratamientos percutáneos difiere de la que se realiza en los pacientes con una valvulopatía sobre válvulas nativas o protésicas. La European Association of Echocardiography y la American Society of Echocardiography han reconocido la necesidad de una evaluación detallada y han establecido una guía de recomendaciones que incluye las intervenciones en CPE como el implante percutáneo de válvula aórtica, la reparación de la regurgitación paravalvular y las intervenciones sobre la válvula mitral1.
Dado que la actividad en este campo aumenta rápidamente con la incorporación de otros tratamientos para las CPE, hay una demanda creciente de técnicas de imagen ecográficas realizadas por el propio cardiólogo intervencionista y de una reducción de la necesidad de usar anestesia general. Además, la ETE tiene otras limitaciones que se han puesto de manifiesto. La visualización de las estructuras de localización más anterior puede verse limitada como consecuencia de la distancia, y las sombras producidas por estructuras circundantes pueden ocultar el campo de visión. A veces, la sonda de ETE puede dificultar parcialmente la visión fluoroscópica óptima al cardiólogo intervencionista. Además, a veces se necesitan alternativas a la ETE, sobre todo para pacientes con contraindicación absoluta para el sondaje transesofágico.
La ventaja de la EIC es que permite obtener imágenes de las estructuras cardiacas próximas a la sonda con una calidad igual o superior a la de las obtenidas mediante ETE, al tiempo que se evitan muchas de sus limitaciones. La EIC puede realizarse con sedación consciente, y el catéter se puede manipular con facilidad y sin interferir con otros dispositivos usados durante la intervención. Proporciona la posibilidad de obtener imágenes adicionales que no se obtienen con ETE, con lo que incrementa la información de la que dispone el cardiólogo intervencionista. Se ha demostrado también que la EIC reduce los tiempos de intervención y de fluoroscopia, así como la exposición total a la radiación tanto del paciente como del médico2.
Los primeros transductores de EIC se describieron en los años sesenta del pasado siglo, y en 1981 apareció una de las primeras descripciones de su uso en el laboratorio de cateterismo cardiaco. Glassman y Kronzon presentaron el uso con éxito de la EIC para facilitar la realización de una punción transeptal, que es una técnica fundamental para el intervencionismo en CPE3. En este estudio, se colocó un transductor en la punta de una aguja transeptal, lo que permitió identificar el momento en que la aguja contactaba con el tabique interauricular e indica que la EIC proporciona una ayuda útil y valiosa en esta técnica. Los catéteres iniciales de EIC proporcionaban imágenes en eje transversal usando un transductor rotatorio mecánico, con frecuencias operativas de entre 2 y 12,5MHz. Se obtenían imágenes bidimensionales que permitían realizar mediciones cardiacas básicas, visualizar estructuras valvulares y determinar las dimensiones de defectos septales. Las imágenes radiales de 360° que se obtenían permitían un campo de visión amplio que facilitaba visualizar muchos defectos cardiacos y su relación con otras estructuras del corazón. Sin embargo, esos catéteres carecían de la capacidad de realizar exploraciones con modo Doppler, que a menudo son necesarias para evaluar los cortocircuitos y las insuficiencias.
La EIC es una técnica de imagen en evolución. Tras los primeros dispositivos, se han introducido transductores rotatorios automáticos que proporcionan imágenes sectoriales mediante 64 cristales piezoeléctricos en disposición longitudinal que generan un haz de ultrasonidos de 4,5 a 12,5MHz. Estos transductores proporcionan imágenes sectoriales de 90° y tienen capacidad Doppler, incluidos el Doppler pulsado, continuo, color, tisular y espectral. La calidad de las imágenes ha mejorado y la profundidad de penetración ha aumentado hasta alcanzar profundidades de 21 cm. Además, estos nuevos sistemas aportan también una mejor maniobrabilidad.
Actualmente se comercializan tres catéteres de EIC. El Ultra ICE (Boston Scientific; Natick, Massachusetts, Estados Unidos) es un transductor rotatorio con un único elemento, tiene un calibre de 9 Fr y rota a 1.800rpm con una frecuencia fija de 9 MHz. Proporciona un campo de visión de 360°, pero con una profundidad radial limitada a 5 cm, lo cual limita la utilidad de este dispositivo para la visualización de las estructuras del corazón izquierdo y para la punción transeptal. Las aplicaciones emergentes de este dispositivo incluirían atravesar el tabique para facilitar la evaluación del corazón izquierdo, pero dado que no dispone de capacidades de exploración Doppler y tiene una manejabilidad reducida, se emplea principalmente en intervenciones de electrofisiología. El AcuNav (Biosense Webster; Diamond Bar, California, Estados Unidos) es un catéter con haz de fase, o phased array, con calibre de 8 o 10 Fr, con 64 elementos piezoeléctricos, que se emplea para el examen en un monoplano longitudinal y utiliza frecuencias de entre 5 y 10MHz. Proporciona un campo de visión de 90°, con una penetración en los tejidos de hasta 16 cm. El catéter permite realizar una deflexión en cuatro planos, cada uno de ellos en un ángulo de 160°, lo cual permite obtener múltiples planos de exploración. Por último, el ViewFlex PLUS (St. Jude Medical; St. Paul, Minnesota, Estados Unidos) es un catéter phased array, de 64 elementos y de calibre 9 Fr que utiliza frecuencias de entre 4,5 y 8,5 MHz y alcanza una profundidad de hasta 21 cm. Tiene un gran radio de curvatura y un asa tipo Agilis (St. Jude Medical; St. Paul, Minnesota, Estados Unidos) que proporciona maniobrabilidad completa, con posibilidad de angulación en dos planos de hasta 120°. Los dos catéteres phased array proporcionan mayores amplitud de frecuencias, profundidad de campo y maniobrabilidad y son los que se emplean predominantemente en las intervenciones de CPE.
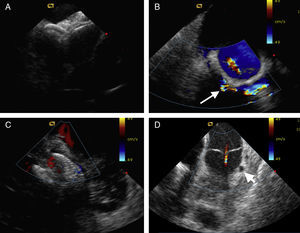
La utilidad de la EIC se ha demostrado en multitud de intervenciones realizadas en CPE, como la punción transeptal, el cierre de comunicaciones tanto interauriculares como interventriculares, la valvuloplastia con balón mitral, pulmonar y aórtica, la biopsia cardiaca para trasplante o de masas cardiacas, la ablación septal en miocardiopatía obstructiva hipertrófica y el cierre de los seudoaneurismas ventriculares izquierdos3, 4, 5, 6, 7, 8, 9 (Figura). Para el acceso transeptal, la EIC proporciona una visualización de las estructuras intracardiacas como la fosa oval, la pared auricular izquierda posterior y la aorta, lo que permite confirmar el lugar de punción óptimo. Cuando hay una anatomía distorsionada o difícil, la guía de la EIC adquiere una importancia relevante. Además, muchas intervenciones para las CPE requieren una localización precisa del lugar de punción transeptal para que la intervención tenga éxito; por ejemplo, se ha propuesto un acceso transeptal a una altura de 3-4 cm por encima de la válvula mitral para el sistema de aplicación MitraClip (Abbott Vascular; Abbott Park, Illinois, Estados Unidos), un lugar de acceso posterior/superior para las fugas paravalvulares mitrales localizadas en el tabique para un cierre anterógrado y un acceso alrededor del dispositivo de cierre previo de una comunicación interauricular. Resulta igualmente esencial la navegación segura a través de otras anomalías anatómicas, como un tabique lipomatoso, un aneurisma del tabique auricular o un tabique convexo o de doble capa.
Figura. Ejemplos de ecocardiografía intracardiaca para intervenciones en cardiopatías estructurales. A: dispositivos de oclusión septal para tratar una comunicación residual a través de un defecto del tabique auricular. B: regurgitación paravalvular mitral (flecha) visible alrededor del anillo protésico. C: cierre con dispositivo percutáneo de una comunicación interventricular muscular. D: fístula de la arteria descendente anterior izquierda a la arteria pulmonar que drena en la parte proximal del tronco principal de la arteria pulmonar, por encima de la válvula pulmonar (punta de flecha).
La EIC se utiliza también para visualizar el seno coronario para la implantación de dispositivos de anuloplastia indirecta y para delimitar el tamaño de la orejuela izquierda y descartar la posible presencia de un trombo en la misma antes de la colocación de un dispositivo oclusor de dicha orejuela izquierda10. La capacidad de la EIC de descartar con exactitud la presencia de un trombo en la orejuela izquierda es cuestionable, puesto que la visualización de las estructuras del corazón izquierdo puede tener una calidad diferente en función de la localización del catéter11. Desde la aurícula derecha, la orejuela izquierda puede no visualizarse bien debido al grosor variable y la orientación del tabique interauricular. Con las mayores versatilidad y maniobrabilidad de los nuevos catéteres de EIC, es posible introducir el catéter en el seno coronario, en el tracto de salida del ventrículo derecho o en la arteria pulmonar, lo que permite superar las limitaciones de la EIC gracias a una navegación más próxima a las estructuras del corazón izquierdo. Además, el buen resultado de la introducción de la EIC intrapericárdica en pacientes a los que se practica una ablación epicárdica ha aportado una nueva vía para mejorar la calidad de la imagen y guiar estos tratamientos12.
Para realizar intervenciones en las CPE de manera eficaz y segura, es fundamental la capacidad de la EIC para identificar las estructuras cardiacas importantes, evaluar la colocación de los dispositivos implantados, determinar la presencia de comunicaciones residuales, valorar la hemodinámica valvular y prevenir o identificar precozmente las complicaciones. Con la EIC, se puede identificar y abordar inmediatamente las posibles complicaciones. Entre ellas se encuentran la perforación cardiaca con taponamiento pericárdico, la formación de trombos, la disfunción de válvulas tanto nativas como protésicas y el hemotórax, sobre todo en casos en los que se utiliza un acceso transapical.
No obstante, esta tecnología tiene ciertas limitaciones. Lo más significativo es el coste de un catéter de un solo uso y la curva de aprendizaje para el manejo del dispositivo. El coste de los catéteres de EIC es elevado, puesto que estos dispositivos no se pueden reesterilizar. Sin embargo, los costes totales pueden ser favorables al uso de EIC, debido a que no son necesarios anestesia general ni anestesista, los tiempos de intervención se reducen, con hospitalizaciones más cortas y con la posibilidad de una reducción de las tasas de complicaciones13. Que no sea necesario un ecocardiografista también puede reducir los costes. Sin embargo, la participación de un ecocardiografista no debe ser un factor determinante en el uso de la EIC. Los autores creen firmemente que la mejora de la calidad y la interpretación de las imágenes se consigue mejor con la presencia de un ecocardiografista. La integración en un equipo multidisciplinario mejora el conocimiento y la asistencia del paciente en el laboratorio de hemodinámica, sobre todo en los casos de CPE complejas.
Además, la curva de aprendizaje de la EIC exige comprender las diferencias de orientación peculiares de esta técnica en comparación con la ecocardiografía estándar, así como la capacidad de manipular el catéter en el interior del corazón para obtener las proyecciones operativas necesarias. Se han propuesto varios protocolos para la obtención de las imágenes con la EIC; sin embargo, la visualización de las estructuras no está tan estandarizada como en la ecocardiografía transtorácica o la ETE. La curva de aprendizaje exige que el operador esté familiarizado con su uso para obtener unas exploraciones de imagen adecuadas, y se construye de forma natural sobre la base de una formación previa en ecocardiografía, para lo que es necesaria la manipulación práctica del dispositivo. En los casos de enfermedad estructural, la visualización completa del dispositivo puede ser de capital importancia para guiar la intervención. Dado que las imágenes obtenidas actualmente con la EIC son bidimensionales, puede requerirse la manipulación cuidadosa y el ajuste de la posición del transductor. En estos casos puede ser necesaria una ETE 3D.
El gran tamaño del eje del catéter de EIC, de un calibre 8-10 Fr, exige el uso de vainas de calibre de 8-11 Fr. Es necesaria una anticoagulación adecuada durante la intervención para reducir la formación de trombos alrededor del catéter, y se debe mantener un tiempo de coagulación activado superior a 250. Además, pueden producirse arritmias transitorias como resultado del contacto directo de la sonda con las paredes del corazón. La colocación de la sonda, aunque sea muy poco común, puede dificultar la colocación simultánea de otros catéteres. Puede ser necesaria una recolocación, aunque generalmente no limita el campo de visión necesario para el tratamiento.
Los futuros avances de la EIC estarán en alcanzar una mayor resolución y diferentes frecuencias, obtener imágenes 3D e imágenes en tiempo real 3D (4D) y la integración con dispositivos de intervención, al tiempo que reduce el tamaño del catéter. Sería ideal disponer de imágenes 3D de alta resolución que permitieran valorar el movimiento cardiaco con imágenes de campo cercano para los detalles y de campo lejano para la perspectiva y la orientación. Se están desarrollando catéteres multiplanares de menor perfil, que integran microtransductores de ultrasonidos (micromachined ultrasound transducers), que constituirán la nueva generación de tecnología ecográfica14. Se espera que los transductores con microtransductores integrados sustituyan a los elementos de cerámica piezoeléctricos utilizados en la tecnología ecográfica actual y que sus propiedades físicas inherentes aumenten la resolución de las imágenes sin aumentar el tamaño del catéter.
Los sistemas de cartografía electroanatómica, como el CARTO (Biosense Webster), permiten actualmente generar imágenes 3D mediante la localización especial con su sonda SoundStar ICE (Biosense Webster)15. Esta sonda es de calibre 10 Fr, con un haz de ultrasonidos similar al del sistema AcuNav y unas frecuencias que van de 5,5 a 10 MHz. En la punta del catéter hay un sensor magnético, reconocido por el CARTO para realizar una triangulación de la punta del catéter cuando se coloca en el interior del corazón mediante un campo magnético. Se puede generar reconstrucciones anatómicas 3D de la estructura cardiaca de interés y fusionarlas con la angiotomografía computarizada 3D o con las imágenes de resonancia magnética. Los sistemas más recientes permiten una reconstrucción manual de una imagen de EIC 3D usando múltiples cortes de imagen bidimensionales16. Estas imágenes se fusionan con una angiotomografía computarizada 3D o de resonancia magnética, lo que proporciona un aumento del detalle intracardiaco y una información anatómica más exacta en tiempo real. Finalmente, el desarrollo de una EIC 4D podría proporcionar también imágenes ecográficas en tiempo real, en vez de una reconstrucción. Se ha presentado el AcuNav V (Siemens; Múnich, Alemania) que permite obtener imágenes volumétricas de alta resolución en tiempo real. En la actualidad está pendiente de aprobación de marca de CE para su uso en Europa.
Las técnicas de imagen para las CPE evolucionan rápidamente. La guía en tiempo real mediante ecocardiografía ha revolucionado las terapias percutáneas al aportar una visualización en alta resolución de las estructuras cardiacas y permitir la realización de intervenciones de forma más segura y eficaz. En este momento no hay ninguna modalidad de imagen de elección, pero con los notables avances tecnológicos y el aumento de su uso, es indudable que la EIC pasará a ser una modalidad útil para guiar los tratamientos de las CPE. Ahora más que nunca, es de suma importancia que el cardiólogo intervencionista se forme en técnicas de imagen cardiaca y actúe en el contexto de un equipo multidisciplinario en el que haya especialistas en técnicas de imagen, para prestar la mejor asistencia posible al paciente con una cardiopatía valvular o congénita.
Conflicto de InteresesNinguno.
Autor para correspondencia: Lenox Hill Heart and Vascular Institute of New York, North Shore Long Island Jewish Health System, 130 East 77th Street, 9th Floor Black Hall Building, Nueva York, NY 10075, Estados Unidos. CRuiz@NSHS.edu