Presentamos el caso de una paciente de 15 años sin antecedentes patológicos previos que presentó como manifestación inicial de su enfermedad un taponamiento cardíaco secundario a una pericarditis purulenta causada por Neisseria meningitidis serogrupo C. Esta bacteria es responsable del 6-16% de las pericarditis purulentas, la inmensa mayoría asociadas a una afectación del sistema nervioso central previa o concomitante (meningitis). Muy excepcionalmente, y así ocurre en nuestro caso, la pericarditis no se acompaña de meningitis (pericarditis meningocócica primaria). Tras el tratamiento con pericardiocentesis, antibioterapia específica y corticoterapia conseguimos controlar el cuadro cardiológico y séptico general. Resaltamos el hecho de que la infección meningocócica puede manifestarse clínicamente de forma distinta de la habitual, lo que puede llevar a dificultades diagnósticas y terapéuticas.
Palabras clave
Pericarditis
Neisseria meningitidis
Taponamiento cardíaco
INTRODUCCIÓN
El meningococo es una bacteria gramnegativa que suele causar cuadros sépticos generales o que afectan al sistema nervioso central (meningitis). Cuando la infección compromete otros órganos, entre ellos al pericardio, generalmente es de forma secundaria. Muy excepcionalmente una bacteriemia transitoria da lugar a patología exclusivamente localizada en otro órgano, sin participación meníngea.
CASO CLÍNICO
Mujer de 15 años, sin antecedentes patológicos de interés, que ingresó con la sospecha de shock séptico.
Presentó, 48 h antes, artromialgias generalizadas, diarrea y astenia, siendo etiquetada de gastroenteritis aguda y dada de alta de otro centro. La evolución posterior no fue buena, empeorando el estado general y añadiéndose febrícula y disnea progresiva.
A su llegada a nuestro centro, con fiebre de 38 ¡C, su aspecto era de gravedad, estaba taquicárdica y taquipneica, no toleraba el decúbito, presentaba una presión arterial sistólica de 90 mmHg, pulso paradójico, hipertensión venosa yugular pasiva a 45¡ hasta la mandíbula, hipoventilación alveolar generalizada y semiología de derrame pleural en la base del hemitórax izquierdo; los ruidos cardíacos rítmicos eran de moderada intensidad sin oírse soplos o roce. Existía hepatomegalia dolorosa homogénea mayor de 5 cm bajo el reborde costal derecho.
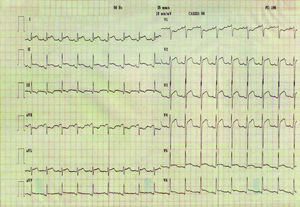
En la analítica se obtuvieron 19.600 leucocitos/μl (88,6% de neutrófilos), anemia normocítica normocrómica (Hb: 9,9 g/dl), actividad de protrombina del 68%, proteínas totales: 5,8 g/dl, hipoalbuminemia y aumento relativo de γ-globulinas (17,9%), hiperglucemia (185 mg/dl) y discreta hiponatremia (128 mEq/l). La gasometría arterial puso de manifiesto pH: 7,46; pCO 2: 28,7 mmHg; pO 2: 90,3 mmHg; HCO 3-: 20,6 mEq/l. En la radiología de tórax se encontró una cardiomegalia global (ICT = 0,6) y derrame pleural izquierdo. El trazado electrocardiográfico demostraba una taquicardia sinusal con supradesnivelación difusa del segmento ST (fig. 1).
Fig. 1. Electrocardiograma de ingreso. Supradesnivelación difusa del segmento ST.
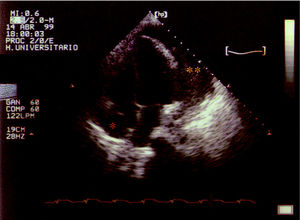
Se sospechó clínicamente un taponamiento cardíaco y realizamos un ecocardiograma, encontrándose un derrame pericárdico severo con colapso de la aurícula derecha (fig. 2). Se procedió a pericardiocentesis urgente diagnosticoterapéutica, extrayendo 600 ml de un líquido turbio (pH: 6,9; glucosa: 69 mg/dl; proteínas totales: 5,4 g/dl; LDH: 2.458 U/l; leucocitos: 40.600/μl con un 99% de segmentados; ADA: 31,3 U/l). Dos cultivos del líquido pericárdico resultaron positivos para Neisseria meningitidis del grupo C. Se mantuvo un drenaje pericárdico durante 72 h, tras las cuales fue retirado. El derrame pericárdico residual se controló mediante ecocardiogramas sucesivos. Las tinciones de Ziehl-Neelsen de líquido pericárdico y pleural, heces y orina, y las citologías de líquido pericárdico, orina y líquido pleural fueron negativas.
Fig. 2. Ecocardiograma. Proyección de 4 cavidades. Derrame pericárdico severo (**) con colapso de la aurícula derecha (*).
Los ANA, ANCA, anticuerpos antifosfolípidos, anticardiolipina y células LE, fueron negativos. Las cifras séricas de las fracciones C3, C4, C5 y C9 del complemento, de inmunoglobulinas y el recuento de las poblaciones linfocitarias no presentaron alteraciones significativas.
Se realizó una TAC toracoabdominal que demostró la ausencia de masas y adenopatías, hepatomegalia gigante que llegaba hasta fosa ilíaca, derrame pleural bilateral (más intenso el izquierdo) e infiltrado atelectásico en el lóbulo pulmonar inferior izquierdo.
Durante su convalecencia se constató ligera colestasis disociada y citólisis hepática. La velocidad de sedimentación globular máxima fue de 121 mm en la primera hora, elevándose también otros reactantes de fase aguda. Se descartó afectación meníngea (en ausencia de meningismo el líquido cefalorraquídeo demostró 160 hematíes/μl, ausencia de leucocitos, glucorraquia de 55 mg/dl, menos de 1 g/l de proteínas, ADA de 0,6 U/l) y coinfección por otro tipo de gérmenes (serologías de VHB, VHA, VHC, VIH, influenza A, influenza B, virus respiratorio sincitial, adenovirus, Mycoplasma pneumoniae, Coxiella burnetii, Chlamydia psitacci, Legionella pneumophila y Toxoplasma: negativas; IgM negativas para citomegalovirus, herpes tipo I y rubéola; Paul-Bunnell negativo). Los valores de TSH y hormonas tiroideas fueron normales.
Posteriormente, ante la persistencia del derrame pleural izquierdo, se procedió a una toracocentesis diagnóstica: líquido inflamatorio estéril (proteínas totales: 4,2 g/dl; leucocitos: 700/μl con un 56% de linfocitos; glucosa: 80 mg/dl; LDH: 499 U/l; ADA: 15,9 U/l).
La paciente permaneció febril durante 14 días, siendo tratada según antibiograma con ceftriaxona a dosis 1-2 g cada 12 horas i.v. teniendo en cuenta el momento evolutivo, durante 25 días, e introduciéndose la corticoterapia con posterioridad (a los 13 días). El derrame pericárdico residual desapareció progresivamente hasta normalizar los hallazgos ecocardiográficos. La paciente fue dada de alta a los 32 días de su ingreso. En revisiones periódicas hasta 97 días posteriores al alta permaneció asintomática, con controles clínicos y analíticos normales. Tampoco se encontraron datos de constricción pericárdica. DISCUSIÓN
Las pericarditis purulentas se producen con frecuencia por extensión directa al saco pericárdico de una infección bacteriana subdiafragmática o intratorácica, o por diseminación hematógena. Su diagnóstico no es fácil, a menudo pasa desapercibido (pueden faltar el dolor torácico y roce pericárdico; síntomas como la disnea pueden atribuirse a otras causas), por lo que precisa para realizarlo de una alta sospecha clínica. Se basa en la obtención de un exudado pericárdico purulento, rico en polimorfonucleares 1. No siempre se consigue cultivar el microorganismo responsable a partir de una muestra de este exudado. Varias bacterias causan estos cuadros 2.
Neisseria meningitidis es un diplococo gramnegativo sensible a la desecación y frío, capaz de metabolizar glucosa y maltosa, que coloniza habitualmente la nasofaringe humana, y es responsable del 6 al 16% de las pericarditis purulentas 3-9 (tras estafilococos, neumococos y estreptococos en la población general, y tras Staphylococcus aureus y Haemophilus influenzae en la población infantil). Habitualmente da lugar a cuadros sépticos generales (meningococemia aguda) y meningitis purulentas. Para documentar nuestro caso se realizó una búsqueda universal en Medline, hasta marzo de 2000, utilizando como palabras claves: Primary Meningococcal Pericarditis, Purulent Pericarditis y Neisseria meningitidis.
El pericardio se ve afectado en el 5,1% de las infecciones meningocócicas, aunque según las series este porcentaje puede llegar al 19% 10. Cuando esto se produce la morbimortalidad aumenta considerablemente. Tres son las formas de afectación pericárdica en el contexto de la enfermedad meningocócica 9:
1. Enfermedad meningocócica diseminada con pericarditis (DMP): provocada por invasión directa del meningococo, se desarrolla en menos de 8 días generalmente, afecta a niños, los cultivos del líquido pericárdico (purulento) suelen ser positivos, así como los hemocultivos y los de líquido cefalorraquídeo, el taponamiento es infrecuente y el tratamiento se basa en la antibioterapia.
2. Pericarditis meningocócica aislada o primaria (IMP o PMP): provocada por invasión directa del meningococo, se desarrolla en menos de 8 días generalmente, afecta a adultos y adolescentes, los cultivos del líquido pericárdico (purulento) suelen ser positivos, el taponamiento es común y el tratamiento se basa en la antibioterapia y la pericardiocentesis. Se define como «la pericarditis purulenta con cultivos de líquido pericárdico o hemocultivos positivos para meningococo en ausencia de compromiso de las meninges o manifestaciones clínicas de meningococemia» 10,11.
3. Pericarditis meningocócica reactiva (RMP): provocada por un mecanismo de hipersensibilidad (inmunológico), se desarrolla en 6-16 días tras un cuadro infeccioso diseminado o localizado tratado adecuadamente con antibióticos, afecta a adultos y adolescentes, los cultivos del líquido pericárdico suelen ser negativos, el taponamiento es común, suele haber afectación articular, cutánea y pleural concomitante, y el tratamiento se basa en los corticoides, los salicilatos y la pericardiocentesis.
A pesar de ser una complicación descrita, resulta inusual, y en la bibliografía se han descrito hasta el momento poco más de 30 casos de PMP (el 1,5% de algunas series extensas de pericarditis meningocócicas 10). En Europa el 75% de las PMP son causadas por el serogrupo C, el 17% por el W-135 y el 8% por el B 10,12. Esta desproporción a favor del serogrupo C 13 no se corresponde con la similitud porcentual relativa en la responsabilidad etiológica de otros cuadros meningocócicos (meningitis, artritis, etc.), y posiblemente obedece a una susceptibilidad especial y capacidad de localizar la infección por parte del pericardio 9. La infección meningocócica en ocasiones se asocia con alteraciones deficitarias de factores del complemento (hipoinmunidad) y/o discrasias de células plasmáticas 14,15.
La clínica de las pericarditis meningocócicas puede iniciarse con una semiología que puede simular desde una gastroenteritis (diarrea, vómitos, mialgias) a un shock séptico 10,16. El dolor torácico, la fiebre y la disnea son los síntomas más frecuentes. El hemograma demuestra en la mayoría de las ocasiones una leucocitosis y los hallazgos electrocardiográficos suelen ser los típicos de las pericarditis. El taponamiento se produce en el 75-82% de las PMP 9,11 (como en nuestro caso). La miocarditis es infrecuente en la enferme-dad meningocócica (más descrito con el serogrupo W-135) 17,18, pero tardíamente la aparición de una pericarditis constrictiva resulta posible 19.
El tratamiento de las PMP se fundamenta en la antibioterapia, con preferencia basada en el antibiograma, aunque empíricamente suele iniciarse con un β-lactámico (penicilina, o más actualmente con una cefalosporina de tercera generación), y en alérgicos a éstos con cloramfenicol 10,12,20. La pericardiocentesis suele ser necesaria 9. Si el tratamiento óptimo se instaura de forma precoz, el pronóstico suele ser excelente. La corticoterapia es una opción para el tratamiento de las complicaciones relacionadas con la hipersensibilidad, aunque nosotros la usamos más bien por su poder antiinflamatorio (erradicación de la serositis residual traducida en el mantenimiento de la fiebre y un leve derrame pericárdico y pleural). No llegamos a considerar el drenaje pericárdico quirúrgico (que a veces se hace imprescindible) dada la buena evolución y lo agresivo del método.
Nuestro caso constituye un ejemplo de pericarditis meningocócica primaria (PMP) causada por el serogrupo C. Que nosotros conozcamos, constituye el primer caso, provocado por este serogrupo, descrito en España. Siguió un curso clínico, diagnóstico y terapéutico típico, aunque no se debe olvidar que ello resulta poco habitual dentro del contexto de las infecciones meningocócicas, y que puede llevar a errores o malinterpretaciones diagnósticas.
El meningococo es una bacteria gramnegativa que suele causar cuadros sépticos generales o que afectan al sistema nervioso central (meningitis). Cuando la infección compromete otros órganos, entre ellos al pericardio, generalmente es de forma secundaria. Muy excepcionalmente una bacteriemia transitoria da lugar a patología exclusivamente localizada en otro órgano, sin participación meníngea.
CASO CLÍNICO
Mujer de 15 años, sin antecedentes patológicos de interés, que ingresó con la sospecha de shock séptico.
Presentó, 48 h antes, artromialgias generalizadas, diarrea y astenia, siendo etiquetada de gastroenteritis aguda y dada de alta de otro centro. La evolución posterior no fue buena, empeorando el estado general y añadiéndose febrícula y disnea progresiva.
A su llegada a nuestro centro, con fiebre de 38 ¡C, su aspecto era de gravedad, estaba taquicárdica y taquipneica, no toleraba el decúbito, presentaba una presión arterial sistólica de 90 mmHg, pulso paradójico, hipertensión venosa yugular pasiva a 45¡ hasta la mandíbula, hipoventilación alveolar generalizada y semiología de derrame pleural en la base del hemitórax izquierdo; los ruidos cardíacos rítmicos eran de moderada intensidad sin oírse soplos o roce. Existía hepatomegalia dolorosa homogénea mayor de 5 cm bajo el reborde costal derecho.
En la analítica se obtuvieron 19.600 leucocitos/μl (88,6% de neutrófilos), anemia normocítica normocrómica (Hb: 9,9 g/dl), actividad de protrombina del 68%, proteínas totales: 5,8 g/dl, hipoalbuminemia y aumento relativo de γ-globulinas (17,9%), hiperglucemia (185 mg/dl) y discreta hiponatremia (128 mEq/l). La gasometría arterial puso de manifiesto pH: 7,46; pCO 2: 28,7 mmHg; pO 2: 90,3 mmHg; HCO 3-: 20,6 mEq/l. En la radiología de tórax se encontró una cardiomegalia global (ICT = 0,6) y derrame pleural izquierdo. El trazado electrocardiográfico demostraba una taquicardia sinusal con supradesnivelación difusa del segmento ST (fig. 1).
Fig. 1. Electrocardiograma de ingreso. Supradesnivelación difusa del segmento ST.
Se sospechó clínicamente un taponamiento cardíaco y realizamos un ecocardiograma, encontrándose un derrame pericárdico severo con colapso de la aurícula derecha (fig. 2). Se procedió a pericardiocentesis urgente diagnosticoterapéutica, extrayendo 600 ml de un líquido turbio (pH: 6,9; glucosa: 69 mg/dl; proteínas totales: 5,4 g/dl; LDH: 2.458 U/l; leucocitos: 40.600/μl con un 99% de segmentados; ADA: 31,3 U/l). Dos cultivos del líquido pericárdico resultaron positivos para Neisseria meningitidis del grupo C. Se mantuvo un drenaje pericárdico durante 72 h, tras las cuales fue retirado. El derrame pericárdico residual se controló mediante ecocardiogramas sucesivos. Las tinciones de Ziehl-Neelsen de líquido pericárdico y pleural, heces y orina, y las citologías de líquido pericárdico, orina y líquido pleural fueron negativas.
Fig. 2. Ecocardiograma. Proyección de 4 cavidades. Derrame pericárdico severo (**) con colapso de la aurícula derecha (*).
Los ANA, ANCA, anticuerpos antifosfolípidos, anticardiolipina y células LE, fueron negativos. Las cifras séricas de las fracciones C3, C4, C5 y C9 del complemento, de inmunoglobulinas y el recuento de las poblaciones linfocitarias no presentaron alteraciones significativas.
Se realizó una TAC toracoabdominal que demostró la ausencia de masas y adenopatías, hepatomegalia gigante que llegaba hasta fosa ilíaca, derrame pleural bilateral (más intenso el izquierdo) e infiltrado atelectásico en el lóbulo pulmonar inferior izquierdo.
Durante su convalecencia se constató ligera colestasis disociada y citólisis hepática. La velocidad de sedimentación globular máxima fue de 121 mm en la primera hora, elevándose también otros reactantes de fase aguda. Se descartó afectación meníngea (en ausencia de meningismo el líquido cefalorraquídeo demostró 160 hematíes/μl, ausencia de leucocitos, glucorraquia de 55 mg/dl, menos de 1 g/l de proteínas, ADA de 0,6 U/l) y coinfección por otro tipo de gérmenes (serologías de VHB, VHA, VHC, VIH, influenza A, influenza B, virus respiratorio sincitial, adenovirus, Mycoplasma pneumoniae, Coxiella burnetii, Chlamydia psitacci, Legionella pneumophila y Toxoplasma: negativas; IgM negativas para citomegalovirus, herpes tipo I y rubéola; Paul-Bunnell negativo). Los valores de TSH y hormonas tiroideas fueron normales.
Posteriormente, ante la persistencia del derrame pleural izquierdo, se procedió a una toracocentesis diagnóstica: líquido inflamatorio estéril (proteínas totales: 4,2 g/dl; leucocitos: 700/μl con un 56% de linfocitos; glucosa: 80 mg/dl; LDH: 499 U/l; ADA: 15,9 U/l).
La paciente permaneció febril durante 14 días, siendo tratada según antibiograma con ceftriaxona a dosis 1-2 g cada 12 horas i.v. teniendo en cuenta el momento evolutivo, durante 25 días, e introduciéndose la corticoterapia con posterioridad (a los 13 días). El derrame pericárdico residual desapareció progresivamente hasta normalizar los hallazgos ecocardiográficos. La paciente fue dada de alta a los 32 días de su ingreso. En revisiones periódicas hasta 97 días posteriores al alta permaneció asintomática, con controles clínicos y analíticos normales. Tampoco se encontraron datos de constricción pericárdica. DISCUSIÓN
Las pericarditis purulentas se producen con frecuencia por extensión directa al saco pericárdico de una infección bacteriana subdiafragmática o intratorácica, o por diseminación hematógena. Su diagnóstico no es fácil, a menudo pasa desapercibido (pueden faltar el dolor torácico y roce pericárdico; síntomas como la disnea pueden atribuirse a otras causas), por lo que precisa para realizarlo de una alta sospecha clínica. Se basa en la obtención de un exudado pericárdico purulento, rico en polimorfonucleares 1. No siempre se consigue cultivar el microorganismo responsable a partir de una muestra de este exudado. Varias bacterias causan estos cuadros 2.
Neisseria meningitidis es un diplococo gramnegativo sensible a la desecación y frío, capaz de metabolizar glucosa y maltosa, que coloniza habitualmente la nasofaringe humana, y es responsable del 6 al 16% de las pericarditis purulentas 3-9 (tras estafilococos, neumococos y estreptococos en la población general, y tras Staphylococcus aureus y Haemophilus influenzae en la población infantil). Habitualmente da lugar a cuadros sépticos generales (meningococemia aguda) y meningitis purulentas. Para documentar nuestro caso se realizó una búsqueda universal en Medline, hasta marzo de 2000, utilizando como palabras claves: Primary Meningococcal Pericarditis, Purulent Pericarditis y Neisseria meningitidis.
El pericardio se ve afectado en el 5,1% de las infecciones meningocócicas, aunque según las series este porcentaje puede llegar al 19% 10. Cuando esto se produce la morbimortalidad aumenta considerablemente. Tres son las formas de afectación pericárdica en el contexto de la enfermedad meningocócica 9:
1. Enfermedad meningocócica diseminada con pericarditis (DMP): provocada por invasión directa del meningococo, se desarrolla en menos de 8 días generalmente, afecta a niños, los cultivos del líquido pericárdico (purulento) suelen ser positivos, así como los hemocultivos y los de líquido cefalorraquídeo, el taponamiento es infrecuente y el tratamiento se basa en la antibioterapia.
2. Pericarditis meningocócica aislada o primaria (IMP o PMP): provocada por invasión directa del meningococo, se desarrolla en menos de 8 días generalmente, afecta a adultos y adolescentes, los cultivos del líquido pericárdico (purulento) suelen ser positivos, el taponamiento es común y el tratamiento se basa en la antibioterapia y la pericardiocentesis. Se define como «la pericarditis purulenta con cultivos de líquido pericárdico o hemocultivos positivos para meningococo en ausencia de compromiso de las meninges o manifestaciones clínicas de meningococemia» 10,11.
3. Pericarditis meningocócica reactiva (RMP): provocada por un mecanismo de hipersensibilidad (inmunológico), se desarrolla en 6-16 días tras un cuadro infeccioso diseminado o localizado tratado adecuadamente con antibióticos, afecta a adultos y adolescentes, los cultivos del líquido pericárdico suelen ser negativos, el taponamiento es común, suele haber afectación articular, cutánea y pleural concomitante, y el tratamiento se basa en los corticoides, los salicilatos y la pericardiocentesis.
A pesar de ser una complicación descrita, resulta inusual, y en la bibliografía se han descrito hasta el momento poco más de 30 casos de PMP (el 1,5% de algunas series extensas de pericarditis meningocócicas 10). En Europa el 75% de las PMP son causadas por el serogrupo C, el 17% por el W-135 y el 8% por el B 10,12. Esta desproporción a favor del serogrupo C 13 no se corresponde con la similitud porcentual relativa en la responsabilidad etiológica de otros cuadros meningocócicos (meningitis, artritis, etc.), y posiblemente obedece a una susceptibilidad especial y capacidad de localizar la infección por parte del pericardio 9. La infección meningocócica en ocasiones se asocia con alteraciones deficitarias de factores del complemento (hipoinmunidad) y/o discrasias de células plasmáticas 14,15.
La clínica de las pericarditis meningocócicas puede iniciarse con una semiología que puede simular desde una gastroenteritis (diarrea, vómitos, mialgias) a un shock séptico 10,16. El dolor torácico, la fiebre y la disnea son los síntomas más frecuentes. El hemograma demuestra en la mayoría de las ocasiones una leucocitosis y los hallazgos electrocardiográficos suelen ser los típicos de las pericarditis. El taponamiento se produce en el 75-82% de las PMP 9,11 (como en nuestro caso). La miocarditis es infrecuente en la enferme-dad meningocócica (más descrito con el serogrupo W-135) 17,18, pero tardíamente la aparición de una pericarditis constrictiva resulta posible 19.
El tratamiento de las PMP se fundamenta en la antibioterapia, con preferencia basada en el antibiograma, aunque empíricamente suele iniciarse con un β-lactámico (penicilina, o más actualmente con una cefalosporina de tercera generación), y en alérgicos a éstos con cloramfenicol 10,12,20. La pericardiocentesis suele ser necesaria 9. Si el tratamiento óptimo se instaura de forma precoz, el pronóstico suele ser excelente. La corticoterapia es una opción para el tratamiento de las complicaciones relacionadas con la hipersensibilidad, aunque nosotros la usamos más bien por su poder antiinflamatorio (erradicación de la serositis residual traducida en el mantenimiento de la fiebre y un leve derrame pericárdico y pleural). No llegamos a considerar el drenaje pericárdico quirúrgico (que a veces se hace imprescindible) dada la buena evolución y lo agresivo del método.
Nuestro caso constituye un ejemplo de pericarditis meningocócica primaria (PMP) causada por el serogrupo C. Que nosotros conozcamos, constituye el primer caso, provocado por este serogrupo, descrito en España. Siguió un curso clínico, diagnóstico y terapéutico típico, aunque no se debe olvidar que ello resulta poco habitual dentro del contexto de las infecciones meningocócicas, y que puede llevar a errores o malinterpretaciones diagnósticas.
Bibliografía
[1]
Guidelines of the Spanish Society of Cardiology on pericardial disease. Rev Esp Cardiol 2000; 53: 394-412.
[2]
Brucellar pericarditis: 2 different forms of presentation for an unusual etiology. Rev Esp Cardiol 1991; 44: 210-212.
[3]
Purulent pericarditis: review of a 20-year experience in a general hospital. J Am Coll Cardiol 1993; 22: 1661-1665.
[4]
Purulent pericarditis in the antibiotic era. Arch Intern Med 1974; 134: 923-927.
[5]
The changed spectrum of purulent pericarditis: an 86 year autopsy experience in 200 patients. Am J Med 1977; 63: 666-673.
[6]
Bacterial pericarditis in infancy and childhood. Am J Cardiol 1994; 74: 807-809.
[7]
Acute bacterial pericarditis in children: report of 25 cases. Am Heart J 1975; 90: 709-713.
[8]
Purulent pericarditis in children: a 15 year-experience. Arch Pediatr 1996; 3: 1084-1090.
[9]
A new classification for pericarditis associated with meningococcal infection. Eur J Pediatr 1997; 156: 585-588.
[10]
Primary meningococcal pericarditis: a disease of adults associated with serogroup C Neisseria meningitidis. Rev Infect Dis 1984; 6: 625-632.
[11]
Pathophysiology of primary meningococcal pericarditis associated with Neisseria meningitidis group C. A case report and review of the literature. Diagn Microbiol Infect Dis 1986; 4: 259-265.
[12]
Pericarditis meningocócica primaria por meningococo serogrupo B [carta]. Enferm Infecc Microbiol Clin 1998; 16: 99-100.
[13]
Primary meningococcal pericarditis. Clin Infec Dis 1999; 29: 213-215.
[14]
Prevalence of congenital or adquired complement deficiency in patients with sporadic meningococcal disease. N Engl J Med 1983; 308: 913-916.
[15]
Multiple myeloma and meningococcal arthritis. Am J Med 1987; 82: 1257-1258.
[16]
Purulent pericarditis misdiagnosed as septic shock. South Med J 1999; 92: 285-288.
[17]
Myopericarditis with cardiac tamponade caused by Neisseria meningitidis serogroup W-135. Eur J Clin Microbiol Infect Dis 1988; 7: 403-404.
[18]
Myopericarditis as an initial presentation of meningococcemia. Unusual manifestation of infection with serotype W-135. Am J Med 1987; 82: 641-644.
[19]
Constrictive pericarditis as a late complication of meningococcal pericarditis. Am J Cardiol 1985; 55: 1442-1443.
[20]
Péricardite purulente ¿ méningocoque. Arch Fr Pediatr 1990; 47: 156.