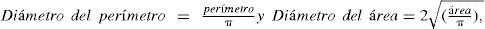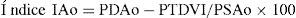Las técnicas de imagen tienen un papel fundamental para conseguir excelentes resultados en el implante de las prótesis aórticas transcatéter. La ecocardiografía transtorácica diagnostica la gravedad de la estenosis aórtica y la presencia de valvulopatías asociadas, valora la morfología y la función del ventrículo izquierdo y determina el diámetro del anillo aórtico. La tomografía computarizada permite definir mejor el tamaño del anillo aórtico, especialmente cuando es de morfología ovoide, la calcificación valvular, la distancia entre las coronarias y el anillo aórtico y la idoneidad de la vía para implantar la prótesis. Tanto la ecocardiografía transesofágica como la fluoroscopia y la angiografía facilitan una correcta monitorización del procedimiento. La ecocardiografía transesofágica, especialmente si es 3D, no solo confirma el tamaño del anillo aórtico, sino que es fundamental para verificar la adecuada posición de la prótesis y el grado de regurgitación residual y descartar posibles complicaciones durante el procedimiento.
Palabras clave
El implante valvular aórtico transcatéter (TAVI) ha mostrado excelentes resultados cuando se realiza con una adecuada selección de los pacientes y una correcta monitorización del procedimiento mediante técnicas de imagen. La tomografía computarizada (TC) multidetectores (TCMD) y la ecocardiografía transtorácica (ETT) permiten una adecuada selección de los casos, y la fluoroscopia con ecocardiografía transesofágica (ETE) y ocasionalmente angiografía facilita una correcta monitorización del procedimiento. La resonancia magnética se ha utilizado poco por su menor capacidad para evaluar el calcio en comparación con la TC.
Selección de los pacientesLa selección de pacientes para TAVI debe realizarla un equipo multidisciplinario que incluya a un cardiólogo clínico, un hemodinamista, un experto en imagen cardiaca, un cirujano cardiaco y un anestesiólogo. En la valoración pre-TAVI se debe evaluar:
Gravedad de la estenosis aórtica y presencia de enfermedades cardiacas asociadasLa ecocardiografía es la técnica de imagen más importante en la cuantificación de la gravedad de la estenosis aórtica (EAo). La guía europea de valvulopatías1 establece como criterios de gravedad un área valvular aórtica < 1 cm2 o un índice de área < 0,6 cm2/m2 y un gradiente medio > 40 mmHg. En casos con depresión de la función ventricular y bajo gradiente, puede ser necesario realizar una ecocardiografía con dobutamina para verificar la gravedad de la estenosis. Especial atención merecen los pacientes con bajo flujo y bajo gradiente con fracción de eyección normal. Estos casos podrían ser candidatos a TAVI, pero se debe descartar la subestimación del área valvular. Para ello es importante valorar otras variables, como la calcificación valvular o la medida del área valvular anatómica valoradas por TCMD. Solo excepcionalmente es necesario recurrir al cateterismo cardiaco para confirmar que se trata de una EAo grave.
La ETT permite además medir el anillo valvular aórtico y valorar la presencia y la gravedad de la insuficiencia aórtica asociada, la morfología de la válvula aórtica con el número de velos y su grado de calcificación, la función del ventrículo izquierdo (VI), la protrusión del tabique interventricular en el tracto de salida del VI, la presencia de insuficiencia mitral grave y su etiología, el tamaño de la aorta ascendente, la hipertensión arterial pulmonar y la función del ventrículo derecho.
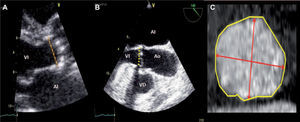
Tamaño del anillo valvular aórticoSin duda, uno de los aspectos fundamentales en la selección de los pacientes candidatos a TAVI es determinar el tamaño del anillo valvular aórtico y, por lo tanto, el tamaño de la prótesis que se debería implantar. La medición del anillo valvular aórtico se puede realizar por la mayoría de las técnicas de imagen, pero en la práctica clínica la ETT es la técnica que aporta la primera información. Mediante la ETT se utiliza el plano paraesternal longitudinal izquierdo, realizando un zoom sobre la válvula aórtica; este diámetro es el localizado entre la sigmoidea coronárica derecha y la no coronárica (figura 1A). La medida debe tomarse en sístole, en el momento en que el diámetro es mayor.
A: plano paraesternal longitudinal (zoom) de una ecocardiografía transtorácica; la línea marca el diámetro del anillo valvular aórtico medido en mesosístole. B: plano longitudinal del tracto de salida del VI mediante ecocardiografía transesofágica; la línea define el diámetro del anillo valvular aórtico en mesosístole y la coaxialidad entre aorta y tracto de salida del VI. C: imagen telesistólica del anillo valvular aórtico obtenido por tomografía computarizada multidetectores; las flechas señalan los diámetros mayor y menor y el trazado del borde define el área del anillo a partir del cual se calcula el diámetro medio. AI: aurícula izquierda; Ao: aorta ascendente; VD: ventrículo derecho; VI: ventrículo izquierdo.
Mediante ETE, el diámetro del anillo valvular aórtico se obtiene en el plano longitudinal a 120-140°. En este plano se visualiza el tracto de salida del VI y su alineación con la aorta ascendente (figura 1B).
La comparación directa de ETT y ETE indica que la medida del anillo aórtico es aproximadamente 1 mm más grande por ETE que por ETT. Las imágenes volumétricas del TCMD y de la ETE tridimensional (3D) muestran que el tracto de salida del VI y el anillo aórtico tienen una morfología elíptica más que circular en la mayoría de los pacientes1. Esta excentricidad del anillo puede condicionar que se subestime el tamaño de la prótesis seleccionada, lo que implica mayor riesgo de fuga paravalvular. Por este motivo, algunos estudios han definido un índice de excentricidad como predictor de fuga paravalvular. Este índice se determina con la ecuación: 1 – (diámetro mínimo / diámetro máximo). Un índice de excentricidad > 0,25 se relacionó con una probabilidad alta de fuga paravalvular significativa: sensibilidad, 80%; especificidad, 86%; valor predictivo negativo, 95% (p < 0,001). Dicha excentricidad aumenta en la fase diastólica2.
El tamaño del anillo obtenido por las distintas técnicas de imagen (ETT, TCMD, resonancia magética) se correlacionó con las mediciones intraoperatorias, y se constató la mayor exactitud de las técnicas tridimensionales3. La ETE 3D permite medir los diámetros mayor y menor en imágenes biplanares o en una reconstrucción volumétrica del tracto de salida del VI4. La reproducibilidad de la medida del anillo valvular aórtico es superior en la MDCT y la ETE que en la ETT y la angiografía5.
La TCMD no solo permite medir los diámetros mayor y menor, sino también el perímetro y el área del anillo (figura 1D). Como las prótesis se clasifican por su diámetro externo en milímetros, la TCMD intenta obtener una medida representativa del diámetro del anillo que permita su comparación con las prótesis. Se ha demostrado que los modelos de TAVI expandibles con balón (Edwards SAPIEN) remodelan el anillo elíptico, que después del implante se convierte en aproximadamente circular, por lo que tiene sentido facilitar la comparación reduciendo la elipse a un círculo de idéntico perímetro o área, pero que se puede describir mediante un diámetro único. El diámetro promedio calculado a partir de los diámetros mayor y menor —Dm = (Dmáx + Dmín) / 2— solo será representativo en los anillos de morfología muy regular, por lo que en general se recomienda extraer el diámetro a partir del perímetro y del área con las fórmulas
respectivamente. En la actualidad no hay consenso claro sobre qué metodología permite obtener los mejores resultados en la determinación del diámetro del anillo aórtico2–5. Otros utilizan directamente el área aórtica del anillo6.
Un estudio prospectivo4 comparó los resultados del implante según los valores de la ETT con los de la TCMD, y mostró una incidencia de regurgitación de grado moderado-grave significativamente menor en el grupo guiado por TCMD (7,5%) que en el grupo guiado por ETT (21,9%). Otro estudio prospectivo y multicéntrico6 evidenció que la incidencia de regurgitación de grado moderado-grave fue del 5,3% en el grupo de TCMD frente al 12,8% del grupo en el que solo se utilizó la ETE bidimensional (2D) y la angiografía.
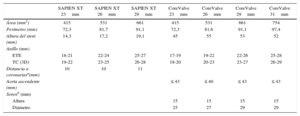
Cuando se selecciona una prótesis de tamaño menor que el adecuado, existe el riesgo de que se produzca una fuga paravalvular significativa o una migración de la prótesis. Cuando se sobredimensiona el tamaño de la prótesis, se puede condicionar una fuga intravalvular por distorsión de los velos, una rotura aórtica o un trastorno de la conducción que puede implicar el implante adicional de un marcapasos definitivo. La ETE 2D practicada durante el procedimiento permite determinar el diámetro anteroposterior, que es el menor si el anillo es excéntrico. Por ello se tiende a sobredimensionar el tamaño de la prótesis 1–2 mm. Mylotte et al7 aconsejan sobredimensionar un 8–20% para las prótesis expandibles con balón (Edwards SAPIEN), y un 5–15% con las prótesis autoexpandibles (CoreValve). Considerando las dos prótesis más utilizadas (Edwards SAPIEN y CoreValve), se dispone de una serie de tamaños de prótesis que se debe escoger antes del implante. Estos tamaños limitan los candidatos a TAVI según el tipo de prótesis, como muestran los valores referidos en la tabla.
Tipos y tamaños de prótesis en relación con el anillo valvular aórtico y el tipo de prótesis
| SAPIEN XT 23mm | SAPIEN XT 26mm | SAPIEN XT 29mm | CoreValve 23mm | CoreValve 26mm | CoreValve 29mm | CoreValve 31mm | |
|---|---|---|---|---|---|---|---|
| Área (mm2) | 415 | 531 | 661 | 415 | 531 | 661 | 754 |
| Perímetro (mm) | 72,3 | 81,7 | 91,1 | 72,3 | 81,6 | 91,1 | 97,4 |
| Altura del stent (mm) | 14,3 | 17,2 | 19,1 | 45 | 55 | 53 | 52 |
| Anillo (mm) | |||||||
| ETE | 18-21 | 22-24 | 25-27 | 17-19 | 19-22 | 22-26 | 25-28 |
| TC (3D) | 19-22 | 23-25 | 26-28 | 18-20 | 20-23 | 23-27 | 26-29 |
| Distancia a coronariasa(mm) | 10 | 10 | 11 | ||||
| Aorta ascendente (mm) | ≤ 43 | ≤ 40 | ≤ 43 | ≤ 43 | |||
| Senosb (mm) | |||||||
| Altura | 15 | 15 | 15 | 15 | |||
| Diámetro | 25 | 27 | 29 | 29 |
ETE: ecocardiografía transesofágica; TC (3D): tomografía computarizada tridimensional.
La EAo grave se acompaña frecuentemente de calcificación de las sigmoideas con masas de calcio que se extienden dentro del plano del anillo. La TCMD es la técnica de imagen de elección para la detección y la cuantificación de calcio. El grado de calcificación de los velos aórticos en la TCMD previo al implante (> 2.000-3.000 unidades de Agatston) se correlaciona significativamente con el riesgo de complicaciones y maniobras complementarias durante el procedimiento8, la presencia y el grado de la regurgitación clínicamente relevante y menores mejoría clínica y supervivencia. Por otro lado, el grado de calcificación subanular se ha correlacionado con la rotura del tracto de salida o del anillo.
La fuga paravalvular tras el despliegue de la prótesis puede ser consecuencia de los nódulos de calcio de los velos o las comisuras. La prótesis no es capaz de aplastar los mazacotes de calcio contra la pared aórtica, y quedan unos canales residuales entre el calcio incluso después de realizar un segundo inflado o balonización de la prótesis. Al parecer, la calcificación comisural tiene más riesgo de fuga residual que la calcificación del borde libre de los velos9.
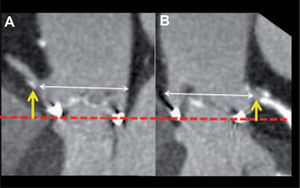
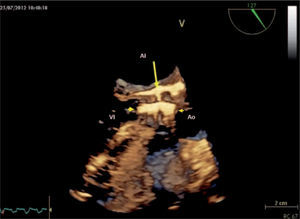
Valoración de la raíz aórtica y arterias coronariasLa distancia del anillo aórtico a los ostium coronarios, la longitud de los velos coronarios, así como la profundidad de los senos valvulares, son datos importantes para planificar la estrategia durante el implante y evitar el riesgo de obstrucción de la coronaria por la parte superior de la prótesis por oclusión del velo coronario izquierdo. Una distancia anillo aórtico-ostium de la coronaria izquierda < 10-11 mm se considera contraindicación para el implante de la prótesis Edwards SAPIEN. Antes del procedimiento, la TCMD permite determinar con exactitud la altura real del origen de las arterias coronarias sobre el plano del anillo valvular10 y el tamaño de la raíz aórtica, requisito necesario para los modelos autoexpandibles. Para los pacientes con mayor riesgo de obstrucción, se puede indicar de forma preventiva la colocación de una guía coronaria durante el procedimiento (figura 2).
Imágenes longitudinales de la raíz aórtica, en el plano de origen de la arteria coronaria derecha (A) y el tronco común (B). Sobre estas imágenes se puede calcular la altura del origen de cada arteria (flechas amarillas) respecto al plano del anillo aórtico (línea discontinua roja) y la amplitud de la raíz (flechas blancas).
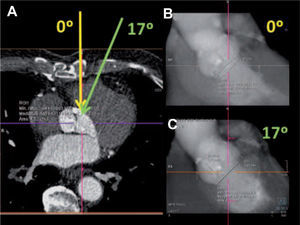
La colocación coaxial del TAVI dentro del anillo aórtico requiere que la imagen de la fluoroscopia muestre un plano perfectamente ortogonal al del anillo. La naturaleza tridimensional de los datos de la TCMD permite valorar la posición del anillo dentro del paciente desde la posición neutra (el plano coronal de la TCMD equivale a un angiograma con el paciente en decúbito supino y el tubo sin angular) y modificar la angulación craneocaudal y lateral de la proyección hasta obtener un plano perfectamente transversal al del anillo11, idéntico al que se obtendría tras un angiograma biplanar. La posición ideal es la que alinea los bordes inferiores de las cúspides de los tres senos con el seno derecho parcialmente visible entre el derecho y el izquierdo. Con este método se puede evitar el aortograma inicial, lo que resulta en una reducción significativa de la duración del procedimiento, el volumen de contraste requerido y la tasa de nefropatía inducida. Adicionalmente, los pacientes con el ángulo de implantación preestablecido por TCMD mostraron una tasa de implante óptimo significativamente superior a la del protocolo convencional, el 90 frente al 65% (figura 3).
Imagen axial de tomografía computarizada a la altura de la válvula aórtica (A). La flecha amarilla simula el trayecto de los rayos durante la fluoroscopia con el tubo en posición neutra, que corresponde a la proyección de corte grueso coronal (B), donde se observa la oblicuidad del anillo. Desviando el eje de la imagen 17° a la izquierda (trayecto de la flecha verde), se obtiene la proyección que permite obtener la alineación perfecta del anillo (C). En este caso se recomienda colocar el tubo de fluoroscopia en craneocaudal a 0° y lateral izquierda a 17°.
La TCMD permite realizar un estudio de toda la anatomía vascular relevante al TAVI, en una adquisición única que incluye los datos de la raíz (equipos de 320 detectores o de doble fuente) o en una segunda adquisición tras la de la raíz (equipos de 64 detectores). El angiograma por TCMD resultante es de utilidad para elegir el mejor acceso vascular disponible en el paciente, incluidos los transfemorales, los subclavios, el transapical y el transaórtico directo.
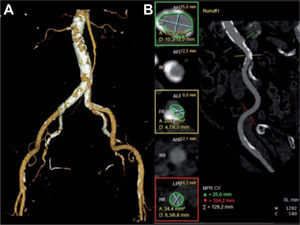
La TCMD permite valorar el diámetro luminal mínimo de los segmentos arteriales involucrados, así como el grado de tortuosidad y la calcificación12, parámetros que se correlacionan con el riesgo de complicaciones vasculares. Las angulaciones entre segmentos iliacos > 90°, las calcificaciones vasculares con afección completamente circunferencial o en herradura, las placas ateromatosas complicadas, la disección segmentaria y los aneurismas aórticos también se consideran contraindicaciones para el abordaje transfemoral12. Se estima que aproximadamente un 20-30% de los candidatos tienen una anatomía desfavorable para el abordaje iliaco. Una relación entre el diámetro externo del introductor del dispositivo y el diámetro luminal mínimo de la arteria ≥ 1,05 se ha relacionado con un aumento de las compli-caciones en el acceso y la mortalidad a 30 días. Actualmente, la aparición de introductores con perfiles de 16–20 Fr (5,3-6,7 mm) permite reducir el calibre mínimo necesario para el abordaje a 6-7 mm.
En el caso de elegirse vías alternativas, los abordajes transapical y transaórtico se benefician del estudio morfológico por TCMD de la caja torácica. De forma específica, en el abordaje transapical, la TCMD permite valorar la relación del ápex ventricular con el punto teórico de entrada y el ángulo entre el trayecto ventricular y la raíz aórtica12, mientras que en el abordaje transaórtico permite descartar afección (dilatación o calcificación) de la zona de punción y valorar las estructuras subyacentes a la zona teórica de incisión (localización de puentes aortocoronarios) (figura 4).
A: reconstrucción de volumen de la aorta abdominal y de ambos sectores iliofemorales, donde se puede apreciar la carga de placa calcificada en el trayecto. B: las reconstrucciones multiplanares curvadas y transversales permiten estudiar detalladamente el luminograma del sector iliofemoral izquierdo, con un trayecto más anguloso que el contralateral, que muestra una placa calcificada en la bifurcación de la iliaca común que reduce significativamente el calibre luminal (recuadro amarillo); se desaconseja el abordaje izquierdo.
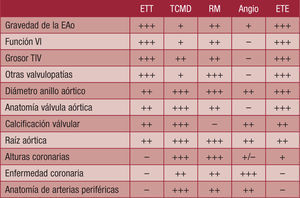
Según la Sociedad Europea de Cardiología, las técnicas de imagen utilizadas en la selección de la vía de implante del TAVI presentan las características que se muestran en la figura 5.
Utilidad de las técnicas de imagen para selección e indicación de la vía para el implante valvular aórtico transcatéter. EAo: estenosis aórtica; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; RM: resonancia magnética; TCMD: tomografía computarizada multidetectores; TIV: tabique interventricular; VI: ventrículo izquierdo.
La fluoroscopia y la angiografía son las técnicas de elección para monitorizar el implante percutáneo de la prótesis. Sin embargo, la ETE tiene una gran utilidad, ya que compensa la falta de visualización de los tejidos mediante la fluoroscopia, especialmente cuando la válvula aórtica está poco calcificada. La ETE 3D tiene ventajas sobre la ETE 2D porque permite una mejor visualización de la guía, el catéter, el balón y la válvula13. Antes del procedimiento se debe valorar el grado de regurgitación aórtica y mitral, la función ventricular, el derrame pericárdico y la arteriosclerosis aórtica complicada, para poder comparar si aparecen complicaciones durante o tras el procedimiento. Si se utiliza la vía transapical, antes se debe marcar el sitio donde la ETT visualiza mejor el plano apical de cuatro cámaras. Igualmente, al inicio del procedimiento, en el laboratorio de hemodinámica, se suele comprobar las medidas del anillo determinadas previamente durante la selección.
Varios estudios han demostrado que el anillo aórtico medido por ETE 3D reduce la incidencia de regurgitación aórtica paravalvular después del TAVI en comparación con las mediciones con ETE 2D13–15. En una serie de 256 pacientes sometidos a TAVI, la valoración del anillo por ETE 3D modificó la elección del tamaño de la prótesis en un 23% de los pacientes respecto a si se hubiera basado solamente en la ETE 2D4. En algunos laboratorios se aprovecha el momento en que se realiza la valvuloplastia previa para medir el diámetro máximo del balón y corroborar el tamaño de prótesis que se había decidido; esta medición se puede realizar tanto por ecocardiografía como por fluoroscopia. En el estudio de Patsalis16, la ausencia de regurgitación con el balón inflado hasta el tamaño de la prótesis que se había decidido colocar reafirmaba en la decisión tomada y prevenía la fuga paravalvular, con menor mortalidad al año. En anillos pequeños con importantes nódulos de calcio, se debe intentar no sobredimensionar en exceso el tamaño de la prótesis y no realizar redilataciones en caso de fuga paravalvular, ya que hay peligro de causar rotura aórtica. También antes del procedimiento conviene revalorar la altura del ostium de la coronaria izquierda, dado el riesgo de oclusión de este en caso de que su salida se encuentre a menos de 10 mm del plano valvular aórtico17. La medición mediante ETE 3D permite realizarla offline, tras adquirir un full volume en el plano transversal en que se realice el corte longitudinal.
En el plano transversal por ETE (si no se ha podido visualizar adecuadamente por ETT o por TCMD) a 30-60°, se deberá descartar la presencia de una válvula aórtica bicúspide. El TAVI puede estar limitado si la válvula es bicúspide debido a que se asocia a un riesgo elevado de fuga paravalvular significativa o embolización de la prótesis.
La monitorización del despliegue de la válvula tiene aspectos comunes para los diferentes tipos de prótesis transcatéter, pero presenta algunas diferencias dependiendo de cuál sea la prótesis elegida. En las prótesis Edwards SAPIEN, se posiciona la prótesis dejando el 50% de su longitud por debajo del nivel de inserción de los velos aórticos y el 50% por encima. De esta manera se contrarresta el posible desplazamiento hacia la aorta que ocurre durante la expansión de la prótesis y se evita que pueda producirse oclusión de una coronaria. En las prótesis CoreValve, la mayor parte del dispositivo se posiciona en la raíz de aorta. La combinación de ETE y fluoroscopia es de gran ayuda para optimizar el posicionamiento y el despliegue de la válvula (figura 6). La imagen multiplanar permite observar mejor el implante valvular aórtico transcatéter en dos planos ortogonales simultáneos en tiempo real, hecho especialmente importante para definir la coaxilidad de la prótesis con el eje de la aorta durante el implante17. Tras la expansión de la prótesis, la ecocardiografía transesofágica tridimensional permite determinar si la zona del implante es la correcta y la relación entre el soporte de la válvula y el origen de la coronaria izquierda18.
Ecocardiografía transesofágica tridimensional realizada durante el posicionamiento de la prótesis antes de su expansión. La flecha larga señala el punto de inserción de las sigmoideas, que separa la porción de prótesis que quedará en el ventrículo y la porción de prótesis que se proyectará a la luz aórtica, en relación ideal del 50%:50%. Las puntas de flecha señalan la posición de los dos extremos de la prótesis antes de la expansión. AI: aurícula izquierda; Ao: aorta; VI: ventrículo izquierdo.
Durante el procedimiento las técnicas de imagen, esencialmente la ETE, deben valorar la posibilidad de que se produzcan algunas complicaciones.
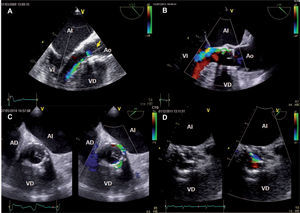
Regurgitación aórticaEn varias series se ha observado un 7-30% de fugas paravalvulares después de un TAVI. Los factores que se relacionan con la aparición de regurgitación aórtica son implante bajo del dispositivo, válvula de pequeño tamaño y presencia de calcio en el anillo aórtico. En general, una combinación del plano transversal de la prótesis (30-40°) y un eje longitudinal a 120-140° suelen dar suficiente información. Si se detecta una fuga significativa de difícil evaluación inmediatamente tras el implante, se deberá retirar los catéteres que aún puedan quedar atravesando la válvula, para descartar que no se trate de una fuga intraprotésica funcional, como muestra la figura 7A.
Ecocardiografía transesofágica tras el implante. A: plano longitudinal; fuga intraprotésica significativa y catéter atravesando la prótesis (flecha); dicha fuga desapareció al retirar el catéter. B: plano longitudinal; se observa una fuga periprotésica con trayecto entre el stent de la prótesis y el velo anterior mitral. C: plano transversal; los velos ocluyen el orificio de la prótesis en diástole; a la derecha se observa una turbulencia que afecta a más de una cuarta parte del perímetro de la prótesis y corresponde a fuga periprotésica. D: plano transversal; en diástole se observa turbulencia diastólica correspondiente a una fuga intraprotésica en relación con el mal despliegue de uno de los velos de la prótesis. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; VD: ventrículo derecho.
Las fugas paravalvulares muestran efecto Coanda y van pegadas a la pared del tracto de salida; frecuentemente, incluso se observa el trayecto entre la prótesis y el anillo aórtico (figura 7B). El eje corto se debe obtener justo por debajo del plano valvular y por encima del tracto de salida del VI y es donde se tiene que determinar la intensidad y la localización de la regurgitación aórtica (figura 7C). La fuga intraprotésica suele ser mínima, aunque en algún caso puede aparecer fuga significativa por mal despliegue de los velos o por mala aposición en diástole por redilataciones sucesivas en implantes con tamaño de la prótesis infradimensionado. En caso de fuga intraprotésica (figura 7D) grave, se puede considerar la colocación de una nueva prótesis en su interior (valve in valve), siempre y cuando la prótesis colocada inicialmente no sea la más pequeña.
La ETE 3D permite cuantificar la regurgitación aórtica de manera más precisa19. La visualización de dos planos ortogonales con el método biplanar con color localiza el jet y evalúa el mecanismo y la gravedad de la regurgitación aórtica con mayor precisión que la ETE 2D20. La planimetría de la vena contracta por ETE 3D facilita una mejor clasificación de las regurgitaciones moderadas21.
La fuga paravalvular es la variable con mayor valor predictivo de mortalidad al año, incluso cuando la fuga paravalvular se haya cuantificado como ligera22. Recientes estudios han demostrado por cinerresonancia magnética que tanto la ETT como la ETE tienden a subestimar el grado de regurgitación aórtica después del TAVI23–24. Se han propuesto nuevos índices para complementar la información de la ETE en la cuantificación de la regurgitación aórtica. El índice calculado como la relación entre el gradiente entre la presión diastólica aórtica (PDAo) y la presión telediastólica del VI (PTDVI) y la presión sistólica sistémica (PSAo) por 100 mostró un valor predictivo independiente en la mortalidad al año post-TAVI25:
Un valor < 25 indica insuficiencia aórtica moderada-grave y su uso complementario se puede considerar.
Otras complicacionesLa embolización de la prótesis es una complicación infrecuente y grave que se debe diagnosticar rápidamente. En ocasiones se produce un desplazamiento de la prótesis hacia el tracto de salida del VI que puede condicionar una insuficiencia mitral por restricción de la valva mitral anterior. El desplazamiento hacia la aorta puede causar oclusión de los ostium coronarios y, como consecuencia, disfunción ventricular. La presencia de ensanchamiento del QRS o el deterioro hemodinámico con anomalías en la contractilidad segmentaria tras la expansión de la prótesis deben alertar de un posible compromiso por obstrucción de las coronarias26. El 70% de los pacientes con obstrucción coronaria mostraba simultáneamente una altura del tronco común < 12 mm y una raíz de anchura máxima < 30 mm. También es importante valorar la raíz aórtica, ya que podría haber aumentado de grosor por un hematoma intramural aórtico o una disección aórtica. La aparición súbita de derrame pericárdico debe alertar de una posible perforación ventricular o aórtica; mediante contraste ecocardiográfico, se puede confirmar e incluso ubicar el origen de la perforación.
Tras el procedimiento, se debe constatar la posición de la prótesis (normoimplantada, implante bajo en el tracto de salida o implante alto en la aorta), el grado de fuga intravalvular o paravalvular, el grado de insuficiencia mitral, la función ventricular y el grado de derrame pericárdico. En caso de que en el estudio previo al procedimiento se hubiera hallado placas complicadas en aorta torácica, se constatará la ausencia de cambios en su morfología27.
SeguimientoTras el implante, se realizará una ETT previa al alta en la que se valorará de nuevo la posición de la prótesis, el gradiente transprotésico, el grado de fuga paravalvular o intravalvular, el grado de insuficiencia mitral, la función ventricular y el grado de derrame pericárdico. En caso de no diagnosticarse ninguna complicación, se realizará un control por ETT al año, y a continuación el seguimiento se realizará como con las prótesis biológicas implantadas mediante cirugía convencional.
Conflicto de interesesNinguno.