La estratificación del riesgo hemorrágico es la pieza limitante del equilibrio isquémico-hemorrágico que permite seleccionar el tipo y la duración del tratamiento antitrombótico. La mayor evidencia en cuanto a la estimación del riesgo hemorrágico reside en la fase hospitalaria, donde se han desarrollado diversas escalas de riesgo con múltiples validaciones y comparaciones, de las cuales la CRUSADE parece la herramienta más útil. Para la estratificación del riesgo hemorrágico a medio-largo plazo tras el alta o tras la revascularización coronaria, han surgido recientemente diversas escalas de riesgo, como la PRECISE-DAPT (PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy), la PARIS (Patterns of Non-Adherence to Anti-Platelet Regimen in Stented Patients), la DAPT (Dual AntiPlatelet Therapy) o la TRILOGY-ACS (Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes). Todas ellas muestran aceptables capacidades predictivas, pero también importantes limitaciones que hacen que surja la necesidad de realizar validaciones comparativas que extiendan su utilidad a los pacientes tratados con los nuevos antiagregantes (ticagrelor y prasugrel) o con anticoagulantes orales, tanto antagonistas de la vitamina K como anticoagulantes de acción directa.
Palabras clave:
Los eventos hemorrágicos relacionados con los antitrombóticos en la enfermedad coronaria son la principal complicación extrínseca de la cardiopatía isquémica 1. Su importancia, en cuanto a incidencia e impacto pronóstico, alcanza su punto álgido en el síndrome coronario agudo (SCA). En estos pacientes, el éxito del tratamiento antitrombó- tico se basa en un buen equilibrio isquémico-hemorrágico.
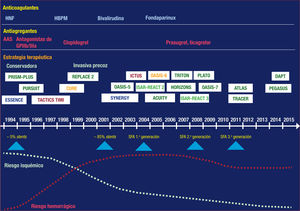
En las últimas 2 décadas, la tasa de eventos isquémicos asociados con el SCA se ha reducido llamativamente. La revascularización per-cutánea y la doble antiagregación, junto con el uso de fármacos antitrombóticos cada vez más potentes, han supuesto una reducción pro-gresiva de la tasa de reinfarto 2. Esto ha condicionado un aumento en la tasa de eventos hemorrágicos, que alcanzó su clímax a mediados de la década pasada, coincidiendo con la utilización generalizada de los inhibidores de la glucoproteína IIb/IIIa. Desde entonces, ha aumentado la conciencia del impacto pronóstico de los eventos hemorrágicos 3, que ha supuesto la disminución y la estabilización de la tasa de sangrado (figura 1). Sin embargo, con la generalización del uso de ticagrelor y prasugrel surge la necesidad de revaluar la estratificación del riesgo hemorrágico y, sobre todo, equilibrar el perfil isquémico-hemorrágico para seleccionar la mejor estrategia en cuanto a tipo y duración del tratamiento antitrombótico.
Diversos estudios han correlacionado los sangrados con la morta-lidad; su pronóstico se equipara al de los reinfartos. Esta cuestión se analizó inicialmente en la fase hospitalaria. Mehran et al. 4 demostraron que el riesgo de muerte a medio plazo de los pacientes sometidos a intervención coronaria percutánea (ICP) podría llegar a ser hasta el 50% más alto en aquellos con sangrados mayores en comparación con los que presentaban reinfarto, y el riesgo se incrementaba aún más en caso de que coincidieran ambos eventos. Recientemente se ha demostrado algo similar tras el alta, en la fase extrahospitalaria. Los pacientes que sufrieron eventos hemorrágicos mayores en el seguimiento tenían un pronóstico —en cuanto a mortalidad total— similar al de los pacientes con eventos isquémicos del tipo del reinfarto. Así, Valgimi-gli et al. 5 han demostrado recientemente que, en eventos hemorrágicos de gravedad > 3B del Bleeding Academic Research Consortium (BARC), el impacto pronóstico de los eventos hemorrágicos es mayor que el de los isquémicos.
En este sentido, conviene destacar la existencia de múltiples defi-niciones de sangrado, lo cual hace que la incidencia de eventos hemo-rrágicos en una misma serie pueda variar en función de la definición empleada. Actualmente la definición más aceptada es la procedente de la clasificación BARC 6 (figura 2).
Definición de sangrado según la escala BARC 6.
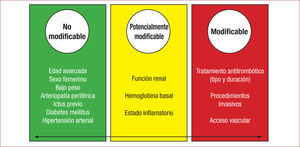
La prevención de las hemorragias es la base racional para la eva-luación del riesgo de sangrado. Para ello, se debe analizar en cada paciente una serie de factores relacionados intrínseca o extrínseca-mente (figura 3) con un mayor riesgo de sangrado 7.
Los factores de riesgo hemorrágico intrínsecos son los secundarios a las características de los pacientes. Algunos son invariables (edad, sexo femenino, diabetes, arteriopatía periférica, antecedentes de sangrado, ictus, etc.), por lo que hay poca capacidad de actuación sobre ellos a la hora de mitigar el riesgo de sangrado. Sin embargo, hay otros que sí son modificables (hipertensión, insuficiencia renal, estado inflamatorio…) y tienen un ligero margen de actuación para optimizar el riesgo hemorrágico 1.
Pero, sin duda, los factores de riesgo hemorrágico más relevantes para la prevención son los extrínsecos, con los que sí hay un notable margen de actuación. La elección de uno u otro fármaco antiagregante plaquetario, el tratamiento coadyuvante anadido, la protección gástrica o el abordaje radial o femoral son ejemplos de factores extrínsecos modificables 1.
Riesgo Hemorrágico Asociado con los Tratamientos AntitrombóticosLa estratificación de riesgo hemorrágico debe realizarse en el momento basal, pues será dicho riesgo el que condicione el tratamiento antitrombótico, y no al revés. Cuanto mayor sea la potencia de los fármacos antitrombóticos, mayor es la protección isquémica, pero también el riesgo hemorrágico, por lo que debe buscarse un equilibrio que condicione el mayor beneficio clínico para el paciente. Un aspecto que hay que tener en cuenta es la sobredosificación del tratamiento antitrombótico, directamente relacionada con la predisposición al sangrado. El registro CRUSADE 8 demostró que más del 42% de los pacientes con SCA sin elevación del segmento ST recibían al menos 1 fármaco antitrombótico por encima de las dosis recomendadas. Para minimizar este riesgo, se debería utilizar los antitrombóticos con perfil de eficacia y seguridad más favorable, acortar su duración y establecer las dosis más adecuadas ajustándolas a edad, peso corporal y función renal.
El ácido acetilsalicílico ha supuesto un aumento del riesgo hemorrágico, sobre todo gastrointestinal (un 40% de más riesgo por ano en com-paración con placebo; p < 0,01) 9, con un aumento absoluto del riesgo de sangrado entre el 0,8 y el 1,1% 10, aspecto que se contrapone al beneficio pronóstico en mortalidad. Dosis más altas de ácido acetilsalicílico (300325 mg/día) no aportan mayor beneficio y sí un ligero incremento de la tasa de hemorragias menores (el 5,0 frente al 4,4%; p = 0,04) 9.
El clopidogrel en combinación con ácido acetilsalicílico se asoció con un aumento de la tasa de hemorragia mayor según la definición del estudio CURE 1 (el 3,7 frente al 2,7%; p = 0,001), aunque sin incrementar el riesgo de sangrado mortal. La dosis de carga como pretrata-miento para los pacientes que van a someterse a ICP no supuso un incremento significativo de la tasa de sangrado mayor (el 1,4% con placebo y el 1,6% con clopidogrel; p = 0,69), pero sí de sangrado menor con clopidogrel en comparación con placebo en el seguimiento a largo plazo (el 2,1 frente al 3,5%; p = 0,03) 12. El estudio ARMYDA-6 13 no encontró diferencias entre las dosis de carga de 300 y de 600 mg de clopidogrel en cuanto al sangrado mayor según la definición de Thrombolysis In Myocardial Infarction (TIMI) (el 1,9% con la dosis alta y el 2,0% con la dosis baja). La dosis de carga de clopidogrel (600 mg) seguida de dosis más altas durante la primera semana (150 mg diarios durante 1 semana y 75 mg/día después) se asoció con una mayor tasa de hemorragia mayor TIMI (el 1,7 frente al 1,3%; p = 0,03), sin diferencias en mortalidad y eventos isquémicos 14.
El prasugrel ha mostrado una mayor potencia antitrombótica que el clopidogrel, pero con un aumento significativo del sangrado mayor TIMI no quirúrgico (el 2,4 frente al 1,8%; p = 0,03), incluida una mayor tasa de sangrado mortal 15. Estos datos, derivados del estudio TRITON-TIMI 15, permitieron identificar subgrupos de pacientes con un beneficio clínico no favorable, entendido como la combinación de muerte, eventos isquémicos y eventos hemorrágicos. Se trataba de los pacientes mayores de 75 anos, de peso < 60 kg y con ictus previo. Además, el pretratamiento con prasugrel entre los pacientes con infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) sometidos a ICP supuso un aumento de la tasa de sangrado mayor TIMI (el 1,3 frente al 0,5%; p = 0,003) 16, sin diferencias en el objetivo primario de eficacia antitrombótica. Entre los pacientes con SCA tratados de manera conservadora, el prasugrel más ácido acetilsalicílico comparado con clo-pidogrel más ácido acetilsalicílico supuso un aumento del riesgo de sangrado, sin diferencias en el objetivo primario de protección anti-trombótica 17.
El ticagrelor mostró una mejora en el objetivo combinado de muerte cardiovascular, infarto agudo de miocardio (IAM) e ictus en comparación con el clopidogrel (el 9,8 y el 11,7% respectivamente; p < 0,001), además de una notable reducción en la mortalidad (el 4,5 frente al 5,9%; p < 0,001), sin diferencias significativas en sangrados mayores según la definición del estudio (el 11,6 frente al 11,2%; p = 0,43) y sangrados mayores TIMI (el 7,9 frente a 7,7%; p = 0,57) 18. De todas formas, conviene aclarar que el ticagrelor sí mostró una mayor tasa de eventos hemorrágicos mayores no relacionados con la cirugía (el 4,5 frente al 3,8%; p = 0,03). Asimismo se demostró que el ticagrelor tiene beneficios en la reducción a largo plazo de las muertes cardiovasculares, el IAM y los ictus en pacientes con IAM previo tras un segui-miento de 3 anos, aunque con un aumento de las tasas de sangrado mayor TIMI, tanto con la dosis habitual (el 2,6 frente al 1,0%; p < 0,001) como con las dosis más bajas (el 2,3 frente al 1,0%; p < 0,001) 19.
En relación con los inhibidores de la glucoproteína IIb/IIIa, su evidencia en la era actual del ticagrelor y el prasugrel es pobre. Se demostró que reducen la tasa de muerte y reinfarto entre los pacientes con IAM sometidos a ICP, a costa de un aumento significativo del riesgo de sangrado, como se demostró en diferentes estudios como el ESPRIT 20 o el EARLY-ACS 21. Por ello, ahora sus indicaciones se restringen a los casos en que haya alta carga trombótica documentada en la coronariografía.
En los últimos anos se han probado otros fármacos. El cangrelor es un antagonista del receptor de la adenosina difosfato, intravenoso y con inicio y reversibilidad rápidos (vida media, aproximadamente 3-5 min), lo que lo convierte en una opción terapêutica atractiva para uso hospitalario en pacientes que no pueden tomar medicamentos orales o necesitan una inhibición plaquetaria periprocedimiento. El uso del cangrelor en el SCA se ha asociado con una reducción de eventos isquémicos y de mortalidad a las 48 h en comparación con el clo-pidogrel (el 4,7 y el 5,9% respectivamente; p = 0,005) 22. No hubo diferencias en la tasa de sangrado grave según la definición Global Utilization of Strategies To open Occluded arteries (GUSTO) (el 0,16 frente al 0,11%; p = 0,44). Sin embargo, en un análisis combinado de la serie de ensayos clínicos CHAMPION, sí hubo un aumento en el riesgo de hemorragia mayor según la definición Acute Catheterization and Urgent Intervention triage strategY (ACUITY) 23 (el 4,2 frente al 2,8%; p < 0,0001).
En cuanto al tratamiento anticoagulante, se demostró que el fondaparinux es el fármaco de elección para el tratamiento hospitala-rio del IAMSEST. En el estudio OASIS-5 24, que comparó fondaparinux 2,5 mg/24 h con enoxaparina 1 mg/kg/h, el primero cumplió el criterio de no inferioridad en cuanto a protección isquémica en el IAMSEST y aportó una reducción significativa de la incidencia de hemorragias mayores (el 2,2 frente al 4,1%; hazard ratio [HR] = 0,52; intervalo de confianza del 95% [IC95%], 0,44-0,61). En el IAM con elevación del segmento ST (IAMCEST), las heparinas son de elección, en especial la enoxaparina, con los datos del estudio SINERGY 25, que demostró que esta es superior a la heparina no fraccionada intravenosa en cuanto a reducción de reinfarto (riesgo relativo [RR] = 0,83; IC95%, 0,70-0,99), con tasas similares de sangrado (RR = 1,00; IC95%, 0,80-1,24). La biva-lirudina puede ser una alternativa a la combinación de heparina no fraccionada más inhibidores de la glucoproteína IIb/IIIa, frente a la cual la bivalirudina sola redujo tanto los eventos isquémicos como los hemorrágicos 26-28. Sin embargo, con la llegada de los nuevos antiagre-gantes y con el menor uso de los inhibidores de la glucoproteína IIb/ IIIa, la bivalirudina ha perdido potencia, debido a que su comparación con la heparina sódica sola no la ha demostrado superior. El estudio MATRIX 29, que comparó la bivalirudina y la heparina sódica con o sin inhibidores de la glucoproteína IIb/IIIa, demostró una reducción del sangrado mayor mortal y no mortal (el 2,3 frente al 3,7%; p = 0,04), aunque con tasas más altas de trombosis del stent.
En los últimos anos también ha aparecido evidencia sobre el uso de anticoagulantes anadidos a la doble antiagregación tras el alta por un SCA. En el estudio TRACER 30, en pacientes con SCACEST tratados con doble antiagregación, el vorapaxar en comparación con placebo disminuyó la tasa de muerte cardiovascular, IAM e ictus (HR = 0,89; IC95%, 0,81-0,98; p = 0,02), a costa de aumentar las tasas de sangrado moderado y grave (HR = 1,35; IC95%, 1,16-1,58; p < 0,001), así como aumentar marcadamente la tasa de hemorragia intracraneal (del 0,2 al 1,1%). En el estudio APPRAISE-II 31, el apixabán no mostró mayor pro-tección isquémica, con un aumento considerable del riesgo de sangrado mayor TIMI (HR = 2,59; IC95%, 1,50-4,46; p = 0,001), y en el estudio ATLAS ACS 2-TIMI 51 32, el rivaroxabán a dosis bajas sí mostró una reducción del objetivo primario de muerte cardiovascular, IAM e ictus, a costa de un aumento de la tasa de sangrado no mortal (el 2,1 frente al 0,6%; p < 0,001), incluidos los sangrados intracraneales (el 0,6 frente al 0,2%; p = 0,009).
Evaluación del Riesgo Hemorrágico HospitalarioEl riesgo de sangrado mayor hospitalario según las diferentes defi-niciones oscila entre el 2 y el 6%. El más predominante es el sangrado relacionado con el acceso vascular, seguido del sangrado digestivo 1. Predecirlo es importante, porque la mortalidad puede llegar a tripli-carse con los sangrados mayores 2. Hay una serie de factores de riesgo de sangrado hospitalario comunes a todos los estudios (edad avan-zada, sexo femenino, antecedente de sangrado, función renal y empleo de trombolíticos o inhibidores de la glucoproteína IIb/IIIa). Estos factores se han integrado en diferentes escalas para la predic-ción del sangrado, de las cuales las más difundidas son la CRUSADE Bleeding Risk Score8 y la ACUITY Bleeding Risk Score33. La primera incluye 8 variables (sexo, frecuencia cardiaca al ingreso, presión arterial sistólica al ingreso, signos de insuficiencia cardiaca, diabetes mellitus, arteriopatía periférica, hematocrito basal y creatinina sérica). Se ha demostrado una buena capacidad predictiva, con discri-minación y calibración aceptables. Aunque se desarrolló inicialmente para el SCASEST, también se demostró su capacidad predictiva en el SCACEST 34. La escala ACUITY incluye 7 variables: sexo, edad, tipo de SCA, anemia, uso de bivalirudina, leucocitos y creatinina sérica 33. Su capacidad predictiva también fue adecuada en términos de discrimi-nación y calibración. Se han comparado ambas escalas, con resultados muy similares, aunque la capacidad discriminativa de la CRUSADE resultó ligeramente superior 35,36.
Otra escala de riesgo también muy difundida es la Acute Coronary Treatment and Intervention Outcomes Network (ACTION) 37, que incluye 7 variables (sexo, edad, peso, presión arterial sistólica, frecuencia cardiaca, hemoglobina, creatinina, diabetes mellitus, arteriopatía periférica, anticoagulación oral previa y cambios electrocardiográficos), pero se demostró inferior a las escalas CRUSADE y ACUITY en la calibración 35,36.
Hay que destacar que estas escalas no se han validado específica-mente en pacientes tratados con ticagrelor o prasugrel, por lo que surge la necesidad de revaluar la predicción del riesgo hemorrágico hospitalario en los próximos anos según el abordaje actual del SCA, con predominio de la vía radial, baja tasa de uso de inhibidores de la glucoproteína IIb/IIIa, alta tasa de uso de fondaparinaux e insistencia en evitar la sobredosificación de antitrombóticos.
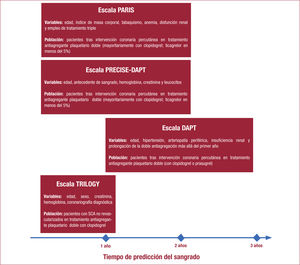
Evaluación del Riesgo Hemorrágico Tras el AltaHasta hace 2 o 3 anos, se había prestado escasa atención a los eventos hemorrágicos tras el alta. Sin embargo, desde 2015 han surgido numerosos estudios que insisten en su importancia pronóstica, así como en sus variables predictoras, como es el caso del proyecto Bleeding complications in a Multicenter registry of patients discharged with diagnosis of Acute Coronary Syndrome38 (BleeMACS), centrado en estudiar las complicaciones hemorrágicas tras un SCA. Las tasas de sangrado significativo que requiere ingreso hospitalario tras un SCA oscilan entre el 1 y el 4% y, a diferencia de los sangrados hospitalarios, en los que predomina el sangrado relacionado con el acceso vascular, entre los posteriores al alta predomina el sangrado digestivo. De los diferentes predictores de riesgo hemorrágico, el más consistente es la edad avanzada. Es interesante considerar el comportamiento de la edad en el equilibrio isquémico-hemorrágico tras un SCA. La edad es factor de riesgo de ambos eventos (reinfarto y sangrado en el segui-miento), aunque el valor predictivo de cada uno es diferente. Para el riesgo isquémico, hay un incremento gradual con la edad, especialmente a partir de los 75 anos. Sin embargo, para el riesgo hemorrágico, el comportamiento es en meseta hasta la séptima década, a partir de la cual el riesgo hemorrágico se incrementa exponencialmente 39. La predicción del riesgo hemorrágico a medio-largo plazo tras un SCA es clave a la hora de elegir el tratamiento antitrombótico tras el alta y la duración del régimen terapéutico antitrombótico. Entre las variables que predicen el sangrado tras el SCA, además de la edad, se han descrito tabaquismo, antecedente de sangrado, antecedente de cán-cer, insuficiencia cardiaca, diabetes mellitus, arteriopatía periférica, insuficiencia renal crónica o hemoglobina basal, entre otras. Las escalas clásicas, como CRUSADE 8, ACUITY 33 y ACTION 37, han mostrado escasa capacidad discriminativa para predecir eventos hemorrágicos tras el alta 40. Recientemente, han surgido modelos predictivos que trataban de equilibrar los riesgos isquémico y hemorrágico en el seguimiento, como es el caso de las escalas Patterns of Non-Adherence to Anti-Platelet Regimen in Stented Patients (PARIS) 41 y Dual AntiPlatelet Therapy (DAPT) 42. La escala PARIS se desarrolló para predecir eventos hemorrágicos e isquémicos durante 2 anos tras el alta; en su modelo hemorrágico incluye 6 variables: edad, índice de masa corporal, tabaquismo, anemia, disfunción renal y empleo de triple trata-miento (doble antiagregación más anticoagulación) al alta. Se estable-cían 3 categorías de riesgo hemorrágico: bajo, intermedio y moderado, que se enfrentaban con las 3 categorías de riesgo isquémico para esta-blecer el perfil de riesgo isquémico-hemorrágico del paciente 41. La escala DAPT establece también un modelo isquémico y otro hemorrá-gico, pero lo hace para pacientes entre los meses 12 y 30 tras el ICP. El modelo hemorrágico incluye 5 variables: edad, hipertensión, arterio-patía periférica, insuficiencia renal y prolongación de la doble antiagregación más allá del primer ano 42. Aunque ambas escalas (PARIS y DAPT) comparten una idea común (analizar el perfil isqué- mico-hemorrágico), tienen diferencias destacables: aunque las 2 surgen de registros de pacientes sometidos a ICP (con menos del 55% de pacientes con SCA), en la escala PARIS se analizan eventos justo desde el alta, lo que permite determinar el mejor tipo de tratamiento anti-trombótico adaptado a cada paciente, mientras que la DAPT tiene en cuenta los eventos desde el primer ano, lo que solo le permite considerar qué pacientes se beneficiarían de prolongar la doble antiagrega-ción más allá del primer ano.
Más recientemente ha surgido una nueva escala, la PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy (PRECISE-DAPT) 43, para facilitar la elección del tipo y la duración de la doble antiagregación no solo en cuanto a prolongar más allá del primer ano, sino también en cuanto a seleccionar pautas de tratamiento más cortas (3-6 meses). La escala PRECISE-DAPT estratifica el riesgo hemorrágico de los pacientes tratados con doble antiagregación según 5 variables: edad, antecedente de sangrado, hemoglobina, creatinina y leucocitos. En la cohorte de validación del estudio PLATO 18 para sangrado mayor TIMI, se ha mostrado superior al modelo PARIS, aunque no en la cohorte de deriva-ción del registro de Berna 44.
Finalmente, para pacientes con IAMSEST tratados sin ICP, se ha derivado recientemente una puntuación de riesgo hemorrágico pro-cedente del ensayo TRILOGY 45, con una aceptable capacidad predictiva. Esta escala se centra en la predicción del riesgo hemorrágico de los pacientes tratados de manera conservadora frente a los otros modelos (DAPT, PARIS y PRECISE-DAPT) 41-43, que se centran única-mente en pacientes sometidos a ICP (figura 4).
Para los próximos anos, queda pendiente aclarar varias cuestiones. No hay información sólida sobre la estimación del riesgo hemorrágico con los nuevos antiagregantes (ticagrelor y prasugrel), ya que las escalas PARIS 41 y PRECISE-DAPT 43 derivan de poblaciones en tratamiento solo con clopidogrel (aunque el PRECISE-DAPT se validó en pacientes con tratamiento antiagregante plaquetario doble con ticagrelor), y DAPT 42 y TRILOGY 45 no analizaron a pacientes con ticagrelor. Por otro lado, sería interesante generalizar los resultados de las escalas PRECISE-DAPT 43, PARIS 41 y DAPT 42 a poblaciones específicas, como es el caso de los pacientes de edad avanzada. Tampoco se dispone de comparaciones directas de la capacidad predictiva de todas estas escalas que permitan simplificar la estimación del riesgo hemorrágico en una única herramienta para todos los pacientes con cardiopatía isquémica.
Riesgo Hemorrágico del Paciente AncianoLa incidencia de infarto de miocardio es especialmente alta entre los pacientes ancianos. Estos, además, tienen mayor riesgo de eventos isquémicos y hemorrágicos. Por otro lado, los ancianos están claramente infrarrepresentados en los ensayos clínicos y en las series a partir de las cuales se derivaron las principales escalas de riesgo hemorrágico. Se ha descrito una peor capacidad predictiva de las escalas de riesgo hemorrágico en pacientes de edad avanzada. En una serie de 2.036 pacientes consecutivos con SCA 46, de los que 369 (18,1%) tenían 75 anos o más, se apreció un constante peor rendi-miento de las escalas CRUSADE 8, ACUITY 33 y ACTION 37 en los ancianos (CRUSADE: ancianos, área bajo la curva ROC [AUC] = 0,63; jóvenes, AUC = 0,81; p = 0,027; Mehran: ancianos, AUC = 0,67; jóvenes, AUC = 0,73; p = 0,340; ACTION: ancianos, AUC = 0,58; jóvenes, AUC = 0,75; p = 0,041). Una de las hipótesis generadas por este trabajo es que las variables frecuentemente vinculadas al envejecimiento (fragilidad, discapacidad, comorbilidades) podrían contribuir en parte a este peor rendimiento predictivo en pacientes de edad avanzada. En un trabajo posterior, Alonso-Salinas et al. 47 describieron un papel predictivo de la fragilidad independiente de la edad cronológica en pacientes ancianos con SCA. De la misma manera, un análisis de la cohorte BleeMACS 38 mostró un peor rendimiento de la escala BleeMACS para la predicción de eventos hemorrágicos significativos 1 ano tras el alta en pacientes de edad avanzada (datos aún no publicados). A pesar de la consistencia de estos datos, se necesitan más estudios destinados a clarificar el papel de la valoración geriátrica integral en la estratificación del riesgo hemorrágico del anciano con SCA.
Tratamiento TripleLa tasa media de sangrado de los pacientes con tratamiento triple (anticoagulación oral en combinación con doble antiagregación) oscila entre el 5 y el 15% 48. Aunque las guías de práctica clínica reco-miendan la escala HAS-BLED para la estratificación del riesgo hemorrágico en estos pacientes, su capacidad predictiva es subóptima 49. La proporción de pacientes con tratamiento triple en las escalas anteriormente descritas es baja, y hasta se ha excluido a estos pacientes de la PRECISE-DAPT o la DAPT. Recientemente se ha descrito la escala DAIGA 50, constituida por 5 variables, que podría ser de utilidad para predecir eventos hemorrágicos en pacientes con fibrilación auricular sometidos a ICP y dados de alta con tratamiento triple. Esta escala muestra una capacidad predictiva (en la población de desarrollo) superior a la de la HAS-BLED.
En los próximos anos posiblemente haya más información sobre la utilidad de las diferentes escalas de riesgo en pacientes tributarios de anticoagulación, con implicaciones clínicas si se tiene en cuenta que estudios como el WOEST 51 o el PIONEER 52 potencian evitar el tratamiento triple y favorecen la combinación de la anticoagulación oral con la antiagregación simple. También va a surgir la necesidad de estimar el riesgo hemorrágico no solo con los antagonistas de la vitamina K, sino con los anticoagulantes de acción directa en combinación con los diferentes antiagregantes.
ConclusionesLa estimación del riesgo hemorrágico es el principal factor limitante del tratamiento antitrombótico, ya que condiciona tanto el tipo como la duración. Existen diversos factores de riesgo hemorrágico hospitalario ampliamente conocidos y que se han integrado en escalas de riesgo, de las cuales la más precisa es la CRUSADE 8, cuya utili-dad ha quedado sobradamente contrastada en pacientes que reciben doble antiagregación con clopidogrel. Por otro lado, en los últimos 2 anos han surgido numerosos estudios que analizan los predictores de sangrado tras el alta por un SCA, y han aparecido escalas de riesgo como PARIS 41, PRECISE-DAPT 43, DAPT 42 o TRILOGY 45, cuya utilidad se debe valorar comparativamente. A pesar de ello, quedan cuestiones por aclarar, como el análisis de la capacidad predictiva de estas escalas en pacientes que reciben ticagrelor o prasugrel, los ancianos o los tributarios de anticoagulación oral. Dados la amplia gama de fárma-cos antitrombóticos disponibles y sus múltiples combinaciones posi-bles, surge la necesidad de mejorar la estratificación del riesgo hemorrágico y, sobre todo, su contraposición con el riesgo isquémico en la era actual.
Conflicto de InteresesNinguno.