La doble antiagregación plaquetaria con ácido acetilsalicílico y un inhibidor del receptor de ADP P2Y12 se considera actualmente el tratamiento de elección para los pacientes con un síndrome coronario agudo otras intervención coronaria percutánea e implante de stent coronario. A pesar de que las guías de práctica clínica recomiendan mantener la doble antiagregación 12 meses en la mayoría de las situaciones, prolongar más dicho tratamiento es actualmente un tema controvertido. Este artículo tiene como objetivo revisar la literatura disponible para discernir qué pacientes pueden beneficiarse de prolongar la doble antiagregación.
Palabras clave:
Se ha demostrado que el uso del tratamiento antiagregante pla-quetario doble (TAPD) con ácido acetilsalicilico (AAS) y un inhibidor del receptor de adenosina difosfato (ADP) P2Y12 disminuye los eventos cardiovasculares recurrentes en pacientes con sindrome coronario agudo o tras intervención coronaria percutánea (ICP) e implante de stent coronario 1-3. Sin embargo, este beneficio se contrapone a un mayor riesgo hemorrágico. A pesar que las guias de práctica clinica indican en la mayoria de los escenarios prolongar 12 meses la doble antiagregación, la duración óptima del TAPD sigue siendo objeto de debate 4-8. En este articulo se discute la evidencia actual sobre la duración del TAPD según las caracteristicas de los pacientes y se realiza una aproximación a las diferentes escalas de valoración para facilitar la decision de prolongar el TAPD o no.
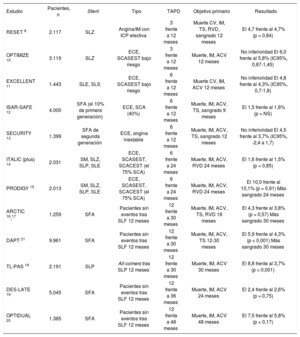
Existen pocos campos en la literatura cientifica que hayan publicado en los últimos anos tantos estudios aleatorizados como el de la duración del TAPD tras la ICP (tabla 1). Pese a compartir una hipótesis similar, existen muchas diferencias entre todos estos estudios en cuanto al tipo de pacientes incluidos (pacientes estables frente a pacientes con sindrome coronario agudo), el tiempo del TAPD (pautas cortas o largas), el tipo de stent implantado o la definición del objetivo principal.
Estúdios aleatorizados que comparan diferentes estrategias de duración del TAPD en pacientes sometidos a ICP e implante de stent
| Estudio | Pacientes, n | Stent | Tipo | TAPD | Objetivo primario | Resultado |
|---|---|---|---|---|---|---|
| RESET 9 | 2.117 | SLZ | Angina/IM con ICP electiva | 3 frente a 12 meses | Muerte CV, IM, TS, RVD, sangrado 12 meses | El 4,7 frente al 4,7% (p = 0,84) |
| OPTIMIZE 10 | 3.119 | SLZ | ECE, SCASEST bajo riesgo | 3 frente a 12 meses | Muerte, IM, ACV 12 meses | No inferioridad El 6,0 frente al 5,8% (IC95%, 0,87-1,45) |
| EXCELLENT 11 | 1.443 | SLE, SLS | ECE, SCASEST bajo riesgo | 6 frente a 12 meses | Muerte CV, IM, ACV 12 meses | No inferioridad El 4,8 frente al 4,3% (IC95%, 0,7-1,8) |
| ISAR-SAFE 12 | 4.000 | SFA (el 10% de primera generación) | ECE, SCA (40%) | 6 frente a 12 meses | Muerte, IM, ACV, TS, sangrado 9 meses | El 1,5 frente al 1,6% (p = NS) |
| SECURITY 13 | 1.399 | SFA de segunda generación | ECE, angina inestable | 6 frente a 12 meses | Muerte, IM, ACV, TS, sangrado 12 meses | No inferioridad El 4,5 frente al 3,7% (IC95%, -2,4 a 1,7) |
| ITALIC (plus) 14 | 2.031 | SM, SLZ, SLP, SLE | ECE, SCASEST, SCACEST (el 75% SCA) | 6 frente a 24 meses | Muerte, IM, ACV, RVD 24 meses | El 1,6 frente al 1,5% (p = 0,85) |
| PRODIGY 15 | 2.013 | SM, SLZ, SLP, SLE | ECE, SCASEST, SCACEST (el 75% SCA) | 6 frente a 24 meses | Muerte, IM, ACV, RVD 24 meses | El 10,0 frente al 10,1% (p = 0,91) Más sangrado 24 meses |
| ARCTIC 16,17 | 1.259 | SFA | Pacientes sin eventos tras SLF 12 meses | 12 frente a 30 meses | Muerte, IM, ACV, TS, RVD 18 meses | El 4,3 frente al 3,8% (p = 0,57) Más sangrado 30 meses |
| DAPT 21 | 9.961 | SFA | Pacientes sin eventos tras SLF 12 meses | 12 frente a 30 meses | Muerte, IM, ACV, TS 12-30 meses | El 5,9 frente al 4,3% (p < 0,001) Más sangrado 30 meses |
| TL-PAS 18 | 2.191 | SLP | All-comers tras SLP 12 meses | 12 frente a 30 meses | Muerte, IM, ACV 30 meses | El 8,8 frente al 3,7% (p < 0,001) |
| DES-LATE 19 | 5.045 | SFA | Pacientes sin eventos tras SLF 12 meses | 12 frente a 36 meses | Muerte, IM, ACV 24 meses | El 2,4 frente al 2,6% (p = 0,75) |
| OPTIDUAL 20 | 1.385 | SFA | Pacientes sin eventos tras SLF 12 meses | 12 frente a 48 meses | Muerte, IM, ACV 48 meses | El 7,5 frente al 5,8% (p = 0,17) |
ACV: accidente cerebrovascular; CV: cardiovascular; ECE: enfermedad coronaria estable; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IM: infarto de miocardio; RVD: revascularización del vaso diana; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stent farmacoactivo; SLE: stent liberador de everolimus; SLP: stent liberador de paclitaxel; SLS: stent liberador de sirolimus; SLZ: stent liberador de zotarolimus; SM: stent metálico; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis del stent.
De los estudios que evaluaron pautas cortas de doble antiagrega-ción, cabe destacar los siguientes:
El estudio RESET 9 comparó a 1.059 pacientes tratados con un stent farmacoactivo (SFA) de zotarolimus y 3 meses de TAPD con 1.058 pacientes tratados con otro SFA y 12 meses de TAPD. La incidencia esperada del objetivo primario de muerte cardiovascular, infarto de miocardio (IAM), trombosis del stent, revascularización del vaso diana o sangrado era del 10,5%, pero la tasa de eventos ocurrió en el 4,7% en ambos grupos (p = 0,84).
El estudio OPTIMIZE 10 valoró la no inferioridad de 3 meses de TAPD frente a 12 meses tras implante de SFA en pacientes con enfermedad coronaria estable o síndrome coronario agudo de bajo riesgo. El estudio mostró la no inferioridad para el objetivo primario de muerte, IAM o accidente cerebrovascular a 12 meses de la pauta corta en com-paración con la larga (el 6,0 frente al 5,8%; p = 0,002).
En el estudio EXCELLENT 11, se aleatorizó a 1.443 pacientes con bajo riesgo a 6 o 12 meses de TAPD. Este estudio, disenado como de no inferioridad, mostró una tasa de eventos (muerte cardiovascular, IAM o accidente cerebrovascular a 12 meses) similar (el 4,8% a 6 meses; el 4,3% a 12 meses; p = 0,001 para no inferioridad).
El estudio ISAR-SAFE 12 comparò el tratamiento de TAPD de 6 meses con el de 12 en pacientes tras implante de SFA de segunda generación. El estudio se detuvo prematuramente dado el bajo número de eventos, a pesar de lo cual demostró la no inferioridad de la pauta corta (el 1,5 frente al 1,6%; p < 0,001).
El estudio SECURITY 13 se interrumpió prematuramente tras incluir a 1.399 pacientes tras implante de SFA de segunda generación por enfermedad estable o angina inestable. El ensayo demostró la hipóte-sis de no inferioridad de 6 frente a 12 meses para el objetivo combinado de muerte, IAM, accidente cerebrovascular, trombosis del stent o sangrado a 12 meses (el 4,5 frente al 3,7%; p < 0,05). Se observaron resultados similares en el estudio ITALIC 14, realizado en 2.031 pacientes, con una estrategia de 6 frente a 24 meses de TAPD.
Por último, el estudio PRODIGY 15 incorporó un diseno factorial para aleatorizar a 2.013 pacientes a recibir TAPD durante 6 o 24 meses tras implante de stent metálico (SM) o SFA de paclitaxel, everolimus o zotarolimus. Los investigadores no encontraron diferencias en el evento combinado de muerte, IAM, accidente cerebrovascular o revascularización del vaso diana (el 10,0 y el 10,1% respectivamente; p = 0,91), pero con mayor incidencia de sangrado mayor.
Otros estudios se centraron en pautas de TAPD más largas. Asi, el ensayo ARCTIC INTERRUPTION 17 se disenó para demostrar la superio-ridad de una pauta larga (30 meses) frente a otra corta (12 meses) tras implante de SFA. No se observó beneficio en cuanto a la reducción de eventos isquémicos (el 4,3 y el 3,8% respectivamente; p = 0,57), con mayor incidencia de sangrado en el grupo de larga duración. Sin embargo, en el estudio TL-PAS 18, que incluyó a pacientes tras implante de SFA de paclitaxel de primera generación, hubo diferencias significativas en la tasa de eventos isquémicos (muerte, IAM, accidente cerebrovascular) entre la estrategia de TAPD de 12 meses (8,8%) y la de 30 meses (3,7%). Los estudios DES-LATE 19 y OPTIDUAL 20 evaluaron pautas de TAPD de 36 y 48 meses respectivamente. Ninguno mostró diferencias significativas en cuanto al objetivo primario de muerte, IAM o accidente cerebrovascular en pacientes sin eventos los primeros 12 meses tras implante de un SFA.
Mención especial merece el estudio DAPT 21 por el elevado número de pacientes incluidos. Se trata de un ensayo multicéntrico y a doble ciego que aleatorizó a 9.961 pacientes sin eventos 12 meses tras el implante de SFA (el 60% de nueva generación) a prolongar hasta 30 meses el TAPD (fundamentalmente con clopidogrel, aunque el 34% estaba con prasugrel). La prolongación del TAPD se tradujo en una dis-minución del evento combinado de muerte, IAM, accidente cerebro-vascular o trombosis del stent (el 5,9% a los 12 meses frente al 4,3% a los 30 meses; p < 0,001). Por el contrario, los pacientes con la pauta larga presentaron mayor incidencia de sangrado grave (el 1,6% a los 12 meses frente al 2,5% a los 30 meses; p = 0,001). Es interesante notar que el tratamiento de 30 meses se asoció con un incremento de la mortalidad: el 2,0 frente al 1,5% (hazard ratio [HR] = 1,36; intervalo de confianza del 95% [IC95%], 1,00-1,85; p = 0,05). Los autores, mediante un análisis exploratorio post hoc, justifican estos resultados por la inci-dencia de muertes por cáncer, más frecuentes en el grupo de TAPD de larga duración. De hecho, excluyendo a estos pacientes, no se observa-ron diferencias en la mortalidad. En cuanto a la mortalidad por causas traumáticas, en su mayoria se relacionaron con eventos de sangrado.
Otro de los mensajes que se puede extraer del estudio DAPT 22 es qué incidencia de eventos sucede tras la interrupción del segundo an-tiagregante. Asi, la interrupción de la tienopiridina tras 12 o 30 meses de TAPD se asoció con un incremento precoz del riesgo de infarto de miocardio, principalmente no relacionado con la trombosis del stent.
Doble antiagregación tras infarto de miocardioLa activación plaquetaria no sucede ùnicamente tras la ICP, sino que forma parte del proceso de aterotrombosis. De hecho, los pacientes con un evento coronario reciente tienen riesgo alto de sufrir episo-dios isquémicos recurrentes, con independencia de la arteria previamente afectada, lo que parece estar relacionado con una progresión de la enfermedad ateroesclerótica 23,24. Varios estudios han demostrado la capacidad del TAPD en la reducción de IAM recurrente el ano siguiente a un sindrome coronario agudo, lo cual queda reflejado en las actuales guias de práctica clinica 1-6. Sin embargo, los datos del estudio CHARISMA 25, que incluyó a pacientes con riesgo cardiovascular con o sin enfermedad cardiovascular establecida, no respal-dan la prolongación del TAPD con AAS y clopidogrel más de 1 ano, aunque en un estudio post hoc se observó beneficio en los pacientes con el antecedente de IAM.
El estudio PEGASUS-TIMI 54 26 es un ensayo clinico multicéntrico y a doble ciego que aleatorizó a 21.162 pacientes con IAM previo (entre 1 y 3 anos después del evento) y 1 factor de riesgo adicional (edad > 65 anos, diabetes mellitus, IAM recurrente, enfermedad multivaso o aclaramiento de creatinina < 60 ml/min) a recibir ticagrelor 90 mg/12 h, ticagrelor 60 mg/12 h o placebo. Todos los pacientes recibieron dosis bajas de AAS (75-150 mg/dia). Tras una mediana de seguimiento de 33 meses, los 2 grupos de tratamiento con ticagrelor mostraron una reducción del objetivo primario, la incidencia del evento combinado de muerte cardiovascular, IAM o ictus: el 7,85% del grupo de ticagrelor 90 mg/12 h, el 7,77% del de ticagrelor 60 mg/12 h y el 9,04% del de placebo (90 mg frente a placebo: HR = 0,85; IC95%, 0,75-0,96; p = 0,008; 60 mg frente a placebo: HR = 0,84; IC95%, 0,74-0,95; p = 0,004). El sangrado mayor fue más frecuente en los pacientes tratados con ticagrelor que con placebo (el 2,60% con 90 mg, el 2,30% con 60 mg y el 1,06% con placebo; p < 0,001 en ambas comparaciones), pero no hubo diferencias en los sangrados mortales o la incidencia de hemorragia intracraneal. Aunque los resultados fueron sólidos en todos los subgrupos evaluados, la mayor reducción en la incidencia de eventos isquémicos se observó en los pacientes con TAPD a los que el inhibidor del receptor de ADP P2Y12 no se interrumpió o la interrup-ción fue < 30 dias (reducción absoluta, 1,9-2,5%). No se observaron beneficios en los pacientes cuyo TAPD se interrumpió más de 1 ano antes de la inclusión en el estudio 27. Recientemente se ha comunicado en el Congreso Europeo de Cardiologia un subanálisis de este estudio, en el que se demuestra la eficacia y la seguridad de la «estrategia Pegasus» en la subpoblación para la que la guia europea recomienda este tratamiento 8,28.
Metanálisis de los principales estudiosHay varios metanálisis publicados acerca de los resultados de todos los estudios previamente descritos. Merece la pena destacar los siguientes:
En el estudio de Elmariah et al. 29 se investigó el inesperado incremento de la mortalidad del estudio DAPT. Tras incluir 14 ensayos cli-nicos que aleatorizaron a 69.644 pacientes a pautas cortas frente a largas (varios intervalos de TAPD, diferentes tipos de stent, distinta presentación clinica, etc.), se observó que continuar el TAPD en com-paración con pautas cortas no se asoció con diferencias estadistica-mente significativas en cuanto a la mortalidad por cualquier causa (HR = 1,05; IC95%, 0,96-1,19; p = 0,33) y muerte cardiovascular (HR = 1,01; IC95%, 0,93-1,12; p = 0,81) o no cardiovascular (HR = 1,04; IC95%, 0,90-1,26; p = 0,66).
Dado que la razón riesgo-beneficio de prolongar el TAPD puede ser especifica de la enfermedad, Palmerini et al. disenaron un metanálisis para homogeneizar los resultados de 10 ensayos clinicos (con un total de 31.666 pacientes) y limitarlos a una población con enfermedad arterial coronaria e implante de SFA similar a la del estudio DAPT 30. Las tasas de mortalidad fueron menores en el grupo de TAPD de corta duración (HR = 0,82; IC95%, 0,69-0,98; p = 0,02) a costa de la mortalidad no cardiovascular. Además, las pautas de corta duración se aso-ciaron con menos riesgo de sangrado mayor, pero con mayor riesgo de IAM y trombosis del stent. En el metanálisis de Gustino et al. se observaron resultados similares, aunque aqui las diferencias en la mortali-dad no llegaron a la significación estadistica 31.
Por último, el metanálisis de Udell et al. 32 analizó los resultados de prolongar el TAPD en pacientes con IAM previo. Con un total de 33.435 pacientes y una mediana de seguimiento de 31 meses, comparada con el tratamiento con AAS en monoterapia, la continuación del TAPD se asoció con una reducción de eventos cardiovasculares (el 6,4 frente al 7,5%; RR = 0,78; IC95%, 0,67-0,90; p = 0,001), sin incremento en la mortalidad por cualquier causa (RR = 0,91; IC95%, 0,83-1,03; p = 0,13) o de causa cardiovascular (RR = 1,03; IC95%, 0,86-1,23; p = 0,76). Si que se puso de manifiesto un aumento en el riesgo de sangrado mayor con las pautas largas (RR = 1,73; IC95%, 1,19-2,50; p = 0,004), pero no de sangrado mortal (RR = 0,91; IC95%, 0,53-1,58; p = 0,75).
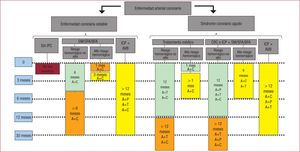
Estratificación del RiesgoLas actuales guias de práctica clinica afirman que, en la mayoria de los escenarios clinicos posibles, se recomienda prolongar el TAPD durante 12 meses 4-7. Sin embargo, resulta más controvertido prolongar el TAPD más de 1 ano, y se debe enfatizar la necesidad de una cuidadosa evaluación del riesgo isquémico y hemorrágico (figura 1). De ahi que recientemente se hayan desarrollado diferentes escalas para decidir qué pacientes se benefician de prolongar el TAPD 33-36.
Algoritmo recomendado por el Grupo de Trombosis Cardiovascular de la Sociedad Española de Cardiología 7,8. Los colores indican el nivel de evidencia (verde: clase I; amarillo: clase IIa; naranja: clase IIb; rojo: clase III). A: ácido acetilsalicílico*; AVB: armazón vascular bioabsorbible; BFA: balón farmacoactivo; C: clopidogrel*; CRC: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; P: prasugrel*; SFA: stent farmacoactivo; SM: stent metálico; T: ticagrelor*.
*Para más información sobre indicaciones y duraciones de tratamiento aprobadas, consulte las fichas técnicas de los fármacos mencionados.
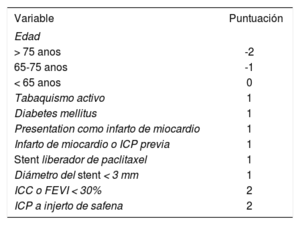
Derivada de los 11.648 pacientes aleatorizados en el estudio DAPT, se desarrolló una herramienta predictiva en función del riesgo isqué- mico y hemorrágico en los 12-30 meses siguientes a la ICP, validada externamente entre los 8.136 pacientes del estudio PROTECT 33,34. La escala DAPT incluye 6 variables clinicas (edad, tabaquismo activo, diabetes mellitus, presentación como IAM, insuficiencia cardiaca o frac-ción de eyección del ventriculo izquierdo < 30% y antecedentes de IAM o ICP) y 3 relacionadas con el procedimiento (diámetro del stent < 3 mm, uso de SFA de paclitaxel e ICP a injerto de safena) y les asigna una puntuación diferente a cada una de ellas (tabla 2). Entre los pacientes con puntuación > 2, continuar con TAPD se asoció significativamente a una reducción de eventos isquémicos, mientras que una puntuación < 2 penaliza los eventos de sangrado. Asi, la escala DAPT puede identificar a los pacientes cuyo riesgo isquémico supere al hemorrágico y viceversa: una puntuación DAPT baja (< 2) tiene un número de pacientes que es necesario tratar (NNT) de 153 para preve-nir isquemia y un número de pacientes expuestos necesario para que se produzca un evento (NNH) de sangrado de 64; una puntuación DAPT alta (> 2) tiene un NNT = 34 para prevenir isquemia y un NNH de sangrado = 272. El estadistico C de esta escala fue 0,70 para predecir isquemia y 0,60 para predecir hemorragia; en la cohorte de validación externa alcanzó un 0,64 para ambas.
Escala DAPT para predecir la duración del TAPD según los riesgos isquémico y hemorrágico
| Variable | Puntuación |
|---|---|
| Edad | |
| > 75 anos | -2 |
| 65-75 anos | -1 |
| < 65 anos | 0 |
| Tabaquismo activo | 1 |
| Diabetes mellitus | 1 |
| Presentation como infarto de miocardio | 1 |
| Infarto de miocardio o ICP previa | 1 |
| Stent liberador de paclitaxel | 1 |
| Diámetro del stent < 3 mm | 1 |
| ICC o FEVI < 30% | 2 |
| ICP a injerto de safena | 2 |
FEVI: fracción de eyección del ventrículo izquierdo; ICC: insuficiencia cardiaca congestiva; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble.
Una de las principales ventajas de la escala DAPT es la valoración en la misma escala del riesgo isquémico y hemorrágico. Sin embargo, y a pesar del entusiasmo inicial, la escala DAPT presenta un importante número de limitaciones, secundarias en su mayoria al diseno del estudio raiz, que condicionan la utilización de esta herramienta en la práctica diaria. En primer lugar, los pacientes incluidos no habian sufrido eventos isquémicos durante los primeros 12 meses tras el episodio que habia llevado al TAPD. Además, la mayoria de los pacientes utilizaron clopidogrel como inhibidor del receptor P2Y12, un tercio prasugrel y ninguno ticagrelor. Se trató con SFA de primera generación hasta el 40% de los pacientes y la indicación por sindrome coronario agudo fue menos de la mitad.
Utilizando los datos de 4.190 pacientes sometidos a ICP e implante de SFA del registro PARIS, se han desarrollado 2 escalas de riesgo para predecir por separado la incidencia de eventos isquémico o hemorrá- gico 35. Aunque el estadistico C muestra una discriminación moderada (C = 0,65 para isquemia y C = 0,64 para sangrado mayor), se trata de un escala sencilla de aplicar, puesto que las variables de ambos modelos son todas clinicas (sindrome coronario agudo, revascularización previa con ICP o cirugia, diabetes mellitus, insuficiencia renal y taba-quismo activo para el riesgo isquémico; edad, indice de masa corporal, tratamiento antitrombótico triple al alta hospitalaria, anemia, tabaquismo activo e insuficiencia renal para el riesgo hemorrágico).
Por último, y a partir de los datos de varios ensayos multicéntricos en 14.963 pacientes sometidos a ICP y tratados con AAS y clopidogrel, se ha desarrollado la escala PRECISE-DAPT, una sencilla escala para predecir el riesgo hemorrágico a 1 ano a través de 5 variables clinicas (edad, antecedentes de sangrado espontáneo, hemoglobina, recuento leucocitario y aclaramiento de creatinina) 36. Según la escala PRECISE-DAPT, prolongar la duración para los pacientes con puntuación > 25 incrementa significativamente el riesgo hemorrágico, lo cual ayuda a decidir la duración del TAPD. Su cálculo, a diferencia de las escalas previas, exige una calculadora o aplicación informática.
Perspectivas FuturasA pesar de la evidencia disponible actualmente, todavia quedan preguntas pendientes acerca de la duración óptima del TAPD. En primer lugar, se desconoce la eficacia de la monoterapia con un nuevo antagonista del receptor P2Y12 comparado con el TAPD. El estudio GLOBAL LEADERS (NCT 01813435) aleatorizará a aproximadamente 16.000 pacientes (estables o con un sindrome coronario agudo some-tidos a ICP e implante de SFA de biolimus con polimero biodegradable) a recibir AAS y ticagrelor durante 1 mes seguido de 23 meses con ticagrelor en monoterapia, frente a una estrategia clásica de 12 meses con TAPD (AAS y ticagrelor en pacientes con sindrome coronario agudo; AAS y clopidogrel en caso de angina estable), seguido de otros 12 meses con AAS en monoterapia 37.
También está por aclarar el papel de la duración del TAPD en los pacientes con alto riesgo hemorrágico. Asi, en el estudio LEADERS-FREE 38 se aleatorizó a 2.466 pacientes con alto riesgo hemorrágico sometidos a ICP e implante de SFA de biolimus libre de polimero frente a SM. Se incluyó a pacientes con enfermedad coronaria en todas sus formas de presentación (angina estable e inestable e IAM) y se realizó un seguimiento clinico a 1 ano, pautando TAPD durante 1 mes, con clopidogrel como segundo antiagregante en su mayoria, y después monoterapia con AAS, manteniendo la anticoagulación cuando estaba indicada. Los pacientes con SFA de biolimus sin polimero tuvieron un mejor perfil de seguridad que los de SM, a expensas de una mayor incidencia de IAM, sin diferencias significativas en la tasa de trombosis del stent.
Otro aspecto que genera incertidumbre es la duración óptima del TAPD en pacientes a los que se implantan armazones vasculares bio-absorbibles, pues algunos trabajos relacionan estos dispositivos con un potencial trombogénico mayor que el de los demás SFA 39. Por ùltimo, es de esperar el desarrollo de futuras escalas de riesgo que incluyan a pacientes en tratamiento con ticagrelor que ayuden a la toma de decisiones en la práctica clinica. (Para más información sobre indicaciones y duraciones de tratamiento aprobadas, consulte las fichas técnicas de los fármacos mencionados).
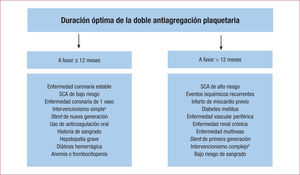
ConclusionesA pesar del gran número de estudios realizados en los últimos anos, la duración óptima del TAPD sigue siendo un tema controvertido. La mayoria de los estudios incluyeron a pacientes en bajo riesgo, con una tasa de eventos baja y un pequeno tamano muestral, en los que se observó mayor «penalización» para los pacientes con SFA de primera generación. Para adecuar la duración del TAPD a cada paciente con mayor precisión, será necesario individualizar tanto como sea posible los riesgos isquémico y hemorrágico en función de variables clinicas y de procedimiento (figura 2). Aunque existen diferentes escalas que pueden ayudar a decidir si prolongar o no el TAPD, hay que tener en cuenta sus limitaciones de aplicabilidad a la práctica clinica.
Recomendaciones para la valoración de los riesgos isquémico y hemorrágico para decidir la duración óptima del tratamiento antiagregante doble; SCA: síndrome coronario agudo.
aIntervencionismo simple: lesión única, stent corto, poco calcio, etc.
bIntervencionismo complejo: varios stents, en bifurcaciones, solapamiento en el implante, pequeño tamaño del vaso tratado, etc.
D. Vivas ha recibido honorarios por ponencias de Bayer, BMS-Pfizer, Daiichi-Sankyo y AstraZeneca. I. Roldan ha recibido honorarios por ponencias de Bayer, BMS-Pfizer, Daiichi-Sankyo y AstraZeneca.