El objetivo de este artículo es analizar la influencia de la variabilidad de respuesta al clopidogrel en los resultados del intervencionismo coronario y discutir las posibles alternativas terapéuticas actuales. El clopidogrel presenta una gran variabilidad del efecto antiagregante, que está limitado por interacciones con fármacos y por polimorfismos genéticos que afectan a su biodisponibilidad. Las técnicas de función plaquetaria podrían establecer en un futuro los niveles de inhibición de la agregación óptimos, pero todavía no hay estudios que avalen su uso. El prasugrel y el ticagrelor no se ven limitados por este problema y reducen de forma significativa las complicaciones trombóticas e incluso la mortalidad en pacientes con síndrome coronario agudo. Las formas de administración menos prolongadas y locales de los inhibidores de la glucoproteína IIb/IIIa reducen el riesgo de hemorragia y presentan un efecto antitrombótico similar.
Palabras clave
Agencia Española de Medicamentos y Productos Sanitarios.
sistema del citocromo P450.
inhibidores de la bomba de protones.
síndrome coronario agudo.
síndrome coronario agudo con elevación del segmento ST.
síndrome coronario agudo sin elevación del segmento ST.
El objetivo de este artículo es analizar la influencia de la variabilidad de respuesta al clopidogrel en los resultados del intervencionismo coronario y discutir las posibles alternativas terapéuticas actuales.
REDUCCIÓN DEL EFECTO ANTIAGREGANTE DEL CLOPIDOGRELVariabilidad del efecto antiagregante del clopidogrelLa reciente nota informativa de la AEMPS sobre el clopidogrel1 ha alertado sobre la posible reducción del efecto antiagregante de este fármaco. Al contrario que la aspirina, que presenta una nítida discriminación entre pacientes «respondedores» y «no respondedores», el clopidogrel tiene un efecto antiagregante muy variable y con una amplia distribución2.
El clopidogrel es una tienopiridina que inhibe el receptor P2Y12 del ADP y requiere bioactivación hepática en su metabolito activo (R130964) por medio del CYP. La respuesta del clopidogrel es pobre: sólo un 15% del profármaco absorbido se transforma en el metabolito activo. Los polimorfismos genéticos de las isoenzimas del CYP y otros fármacos que son metabolizados por la misma vía pueden afectar a la biodisponibilidad del metabolito activo. En concreto, el CYP2C19, que genera el 20% del metabolito activo, presenta una variante (CYP2C19*2) que afecta al 95% de los pacientes con disminución de la función del CYP2C193. La inhibición competitiva del CYP2C19 por otros fármacos, como los inhibidores de la bomba de protones (IBP), también puede reducir la capacidad antiagregante del clopidogrel. Sin embargo, las Guías de Práctica Clínica4 recomiendan tratamiento profiláctico con IBP en pacientes con tratamiento antiagregante que presentan riesgo de hemorragia gastrointestinal. Es indispensable, pues, determinar con exactitud la traducción clínica de los datos experimentales descritos porque los pacientes con una falta de inhibición de la agregación plaquetaria tienen un riesgo elevado de complicaciones trombóticas a corto plazo5.
Inhibición competitiva del CYP2C19 por otros fármacosLos pacientes que toman clopidogrel y un IBP presentan una reducción del 45% de la concentración del metabolito activo y una reducción del 47% del efecto antiagregante6. Estas reducciones se producen también si se administran los fármacos con un intervalo de 12 h.
La AEMPS publicó el 27 de abril de 2010 una nota informativa basada en los datos analizados por las agencias europeas de medicamentos7,8 (tabla 1). Esta nota confirma la existencia de una interacción entre clopidogrel y omeprazol o esomeprazol. No existen suficientes datos para hacer extensiva esta precaución al resto de los IBP porque no se ha hallado una diferencia significativa cuando se asocian otros IBP diferentes de omeprazol6,9,10.
Interacción de clopidogrel con los inhibidores de la bomba de protones: actualización de la información y recomendaciones de uso1,7,8
| En pacientes en tratamiento con clopidogrel se desaconseja el uso concomitante de omeprazol o esomeprazol, excepto que se considere estrictamente necesario. En este caso no se recomienda espaciar la administración de ambos medicamentos, ya que no previene la interacción entre clopidogrel y omeprazol o esomeprazol |
| Estas recomendaciones no se aplican actualmente a los demás IBP ya que, aunque no puede descartarse completamente esta interacción, la evidencia disponible no respalda esta precaución. En cualquier caso, se recomienda valorar individualmente la necesidad del tratamiento con IBP en pacientes tratados con clopidogrel y los beneficios esperados de ello respecto a sus posibles riesgos |
| Se desaconseja el uso concomitante de clopidogrel y otros inhibidores de CYP2C19 diferentes de omeprazol o esomeprazol, como fluvoxamina, fluoxetina, moclobemida, voriconazol, fluconazol, ticlopidina, ciprofloxacino, cimetidina, carbamazepina, oxcarbazepina y cloramfenicol, excepto que se considere estrictamente necesario |
La repercusión clínica de la interacción es dudosa. La nota informativa cita un estudio retrospectivo que muestra un incremento de los «eventos cardiovasculares adversos» en pacientes tratados con clopidogrel e IBP11; sin embargo, se trata de un estudio muy pequeño en pacientes con stent recubierto, en el que se compara a 62 pacientes con IBP contra 117 sin protectores gástricos y 35 con inhibidores del receptor H2. Además, los eventos cardiovasculares adversos consistían en un objetivo compuesto de reestenosis del stent, desarrollo de lesiones nuevas e infarto agudo de miocardio. El objetivo compuesto se cumplió en 22 de los pacientes con IBP (35%), 25 de los pacientes sin tratamiento protector (22%) y en 9 de los pacientes con inhibidor H2 (26%) (p < 0,05). Se sabe que el clopidogrel no influye en la reestenosis del stent ni en el desarrollo de lesiones nuevas, por lo que la validez de la comparación es nula. La diferencia en la presentación de infarto agudo de miocardio en este reducido número de pacientes (el 4,8, 0 y el 2,8%) no es significativa. Por otro lado, se han citado con frecuencia dos estudios retrospectivos que relacionan el uso de IBP asociado a clopidogrel con una mayor incidencia de eventos adversos12,13.
En el estudio de Ho et al12, los pacientes dados de alta tras un SCA con la asociación IBP+clopidogrel presentaron más mortalidad y rehospitalización que los que no siguieron tratamiento con IBP. Sin embargo, hay que decir que los pacientes en tratamiento con IBP tenían mayor morbilidad (mayor edad, diabetes mellitus, infarto previo, cirugía cardiaca previa, insuficiencia cardiaca, enfermedad arterial periférica, cáncer, enfermedad renal crónica, enfermedad pulmonar obstructiva crónica y enfermedad hepática) que los no tratados. Además, sólo un 60% de los pacientes con IBP recibieron un inhibidor del CYP2C19 como el omeprazol, aunque se encontró una relación entre el uso de este y la aparición de eventos adversos.
En el estudio de Juurlink et al13, se estudió la incidencia de reinfarto en 13.636 pacientes dados de alta tras un infarto agudo de miocardio, y se comparó a 734 pacientes reingresados por infarto con 2.054 controles ajustados por edad, revascularización realizada y riesgo cardiovascular. Tras realizar un análisis multivariable, los pacientes con IBP presentaron más riesgo de reinfarto (odds ratio [OR] = 1,27; intervalo de confianza [IC] del 95%, 1,03-1,57), algo que no les sucedió a los pacientes con pantoprazol (OR = 1,02; IC del 95%, 0,7-1,47), un fármaco que no inhibe el CYP2C19. La crítica a estos resultados se basa en que los pacientes con reinfarto presentaban con más frecuencia diabetes mellitus complicada, insuficiencia renal e insuficiencia cardiaca y, por otro lado, recibían menos tratamiento de prevención de reinfarto con estatinas, bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina.
También hay evidencias contrarias a que esta interacción tenga repercusión clínica significativa. En el estudio TRITON-TIMI 3814, se incluyó a 16.608 pacientes con SCA asignados a prasugrel (n = 6.813) o clopidogrel (n = 6.795); el objetivo primario compuesto fue muerte, infarto y accidente cerebrovascular. Un 33% (n = 4.529) de los pacientes seguía tratamiento con un IBP en el momento de la distribución aleatoria. No se encontró una relación entre la consecución del objetivo primario y el tratamiento con IBP asociado a clopidogrel ni a prasugrel. Los autores concluyen que no existe contraindicación para el uso de IBP con clopidogrel o prasugrel14.
El estudio COGENT15 se diseñó para resolver esta cuestión. Los objetivos fueron: a) analizar si el tratamiento con omeprazol 20 mg comparado con placebo reducía significativamente las complicaciones gastrointestinales en pacientes con aspirina más clopidogrel, y b) determinar si existe alguna interacción clínica entre el clopidogrel y el omeprazol. Tras seguir a 3.267 pacientes durante 1 año, no se apreciaron diferencias en el objetivo compuesto de muerte cardiovascular, infarto no fatal, revascularización o accidente cerebrovascular entre los dos grupos (OR = 1,02; IC del 95%, 0,7-1,51). Tampoco hubo más infartos ni revascularizaciones en el grupo con omeprazol. Como era de esperar, sí que se produjeron más complicaciones gastrointestinales en el grupo tratado con placebo (OR = 0,55; IC del 95%, 0,36-0,85; p = 0,007). La traducción clínica de esta interacción es, pues, dudosa. Los estudios clínicos son retrospectivos y con poblaciones no comparables. La nota concluye que: «Hasta la fecha no se dispone de ensayos clínicos controlados, diseñados para evaluar si existe un incremento en la morbimortalidad cardiovascular relacionada con esta interacción», pero recomienda evitar la asociación omeprazol+clopidogrel hasta disponer de datos fiables.
Polimorfismos genéticos que reducen el efecto del clopidogrelLa Food and Drug Administration de Estados Unidos también emitió una nota informativa similar a la de la AEMPS sobre la interacción entre omeprazol y clopidogrel desaconsejando el uso combinado de estos fármacos, pero ha insistido mucho más en la variabilidad genética que afecta al metabolismo del clopidogrel16-18. Este interés se ha traducido en dos avisos sobre la seguridad de la administración de clopidogrel a pacientes con el polimorfismo CYP2C19*2. Los avisos concluyen que los médicos deben saber que existen tests genéticos que identifican a los pacientes con este polimorfismo y que deben considerar otros fármacos antiagregantes u otras estrategias de dosis en pacientes identificados como «poco respondedores a clopidogrel». Y es que los homocigotos CYP2C19*2 presentan una disminución del metabolito activo del clopidogrel, de su biodisponibilidad y de su efecto antiagregante y podrían presentar peor evolución clínica19.
Los sujetos con la variación CYP2C19*2 (homocigotos y heterocigotos) varían de un 19 a un 50% según las razas, mientras que los otros polimorfismos que afectan al metabolismo del clopidogrel (CYP2C19*3, 4, 5, 8) se presentan con una frecuencia no significativa17,18. Los sujetos portadores del CYP2C19*2 y en tratamiento con clopidogrel presentan un mayor número de complicaciones trombóticas si han tenido un infarto o una intervención coronaria percutánea19-24. En un estudio de 2.485 pacientes consecutivos con stent coronario, los portadores del polimorfismo CYP2C19*2 presentaron mayor incidencia de trombosis del stent a los 30 días20.
En una revisión de 10 estudios que incluyeron a 11.959 pacientes, tanto los CYP2C19*2 homocigotos portadores como los heterocigotos presentaron mayor mortalidad y trombosis del stent24. En el Registro francés FAST-MI, de 2.208 pacientes con infarto agudo de miocardio, sólo los homocigotos portadores del CYP2C19*2 presentaron mayor mortalidad, infarto o accidente cerebrovascular, mientras que los heterocigotos presentaron una tasa de eventos trombóticos similar a la de los pacientes sin el polimorfismo21. De igual modo, en el estudio CHARISMA Genomics, sólo los homocigotos CYP2C19, comparados con los heterocigotos y los normales, presentaron un mayor número de complicaciones trombóticas25, aunque es interesante observar que los tratados con clopidogrel presentaron más eventos adversos que los no tratados.
En el estudio de Hulot et al24, tanto los homocigotos como los heterocigotos tuvieron más mortalidad, pero la mortalidad en estos estudios retrospectivos se relaciona más con el perfil de riesgo del paciente y puede sesgar los resultados.
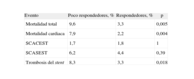
En nuestro entorno, aproximadamente un 30% es portador del polimorfismo, pero sólo un 3% es homocigoto para la mutación. Además, existen otros polimorfismos que afectan al clopidogrel19,21,25. Disponemos de mucha información, pero no sabemos cuál es la actuación correcta en este tipo de pacientes. En julio de 2010 se publicó un documento conjunto del American College of Cardiology y la American Heart Association26 sobre cómo enfocar el problema de los polimorfismos del CYP2C19. Aunque reconoce que los pacientes con mala respuesta a clopidogrel en un test de función plaquetaria presentan un aumento de la complicaciones trombóticas5,27 (tabla 2), el documento concluye que en la actualidad no se recomienda realizar ni análisis genético ni tests de función plaquetaria porque no hay datos que avalen su utilidad en la clínica.
Eventos cardiacos adversos en pacientes poco respondedores y respondedores al clopidogrel27
| Evento | Poco respondedores, % | Respondedores, % | p |
| Mortalidad total | 9,6 | 3,3 | 0,005 |
| Mortalidad cardiaca | 7,9 | 2,2 | 0,004 |
| SCACEST | 1,7 | 1,8 | 1 |
| SCASEST | 6,2 | 4,4 | 0,39 |
| Trombosis del stent | 8,3 | 3,3 | 0,018 |
SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
El prasugrel es una tienopiridina, como el clopidogrel, que inhibe de forma específica e irreversible el receptor de ADP P2Y12 de la plaqueta28. El prasugrel es también un profármaco pero, al contrario que el clopidogrel, se absorbe y se metaboliza rápidamente en su forma activa (R-138727) por varios isotipos del CYP. Por ello, el prasugrel es un antiagregante más rápido y potente que el clopidogrel, pues consigue efecto inhibitorio en 15-60 min28. Otra ventaja del prasugrel sobre el clopidogrel es que no hay variabilidad de su efecto antiagregante ni pacientes no respondedores. Al ser un inhibidor irreversible de la agregación, su efecto antiagregante se prolonga durante 7 días.
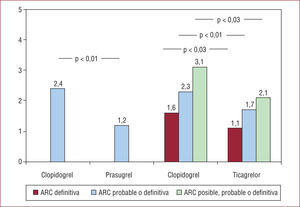
El estudio TRITON-TIMI 3829-33 incluyó a 13.608 pacientes con SCA de riesgo moderado-alto (10.074 con SCASEST y 3.534 con SCACEST) con intervencionismo coronario programado y asignados a aspirina más una dosis de carga de 60 mg de prasugrel seguida de 10 mg/día (n = 6.813) o 300 mg de clopidogrel seguidos de 75 mg/día (n = 6.795). El objetivo primario de eficacia se compuso de muerte por causa cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal, y se redujo significativamente con prasugrel (9,9%) con respecto a clopidogrel (12,1%) (OR = 0,81; IC del 95%, 0,73-0,9; p < 0,001) tanto en los pacientes con SCASEST29 como en los SCACEST29,33. La reducción del objetivo compuesto se debió exclusivamente a una reducción de los infartos (el 7,3 frente al 9,5%; OR = 0,76; IC del 95%, 0,67-0,85; p < 0,001), y la disminución del número de infartos fue una traducción de una menor tasa de trombosis del stent en el grupo de prasugrel (el 1,1 y el 2,4%; OR = 0,48; IC del 95%, 0,36-0,64; p < 0,001)29,32 (fig. 1). El resto de los resultados se detallan en otro artículo de esta monografía.
El grupo tratado con prasugrel presentó más hemorragias mayores no relacionadas con la cirugía coronaria (el 2,4 frente al 1,8%; OR = 1,32; IC del 95%, 1,03-1,68; p = 0,03). Los pacientes que fueron a cirugía coronaria presentaron un incremento de sangrado significativo (el 13,4 frente al 3,2%; OR = 4,73; IC del 95%, 1,9-11,82; p < 0,001) y, en el seguimiento, muchos más pacientes interrumpieron el tratamiento con prasugrel debido a sangrado (el 2,5 y el 1,4%; p < 0,001)29,30. Estos son datos relevantes, ya que actualmente, y debido al aumento de la mortalidad que se asocia a la presencia de hemorragia34, se considera el beneficio clínico neto del fármaco (mortalidad cardiovascular + infarto + accidente cerebrovascular + hemorragias mayores), que fue favorable al prasugrel (el 13,9% con clopidogrel y el 12,2% con prasugrel; OR = 0,87; IC del 95%, 0,79-0,95; p = 0,004) (tabla 3).
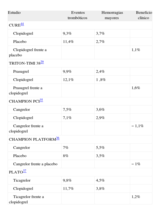
Beneficio clínico (reducción del efecto antitrombótico menos incremento de complicaciones hemorrágicas mayores) de clopidogrel, prasugrel, cangrelor y ticagrelor
| Estudio | Eventos trombóticos | Hemorragias mayores | Beneficio clínico |
| CURE44 | |||
| Clopidogrel | 9,3% | 3,7% | |
| Placebo | 11,4% | 2,7% | |
| Clopidogrel frente a placebo | 1,1% | ||
| TRITON-TIMI 3829 | |||
| Prasugrel | 9,9% | 2,4% | |
| Clopidogrel | 12,1% | 1 ,8% | |
| Prasugrel frente a clopidogrel | 1,6% | ||
| CHAMPION PCI35 | |||
| Cangrelor | 7,5% | 3,6% | |
| Clopidogrel | 7,1% | 2,9% | |
| Cangrelor frente a clopidogrel | −1,1% | ||
| CHAMPION PLATFORM36 | |||
| Cangrelor | 7% | 5,5% | |
| Placebo | 8% | 3,5% | |
| Cangrelor frente a placebo | −1% | ||
| PLATO37 | |||
| Ticagrelor | 9,8% | 4,5% | |
| Clopidogrel | 11,7% | 3,8% | |
| Ticagrelor frente a clopidogrel | 1,2% | ||
No obstante, el análisis post-hoc de los resultados revela que hay subgrupos de pacientes que no se benefician del tratamiento con prasugrel. Los pacientes con antecedentes de accidente cerebrovascular o ataque isquémico transitorio presentan un beneficio clínico negativo (OR = 1,54; IC del 95%, 1,02-2,32; p = 0,04), mientras que en los pacientes mayores de 75 años (OR = 0,99) y en los que pesan menos de 60 kg (OR = 1,03) no se observa beneficio por un exceso del número de complicaciones hemorrágicas29. El exceso de sangrado en los pacientes que han tenido cirugía coronaria (4 veces más que con clopidogrel) nos lleva a pensar que con prasugrel sería mejor esperar a conocer la anatomía coronaria antes de comenzar el tratamiento en pacientes con SCASEST. Cuidando estas consideraciones, el prasugrel presenta grandes ventajas sobre el clopidogrel. Su efecto antiagregante es más potente, casi inmediato y sin variabilidad ni interacciones28.
El cangrelor posee inmejorables propiedades como antiagregante: tiene una estructura similar a la del adenosintrifosfato, que inhibe completamente el receptor P2Y12 en cuestión de segundos tras la administración del bolo i.v., mantiene niveles estables de inhibición de la agregación, tiene una vida media de minutos, se metaboliza en plasma sin eliminación renal o hepática y la función plaquetaria se recupera totalmente en 60 min28. Todas estas propiedades hacían de él un campeón para su uso en el laboratorio de cateterismo cardiaco.
El estudio Champion PCI35 incluyó a 8.877 pacientes asignados a cangrelor o 600 mg de clopidogrel administrados inmediatamente antes de realizar intervencionismo coronario. El objetivo primario se compuso de mortalidad total, infarto de miocardio o revascularización indicada por isquemia en las primeras 48 h. No se consiguió demostrar la superioridad del cangrelor a las 48 h, ya que el objetivo primario ocurrió en el 7,5% de los pacientes con cangrelor frente al 7,1% de los pacientes con clopidogrel (OR = 1,05; IC del 95%, 0,88-1,24). Tampoco se apreció beneficio del cangrelor a los 30 días. Además, la incidencia de hemorragia mayor fue casi significativamente mayor en el grupo con cangrelor (el 3,6 y el 2,9%; OR = 1,26; IC del 95%, 0,99-1,6; p = 0,06) y la de hemorragias menores fue significativamente mayor (el 17,6 y el 15,2%; p < 0,003).
El estudio Champion PLATFORM36 incluyó a 5.362 pacientes con intervencionismo coronario sin pretratamiento con clopidogrel y los asignó a cangrelor o placebo. Tras el procedimiento, ambos grupos recibieron una dosis de carga de 600 mg de clopidogrel. El objetivo primario fue el mismo que en el estudio Champion PCI, y no hubo diferencias entre grupos: se alcanzó en el 7% de los pacientes tratados con cangrelor, frente al 8% en los pacientes con placebo (OR = 0,87; IC del 95%, 0,71-1,07; p = 0,17). Los pacientes con cangrelor sí que presentaron menos trombosis del stent a las 48 h del procedimiento (el 0,2 y el 0,6%; OR = 0,31; IC del 95%, 0,1-0,85; p = 0,02) y menos mortalidad a las 48 h (no hay que olvidar que se comparaba con placebo) probablemente derivada de ese hecho (el 0,2 y el 0,7%; OR = 0,33; IC del 95%, 0,13-0,83; p = 0,02), pero este inicial efecto beneficioso se pierde al cabo de 1 mes (trombosis del stent, el 0,38 frente al 0,46%; p = 0,65; mortalidad total, el 1,1 frente al 1,1%; p = 0,97). Además, el tratamiento con cangrelor se asoció a un mayor número de hemorragias totales (el 17,5 y el 12,8%; p < 0,001).
El cangrelor era, pues, un campeón en potencia que ofrecía antiagregación inmediata, predecible, potente y rápidamente reversible; sin embargo, sus efectos beneficiosos parece que se han perdido en la traslación clínica de sus resultados experimentales28,36. En el estudio Champion PCI no se aprecia beneficio antitrombótico frente al clopidogrel y aumenta el número de complicaciones hemorrágicas. En el estudio Champion PLATFORM se reduce la trombosis del stent a las 48 h, pero no al mes, y hay que recordar que el cangrelor se compara contra placebo, que la incidencia de hemorragias es mayor y, por lo tanto, el beneficio clínico del fármaco sigue siendo negativo (a favor del clopidogrel o incluso del placebo) (tabla 3).
El ticagrelor no es una tienopiridina, sino una ciclopentiltriazolopirimidina, que se administra por vía oral y actúa directamente (sin biotransformación hepática) sobre el receptor P2Y12 de la plaqueta28. Presenta una gran rapidez de acción y un efecto antiagregante mayor que el de clopidogrel y además su efecto es reversible en 48 h28,37,38.
El estudio PLATO37,38 compara el efecto del ticagrelor (dosis de carga de 180 mg + 90 mg/12 h) con el del clopidogrel (dosis de carga de 300 a 600 mg + 75 mg/día), en pacientes con SCASEST o SCACEST. El objetivo primario (muerte cardiovascular, infarto de miocardio o accidente cerebrovascular) se obtuvo en el 9,8% de los pacientes asignados a ticagrelor frente al 11,7% con clopidogrel (OR = 0,84; IC del 95%, 0,77-0,92; p < 0,001). Además, el ticagrelor redujo la tasa de infarto (el 5,8 frente al 6,9%; p = 0,005), la mortalidad de causa cardiovascular (el 4 frente al 5,1%; p = 0,001), así como la mortalidad total (el 4,5 frente al 5,9%; p < 0,001). No se apreciaron diferencias en el objetivo de seguridad de sangrado (el 11,6 y el 11,2%; p = 0,43) porque este incluía el sangrado relacionado con cirugía cardiaca. Sin embargo, sí se apreció un aumento de las complicaciones hemorrágicas no relacionadas con cirugía (el 4,5 y el 3,8%, respectivamente; p = 0,03) y de las hemorragias intracraneales fatales (el 0,1 y el 0,01%; p = 0,02). El resto de los resultados se detallan en otro artículo de esta monografía.
El ticagrelor, en teoría, consigue redondear el círculo: reduce las complicaciones trombóticas en el SCA sin aumentar el objetivo compuesto de complicaciones hemorrágicas. La realidad no es tan simple: se reducen las hemorragias en pacientes intervenidos de cirugía cardiaca porque el efecto del fármaco es rápidamente reversible, pero se produce un aumento significativo de las hemorragias mayores y totales, como es de esperar en un antitrombótico potente. Por otro lado, es el único de los antitrombóticos disponibles en intervencionismo coronario que claramente disminuye la mortalidad cardiovascular y total37,38. Por ello, es seguro que tiene un papel significativo en el SCA. Se ha publicado un metaanálisis indirecto comparativo de prasugrel y ticagrelor39 en el que se señala que prasugrel se asociaría a menos trombosis del stent y ticagrelor produciría menos hemorragias (fig. 1). Salvando la crítica a la metodología de este estudio, seguro que disponer de distintos antiagregantes nos permitirá individualizar el tratamiento según la carga trombótica y las posibilidades de hemorragia de cada paciente.
INHIBIDORES DIRECTOS DE LA TROMBINAEl estudio HORIZONS-AMI ha concluido su seguimiento y presenta los resultados finales a 3 años40. Se confirma la reducción del objetivo de hemorragias (OR = 0,64; IC del 95%, 0,51-0,8; p < 0,001) en el grupo tratado con bivalirudina. Esta diferencia se produjo en el primer día de tratamiento y se mantuvo invariable durante el seguimiento. Sin embargo, la mortalidad cardiaca (OR = 0,56; IC del 95%, 0,4-0,8; p = 0,001) y la incidencia de reinfarto aumentaron desde el primer mes a los 3 años en el grupo con bivalirudina con respecto a heparina+inhibidor de la GPIIb/IIIa (OR = 0,76; IC del 95%, 0,59-0,92; p = 0,04). La trombosis del stent tuvo un comportamiento paradójico: fue significativamente mayor el primer día en el grupo bivalirudina (el 0,3 frente al 1,5%; p < 0,001), para igualarse a los 3 años (el 5,1 frente al 4,5%; p = 0,49).
INHIBIDORES DE LA GPIIb/IIIaEl estudio EARLY ACS41 incluyó a 9.492 pacientes con SCASEST asignados a intervencionismo coronario con el objetivo de comparar la administración precoz (> 12 h antes de la intervención) de un inhibidor de la GPIIb/IIIa (eptifibatida) con la administración del fármaco durante el procedimiento. El objetivo compuesto de muerte, infarto, isquemia recurrente o una complicación trombótica durante el procedimiento que requiriese tratamiento antitrombótico bailout fue idéntico en los dos grupos (el 9,3 y el 10%; OR = 0,92; IC del 95%, 0,8-1,06; p = 0,23) y además se asoció a un mayor número de hemorragias (el 5,8 y el 3,4%; OR = 1,75; IC del 95%, 1,43-2,14; p = 0,001). Realizar intervencionismo con administración downstream es más resolutivo y se asocia a un menor número de hemorragias que con el tratamiento upstream.
El estudio ICE42 demostró en un grupo pequeño de pacientes que la administración de un bolo intracoronario de eptifibatida produce una mayor ocupación del receptor de GPIIb/IIIa que la perfusión intravenosa (el 94 y el 51%; p < 0,001). Además, mejoró la perfusión microvascular medida por el corrected TIMI frame count.
El estudio Brief43 comparó una perfusión de eptifibatida estándar de 18 h de duración con una < 2 h en todo tipo de pacientes con intervencionismo coronario. No hubo diferencias en la presentación de mionecrosis periprocedimiento (el 30,1 y el 28,3%), pero la perfusión acortada a < 2 h se asoció a un menor número de hemorragias (el 1 y el 4,2%; p = 0,02).
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.