Palabras clave
INTRODUCCIÓN
El uso creciente de medios de contraste (MC) yodados en procedimientos radiológicos como la angiografía coronaria ha motivado una mayor preocupación acerca del probable aumento en la incidencia de la nefropatía inducida por contraste (NIC) como potencial complicación. La NIC es la tercera causa de insuficiencia renal aguda hospitalaria1 y conlleva un mayor riesgo de mortalidad, infarto de miocardio y accidente cerebrovascular, principalmente en casos que requieren diálisis por este motivo tras el procedimiento2-5.
La incidencia general de la NIC tras coronariografía oscila entre un 2 y un 50%, la insuficiencia renal crónica (IRC) de base y el antecedente de diabetes mellitus son los factores de riesgo más importantes2. Así, la IRC se considera tanto necesaria como suficiente para que se produzca NIC, mientras la diabetes mellitus es un «potenciador»6. Otros factores de riesgo que tener en cuenta son la hipotensión, el balón de contrapulsación, la insuficiencia cardiaca congestiva, la edad superior a 75 años, la anemia y el volumen del MC utilizado6,7.
Además, la NIC es uno de los pocos tipos de insuficiencia renal hospitalaria prevenibles. La piedra angular de esta profilaxis, tanto en los pacientes en alto riesgo (con IRC previa) como en bajo riesgo, ha sido asegurar una adecuada hidratación parenteral. Otras medidas farmacológicas como la administración previa de N-acetilcisteína (NAC) a los pacientes con IRC, dado su carácter antioxidante y vasodilatador, han sido previamente evaluadas en diversos ensayos clínicos, aunque los resultados hasta la fecha son muy heterogéneos8-23. También se ha postulado que evaluar el efecto renoprotector de la NAC basándose sólo en cambios en la concentración sérica de creatinina (CrSr) podría artefactarse por un efecto directo del fármaco en la secreción tubular de creatinina o en el metabolismo muscular24. Se ha propuesto por ello otros marcadores de daño renal, como la cistatina C25,26, aunque recientes estudios defienden el uso de la CrSr como marcador adecuado en el diagnóstico de la NIC27.
Por todo ello, hemos llevado a cabo un estudio prospectivo aleatorizado que evalúa la hipótesis de que la administración intravenosa de NAC previene la NIC en los pacientes coronarios en alto riesgo con IRC sometidos a angiografía coronaria. Paralelamente también se han evaluado otros efectos clínicos a corto y largo plazo.
MÉTODOS
Pacientes
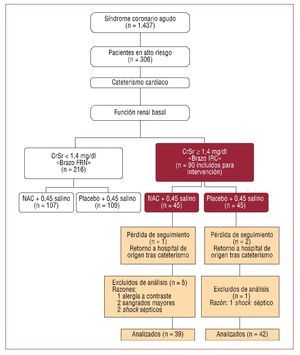
El Hospital Clínico Universitario de Valencia es un centro terciario de referencia dotado de 600 camas. Se incluyó en el estudio a 90 pacientes ingresados en la Unidad Coronaria con diagnóstico de síndrome coronario agudo e IRC que se iban a someter a cateterismo cardiaco. En la figura 1 se muestra el diagrama de flujo de los sujetos participantes en diferentes fases, siguiendo las recomendaciones CONSORT (Consolidated Standards of Reporting Trials)28. Se consideró en alto riesgo coronario a los pacientes incluidos por los siguientes motivos: inestabilidad clínica con persistencia de angina, angina tras infarto o fracaso de la revascularización con tratamiento trombolítico y la consiguiente necesidad urgente de cateterismo de rescate. La IRC se definió como cifras estables de CrSr ≥ 1,4 mg/dl (123,76 μmol/l)9 o aclaramiento de creatinina < 60 ml/min según fórmula de Cockcroft-Gault29. Los criterios de exclusión fueron: inestabilidad hemodinámica (presión arterial sistólica < 90 mmHg), alergia conocida a la NAC o el MC intraarterial, sangrado gastrointestinal activo y/o tratamiento previo con teofilina, manitol o antibióticos nefrotóxicos.
Fig. 1. Diseño del protocolo principal del estudio. Diagrama de flujo de sujetos participantes en el brazo IRC. Brazo FRN: brazo de pacientes con función renal normal; Brazo IRC: brazo de pacientes con insuficiencia renal crónica; CrSr: niveles séricos de creatinina; n: tamaño muestral; NAC: N-acetilcisteína. (Reproducido de Carbonell et al30, con permiso de Elsevier.)
El periodo de recogida de datos finalizó al alta hospitalaria, salvo por la mortalidad al año de seguimiento. Se llevó a cabo entre el 1 de marzo de 2002 y el 31 de diciembre de 2006. El diseño del estudio fue aprobado por el comité ético local y todos los pacientes o sus familiares dieron su consentimiento informado.
Diseño de estudio
Este estudio es uno de los dos brazos («brazo IRC») del protocolo original previamente publicado con los resultados relativos a la población con función renal normal («brazo FRN»)30 (fig. 1). Del mismo modo, se trata de un estudio prospectivo y a doble ciego, en el que los pacientes fueron asignados aleatoriamente a recibir profilaxis con NAC vía intravenosa (600 mg diluidos en 50 ml de salino isotónico a pasar durante 30 min/12 h, con un total de 4 dosis) o placebo (50 ml de salino isotónico), comenzando durante las 24 h previas al cateterismo. Ambos grupos recibieron paralelamente suero salino hipotónico vía intravenosa (1 ml/kg/h) en las 6 h previas al procedimiento, que se mantuvo durante 12 h tras la administración del contraste. La aleatorización se realizó con una tabla de números aleatorios. El análisis de datos se llevó a cabo por intención de tratar.
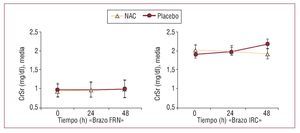
Fig. 2. Cambios en las cifras medias de concentración sérica de creatinina (CrSr) en cada brazo del estudio. Brazo FRN: brazo de pacientes con función renal normal; brazo IRC: brazo de pacientes con insuficiencia renal crónica; NAC: N-acetilcisteína. Los resultados expresan media ± desviación estándar. Se utilizó el test de Wilcoxon-U de Mann-Whitney para valorar las diferencias entre los grupos tratados con NAC y con placebo en cada brazo del estudio principal. (Los resultados relativos al brazo con FRN se reproducen de Carbonell et al30, con permiso de Elsevier.)
Durante las 24 h previas al cateterismo, se determinaron la CrSr, la concentración plasmática de urea y los electrolitos, considerados como valores basales. Estas mismas determinaciones se realizaron a las 24 y a las 48 h de la administración de contraste. El objetivo primario fue la aparición de NIC, definida como el incremento brusco de CrSr ≥ 0,5 mg/dl (44 μmol/l) o del 25% del valor basal a las 48 h del procedimiento. Los objetivos secundarios fueron la necesidad de diálisis por NIC y la mortalidad en la unidad coronaria, así como la mortalidad hospitalaria y al año de seguimiento, que se analizaron como variable resultado compuesta. Se recogieron efectos adversos del medicamento durante su administración, tales como vómitos, hipotensión, broncospasmo, fiebre, convulsiones, erupción cutánea y prurito. En el laboratorio de hemodinámica se utilizó iopromida (Ultravist, Schering AG, Alemania) como contraste intraarterial, definido como no iónico y de baja osmolaridad respecto al plasma.
Análisis estadístico
El análisis estadístico se llevó a cabo con el programa SPSS 9.0. Los datos continuos se expresaron como media ± desviación estándar o como mediana (intervalo) y los categóricos, como porcentajes. Las variables continuas que seguían una distribución normal se analizaron utilizando el test de la t de Student y las cualitativas, con el test de Fisher y el de la χ2. Dado que la CrSr no seguía una distribución normal según el test de Kolmogorov-Smirnov, se evaluaron las diferencias entre grupos utilizando las pruebas no paramétricas de Wilcoxon y Mann-Whitney. El incremento/decremento de la CrSr se calculó como la diferencia entre la CrSr a las 48 h del contraste menos la basal, dividido por la CrSr basal.
El nivel de significación estadística alfa se estableció en 0,05 y el poder estadístico 1 - beta, en 0,8. El tamaño muestral se estimó utilizando el programa C4-Study Design Pack (GlaxoWellcome, SA) tras proyectar los resultados de los estudios de Tepel et al8 y Goldenberg et al21, donde se da una probabilidad de NIC en el grupo NAC de p1 = 0,02 y una probabilidad de este objetivo principal en el grupo placebo de p2 = 0,21. Obtuvimos así la cifra de 45 pacientes como tamaño necesario para cada grupo del brazo IRC del estudio principal.
Se realizó un análisis univariable y después se incluyeron en el multivariable (regresión logística) todas las variables clínico-demográficas que se habían asociado de forma significativa a la variable dependiente para determinar los factores predictivos de mortalidad.
RESULTADOS
Se obtuvo la totalidad de los datos en 81 pacientes; salieron del estudio 9/90 pacientes ya aleatorizados en los que no se pudo completar las variables previstas (fig. 1): 3 de ellos por falta de seguimiento (trasladados al hospital de origen poco después del cateterismo) y 6 a los que finalmente se excluyó del análisis (1 porque sufrió una alergia «no conocida» al MC durante el procedimiento, 2 porque presentaron hemorragia secundaria a tratamiento trombolítico —cerebral y gastrointestinal— y 3 porque presentaron tras cateterismo cifras mantenidas de presión arterial sistólica < 90 mmHg con oligoanuria y signos de sepsis). Quedó así un total de 81 pacientes para analizar en el estudio (NAC, 39; placebo, 42), cuyas características clínicas basales se muestran en la tabla 1. Ambos grupos resultaron comparables respecto a datos demográficos, factores de riesgo cardiovascular, tratamiento médico concomitante, datos analíticos y las variables relativas al cateterismo. Recibieron tratamiento médico trombolítico 15 de los 29 pacientes (51,7%) diagnosticados de síndrome coronario agudo con elevación del segmento ST, de los que 3 (20%) precisaron angioplastia de rescate. En la tabla 1 se muestra el volumen del MC utilizado en cada grupo del estudio. Resultó significativamente superior en los casos que precisaron intervencionismo (implantación de stent) respecto a las coronariografías simplemente diagnósticas (204,41 ± 23,7 frente a 124,6 ± 11,8; p = 0,001). Sin embargo, no se observaron diferencias en el porcentaje de cada tipo de procedimiento llevado a cabo en cada grupo.
La incidencia general de NIC fue del 14,8% (12 pacientes), el 5,1% (2) en el grupo al que se administró NAC y el 23,8% (10) en el grupo placebo (odds ratio [OR] = 0,17; intervalo de confianza [IC] del 95%, 0,03-0,84; p = 0,027). No se detectó ningún efecto adverso del fármaco durante su administración. La CrSr media pasó de la basal de 2,01 ± 0,77 a 1,9 ± 0,83 mg/dl a las 48 h de la angiografía coronaria en los pacientes tratados con NAC, mientras que aumentó desde 1,87 ± 0,7 a 2,15 ± 0,94 mg/ dl en el grupo con placebo (p = NS) (fig. 2). No se observaron cambios significativos en la concentración plasmática de urea a las 48 h del cateterismo: pasó de 80 ± 36 a 76 ± 37 mg/dl y de 67 ± 23 a 71 ± 27 mg/dl en cada grupo respectivamente.
La mediana de estancia en la unidad coronaria fue de 5 (1-20) días en el grupo NAC y 4 (2-27) en el placebo, mientras que la hospitalaria fue de 10 (1-42) y 10 (2-73) días respectivamente (p = 0,20). Uno de los pacientes que contrajo NIC precisó diálisis por este motivo durante su ingreso en la unidad (el 1,2% del total de pacientes). Este paciente pertenecía al grupo al que se administró placebo y falleció 1 año después. El otro paciente diagnosticado de NIC, fallecido 1 mes después del ingreso, también pertenecía al mencionado grupo (mortalidad general por NIC, del 17%). En total, 3 y 2 pacientes (el 7,7 y el 4,8%) fallecieron en la unidad coronaria (p = 0,18). En el análisis multivariable, la NAC resultó factor protector predictivo independiente de la variable resultado compuesta por nefropatía por contraste, necesidad de diálisis y mortalidad durante la estancia en la unidad coronaria (OR = 0,20; IC del 95%, 0,04-0,97; p = 0,04). Se realizó revascularización quirúrgica a 7 (17,9%) de los pacientes del grupo con NAC y en 12 (28,6%) del grupo a placebo durante el ingreso hospitalario (p = 0,25). Por otra parte, no se observaron diferencias respecto a la mortalidad a medio y largo plazo (tabla 2). De los 4 fallecidos tras el alta hospitalaria, sólo en 1 fue por causa cardiaca.
DISCUSIÓN
El uso creciente de MC yodados en la angiografía coronaria sigue generando preocupación acerca del probable aumento en la incidencia de NIC, especialmente cuando se trata de casos urgentes en los que no es posible realizar una adecuada hidratación profiláctica o cuando se trata de pacientes con un perfil con alto riesgo de NIC (p. ej., IRC o insuficiencia cardiaca congestiva).
La NAC ha ganado protagonismo en la práctica clínica habitual en estos grupos en alto riesgo por el perfil favorable del fármaco en cuanto a efectos adversos, su bajo coste y algunos resultados positivos en ensayos clínicos. Sin embargo, la evidencia clínica sobre su papel renoprotector aún es escasa y se lo sigue considerando una cuestión por resolver31. Por todo ello, llevamos a cabo un estudio prospectivo aleatorizado para evaluar la hipótesis de que la administración intravenosa de NAC prevendría la NIC en los pacientes coronarios de alto riesgo con IRC sometidos a angiografía coronaria.
Entre los hallazgos con más relevancia del presente estudio, está la confirmación del efecto beneficioso de la NAC en la prevención de la NIC, basada en una reducción de las cifras de CrSr. Hemos observado una menor incidencia, estadísticamente significativa, de NIC cuando se ha utilizado NAC antes de la coronariografía en los pacientes con IRC (el 5,1 frente al 23,8%), de forma similar que en estudios previos16. Sin embargo, este resultado adicional al de la mera hidratación no se observa en los pacientes coronarios con función renal normal del otro brazo del estudio previamente publicado30 (incidencia de NIC, el 10,3 frente al 10,1% en los grupos con NAC y con placebo, respectivamente). A nuestro juicio, estos resultados limitarían el beneficio clínico de la NAC a los pacientes con alto riesgo e IRC.
Paralelamente, los valores medios de CrSr de los pacientes incluidos en el brazo IRC que habían recibido NAC disminuyeron a las 24 y las 48 h de la administración del contraste, con lo que se comportaron de forma opuesta a la tendencia creciente observada en el grupo NAC del brazo FRN (fig. 2)30. Este diferente comportamiento de la CrSr en el grupo tratado con fármaco entre ambos brazos del estudio original es el principal motivo por el que no compartimos que se cuestione su papel como biomarcador fiable en la evaluación del efecto renoprotector de la NAC. En el estudio llevado a cabo por Hoffmann et al24, se incluyó a voluntarios sanos tratados con NAC (sin MC) y se cuestionó el efecto glomerular de la NAC en la CrSr basándose en la ausencia de efecto en la cistatina C 4 h tras la administración del fármaco. El mismo año Rickli et al25, en un estudio llevado a cabo sobre pacientes con tasas normales o casi normales de filtrado glomerular, compararon las diferentes cinéticas de la cistatina C y la CrSr a las 5, 24 y 48 h de la administración de contraste. Observaron que la cistatina C alcanzó su máximo a las 24 h de la angiografía, más precozmente que el incremento de la CrSr, y no detectaron ningún cambio significativo a las 5 h del contraste en ningún biomarcador. Aunque este estudio no se realizó con el fármaco antioxidante, a nuestro juicio pone en entredicho las conclusiones de Hoffmann et al, ya que no presentaron resultados bioquímicos a las 24 h del procedimiento, momento crucial según el estudio de cinéticas en la detección de cambios en la cistatina C. Además, recientemente Levin A et al26 han descrito un efecto biológico de la NAC basándose en la excreción de albúmina, lo que implicaría que este fármaco atenúa el daño glomerular o tubular inducido por el contraste independientemente de cualquier efecto en la creatinina. Al igual que Marenzi et al27, pensamos que el efecto protector de la NAC se obtiene en mayor medida en presencia de un estrés oxidativo inducido por isquemia-reperfusión que en su ausencia, como es el caso de los sujetos sanos24. Probablemente el efecto antioxidante supere al vasodilatador a la hora de explicar fisiopatológicamente su beneficio renal.
Por otra parte, el resultado clínico obtenido con este nuevo protocolo de administración intravenosa de NAC en pacientes con alto riesgo, previamente discutido cuando se utilizó en pacientes sin disfunción renal30, es importante por varias razones: a) la ausencia de reacciones adversas, comparado con el 14% observado por Baker et al13 utilizando una mayor dosis intravenosa; b) la posibilidad de usar el fármaco en pacientes de urgencias (estudios previos de farmacocinética establecen en «6 h» la vida media del metabolito32), y c) su reducida biodisponibilidad por vía oral (20%), y finalmente porque hay pacientes que rechazan la administración del fármaco por boca a causa de su especial mal sabor.
El segundo gran hallazgo de este estudio se refiere al beneficio clínico a corto plazo que ofrece la administración de NAC. Hasta hace poco tiempo, sólo existía un estudio aleatorizado que mostrara una reducción significativa en la estancia hospitalaria tras aplicación de contraste en el grupo de pacientes tratados con NAC oral11. Amplias series y estudios de cohorte2,4 han mostrado que la NIC que precisa diálisis tras intervencionismo coronario es poco frecuente (< 1 frente al 14,6% de NIC que no requiere tratamiento sustitutivo), pero conlleva una elevada mortalidad hospitalaria. La mayoría de los ensayos con más evidencia carecen de resultados positivos cuando analizan eventos clínicos evolutivos. Sin embargo, Mehran et al7 desarrollaron una escala sencilla para predecir el riesgo de NIC y observaron un aumento exponencial en la tasa general de NIC del 13%, así como la necesidad de diálisis y mortalidad al año conforme se incrementaba el valor de la escala. Esos autores demostraron un riesgo de que se precisara diálisis del 0,12 y el 1,09% asociado al riesgo de NIC del 14 y el 26% respectivamente. Estos datos podrían justificar la falta de eventos en la mayoría de los estudios previos y a su vez concordarían con nuestros resultados, ya que la incidencia general de NIC fue del 14,8% y uno de los pacientes del grupo placebo necesitó diálisis en la unidad coronaria (1,2%), mientras que la incidencia de nefropatía en este grupo fue del 23,8%.
Además, en este estudio se ha identificado que la NAC es factor protector independiente a corto plazo. Marenzi et al27, que incluyeron a pacientes consecutivos con infarto de miocardio sometidos a angioplastia primaria, también han demostrado recientemente una mejor evolución hospitalaria y una reducción dependiente de la dosis en la gravedad de la NIC. Esos autores, sin embargo, principalmente en el grupo control, describen cifras de incidencia de NIC y eventos a corto plazo muy superiores a los ofrecidos por estudios previos, con tasas de mortalidad que superaban en gran medida el 4-5% típicamente descrito en los grandes registros33. Aunque nuestro estudio no incluye exactamente el mismo tipo de población sometida a cateterismo, la mortalidad en la unidad coronaria del 4,8% del grupo al que se administró placebo concuerda con los registros que reflejan la práctica clínica habitual.
Limitaciones del estudio
El estudio se diseñó para evaluar la incidencia de la NIC, y por ello el tamaño de la muestra no tendría suficiente poder estadístico para evaluar diferencias en morbimortalidad. Aunque el tamaño muestral relativamente pequeño conlleva una interpretación cautelosa de los resultados del estudio, hemos de resaltar que se obtuvo utilizando un programa para diseño de experimentos que incluía los resultados de la literatura previa. Por otra parte, habría resultado de gran ayuda disponer de determinaciones de cistatina C como marcador del filtrado glomerular, ya que parece que refleja los cambios en la función renal inducidos por el contraste mejor que la CrSr, que podría llevar a conclusiones erróneas sobre el beneficio de la NAC34. Sin embargo, los resultados recientemente obtenidos por Kimmel et al son preliminares y todavía tienen un poder limitado debido al reducido tamaño muestral del estudio.
CONCLUSIONES
A la espera de un estudio multicéntrico, nosotros recomendamos utilizar NAC intravenosa antes de la angiografía coronaria en los pacientes con alto riesgo y cifras basales de CrSr ≥ 1,4 mg/dl, especialmente cuando no es posible realizar una adecuada hidratación debido a su situación clínica.
ABREVIATURAS
CrSr: concentración sérica de creatinina.
FRN: función renal normal.
IRC: insuficiencia renal crónica.
MC: medio de contraste.
NAC: N-acetilcisteína.
NIC: nefropatía inducida por contraste.
Full English text available from: www.revespcardiol.org
VÉASEEDITORIALENPÁGS. 9-11
Correspondencia: Dra. N. Carbonell.
Unidad Coronaria y de Medicina Intensiva. Hospital Clínico Universitario. Avda. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: edurnecarbonell@yahoo.es
Recibido el 10 de noviembre de 2008.
Aceptado para su publicación el 5 de agosto de 2009.