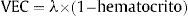La resonancia magnética cardiaca ha evolucionado hasta convertirse en una modalidad diagnóstica esencial en la evaluación de la miocardiopatía, gracias a su capacidad para caracterizar la estructura y la función del miocardio. En los últimos años ha aumentado el interés en el potencial de las técnicas de mapeo que aportan una cuantificación directa y objetiva de las propiedades del miocardio, como los tiempos T1, T2 y T2*. Estos métodos permiten detectar anomalías que afectan al miocardio de manera difusa o son demasiado sutiles para identificarlas en un examen visual. En este artículo se revisa el estado actual del mapeo miocárdico T1 y T2 tanto en salud como en enfermedad.
Palabras clave
Los métodos estándares de caracterización del miocardio con resonancia magnética cardiaca (RMC) son la potenciación T1, la potenciación T2 y las imágenes de realce tardío de gadolinio (RTG), que permiten ver la infiltración grasa, el edema o la necrosis/cicatrización1. Estas secuencias se basan en los cambios relativos de la intensidad de señal existentes entre el miocardio anormal y el normal. Sin embargo, se ven dificultadas por su carácter a menudo semicuantitativo y sus limitaciones inherentes a la presentación gráfica de procesos miocárdicos difusos sin un miocardio «normal» de referencia en el momento de obtener las imágenes. El mapeo miocárdico mediante RMC evoluciona rápidamente como método objetivo y cuantitativo de caracterización no invasiva de propiedades miocárdicas como la expansión del volumen extracelular, el edema u otras anomalías de la composición tisular. En este artículo se revisa el estado actual del mapeo miocárdico T1 y T2 en estados de salud y enfermedad. Las técnicas anteriores de mapeo T2* que permiten detectar la sobrecarga de hierro o la hemorragia intramiocárdica se revisan en otra publicación2.
MAPEO T1 Y T2La descripción detallada de los principios físicos de la RMC queda fuera del ámbito de esta revisión. En resumen, la RMC genera las imágenes mediante la transferencia de energía a los protones 1H del agua y la grasa; esta energía se libera cuando recuperan su estado basal («relajación») y se puede detectar y cartografiar en una distribución espacial de los protones. Determinan la velocidad a la que se produce esta relajación los tiempos T1 y T2 (tiempos de relajación longitudinal y transversal respectivamente). Los tiempos T1 y T2 son propiedades intrínsecas de los tejidos que dependen también de la intensidad del campo magnético: T1 aumenta en los campos de mayor intensidad, mientras que T2 se mantiene relativamente constante3, aunque el T2 miocárdico tiende a reducirse4. Los medios de contraste a base de gadolinio modifican los tiempos de relajación, sobre todo por reducción de T1.
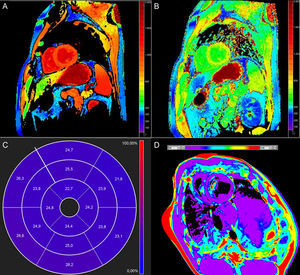
Un mapa T1 o T2 es una imagen en la que la intensidad de señal de cada vóxel es directamente proporcional al tiempo T1 o T2 del tejido en que se encuentra. Se puede comparar estos tiempos con los de una zona lejana del miocardio en los procesos focales o heterogéneos o con valores de referencia normales en los casos de enfermedad difusa. Mientras que el RTG detecta la fibrosis de sustitución localizada5, las técnicas de mapeo T1 se desarrollaron inicialmente para el estudio de la fibrosis intersticial difusa, aunque sus aplicaciones continúan ampliándose. El objetivo principal del mapeo T2 es la detección de edema2.
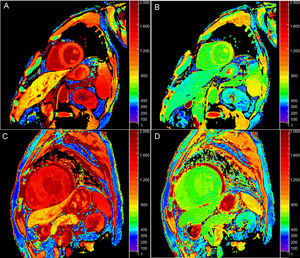
Tiempo T1 nativoUna posible aplicación del mapeo T1 es la cuantificación del T1 miocárdico nativo (es decir, previo al contraste) (figura 1A). El T1 nativo puede prolongarse o reducirse en diversos trastornos clínicos (véase más adelante). Dado que no requiere la administración de contraste, el mapeo del T1 nativo aporta un potencial diagnóstico en pacientes con contraindicaciones relativas para el uso de gadolinio (p. ej., insuficiencia renal avanzada). Las características histopatológicas correlacionadas con el T1 no están completamente esclarecidas, pero el T1 refleja los cambios que se producen tanto en el compartimento intracelular como en el extracelular, y se ve influido por la presencia de edema, colágeno u otras proteínas, hierro y lípidos6.
Tiempo T1 poscontrasteEl T1 puede calcularse tras la administración de gadolinio (figura 1B). La mayoría de los contrastes a base de gadolinio son compuestos extracelulares: se distribuyen en los compartimentos intravascular e intersticial, pero no en el interior de las células. En consecuencia, el T1 poscontraste refleja el acceso al espacio intracelular (p. ej., pérdida de la integridad de la membrana celular en la necrosis aguda) o la expansión del espacio intersticial, que se considera en gran parte un indicador sustitutivo indirecto de la fibrosis intersticial7. Aunque este fue el primer enfoque utilizado para la elaboración de mapas de T1 miocárdicos8, el uso del T1 poscontraste ha perdido algo de popularidad debido a su dependencia del tiempo transcurrido tras la administración del gadolinio, la dosis de contraste utilizada, la composición corporal, la función renal, la frecuencia cardiaca y el hematocrito5. No obstante, se han propuesto métodos para corregir estas variaciones9–12.
Coeficiente de reparto (λ)λ indica la relación entre los cambios del T1 del miocardio y de la sangre antes y después de la administración del contraste y se calcula del siguiente modo:
donde R1 es la relajabilidad del tejido (1 / T1) y ΔR1 es R1poscontraste – R1precontraste13.Con λ se intenta tener en cuenta las variaciones interindividuales en la dosis de contraste, el tiempo transcurrido tras la administración del contraste o el aclaramiento renal de este mediante una corrección para el T1 precontraste, así como los cambios del T1 de la sangre; además, es menos sensible a la intensidad del campo magnético14. Sin embargo, continúa siendo sensible a algunos factores de confusión, en especial el volumen plasmático sanguíneo (véase más adelante).
Volumen extracelularEl volumen extracelular (VEC) (figura 1C) incorpora una corrección respecto al volumen plasmático sanguíneo y se calcula13:
Pueden generarse también mapas del VEC. De ser posible, se debe determinar el hematocrito simultáneamente a la exploración por RMC6,15; sin embargo, se ha puesto en duda esta recomendación por cuestiones logísticas y la considerable variabilidad de las determinaciones del hematocrito16. Además, recientemente se ha propuesto y validado un método que utiliza el hematocrito estimado a partir del R1 de la sangre16 que puede obviar la necesidad de una determinación real.
En condiciones normales, el espacio extracelular constituye aproximadamente un 25% del volumen del miocardio5,15. El VEC está formado por la combinación del espacio intersticial y el espacio intravascular y, de manera similar a lo que ocurre con el T1 poscontraste, a menudo se lo considera un indicador indirecto sustitutivo de la fibrosis intersticial15. El VEC puede cuantificarse durante una infusión continua y lenta de contraste o con una aproximación razonable al menos 15 min después de la inyección de un bolo17,18, aunque esto tiende a sobrestimar los valores de VEC altos18. Aunque el VEC es menos sensible a los factores de confusión, las secuencias utilizadas pueden ser, de todos modos, propensas al error y persiste cierta influencia de la concentración de gadolinio (a su vez influida por la dosis de contraste, el retraso poscontraste o la complexión)6,17,19,20.
Actualmente6, el T1 nativo y el VEC son los índices preferidos obtenidos a partir del mapeo T1.
Tiempo T2 nativoEl tiempo T2 aumenta en proporción al contenido de agua21 y, por consiguiente, el aumento del T2 refleja en gran parte el edema del miocardio. Las imágenes potenciadas en T2 estándares tienen limitaciones como consecuencia de su susceptibilidad a los artefactos y la interpretación subjetiva, por lo que el mapeo T2 (figura 1D) brinda la posibilidad de una detección y una cuantificación más objetivas de la inflamación o el edema asociado a la reperfusión.
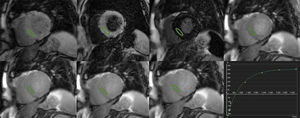
CUANTIFICACIÓN DE T1 Y T2Las secuencias de RMC para el mapeo T1 se basan en la generación de imágenes a diferentes grados de relajación longitudinal con objeto de generar una curva de la intensidad de señal respecto al tiempo (figura 2) con la que se pueda calcular el T1. Esto puede hacerse mediante adquisiciones repetidas con diversos tiempos de inversión-recuperación8,22; sin embargo, requiere múltiples apneas. En consecuencia, se han diseñado secuencias que permitan la adquisición de todas las imágenes necesarias en una sola apnea y en la misma fase del ciclo cardiaco. La primera de ellas, desarrollada en 2004, se denomina inversión-recuperación de look-locker modificada (MOLLI)23. Se han propuesto diversas modificaciones de la secuencia MOLLI y otros enfoques alternativos15,24 como una versión acortada (shMOLLI) que permite reducir el tiempo de apnea12.
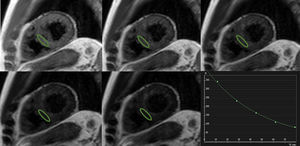
De manera análoga, el mapeo de T2 se basa en el ajuste de una curva de valores de intensidad de señal en diferentes momentos durante la relajación transversal (figura 3). Esto se realiza habitualmente empleando pulsos T2 preparatorios25 o con tiempos de eco diferentes durante la adquisición26, y las diferentes secuencias muestran puntos fuertes y limitaciones específicas4. Aunque menos pronunciadamente y menos explorada sistemáticamente que en el caso del mapeo T1, se ha descrito una posible dependencia de la frecuencia cardiaca en los valores de T2 medidos27,28.
En la tabla 1 se recogen los valores normales de los tiempos T1 y del VEC miocárdicos nativos19,28–39. El tiempo T1 nativo a 1,5 T es de aproximadamente 900-1.000 ms (> 3 T), mientras que el VEC normal es del orden de un 20-30%, lo cual concuerda con los valores esperados5. Como ya se ha indicado, los tiempos T1 poscontraste dependen de varios factores técnicos y fisiológicos, y los valores de λ normales descritos están entre 0,25 y 0,7019,29,36. Múltiples publicaciones han descrito un aumento del VEC con la edad19,28,35,38,40. El estudio más grande realizado hasta la fecha, con 1.231 pacientes36, confirmó estas asociaciones, en especial en los varones, y describió unos valores de T1 y VEC precontraste más altos en las mujeres, tal como habían observado otros autores34,41. La presencia de índices basados en T1 anormales, en especial el T1 nativo y el VEC, permite identificar el miocardio enfermo29,33,34,40, y se han utilizado unos umbrales de aproximadamente 1.000 ms (a 1,5 T) y del 30% respectivamente33,42–45. En 52 pacientes con miocardiopatía dilatada (MCD) o hipertrófica (MCH) y 30 controles, el T1 nativo fue el parámetro que mostró mayor exactitud para diferenciar el miocardio sano del enfermo, con sensibilidad del 100%, especificidad del 96% y exactitud diagnóstica del 98% (área bajo la curva = 0,99; intervalo de confianza del 95% [IC95%], 0,96-1,00; p < 0,001)37.
Tiempos T1 nativos y volumen extracelular del miocardio normal (estudios con al menos 30 participantes)
| Estudio | n | Secuencia | T1 nativo (ms) | VEC (%) |
|---|---|---|---|---|
| 1,5 T | ||||
| Dabir et al.19 | 34 | MOLLI | 950 ± 21 | 25 ± 4 |
| Rogers et al.29 | 38 | MOLLI | 952 ± 41 | NA |
| Reiter et al.30 | 40 | MOLLIa | 984 ± 28 | NA |
| Fontana et al.31 | 50 | shMOLLI | NA | 27 ± 3 |
| IR-GRE | NA | 26 ± 3 | ||
| Luetkens et al.32 | 50 | MOLLI | 967 ± 28 | 27,7 ± 5,8 |
| shMOLLI | 831 ± 27 | 25 ± 4,5 | ||
| Kellman et al.33 | 62 | MOLLIa | 965 ± 35 | 25,4 ± 2,5 |
| Sado et al.34 | 81 | IR-GRE | NA | 25,3 ± 2,9 |
| Piechnik et al.35 | 342 | shMOLLI | 953 ± 23 | NA |
| Liu et al.36 | 625 mujeres | MOLLI | 986 ± 45 | 28,1 ± 2,8 |
| 606 varones | 968 ± 38 | 25,8 ± 2,9 | ||
| 3 T | ||||
| Puntmann et al.37 | 30 | MOLLI | 1.070 ± 55 | 27 ± 9 |
| Neilan et al.38 | 32 | Look-locker | NA | 28 ± 3 |
| Dabir et al.19 | 32 | MOLLI | 1.052 ± 23 | 26 ± 4 |
| Rogers et al.29 | 38 | MOLLI | 1.087 ± 60 | NA |
| Von Knobelsdorff-Brenkenhoff et al.28 | 60 | MOLLI | 1.158,8 (1.074,0-1.250,1)b | NA |
| Liu et al.39,c | 92 | MOLLI | 1.232 ± 51 | NA |
IR–GRE: eco de gradiente de inversión-recuperación; MOLLI: inversión-recuperación de look-locker modificada; NA: no aplicable; shMOLLI: versión corta de MOLLI; VEC: volumen extracelular.
Los valores de T1 y VEC se expresan en forma de media ± desviación estándar.
En la tabla 2 se resumen los valores normales del T2 miocárdico4,27,28,32,46–48. A 1,5 T, el T2 es del orden de 50–60 ms (ligeramente < 3 T) y se ha descrito un posible aumento con el aumento de la edad49. Aunque mucho menos validado, el T2 puede usarse también para diferenciar el miocardio normal del anormal, con un valor de corte próximo a los 60 ms27,50–52.
Tiempos T2 nativos del miocardio normal (estudios con al menos 20 participantes)
| Estudio | n | Secuencia | T2 nativo (ms) |
|---|---|---|---|
| 1,5 T | |||
| Sprinkart et al.26 | 20 | GraSE | 52,2 ± 2 |
| Radunski et al.46 | 21 | T2-SSFP | 55 [54-60]a |
| Mordi et al.47 | 21 | T2-SSFP | 52,9 ± 3,3 |
| Thavendiranathan et al.27 | 30 | T2-SSFP | 54,5 ± 2,2 |
| Baessler et al.4 | 30 | GraSE | 58,6 ± 4,2 |
| T2-SSFP | 52,5 ± 2,5 | ||
| Luetkens et al.32 | 50 | GraSE | 52,4 ± 2,6 |
| Wassmuth et al.48 | 69 | T2-SSFP | 55 ± 5 |
| T2-GRE | 52 ± 5 | ||
| 3 T | |||
| Baessler et al.4 | 30 | GraSE | 54,2 ± 4,1 |
| T2-SSFP | 44 ± 3,2 | ||
| Von Knobelsdorff-Brenkenhoff et al.28,a | 60 | T2-SSFP | 45,1 (39,9-50,1)b |
GraSE: secuencia de gradiente de espín-eco; T2-GRE: eco de gradiente con preparación T2; T2-SSFP: precesión libre de equilibrio estable con preparación T2.
Los tiempos T2 se expresan en forma de media ± desviación estándar.
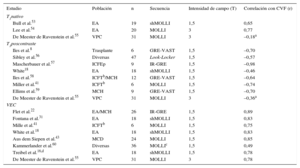
Además de los experimentos realizados en phantom y en animales, las técnicas de mapeo T1 se han validado mediante comparación con la histología del miocardio humano8,16,18,22,31,41,43,53–60 (tabla 3). Es importante señalar que estos estudios incluyen datos de diversas situaciones clínicas, como MCH, MCD, insuficiencia cardiaca con fracción de eyección conservada, insuficiencia cardiaca en fase terminal o valvulopatías cardiacas. En la mayoría de los estudios se utilizó biopsia endomiocárdica para la validación, aunque en dos de ellos se examinaron corazones enteros explantados. Dos estudios han mostrado correlaciones significativas del T1 nativo con la fracción de volumen de colágeno, si bien un tercer estudio no observó una asociación significativa. La mayor parte de los estudios identificaron también correlaciones significativas entre el T1 poscontraste y la cantidad de colágeno, habitualmente de un modo menos uniforme que con el VEC (tabla 3). Este tiende a proporcionar valores superiores a los de la fracción de volumen de colágeno, lo que probablemente refleje que el espacio intersticial no está ocupado exclusivamente por tejido conjuntivo.
Estudios de validación del mapeo T1 mediante comparación con la histopatología (fracción de volumen de colágeno)
| Estudio | Población | n | Secuencia | Intensidad de campo (T) | Correlación con CVF (r) |
|---|---|---|---|---|---|
| T1nativo | |||||
| Bull et al.53 | EA | 19 | shMOLLI | 1,5 | 0,65 |
| Lee et al.54 | EA | 20 | MOLLI | 3 | 0,77 |
| De Meester de Ravenstein et al.55 | VPC | 31 | MOLLI | 3 | –0,18a |
| T1poscontraste | |||||
| Iles et al.8 | Trasplante | 6 | GRE-VAST | 1,5 | –0,70 |
| Sibley et al.56 | Diversas | 47 | Look-Locker | 1,5 | –0,57 |
| Mascherbauer et al.57 | ICFEp | 9 | IR-GRE | 1,5 | –0,98 |
| White18 | EA | 18 | shMOLLI | 1,5 | –0,46 |
| Iles et al.58 | ICFTb/MCH | 12 | GRE-VAST | 1,5 | –0,64 |
| Miller et al.41 | ICFTb | 6 | MOLLI | 1,5 | –0,74 |
| Ellims et al.59 | MCH | 9 | GRE-VAST | 1,5 | –0,70 |
| De Meester de Ravenstein et al.55 | VPC | 31 | MOLLI | 3 | –0,36a |
| VEC | |||||
| Flet et al.22 | EA/MCH | 26 | IR-GRE | 1,5 | 0,89 |
| Fontana et al.31 | EA | 18 | shMOLLI | 1,5 | 0,83 |
| Mille et al.41 | ICFTb | 6 | MOLLI | 1,5 | 0,75 |
| White et al.18 | EA | 18 | shMOLLI | 1,5 | 0,83 |
| Aus dem Siepen et al.43 | MCD | 24 | MOLLI | 1,5 | 0,85 |
| Kammerlander et al.60 | Diversas | 36 | MOLLIc | 1,5 | 0,49 |
| Treibel et al.16,d | EA | 18 | shMOLLI | 1,5 | 0,78 |
| De Meester de Ravenstein et al.55 | VPC | 31 | MOLLI | 3 | 0,78 |
CVF: fracción de volumen de colágeno; EA: estenosis aórtica; GRE: eco de gradiente; ICFEp: insuficiencia cardiaca con fracción de eyección preservada; ICFT: insuficiencia cardiaca en fase terminal; IR: inversión-recuperación; MCD: miocardiopatía dilatada; MCH: miocardiopatía hipertrófica; MOLLI: inversión-recuperación de look-locker modificada; shMOLLI: versión corta de MOLLI; VAST: muestreo temporal variable de espacio k; VEC: volumen extracelular; VPC: valvulopatía cardiaca.
Los datos de validación histológica del mapeo T2 escasean mucho más. Hasta el momento, solo una publicación ha demostrado elevación del T2 en casos de miocarditis confirmada mediante biopsia51 y se ha comparado una secuencia de mapeo T2 moderna con el contenido de agua real del miocardio empleando las intensidades de campo de uso actual61.
MAPEO T1 Y T2 CLÍNICOEl mapeo T1 es el más ampliamente utilizado en los estudios clínicos. Con la excepción de los trastornos de acumulación de hierro y lípidos, las enfermedades del miocardio causan elevaciones del T1 nativo (tabla 4). No es de extrañar que el VEC aumente también en la mayoría de los trastornos, en especial el infarto de miocardio (IM) y la amiloidosis (tabla 4). El mapeo T2 se ha utilizado principalmente en la enfermedad isquémica aguda y en la inflamatoria.
Cambios del T1 nativo y el volumen extracelular en diferentes enfermedades
| T1 nativo | Volumen extracelular | |
|---|---|---|
| Hipertensión | ↑ | ↑ |
| Diabetes mellitus | ↑ | ↑ |
| Insuficiencia cardiaca con fracción de eyección preservada | ↑ | ↑ |
| Infarto agudo de miocardio | ↑↑ | ↑↑ |
| Infarto crónico de miocardio | ↑ | ↑↑ |
| Miocarditis | ↑↑ | ↑ |
| Otras miocardiopatías inflamatorias | ↑ | ↑ |
| Amiloidosis | ↑↑ | ↑↑ |
| Enfermedad de Anderson-Fabry | ↓ | ↔ |
| Hemosiderosis | ↓ | ↔ ↑ |
| Miocardiopatía hipertrófica | ↑ | ↑ |
| Miocardiopatía dilatada | ↑ | ↑ |
| Cardiopatía congénita | ? | ↑ |
| Valvulopatía | ↑ | ↑ |
↑: aumento; ↓: disminución; ↔: sin cambio; ?: desconocido.
Se ha demostrado una reducción del tiempo T1 poscontraste tanto en la insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo (VI) reducida como en la insuficiencia cardiaca con fracción de eyección conservada, con correlaciones con el grado de disfunción diastólica8,57. Se ha descrito también un aumento de los valores de T1 nativo y VEC, que se ha validado en la MCD37,43. El mapeo miocárdico de T2, VEC y, en especial, T1 nativo resultaron útiles en la identificación de las fases iniciales de la MCD no isquémica y en su diferenciación respecto al corazón del deportista en un estudio reciente47.
Los factores de riesgo cardiovascular que contribuyen a producir la insuficiencia cardiaca y en especial la insuficiencia cardiaca con fracción de eyección conservada son, entre otros, la hipertensión arterial y la diabetes mellitus. En estudios recientes se ha demostrado un aumento de los valores del T1 nativo y el VEC en presencia de cardiopatía hipertensiva, definida como hipertrofia del VI o por alteración de la mecánica, pero no por la hipertensión en sí62. Se ha demostrado también un aumento independiente del VEC en la diabetes mellitus63. Además, los índices de mapeo T1 anormales que indican fibrosis se asocian con unas puntuaciones de riesgo cardiovascular crecientes en la población general, sobre todo los varones64. Tanto en los individuos aparentemente sanos como en los que tienen enfermedad, los índices de T1 se han relacionado con disfunción sistólica y diastólica del VI, remodelado y deterioro energético, incluso en ausencia de RTG20,40,42,65,66.
En la hipertensión pulmonar, se ha demostrado un aumento del VEC en los puntos de inserción del ventrículo derecho a nivel del tabique en un modelo animal grande67 y más recientemente en la pared libre en pacientes68, con una asociación significativa con la hemodinámica pulmonar y la función ventricular derecha.
Cardiopatía isquémicaLas técnicas de RMC tienen una gran exactitud en la determinación de los volúmenes ventriculares y la función ventricular y presentan la ventaja adicional de ser capaces de caracterizar el miocardio y mostrar cambios asociados al daño isquémico, como necrosis/fibrosis, edema, obstrucción microvascular y hemorragia intramiocárdica69. Los mapeos de T1 y T2 nativos pueden utilizarse para detectar el edema miocárdico en la lesión isquémica aguda con exactitud y reproducibilidad mayores que con las imágenes estándares potenciadas en T270,71. La determinación del tamaño del área en riesgo mediante las elevaciones de T1 o T2 se ha validado mediante comparación con la técnica de microesferas fluorescentes en modelos animales72 y con gammagrafía en pacientes44. El mapeo T2 ha permitido también la realización de un análisis cuantitativo de la evolución temporal del edema tras el IM73.
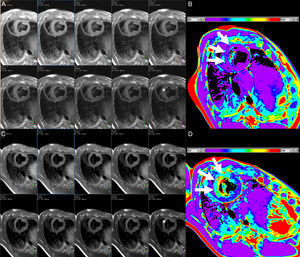
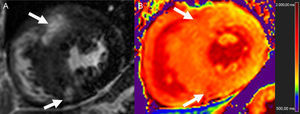
En el contexto del IM, se utilizó el mapeo T1 en un estudio inicial para evaluar el infarto agudo (8 días) y crónico (6 meses). La elevación del T1 nativo (3 desviaciones estándares por encima del valor observado en el miocardio distante) detectó el IM agudo con sensibilidad y especificidad del 96 y el 91% respectivamente, mientras que el T1 poscontraste fue superior en la identificación del IM crónico74. No resulta extraño que el VEC en las regiones infartadas muestre una notable elevación, generalmente ≥ 50%33,34,75. Los tiempos T1 nativos son máximos en la fase aguda y tienden a sobrestimar el tamaño del infarto, en consonancia con el mayor contenido de edema74,75 y, aunque luego se mantienen elevados, su especificidad es alta, pero tienen una sensibilidad baja en la detección del IM crónico76. Los tiempos T2 están elevados también en el IM agudo (figura 4), en el que el mapeo T2 es nuevamente superior a las imágenes potenciadas en T2 estándares50. Los valores de T1 y T2 están reducidos cuando hay obstrucción microvascular o hemorragia intramiocárdica50,75, y la presencia de una disminución del T1 nativo en el núcleo del IM se ha relacionado con un aumento posterior del riesgo de muerte u hospitalización por insuficiencia cardiaca77.
Proyecciones de eje corto consecutivas de una secuencia de mapeo T2 con tiempos de eco crecientes (A y C, de izquierda a derecha y de arriba a abajo) y mapas de T2 correspondientes (B y D) en un animal en la situación basal (A y B) y después de un infarto de miocardio inducido experimentalmente (C y D). Obsérvese la diferencia de intensidad de señal con los tiempos de eco crecientes en la parte anterior del tabique después del infarto pero no en la situación basal (asteriscos). Los mapas T2 muestran unos valores de T2 normales en la parte anterior del tabique en la situación basal, pero con un aumento notable después del infarto de miocardio (flechas blancas). Las barras blancas indican la gama del código de colores de los valores de T2. Imágenes cortesía del Dr. Javier Sánchez-González.
Recientemente se ha descrito la viabilidad de detectar isquemia durante las pruebas de estrés farmacológico sin medios de contraste determinando el T1 nativo miocárdico78.
Miocardiopatías inflamatoriasMiocarditisEl método estándar utilizado para el diagnóstico de la miocarditis aguda por RMC se basa en la combinación de diferentes técnicas, incluidas las imágenes potenciadas en T2, la captación temprana de gadolinio y la RTG (criterios de Lake-Louise)79. Sin embargo, cada vez hay más datos que indican un rendimiento diagnóstico superior del mapeo miocárdico. El T2 muestra una elevación anormal en la miocarditis aguda, incluso en ausencia de RTG o anomalías del movimiento de la pared apreciables visualmente, y su rendimiento es superior al de las imágenes potenciadas en T2 estándares27. En 50 pacientes con sospecha de miocarditis aguda (mediana de tiempo desde la presentación clínica inicial, 3 días), el tiempo T1 nativo ≥ 990 ms tuvo una sensibilidad del 90% y especificidad y exactitud del 91% en la diferenciación respecto a los controles. Mostró una sensibilidad superior a la de las imágenes potenciadas en T2 y el RTG, lo que puede ser de especial utilidad en la detección de una enfermedad focal sutil cuando no es posible la administración de gadolinio45. En otra publicación del mismo grupo, el mapeo T1 nativo detectó áreas afectadas significativamente mayores que las identificadas por las imágenes potenciadas en T2 y con RTG identificó áreas de lesión en las que estas técnicas fueron negativas, y mejoró la fiabilidad diagnóstica en otro 30% de los casos80. Se realizaron observaciones similares de mayor exactitud del T1 nativo respecto a los criterios de Lake-Louise e incluso respecto al VEC en los casos de sospecha de miocarditis (mediana de tiempo de evolución, 3 días) empleando un umbral de T1 nativo ≥ 1.140 ms a 3 T81. En un estudio más reciente, esos mismos autores realizaron a 34 pacientes con sospecha de miocarditis aguda (también con mediana de tiempo de 3 días) mapeo miocárdico, RMC estándar y cuantificación del strain longitudinal. El mapeo de T1 y T2 nativos mostró mayor exactitud (áreas bajo la curva de 0,95 y 0,92 respectivamente) que el VEC y los criterios estándares y mejoró hasta 0,98 cuando se combinó el T1 nativo con el RTG32.
En otro estudio se evaluó a 104 pacientes con miocarditis aguda/subaguda diagnosticada clínicamente (mediana de tiempo desde el inicio de los síntomas, 2 semanas) que presentaban un cuadro clínico inicial de insuficiencia cardiaca o dolor torácico. El VEC fue el parámetro que proporcionó mejor exactitud diagnóstica (76%), en comparación con el mapeo de T1 y T2 nativos (el 69 y el 63% respectivamente), y a su vez estos fueron similares a los criterios de Lake-Louise (exactitud de un 59-70%). Un uso escalonado del RTG (con alta especificidad), seguido del VEC miocárdico general (≥ 27%) en caso de que el RTG fuera negativo, mejoró significativamente la exactitud diagnóstica en comparación con la de los criterios de Lake-Louise (el 90 frente al 79%; p = 0,004)46. En un estudio de 165 pacientes con miocarditis diagnosticada clínicamente, se dividió a la población en un grupo de pacientes en fase aguda (n = 61; mediana de tiempo tras la presentación clínica, 5 días) y un grupo en fase de convalecencia (n = 67; mediana, 6 meses). Mientras que el mapeo T1 nativo mostró la máxima exactitud (99%) en la fase aguda, superando nuevamente a la de la RMC estándar, en la fase de convalecencia el RTG fue superior (exactitud del 94%). Los autores demostraron que la miocarditis aguda puede identificarse de manera independiente por un T1 nativo > 5 desviaciones estándares por encima de la media del intervalo de normalidad, mientras que la convalecencia se define mejor por un T1 nativo anormal > 2 desviaciones estándares o por la presencia de RTG, lo que luego se validó en una cohorte independiente82. En 31 pacientes con insuficiencia cardiaca de nueva aparición (mediana de tiempo desde la presentación clínica, 1 mes), el mapeo T2 permitió diferenciar a los pacientes con y sin inflamación demostrada histológicamente, con una exactitud moderada (área bajo la curva = 0,78), mientras que esto no fue posible con los criterios estándares, el T1 nativo o el VEC51.
En conjunto, estos resultados apuntan a un posible papel importante del mapeo miocárdico en la evaluación de la miocarditis, si bien, y de modo similar a lo que ocurre con los criterios de Lake-Louise, es probable que la exactitud y la utilidad de los diferentes índices dependan de la forma de presentación clínica y el estadio de la enfermedad.
OtrasSe han descrito valores elevados de los tiempos T1 y T2 nativos en series pequeñas de pacientes con miocardiopatía de tako-tsubo27,71. De manera análoga, más de la mitad de una serie de 50 pacientes con sarcoidosis extracardiaca demostrada presentaron valores de T2 elevados independientemente de la presencia de RTG83. Después del trasplante cardiaco, la prolongación del T2 miocárdico puede ser un signo de rechazo o rechazo inminente, y se normaliza tras el tratamiento inmunosupresor52,84.
Los estudios preliminares indican otro posible uso del mapeo de RMC para detectar la afección cardiaca en trastornos autoinmunitarios. En una serie de 24 pacientes con lupus eritematoso sistémico, se observaron aumentos del tiempo T2 en comparación con los controles, lo cual indica inflamación miocárdica subclínica85. En otros estudios se han descrito aumentos del T1 nativo y el VEC en la artritis reumatoide y la esclerodermia sistémica, que están correlacionados con los marcadores de la actividad de la enfermedad86,87, así como en el lupus88, de manera independiente de la presencia de RTG. No está claro si estas alteraciones reflejan inflamación, fibrosis difusa o ambas.
Miocardiopatías infiltrantes y de depósitoAmiloidosisEn la amiloidosis cardiaca, la RMC muestra con frecuencia un patrón característico de RTG general con predominio subendocárdico, junto con una cinética del gadolinio anormal en el miocardio y en el total de la sangre89. Aunque la RMC muestra ya gran exactitud, el mapeo de T1 puede aportar información adicional (figura 5).
Mapas de T1 nativo (A y C) y T1 poscontraste (B y D) a 3 T en pacientes sin (fila superior) y con amiloidosis cardiaca (fila inferior). Obsérvese el aumento del T1 nativo y la disminución del T1 poscontraste en la amiloidosis, que se traduce en un aumento notable del volumen extracelular (el 21 frente al 46% respectivamente).
El T1 nativo presenta una elevación anormal en diferentes formas de amiloidosis cardiaca. En 51 pacientes con amiloidosis primaria, el T1 miocárdico (1,5 T) presentó una elevación significativa en los que tenían afección cardiaca (1.140 ± 61 ms) en comparación con los participantes sanos (958 ± 20 ms; p < 0,001). El T1 aumentó a pesar de que la presencia de afección cardiaca fuera incierta (1.048 ± 48 ms) o se pensara que no la había (1.009 ± 31 ms; p < 0,01 en ambos casos). Un valor de corte de 1.020 ms tuvo una exactitud del 92% en la identificación de afección cardiaca posible o definida90. En otra serie de 79 pacientes con amiloidosis primaria y 85 con amiloidosis hereditaria por mutación del gen de la transtiretina, se observaron aumentos del T1 en ambos tipos, que fueron significativos en comparación con los controles y con pacientes con MCH (área bajo la curva = 0,85 frente a estos). En la amiloidosis hereditaria por transtiretina, el tiempo T1 está correlacionado con la carga de amiloide determinada mediante gammagrafía91. Un estudio de mayor tamaño92 confirmó estas observaciones y la mayor elevación del T1 en la amiloidosis de cadena ligera (1.126 ± 70 ms) en comparación con la amiloidosis hereditaria por transtiretina (1.101 ± 46 ms; p < 0,05). Como ya se ha mencionado, el VEC muestra una notable elevación en la amiloidosis, habitualmente del orden de un 40–70%20,92–94, incluso en segmentos sin RTG o aumento del grosor de la pared evidentes93. De nuevo, parece que haya diferencias entre los distintos subtipos de amiloidosis, con mayor VEC en la variante de transtiretina (el 58 ± 6% frente al 54 ± 7%; p = 0,001)92.
El VEC y el T1 miocárdico nativo muestran correlación con los marcadores de la gravedad de la enfermedad en la amiloidosis, como el grosor de la pared, la disfunción sistólica y diastólica, las anomalías electrocardiográficas, los biomarcadores séricos y la clase funcional90,92–94.
Enfermedad de Anderson-FabryLa enfermedad de Anderson-Fabry es un trastorno lipídico minoritario e infradiagnosticado que cursa con hipertrofia del VI. A diferencia de lo que ocurre en otros trastornos infiltrantes, el T1 nativo está acortado, pero el VEC se mantiene normal y el grado de reducción se correlaciona con el contenido lipídico95. En un estudio se evaluó a pacientes con enfermedad de Anderson-Fabry (n = 44) o hipertrofia del VI de otras etiologías (n = 105) y controles sanos (n = 67). El T1 septal nativo fue inferior en los pacientes con enfermedad de Anderson-Fabry que en los controles y superior en los casos de hipertrofia (882 ± 47, and 968 ± 32 y 1.018 ± 74 ms respectivamente; p < 0,0001). No hubo solapamiento entre la enfermedad de Anderson-Fabry y otras formas de hipertrofia, y es importante resaltar que fue anormal en los pacientes genéticamente positivos que tenían un grosor normal de la pared96.
HemosiderosisLa sobrecarga de hierro es otro trastorno que causa un significativo acortamiento del T1. El hierro férrico altera el campo magnético local, y se caracteriza generalmente por una reducción del T2* (ampliamente utilizado en la práctica clínica)2. En el contexto de la sobrecarga de hierro miocárdica, el T1 acortado muestra también una intensa correlación con el T2*97,98 y se ha validado histológicamente en modelos animales99. En consecuencia, el mapeo del T1 nativo puede pasar a ser un método alternativo para la detección del hierro cardiaco (T1 < 900 ms a 1,5 T) y su cuantificación, con las posibles ventajas de presentar menos artefactos de imagen, una mejor identificación de la carga de hierro leve y una mayor reproducibilidad97. El T2 se correlaciona también con el T2* y el grado de depósito de hierro99, y se ha descrito una asociación inversa más débil (pero significativa) entre el T2* y el VEC98.
Miocardiopatía hipertróficaEn un estudio de 130 pacientes con MCH y 25 controles, se utilizó el mapeo T1 para evaluar los patrones regional y difuso de la fibrosis miocárdica. Los tiempos T1 poscontraste se redujeron en la MCH (figura 6) y, mientras que una mayor cantidad de RTG se asoció a reducción de la función sistólica del VI y menor obstrucción del tracto de salida, los pacientes con valores de T1 poscontraste inferiores sufrieron mayor deterioro sistólico y más disnea59.
Proyección de eje corto de realce tardío de gadolinio (A) y mapa de T1 nativo correspondiente a 3 T (B) en un paciente con miocardiopatía hipertrófica. Obsérvese el aumento de T1 en el tabique en comparación con la pared lateral, en especial en las áreas de captación tardía de gadolinio (flechas).
El T1 nativo y el VEC están aumentados también en la MCH34,37,65. Se han descrito anomalías del T1 nativo en segmentos miocárdicos sin RTG en pacientes con MCH37,65, aunque el VEC fue similar al de los controles sanos en un estudio100. Esto puede explicarse por la presencia simultánea de miocitos hipertróficos; por lo tanto, el VEC total (VEC × masa miocárdica) puede ser un mejor indicador de la expansión en los pacientes con MCH o amiloidosis92. Parece que el VEC, y en especial el mapeo de T1 nativo, pueden diferenciar tanto la MCH de la cardiopatía hipertensiva como a los pacientes portadores de una mutación sarcomérica de los controles normales, incluso en ausencia de hipertrofia del VI o RTG42,101. Estos datos aportan respaldo adicional al concepto de que el remodelado fibroso se desencadena de manera temprana en el proceso de la enfermedad.
El Hypertrophic Cardiomyopathy Registry (NCT01915615) es un estudio multicéntrico internacional que se está llevando a cabo actualmente y en el que se pretende incluir a un total de 2.750 pacientes con MCH; se espera que aporte una perspectiva importante respecto al posible valor clínico del mapeo T1 en esta enfermedad102.
Cardiopatía congénitaSe realizó un mapeo T1 en el ventrículo sistémico de 50 pacientes adultos con diversas anomalías congénitas, y se observó un aumento del VEC, en especial en los casos de ventrículo derecho sistémico o cardiopatía cianótica103. Una publicación reciente ha observado también una fibrosis miocárdica difusa en pacientes con tetralogía de Fallot reparada y señala que los valores de VEC biventriculares estaban aumentados y mostraban correlación positiva, probablemente secundaria a una interacción interventricular adversa. El aumento del VEC se asoció tanto a la sobrecarga de volumen del ventrículo derecho como a la arritmia104, y es posible que tenga alguna utilidad para establecer el pronóstico de estos pacientes105.
Valvulopatías cardiacasComo se indica en la tabla 3, varios estudios de validación han demostrado un aumento del T1 miocárdico nativo y el VEC en los pacientes con estenosis aórtica, que se ha asociado a un aumento de la fibrosis intersticial en las muestras histológicas. En pacientes jóvenes con estenosis aórtica congénita, el VEC fue superior al de los participantes sanos y mostró correlación con los índices ecográficos de la disfunción diastólica106. Aunque en este estudio el VEC no mostró asociación con la gravedad de la estenosis, los estudios realizados en pacientes adultos de más edad con una enfermedad degenerativa han mostrado correlaciones de este tipo, así como asociación con el deterioro de las funciones diastólica y sistólica del VI53,54,107.
Por lo que respecta a las lesiones con insuficiencia valvular, en un estudio transversal se comparó a 35 pacientes con insuficiencia mitral degenerativa primaria moderada o grave, asintomática y sin indicación de clase I para el tratamiento quirúrgico, con controles apareados por edad y sexo. El VEC estaba aumentado en los pacientes y se asoció a aumento del volumen del VI y la aurícula izquierda y reducción de la función sistólica y el consumo máximo de oxígeno108.
PronósticoEl posible valor pronóstico de los índices de mapeo está siendo objeto de intenso estudio. Los estudios iniciales indican que el VEC puede tener como mínimo el mismo valor pronóstico que la fracción de eyección del VI y resaltan el papel del intersticio miocárdico como causa de la «vulnerabilidad» del paciente63,109. En una serie amplia de un solo centro109 con un total de 1.172 pacientes consecutivos sin amiloidosis, MCH ni miocardiopatía de estrés remitidos a una RMC, se demostró un aumento del riesgo de muerte u hospitalización por insuficiencia cardiaca a lo largo de una mediana de 1,7 años (por cada 5% de aumento del VEC, hazard ratio [HR] = 1,85; IC95%, 1,50-2,27), tras un ajuste respecto a múltiples factores de confusión como edad, fracción de eyección del VI y tamaño del IM. El mismo grupo describió un valor pronóstico comparable en los pacientes diabéticos63. En otra serie de 473 pacientes consecutivos remitidos a RMC que no presentaban MCH, amiloide ni enfermedad de Anderson-Fabry, el VEC fue un factor predictivo de los eventos cardiovasculares posteriores, si bien no mantuvo la significación estadística tras introducir un ajuste respecto a las variables clínicas60. El VEC calculado sin determinación directa del hematocrito mostró también capacidad predictiva de mortalidad (por cada 5% de aumento del VEC, HR = 1,9; IC95%, 1,55-2,31)16.
Los estudios mencionados han investigado las asociaciones del mapeo T1 en poblaciones no seleccionadas remitidas a un examen de RMC. Más recientemente, en un registro prospectivo multicéntrico se identificó el T1 nativo como el más potente factor independiente predictivo de muerte y hospitalización por insuficiencia cardiaca en 637 pacientes con MCD no isquémica seguidos una mediana de 22 meses110. En otro estudio prospectivo de 100 pacientes con MCD isquémica y no isquémica a los que se implantó un desfibrilador, se identificó que el T1 nativo era un factor independiente predictivo de tratamiento antiarrítmico apropiado durante el seguimiento111. En un estudio prospectivo de 100 pacientes con insuficiencia cardiaca con fracción de eyección preservada, el T1 poscontraste, el área auricular izquierda y la resistencia vascular pulmonar mostraron asociación significativa con los resultados (muerte u hospitalización por insuficiencia cardiaca)57. En la amiloidosis cardiaca, la determinación visual del T1 miocárdico poscontraste anormal y de la cinética del contraste en una secuencia de look-locker fue el más potente factor predictivo de la mortalidad (HR ajustada = 5,5; IC95%, 2,7-11,0; p < 0,0001) en 90 pacientes con sospecha de afección cardiaca112. En una serie reciente de 100 pacientes con amiloidosis primaria seguidos una mediana de 23 meses, tanto el T1 nativo (> 1.044 ms a 1,5 T) como el VEC (> 45%) fueron marcadores del aumento de riesgo de muerte, y el VEC continuó mostrando asociación significativa con la mortalidad en los modelos multivariables (HR ajustada = 4,4; IC95%, 1,4-14,4; p = 0,01)94.
Aunque la demostración de la presencia de edema en las imágenes potenciadas en T2 estándar se ha relacionado con los resultados clínicos en los síndromes coronarios agudos113, aún no se ha realizado ningún estudio que haya explorado las posibles consecuencias pronósticas del mapeo T2.
PERSPECTIVAS FUTURASEl mapeo miocárdico con RMC se está convirtiendo rápidamente en un método útil para el diagnóstico y la caracterización de diversas miocardiopatías, y proporciona mediciones cuantitativas objetivas, incluso sin necesidad de utilizar medios de contraste. No obstante, continúan existiendo diversas dificultades que será preciso superar antes de que pueda implantarse un uso clínico generalizado. Como ya se ha comentado, cada uno de los diferentes métodos utilizados para la cuantificación de los tiempos T1 y T2 del miocardio tiene puntos fuertes y limitaciones específicas, y proporciona valores ligeramente diferentes (tabla 1 y tabla 2). En consecuencia, habrá que estandarizar el mapeo miocárdico de modo similar a lo que se ha hecho con las imágenes de RTG. Mientras tanto, los resultados pueden no ser necesariamente extrapolables entre las diversas secuencias, los diversos proveedores o los distintos centros, y las unidades que realicen mapeos T1 y T2 deben desarrollar su propia serie de valores de referencia normales6,15. La mayoría de las secuencias son sensibles a la presencia de arritmias y existe también la posibilidad de que se produzcan errores en la adquisición o el análisis6,24,48; no obstante, hay una buena reproducibilidad entre estudios y escáneres, en especial por lo que respecta al mapeo T129,35,55,114, pero también para el mapeo T226,48. Esto indica potencial para el uso en ensayos clínicos115 y se ha demostrado ya en modelos animales la viabilidad de usarlo para evaluar el efecto de los tratamientos116. Sin embargo, es preciso reconocer que el mapeo miocárdico todavía no está disponible de manera generalizada y continúa teniendo en gran parte un uso de investigación; en Estados Unidos no se ha autorizado todavía su uso clínico.
De manera similar a lo que ocurre con el RTG, las anomalías de los tiempos de relajación del miocardio no son específicas. Aunque la prolongación del T2 refleja en gran parte la presencia de inflamación, y el número de enfermedades que causan un acortamiento del T1 nativo es pequeño, se puede observar aumento del T1 nativo y el VEC en prácticamente cualquier trastorno cardiaco (tabla 4). Así pues, los mapas miocárdicos tienen actualmente escasa utilidad como técnicas para uso aislado y es necesario interpretarlas en el contexto clínico. Además, la capacidad diagnóstica del mapeo miocárdico se ha evaluado a menudo mediante la comparación con controles sanos, mientras que en la práctica clínica se desea con más frecuencia un diagnóstico diferencial para pacientes que presentan síntomas similares a los de la posible enfermedad de referencia. Por último, serán necesarios más estudios y de mayor tamaño para establecer el valor diagnóstico y pronóstico adicional que aporta el mapeo de RMC al tener en cuenta otras variables clínicas, así como su potencial para orientar las intervenciones terapéuticas.
CONFLICTO DE INTERESESNinguno.