Palabras clave
INTRODUCCIÓN
El aislamiento circunferencial de las venas pulmonares (VP) ha demostrado ser un tratamiento eficaz de la fibrilación auricular1. Las lesiones de radiofrecuencia se realizan en una zona de transición entre los ostia de las VP (OVP) y la aurícula izquierda (AI), evitando la estenosis de las VP2, además de eliminar rotores, drivers y plexos ganglionares que ocupan esta región3. Es conocido que las impedancias (RB) de las VP (RVP), sus ostia y la AI (RAI) son diferentes4-7, por lo que se podría identificar la zona de transición utilizando mapas tridimensionales de impedancia para guiar la ablación con seguridad.
MÉTODOS
Se incluyó a 25 pacientes (15 en estudio basal y 10 en fase prospectiva) sometidos a ablación por fibrilación auricular paroxística (tabla 1). Se realizó ecocardiograma transesofágico y tomografía computarizada de tórax. El estudio se practicó bajo sedación con remifentanilo y anticoagulación con heparina sódica. Mediante punción transeptal se introdujeron en la AI un catéter circular para cartografiar secuencialmente cada VP (Lasso, Biosense-Webster) y un catéter de ablación de punta irrigada de 3,5 mm (Navi-Star, ThermocoolTM, Biosense-Webster).
Construcción del mapa de impedancia
Componían el circuito de impedancia: el generador de radiofrecuencia (Stockert, Biosense-Webster), el catéter de ablación y el parche de referencia (Ref-Star, Biosense-Webster), colocado en todos los pacientes entre las vértebras dorsales 2 y 6. La RB se midió tras liberar desde el generador una corriente eléctrica de 50 kHz y baja amplitud (2μA). El contacto entre el catéter y el tejido se consideró óptimo si eran estables el movimiento del catéter y la señal eléctrica. En cada punto explorado, la RB fue medida al menos dos veces antes de registrarla. Para considerarla válida no debía variar más de 2 Ω en la misma posición.
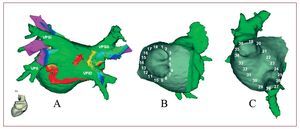
El mapa tridimensional de impedancias de la AI y las VP se realizó con un sistema de cartografía electroanatómica (CARTO XP, Biosense-Webster) con codificación en colores (rojo, el valor más bajo; violeta, el más alto) de las RB. Se reconstruyó cada VP y la AI en mapas independientes. Con el catéter de ablación se comenzó la adquisición de puntos desde en el interior de cada VP (1-3 cm) hasta el OVP, donde se tomaron puntos en toda su circunferencia. El OVP fue definido por la aparición simultánea de señal eléctrica correspondiente al potencial de VP junto al potencial de AI en el electrodo distal, y ausencia de potencial de VP en el proximal, coincidentes con la entrada del catéter en la silueta cardiaca. Se consideró que se estaba en la AI cuando coincidía la aparición de la señal eléctrica de AI en el electrodo distal sin potencial de VP, junto con un desplazamiento característico del catéter al salir de la vena. En la AI se tomaron puntos en pared posterior, techo, septum, anillo mitral y orejuela, poniendo especial cuidado y adquiriendo el mayor número de puntos posible en la vecindad de los OVP. El mapa obtenido fue integrado a la imagen de la tomografía computarizada (CARTO MERGE Biosense-Webster) (fig. 1).
Fig. 1. A: mapa de impedancia integrado en la tomografía (CARTO MERGE). B-C: esquema de la toma de 36 puntos alrededor de las venas pulmonares (VP). VPID: VP inferior derecha. VPII: VP inferior izquierda. VPSD: VP superior derecha. VPSI: VP superior izquierda.
Fase prospectiva. Ablación
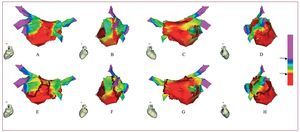
En los últimos 10 pacientes, un operador independiente que no conocía la situación del catéter en el CARTO, clasificó 36 puntos/paciente (fig. 1) como AI o OVP leyendo exclusivamente el valor de la RB. Se consideró impedancia límite de AI la RAI + 4% Ω (vide infra). Otro operador que no conocía el valor de la RB clasificaba el mismo punto como AI o OVP con CARTO. En todos se realizó una ablación circunferencial de las VP haciendo un cerclaje o corona de venas ipsolaterales (hasta la disminución de voltaje del electrograma auricular en un 90% o < 0,05 mV) según las líneas de impedancia del mapa (fig. 2), con aplicaciones de radiofrecuencia de 35 W y temperatura máxima de 45 °C. En caso de «distorsión» de la línea de impedancia, se utilizaba la imagen anatómica para decidir la aplicación. Si con el cerclaje no se conseguía el aislamiento de las VP —comprobado por la desaparición de todos los potenciales en cada VP con el catéter Lasso—, se aplicaba en el interior de la corona hasta alcanzar el objetivo de la ablación, que fue el aislamiento de todas las VP. Todos los pacientes fueron dados de alta con antiarrítmicos durante 3 meses y se hicieron una tomografía cardiaca de control.
Fig. 2. A-D: proyecciones de un mapa tridimensional de impedancias con un rango entre 133 Ω, límite inferior en la aurícula izquierda (AI) (rojo), y 166 Ω(violeta) que es el límite superior obtenido 1-3 cm dentro de las venas pulmonares (VP). Destaca el gradiente de impedancias desde las VP profundas hasta la AI, así como la transición AI-VP (rojo-verde). E-H: ablación (puntos rojos) siguiendo las líneas de impedancia en la unión VP-AI.
Se utilizó el paquete estadístico SPSS14 (Chicago, Illinois) para Windows. Para identificar diferencias significativas entre medias de impedancias se utilizó la prueba de la t de Student. Se trazó la curva ROC (receiver operating characteristic) para conocer de forma gráfica la sensibilidad y la especificidad de un determinado valor de impedancia que diferencie AI de OVP.
RESULTADOS
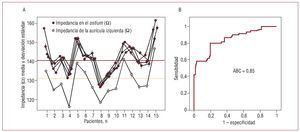
En los primeros 15 pacientes se observó un gradiente de RB desde el interior de las VP (1-3 cm) hasta a la AI: RVP, 165,4 ± 7,5 Ω; RVP ostium, 141,6 ± 7,3 Ω RAI, 131,09 ± 8,3 Ω (tabla 2), que se mantuvo individualmente en cada paciente (fig. 3A). La RAI no mostró diferencias en las diferentes zonas analizadas (septum, anillo mitral, pared posterior y techo), pero fue más alta en la base de la orejuela izquierda y en su vértice (tabla 2). Un valor de 136 Ω (RAI + 4% Ω) definió los límites de la AI con sensibilidad del 80%, especificidad del 80% y área bajo la curva ROC = 0,85 (intervalo de confianza del 95%, 0,79-0,90) (fig. 3B).
Fig. 3. A: gradiente de impedancias entre los ostia de las venas pulmonares (OVP) (por vena) y la aurícula izquierda (AI) en los primeros 15 pacientes. B: curva ROC de impedancia para diferenciar AI y OVP. ABC = área bajo la curva.
En los últimos 10 pacientes un observador que sólo conocía la RB clasificó como AI (≤ RAI + 4% Ω) 206 (85%) de 242 puntos de CARTO en la AI, y como OVP (> RAI AI + 4% Ω) 98 (83%) de 118 puntos de CARTO en los OVP (valor predictivo positivo del 91% y negativo del 73% para identificar la AI). Utilizando como guía las líneas de impedancia, se aislaron todas las VP, y fue necesario aplicar en el interior de la corona hasta en un 10% de las VP. Si la RB subía más de un 4% Ω, se paraba la aplicación de radiofrecuencia. El tiempo medio de radiofrecuencia para la corona izquierda fue 22 ± 9 min y para la derecha, 19 ± 6 min. No hubo complicaciones. Un 70% de los pacientes estaban libres de arritmias auriculares a los 5 ± 3 meses. No se han observado estenosis de las VP en la tomografía de tórax.
DISCUSIÓN
Existe un gradiente lineal de impedancias de mayor a menor desde las VP profundas hasta la AI, que es homogéneo y constante para cada paciente. Es posible reconstruir un mapa tridimensional de impedancias de la AI y de las VP en el que, ajustando la escala un 4% de la impedancia por encima del valor medio de la RAI, se puede delimitar la zona transicional para realizar el aislamiento circunferencial con seguridad.
El valor basal de la impedancia cardiaca está determinado por multitud de factores, algunos biológicos, como el volumen de sangre dentro de una cavidad, el radio de ésta o la resistividad pulmonar adyacente a una vena4-7. Hay que tener en cuenta también factores extrínsecos como el tamaño y la colocación del parche de referencia, el tamaño del electrodo del catéter de cartografía, la presión que se ejerce en el tejido, la fuente de energía utilizada y factores relacionados con el paciente, como la superficie corporal4-7. Todo ello hace que la RB varíe para cada investigador y cada centro, por lo que cada uno debería conocer sus valores. Lo importante es que, aunque cada paciente presente un RB diferente, se mantiene lineal y constante el gradiente descendente desde el interior de una VP hasta la AI en cada uno de ellos.
La unión entre la VP y la AI es una zona histológica compleja con fibras miocárdicas entrecruzadas en varias direcciones8. La resistividad eléctrica está determinada por la dirección de las fibras9 y el grado de fibrosis que pueden justificar las diferencia de RB obtenidas en esta zona. Hemos validado de forma prospectiva que RAI + 4% Ω delimita una zona de seguridad en la AI para guiar el aislamiento circunferencial. A diferencia del modelo utilizado por Lang et al7, consideramos más exacto un incremento porcentual y no absoluto de RAI, ya que varía de paciente a paciente.
Los mapas de cada VP, en vez de los tubos virtuales que se utilizan habitualmente, permiten delimitar su forma y observar el gradiente de impedancia cuando se acerca el catéter al OVP. De esta forma, pequeños ramos de las VP serán identificados y codificados con una impedancia mayor, con lo que se evita el riesgo de aplicar radiofrecuencia en su interior. También es útil cuando existen ramos accesorios derechos (dos en nuestra población).
La principal limitación del estudio es la identificación de los OVP en ausencia de imagen de las VP10. Las técnicas de imagen, con sus limitaciones, podrían haber ayudado a una localización más exacta del OVP, pero la combinación de fluoroscopia, señales eléctricas y desplazamiento del catéter utilizadas por nosotros pueden ser admitidas como válidas. Este estudio está limitado a pacientes sometidos a un único procedimiento de ablación y que presentan fibrilación auricular paroxística. Los resultados no deben trasladarse a pacientes ya sometidos a ablación o con fibrilación auricular crónica.
En conclusión, los mapas tridimensionales de impedancia permiten identificar la zona de transición entre los OVP y la AI, y son de ayuda para guiar el aislamiento circunferencial de las VP.
Full English text available from: www.revespcardiol.org
Adriano Jiménez-Velasco disfruta una beca de Biosense-Webster.
Correspondencia:
Dr. A. Pedrote.
Unidad de Arritmias. Servicio de Cardiología. Hospital Virgen del Rocío. Manuel Siurot, s/n. 41013 Sevilla. España.
Correo electrónico: pedroteal@hotmail.com
Recibido el 4 de febrero de 2008.
Aceptado para su publicación el 14 de mayo de 2008.