A menudo se excluye de los ensayos clínicos a los pacientes hemodinámica o eléctricamente vulnerables, por lo que escasea la información sobre el acceso vascular y el tratamiento antitrombótico óptimos. En este trabajo se estudia la evolución de los pacientes vulnerables con síndrome coronario agudo tratados invasivamente según el acceso fuera radial o femoral y el tratamiento fuera con bivalirudina o con heparina no fraccionada (HNF).
MétodosEl estudio MATRIX aleatorizó a 8.404 pacientes a acceso radial o femoral y a 7.213 pacientes a bivalirudina o a HNF. Se consideró vulnerables a 934 pacientes (11,1%) debido a clase Killip avanzada (808), parada cardiaca (168) o ambas a la vez (42). El objetivo primario compuesto a 30 días fueron los eventos cardiovasculares y cerebrovasculares mayores (MACE: muerte, infarto de miocardio e ictus) y los eventos clínicos adversos netos (NACE: MACE o hemorragia grave).
ResultadosEl acceso radial, comparado con el femoral, redujo los MACE y NACE de modo similar en pacientes vulnerables y no vulnerables. El acceso radial se asoció con un claro beneficio relativo en la mortalidad total y cardiovascular y las hemorragias BARC 3 o 5, con mayor beneficio absoluto en los pacientes vulnerables. Los efectos de la bivalirudina comparada con la HNF en MACE y NACE concuerdan entre pacientes vulnerables y no vulnerables. La bivalirudina se asoció con menores mortalidad cardiovascular y por todas las causas en pacientes vulnerables, pero no en los no vulnerables, con test de interacción en el límite. La bivalirudina redujo las hemorragias en ambos grupos de pacientes, con un beneficio absoluto mayor en el caso de los pacientes vulnerables.
ConclusionesEn pacientes con síndrome coronario agudo sometidos a tratamiento invasivo, los efectos de los tratamientos aleatorizados fueron concordantes entre los pacientes vulnerables y los no vulnerables, pero la reducción del riesgo absoluto del acceso radial y bivalirudina fue mayor en los vulnerables, con una reducción de 5 a 10 veces en el número de pacientes que es necesario tratar.
Número de registro: NCT01433627.
Palabras clave
En la intervención coronaria percutánea (ICP), con frecuencia se adopta el acceso radial (ATR) y, en pacientes con síndrome coronario agudo (SCA), aquel se prefiere al acceso femoral (ATF, transfemoral access) de acuerdo con las recomendaciones de las guías de práctica clínica1,2. Cuando se compara el ATF con el ATR, este último presenta varias ventajas, como tasas más bajas de hemorragia grave, menor tiempo de reposo en cama y alta hospitalaria más temprana, todo lo cual es muy importante para los pacientes con SCA con tratamiento invasivo. En cambio, han surgido dudas sobre el uso del ATR en pacientes vulnerables (PV), como aquellos con trastornos hemodinámicos (clase Killip avanzada) o eléctricos (supervivientes a parada cardiaca extrahospitalaria [PCEH]) concomitantes, en quienes el ATF aún podría continuar siendo preferible para tratarlos oportunamente. Estudios anteriores, como el estudio clave RIVAL, han excluido a los pacientes con shock cardiogénico y hay poca información sobre pacientes con PCEH en quienes se haya utilizado el TRA3.
La insuficiencia cardiaca (IC) se asocia con altas concentraciones de trombina que causan una formación más rápida de coágulos de fibrina compactos y resistentes. Datos de estudios observacionales recientes indican que los pacientes con IC sometidos a ICP podrían beneficiarse de un inhibidor directo de la trombina, como la bivalirudina, en lugar de un inhibidor indirecto, como la heparina no fraccionada (HNF), por los menores riesgos de mortalidad y hemorragia que la primera conlleva4,5.
Este estudio intenta realizar un análisis comparativo de la seguridad y la eficacia del ATR respecto al ATF y de la bivalirudina respecto a la HNF en PV con SCA y tratamiento invasivo.
MÉTODOSDiseño del estudio y selección de los pacientesEl diseño y los principales resultados del ensayo MATRIX ya se han descrito con anterioridad6–8.
A modo de resumen, el MATRIX (NCT01433627) es un programa de 3 ensayos aleatorizados independientes con una población de pacientes no seleccionados (all-comers) con SCA. El primer ensayo, MATRIX-Access Site, comparó el ATR con el ATF en 8.404 pacientes con SCA. El segundo ensayo, MATRIX-Antithrombin (n=7.213), fue una comparación aleatorizada de 2 estrategias antitrombóticas: bivalirudina, con el uso de inhibidores de la glucoproteína IIb/IIIa (iGPIIb/IIIa) limitado a complicaciones angiográficas (ausencia de reflujo o trombos gigantes) y HNF, con el uso de iGPIIb/IIIa a criterio del investigador. En el tercer ensayo, MATRIX-Treatment-Duration, se aleatorizó a los pacientes asignados a bivalirudina a una administración prolongada (después de la ICP) o una administración a corto plazo de bivalirudina (solo durante la ICP). Los PV presentaban IC aguda (clases Killip II-IV)9–11 o PCEH en el momento de la aleatorización. El consejo de revisión interno de cada centro participante aprobó el ensayo y todos los pacientes dieron su consentimiento informado por escrito.
Protocolo de estudio y aleatorizaciónSe aleatorizó a los pacientes a recibir tratamientos en proporción 1:1, con una aleatorización por bloques estratificada por tipo de SCA, uso previsto o continuo del inhibidor del P2Y12 (clopidogrel comparado con ticagrelor o prasugrel) y lugar del estudio. Todas las intervenciones se administraron de forma abierta. El abordaje según el lugar de acceso durante y después del diagnóstico o procedimiento terapéutico se dejó a criterio del médico responsable y se permitió el uso de dispositivos de cierre según la práctica local. Se administró bivalirudina de acuerdo con la ficha técnica del producto, con un bolo de 0,75mg/kg, seguido inmediatamente por una perfusión de 1,75mg/kg/h hasta la finalización de la ICP. En el caso de los pacientes asignados a un tratamiento prolongado con bivalirudina, la elección entre 2 pautas posológicas (dosis completa de hasta 4 h o dosis reducida de 0,25mg/kg/h al menos durante 6 h) se realizó a criterio de los médicos responsables. La HNF se administró a una dosis de 70-100 U o de 50-70 U/kg en función de si los pacientes no habían recibido o habían recibido iGPIIb/IIIa respectivamente. El posterior ajuste de la dosis de la HNF en función de la activación del tiempo de coagulación se dejó a criterio de los médicos responsables. Se pudo administrar un iGPIIb/IIIa antes de la ICP a todos los pacientes del grupo de HNF a criterio del médico responsable, pero en el grupo de bivalirudina el fármaco solo se administró a pacientes con complicaciones isquémicas periprocedimentales después de la ICP. Se permitió el uso de otros medicamentos según las guías de práctica clínica profesionales.
Seguimiento y resultados del estudioSe realizó seguimiento clínico a 30 días. Los 2 objetivos primarios compuestos a 30 días de los ensayos MATRIX-Access y Antithrombin fueron los eventos adversos cardiovasculares mayores (MACE), definidos como la combinación de mortalidad general, infarto de miocardio e ictus, y los eventos clínicos adversos netos (NACE), definidos como la combinación de MACE y hemorragia grave relacionada con injerto de revascularización no coronaria (Bleeding Academic Research Consortium [BARC] 3 o 5). El objetivo primario del MATRIX-Treatment-Duration fue la combinación de revascularización urgente del vaso diana, trombosis del stent confirmada y NACE. Entre los objetivos secundarios se encontraba cada componente de los objetivos compuestos, mortalidad cardiovascular y trombosis del stent (definido como la aparición probable o confirmada de un evento trombótico relacionado con el stent según la clasificación del Academic Research Consortium). También se evaluó la hemorragia y se confirmó con base en las escalas Thrombosis in Myocardial Infarction (TIMI) y Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Arteries (GUSTO). Todos los objetivos se establecieron previamente. Un comité independiente de eventos clínicos, que desconocía la asignación del tratamiento, confirmó todos los eventos sospechosos.
Análisis estadísticosLos ensayos MATRIX-Access y Antithrombin se elaboraron como estudios clínicos de superioridad con 2 objetivos primarios compuestos a 30 días, en los que se esperaba una reducción de la tasa del 30%, que correspondía a una razón de tasas de 0,70. Todos los análisis se realizaron según el principio por intención de tratar y se incluyó a todos los pacientes en el análisis en función del tratamiento asignado. Se tuvieron en cuenta los eventos hasta 30 días después de la aleatorización. Se analizaron independientemente los objetivos primarios y secundarios de PV y pacientes no vulnerables como tiempo hasta el primer evento utilizando el método Mantel-Cox, acompañado de pruebas del orden logarítmico para calcular los correspondientes valores bilaterales de p. No se realizó ningún ajuste para comparaciones múltiples, pero se estableció el error alfa al 2,5% para corregir los 2 objetivos primarios compuestos. Se analizaron los objetivos secundarios con un conjunto α bilateral al 5% para que fuera posible la interpretación convencional de los resultados. Las curvas de supervivencia se construyeron utilizando estimaciones de Kaplan-Meier. También se calcularon la diferencia absoluta del riesgo y el número de pacientes que es necesario tratar/número de pacientes expuestos necesario para que se produzca un evento (NNT/NNH). Se realizaron análisis secundarios en el grupo de PV para evaluar por separado los resultados clínicos en los subgrupos IC y PCEH. También se realizaron análisis estratificados según subgrupos preespecificados (volumen anual de ICP del centro, proporción de ICP radial del centro, edad, sexo, tipo de SCA, índice de masa corporal, inicio previsto o mantenimiento de prasugrel o ticagrelor, diabetes, estimación de la velocidad de filtrado glomerular, antecedentes de enfermedad vascular periférica, tratamiento anterior con heparina y aleatorización del lugar de acceso/tipo de antitrombina) y estimaciones de las posibles modificaciones del efecto utilizando términos de interacción o pruebas de tendencia en los grupos ordenados por separado de las poblaciones de estudio de PC y pacientes no vulnerables. También se realizaron análisis de sensibilidad mediante el análisis de regresión de Cox (no corregido y corregido) de los resultados primarios compuestos y la mortalidad general, y análisis de riesgo en competencia (de muerte) de los componentes individuales de los resultados primarios compuestos (IM, ictus y BARC 3 o 5). Todos los análisis se realizaron con el paquete estadístico Stata 15.1 y R 3.4.4.
RESULTADOSEn el ensayo MATRIX-Access participaron 8.404 pacientes con SCA de 78 centros de Italia, Países Bajos, España y Suecia entre octubre de 2011 y noviembre de 2014. Entre ellos, se consideró PV a 934 (11,1%): 808 pacientes debido a clase Killip avanzada (clase Killip II, 569; III, 167 y IV, 72), 168 por PCEH y un total de 42 pacientes por ambas (clase Killip II, 23; III, 6 y IV, 13). De todos ellos, se asignó a 462 (5,5%) a ATR y a 472 (5,6%) a ATF. Entre los 7.213 pacientes que participaron en el ensayo MATRIX-Antithrombin, 819 (11,4%) cumplían los criterios de PV: 698 pacientes debido a la clase Killip avanzada, 163 por PCEH y un total de 42 pacientes por ambas. De todos ellos, se asignó a 397 (5,5%) a bivalirudina y a 422 (5,9%) a HNF.
Las características iniciales y las del procedimiento estaban, en gran medida, desequilibradas entre PV y no vulnerables (tabla 1 y tabla 2), mientras que los subgrupos de PV y no vulnerables asignados a ATR o ATF o a bivalirudina o HNF generalmente se ajustaban a las características demográficas, la historia clínica, el cuadro clínico inicial y las características del procedimiento (tablas 1-4 del material adicional).
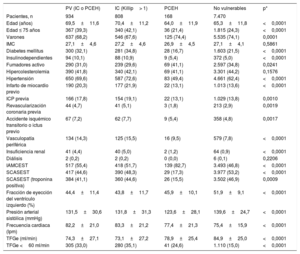
Características basales de los pacientes con vulnerabilidad hemodinámica o eléctrica o sin ella
| PV (IC o PCEH) | IC (Killip> 1) | PCEH | No vulnerables | p* | |
|---|---|---|---|---|---|
| Pacientes, n | 934 | 808 | 168 | 7.470 | |
| Edad (años) | 69,5±11,6 | 70,4±11,2 | 64,0±11,9 | 65,3±11,8 | <0,0001 |
| Edad ≤ 75 años | 367 (39,3) | 340 (42,1) | 36 (21,4) | 1.815 (24,3) | <0,0001 |
| Varones | 637 (68,2) | 546 (67,6) | 125 (74,4) | 5.535 (74,1) | 0,0001 |
| IMC | 27,1±4,6 | 27,2±4,6 | 26,9±4,5 | 27,1±4,1 | 0,5861 |
| Diabetes mellitus | 300 (32,1) | 281 (34,8) | 28 (16,7) | 1.603 (21,5) | <0,0001 |
| Insulinodependientes | 94 (10,1) | 88 (10,9) | 9 (5,4) | 372 (5,0) | <0,0001 |
| Fumadores activo | 290 (31,0) | 239 (29,6) | 69 (41,1) | 2.597 (34,8) | 0,0241 |
| Hipercolesterolemia | 390 (41,8) | 340 (42,1) | 69 (41,1) | 3.301 (44,2) | 0,1576 |
| Hipertensión | 650 (69,6) | 587 (72,6) | 83 (49,4) | 4.661 (62,4) | <0,0001 |
| Infarto de miocardio previo | 190 (20,3) | 177 (21,9) | 22 (13,1) | 1.013 (13,6) | <0,0001 |
| ICP previa | 166 (17,8) | 154 (19,1) | 22 (13,1) | 1.029 (13,8) | 0,0010 |
| Revascularización coronaria previa | 44 (4,7) | 41 (5,1) | 3 (1,8) | 213 (2,9) | 0,0019 |
| Accidente isquémico transitorio o ictus previo | 67 (7,2) | 62 (7,7) | 9 (5,4) | 358 (4,8) | 0,0017 |
| Vasculopatía periférica | 134 (14,3) | 125 (15,5) | 16 (9,5) | 579 (7,8) | <0,0001 |
| Insuficiencia renal | 41 (4,4) | 40 (5,0) | 2 (1,2) | 64 (0,9) | <0,0001 |
| Diálisis | 2 (0,2) | 2 (0,2) | 0 (0,0) | 6 (0,1) | 0,2206 |
| IAMCEST | 517 (55,4) | 418 (51,7) | 139 (82,7) | 3.493 (46,8) | <0,0001 |
| SCASEST | 417 (44,6) | 390 (48,3) | 29 (17,3) | 3.977 (53,2) | <0,0001 |
| SCASEST (troponina positiva) | 384 (41,1) | 360 (44,6) | 26 (15,5) | 3.502 (46,9) | 0,0009 |
| Fracción de eyección del ventrículo izquierdo (%) | 44,4±11,4 | 43,8±11,7 | 45,9±10,1 | 51,9±9,1 | <0,0001 |
| Presión arterial sistólica (mmHg) | 131,5±30,6 | 131,8±31,3 | 123,6±28,1 | 139,6±24,7 | <0,0001 |
| Frecuencia cardiaca (lpm) | 82,2±21,0 | 83,3±21,2 | 77,4±21,3 | 75,4±15,9 | <0,0001 |
| TFGe (ml/min) | 74,3±27,1 | 73,1±27,2 | 78,9±25,4 | 84,9±25,0 | <0,0001 |
| TFGe <60 ml/min | 305 (33,0) | 280 (35,1) | 41 (24,6) | 1.110 (15,0) | <0,0001 |
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; PCEH: parada cardiaca extrahospitalaria; PV: pacientes vulnerables; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%) o media±desviación estándar.
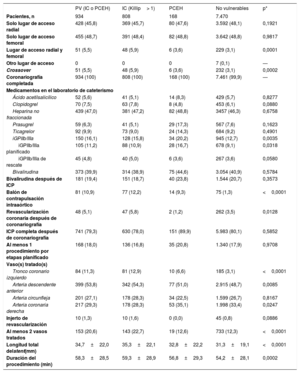
Características del procedimiento de los pacientes con vulnerabilidad hemodinámica o eléctrica o sin ella
| PV (IC o PCEH) | IC (Killip> 1) | PCEH | No vulnerables | p* | |
|---|---|---|---|---|---|
| Pacientes, n | 934 | 808 | 168 | 7.470 | |
| Solo lugar de acceso radial | 428 (45,8) | 369 (45,7) | 80 (47,6) | 3.592 (48,1) | 0,1921 |
| Solo lugar de acceso femoral | 455 (48,7) | 391 (48,4) | 82 (48,8) | 3.642 (48,8) | 0,9817 |
| Lugar de acceso radial y femoral | 51 (5,5) | 48 (5,9) | 6 (3,6) | 229 (3,1) | 0,0001 |
| Otro lugar de acceso | 0 | 0 | 0 | 7 (0,1) | — |
| Crossover | 51 (5,5) | 48 (5,9) | 6 (3,6) | 232 (3,1) | 0,0002 |
| Coronariografía completada | 934 (100) | 808 (100) | 168 (100) | 7.461 (99,9) | — |
| Medicamentos en el laboratorio de cateterismo | |||||
| Ácido acetilsalicílico | 52 (5,6) | 41 (5,1) | 14 (8,3) | 429 (5,7) | 0,8277 |
| Clopidogrel | 70 (7,5) | 63 (7,8) | 8 (4,8) | 453 (6,1) | 0,0880 |
| Heparina no fraccionada | 439 (47,0) | 381 (47,2) | 82 (48,8) | 3457 (46,3) | 0,6758 |
| Prasugrel | 59 (6,3) | 41 (5,1) | 29 (17,3) | 567 (7,6) | 0,1623 |
| Ticagrelor | 92 (9,9) | 73 (9,0) | 24 (14,3) | 684 (9,2) | 0,4901 |
| iGPIIb/IIIa | 150 (16,1) | 128 (15,8) | 34 (20,2) | 945 (12,7) | 0,0035 |
| iGPIIb/IIIa planificado | 105 (11,2) | 88 (10,9) | 28 (16,7) | 678 (9,1) | 0,0318 |
| iGPIIb/IIIa de rescate | 45 (4,8) | 40 (5,0) | 6 (3,6) | 267 (3,6) | 0,0580 |
| Bivalirudina | 373 (39,9) | 314 (38,9) | 75 (44,6) | 3.054 (40,9) | 0,5784 |
| Bivalirudina después de ICP | 181 (19,4) | 151 (18,7) | 40 (23,8) | 1.544 (20,7) | 0,3573 |
| Balón de contrapulsación intraaórtico | 81 (10,9) | 77 (12,2) | 14 (9,3) | 75 (1,3) | <0,0001 |
| Revascularización coronaria después de coronariografía | 48 (5,1) | 47 (5,8) | 2 (1,2) | 262 (3,5) | 0,0128 |
| ICP completa después de coronariografía | 741 (79,3) | 630 (78,0) | 151 (89,9) | 5.983 (80,1) | 0,5852 |
| Al menos 1 procedimiento por etapas planificado | 168 (18,0) | 136 (16,8) | 35 (20,8) | 1.340 (17,9) | 0,9708 |
| Vaso(s) tratado(s) | |||||
| Tronco coronario izquierdo | 84 (11,3) | 81 (12,9) | 10 (6,6) | 185 (3,1) | <0,0001 |
| Arteria descendente anterior | 399 (53,8) | 342 (54,3) | 77 (51,0) | 2.915 (48,7) | 0,0085 |
| Arteria circunfleja | 201 (27,1) | 178 (28,3) | 34 (22,5) | 1.599 (26,7) | 0,8167 |
| Arteria coronaria derecha | 217 (29,3) | 178 (28,3) | 53 (35,1) | 1.998 (33,4) | 0,0247 |
| Injerto de revascularización | 10 (1,3) | 10 (1,6) | 0 (0,0) | 45 (0,8) | 0,0886 |
| Al menos 2 vasos tratados | 153 (20,6) | 143 (22,7) | 19 (12,6) | 733 (12,3) | <0,0001 |
| Longitud total delstent(mm) | 34,7±22,0 | 35,3±22,1 | 32,8±22,2 | 31,3±19,1 | <0,0001 |
| Duración del procedimiento (min) | 58,3±28,5 | 59,3±28,9 | 56,8±29,3 | 54,2±28,1 | 0,0002 |
IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; iGPIIb/IIIa: inhibidor de la glucoproteína IIb/IIIa; PCEH: parada cardiaca extrahospitalaria; PV: pacientes vulnerables.
Los valores expresan n (%) o media±desviación estándar.
Las tasas de MACE y NACE fueron más altas en los PV que en los no vulnerables, al igual que casi todos los objetivos secundarios (tabla 5 del material adicional).
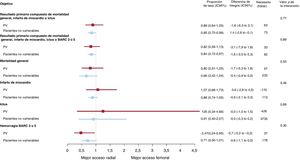
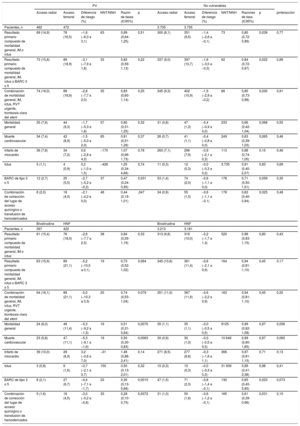
No se observó ninguna interacción importante entre el lugar de acceso y los criterios de PV respecto a los resultados primarios compuestos MACE y NACE a 30 días (pinteracción = 0,77 y pinteracción=0,89 respectivamente) (figura 1 y tabla 3; figura 1 del material adicional y tabla 6 del material adicional). MACE y NACE se redujeron de manera similar con el ATR y con el ATF tanto en PV (MACE: el 14,9 frente al 16,5%; riesgo relativo [RR]=0,89; intervalo de confianza del 95% [IC95%], 0,64-1,25; p=0,51; NACE: el 15,8 frente al 18,9%; RR=0,82; IC95%, 0,59-1,13; p=0,22) como en pacientes no vulnerables (MACE: el 8,1 frente al 9,5%; RR=0,85; IC95%: 0,72-0,99; p=0,039; NACE: el 9,0 frente al 10,7%; RR=0,84; IC95%: 0,72-0,97; p=0,022) (figura 1 y tabla 3; tabla 6 del material adicional). El ATR aportó beneficios relativos claros en comparación con el ATF por lo que se refiere a resultados individuales (tabla 3; figura 2 y tabla 6 del material adicional), como mortalidad general (pinteracción=0,55), mortalidad cardiovascular (pinteracción = 0,46) y hemorragia BARC 3 o 5 (pinteracción=0,30). Los beneficios absolutos a favor del ATR sobre el ATF fueron ≥ 4 veces superiores en los PV en comparación con los pacientes no vulnerables (diferencias de riesgo absoluto del –1,7, el –1,5 y el –2,7% en los PV y del –0,4, el –0,4 y el –0,6% en pacientes no vulnerables respecto a mortalidad general, mortalidad cardiovascular y hemorragia BARC 3 o 5 respectivamente) (tabla 3; tabla 6 del material adicional).
Principales resultados con el uso de los accesos radial y femoral en PV y pacientes no vulnerables. Se comparó el acceso radial con el femoral en función de la vulnerabilidad hemodinámica/eléctrica, con razones de tasas e intervalos de confianza del 95% (IC95%), por lo que respecta a los resultados primarios compuestos y sus componentes (muerte, infarto de miocardio, ictus y BARC 3 o 5). BARC: Bleeding Academic Research Consortium; IM: infarto de miocardio; PV: pacientes vulnerables.
Principales objetivos clínicos a 30 días con el ATR y el ATF y con bivalirudina y HNF en pacientes con vulnerabilidad hemodinámica o eléctrica o sin ella
| PV | No vulnerables | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Acceso radial | Acceso femoral | Diferencia de riesgo (%) | NNT/NNH | Razón de tasas (IC95%) | p | Acceso radial | Acceso femoral | Diferencia de riesgo (%) | NNT/NNH | Razones de tasa (IC95%) | p | pinteracción | |
| Pacientes, n | 462 | 472 | 3.735 | 3.735 | |||||||||
| Resultado primario compuesto de mortalidad general, IM o ictus | 69 (14,9) | 78 (16,5) | –1,6 (−6,3 a 3,1) | 63 | 0,89 (0,64-1,25) | 0,51 | 300 (8,1) | 351 (9,5) | −1,4 (−2,6 a −0,1) | 73 | 0,85 (0,72-0,99) | 0,039 | 0,77 |
| Resultado primario compuesto de mortalidad general, IM, ictus o BARC 3 o 5 | 73 (15,8) | 89 (18,9) | −3,1 (−7,9 a 1,8) | 33 | 0,82 (0,59-1,13) | 0,22 | 337 (9,0) | 397 (10,7) | −1,6 (−3,0 a −0,3) | 62 | 0,84 (0,72-0,97) | 0,022 | 0,89 |
| Combinación de mortalidad general, IM, ictus, RVT urgente, trombosis clara del stent | 74 (16,0) | 89 (18,9) | −2,8 (−7,7 a 2,0) | 35 | 0,83 (0,60-1,14) | 0,25 | 345 (9,3) | 402 (10,9) | −1,5 (−2,9 a −0,2) | 66 | 0,85 (0,73-0,98) | 0,030 | 0,91 |
| Mortalidad general | 35 (7,6) | 44 (9,3) | −1,7 (−5,3 a 1,8) | 57 | 0,80 (0,51-1,25) | 0,32 | 31 (0,8) | 47 (1,3) | −0,4 (−0,9 a 0,0) | 233 | 0,66 (0,42-1,04) | 0,068 | 0,55 |
| Muerte cardiovascular | 34 (7,4) | 42 (8,9) | −1,5 (−5,0 a 2,0) | 65 | 0,81 (0,51-1,28) | 0,37 | 26 (0,7) | 41 (1,1) | −0,4 (−0,8 a 0,0) | 249 | 0,63 (0,39-1,03) | 0,065 | 0,46 |
| Infarto de miocardio | 36 (7,8) | 34 (7,2) | 0,6 (−2,8 a 4,0) | −170 | 1,07 (0,66-1,73) | 0,78 | 263 (7,1) | 296 (7,9) | −0,9 (−2,1 a 0,3) | 113 | 0,88 (0,74-1,05) | 0,15 | 0,46 |
| Ictus | 5 (1,1) | 4 (0,9) | 0,2 (−1,0 a 1,5) | −426 | 1,25 (0,34-4,66) | 0,74 | 11 (0,3) | 12 (0,3) | −0,0 (−0,3 a 0,2) | 3.735 | 0,91 (0,40-2,07) | 0,83 | 0,69 |
| BARC de tipo 3 o 5 | 12 (2,7) | 25 (5,5) | −2,7 (−5,2 a −0,2) | 37 | 0,47 (0,24-0,95) | 0,031 | 53 (1,4) | 74 (2,0) | −0,6 (−1,1 a 0,0) | 178 | 0,71 (0,50-1,01) | 0,059 | 0,30 |
| Combinación de corrección del lugar de acceso quirúrgico o transfusión de hemoderivados | 8 (2,0) | 18 (4,0) | −2,1 (−4,2 a 0,0) | 48 | 0,44 (0,19-1,01) | ,047 | 34 (0,9) | 55 (1,5) | −0,6 (−1,1 a −0,1) | 178 | 0,62 (0,40-0,94) | 0,025 | 0,48 |
| Bivalirudina | HNF | Bivalirudina | HNF | ||||||||||
| Pacientes, n | 397 | 422 | 3.213 | 3.181 | |||||||||
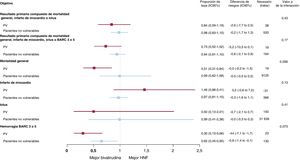
| Resultado primario compuesto de mortalidad general, IM o ictus | 61 (15,4) | 76 (18,0) | −2,6 (−7,7 a 2,5) | 38 | 0,84 (0,59-1,19) | 0,33 | 313 (9,8) | 316 (10,0) | −0,2 (−1,7 a 1,3) | 520 | 0,98 (0,83-1,15) | 0,80 | 0,43 |
| Resultado primario compuesto de mortalidad general, IM, ictus o BARC 3 o 5 | 63 (15,9) | 89 (21,1) | −5,2 (−10,5 a 0,1) | 19 | 0,73 (0,52-1,02) | 0,064 | 345 (10,8) | 361 (11,4) | −0,6 (−2,1 a 0,9) | 164 | 0,94 (0,81-1,10) | 0,45 | 0,17 |
| Combinación de mortalidad general, IM, ictus, RVT urgente, trombosis clara del stent | 64 (16,1) | 89 (21,1) | −5,0 (−10,3 a 0,3) | 20 | 0,74 (0,53-1,04) | 0,079 | 351 (11,0) | 367 (11,6) | −0,6 (−2,2 a 0,9) | 163 | 0,94 (0,81-1,10) | 0,45 | 0,20 |
| Mortalidad general | 24 (6,0) | 48 (11,4) | −5,3 (−9,2 a −1,5) | 19 | 0,51 (0,31-0,84) | 0,0070 | 35 (1,1) | 35 (1,1) | −0,0 (−0,5 a 0,5) | 9125 | 0,99 (0,62-1,58) | 0,97 | 0,056 |
| Muerte cardiovascular | 23 (5,8) | 47 (11,1) | −5,3 (−9,1 a −1,6) | 19 | 0,50 (0,30-0,83) | 0,0063 | 30 (0,9) | 30 (1,0) | −0,0 (−0,5 a 0,5) | 10 646 | 0,99 (0,60-1,65) | 0,97 | 0,060 |
| Infarto de miocardio | 39 (10,0) | 28 (6,9) | 3,2 (−0,6 a 7,0) | −31 | 1,46 (0,88-2,41) | 0,14 | 271 (8,5) | 277 (8,8) | −0,3 (−1,6 a 1,1) | 366 | 0,97 (0,81-1,15) | 0,71 | 0,13 |
| Ictus | 3 (0,8) | 6 (1,6) | −0,7 (−2,1 a 0,7) | 150 | 0,50 (0,13-2,01) | 0,32 | 10 (0,3) | 10 (0,3) | −0,0 (−0,3 a 0,3) | 31 939 | 0,99 (0,41-2,38) | 0,98 | 0,41 |
| BARC de tipo 3 o 5 | 8 (2,1) | 27 (6,7) | −4,4 (−7,1 a −1,7) | 23 | 0,30 (0,13-0,66) | 0,0015 | 47 (1,5) | 71 (2,3) | −0,8 (−1,4 a −0,1) | 130 | 0,65 (0,45-0,95) | 0,023 | 0,073 |
| Combinación de corrección del lugar de acceso quirúrgico o transfusión de hemoderivados | 5 (1,6) | 18 (4,5) | −3,0 (−5,2 a −0,8) | 33 | 0,28 (0,10-0,75) | 0,0072 | 31 (1,0) | 50 (1,6) | −0,6 (−1,2 a −0,1) | 165 | 0,61 (0,39-0,96) | 0,031 | 0,15 |
BARC: Bleeding Academic Research Consortium; HNF: heparina no fraccionada; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; NNT/NNH: número de pacientes que es necesario tratar/número de pacientes expuestos necesario para que se produzca un evento; PV: pacientes vulnerables; RVT: revascularización del vaso tratado.
Salvo otra indicación, los valores expresan n (%) o media (intervalo).
Principales resultados con el uso de bivalirudina o HNF en PV y pacientes no vulnerables. Se comparó la bivalirudina con la HNF en función de la vulnerabilidad hemodinámica/eléctrica, con razones de tasa e intervalos de confianza del 95% (IC95%), por lo que respecta a los resultados primarios compuestos y sus componentes (muerte, infarto de miocardio, ictus y BARC 3 o 5). BARC: Bleeding Academic Research Consortium; HNF: heparina no fraccionada; IM: infarto de miocardio; PV: pacientes vulnerables.
Tampoco hubo interacción entre la asignación al tratamiento con antitrombina y los criterios de PV para MACE o NACE (pinteracción=0,43 y pinteracción=0,17 respectivamente) (figura 2 y tabla 3; figura 3 y tabla 7 del material adicional). La bivalirudina se asoció con una reducción nominal importante de la mortalidad general y cardiovascular en comparación con la HNF en los PV (mortalidad general, RR=0,51; IC95%, 0,31-0,84; p=0,007; mortalidad cardiovascular, RR=0,50; IC95%, 0,30-0,83; p=0,006; con diferencias de riesgo de −5,3% para ambos), pero no en los pacientes no vulnerables (mortalidad general, RR=0,99; IC95%, 0,62-1,58; p=0,97; mortalidad cardiovascular, RR=0,99; IC95%, 0,60-1,65; p=0,97; con diferencias de riesgo del 0% en ambos casos) (tabla 3; tabla 7 del material adicional). Sin embargo, no se encontró significación estadística en las pruebas de interacción de ambos resultados (pinteracción=0,056 y pinteracción=0,060) (figura 4 del material adicional). La bivalirudina redujo las tasas de hemorragia BARC 3 o 5 tanto en los PV (RR=0,30; IC95%, 0,13-0,66; p=0,0015) como en los pacientes no vulnerables (RR=0,65; IC95%, 0,45-0,95; p=0,023), mientras que la HNF (pinteracción=0,073) logró un beneficio absoluto algo mayor en el primer grupo (diferencia de riesgo absoluto, −4,4%) en comparación con el segundo (diferencia de riesgo absoluto: −0,8%) (tabla 3; tabla 7 del material adicional).
Análisis adicionalesLos resultados generales concordaron, en gran medida, cuando el grupo de PV se estratificó según la existencia, ausencia o gravedad de la clase Killip avanzada o la PCEH en la presentación, así como según los subgrupos preespecificados (datos no mostrados) o cuando se aplicaron métodos estadísticos alternativos (tabla 8 del material adicional).
DISCUSIÓNEl MATRIX es el mayor ensayo aleatorizado contemporáneo que compara el ATR con el ATF y el único estudio que une la comparación del lugar de acceso con una selección aleatoria de tipos de antitrombina, como bivalirudina o HNF (±iGPIIb/IIIa) en pacientes con SCA sometidos a tratamiento invasivo. En este estudio, el 11,1% de los pacientes presentaban inestabilidad hemodinámica (clase Killip avanzada) o eléctrica (supervivientes a una PCEH) y se consideraron PV según el análisis a posteriori.
Estos son los principales resultados:
- •
Los PV (el 9,6% con IC aguda, el 2,0% con PCEH y el 0,5% con ambas afecciones) presentaban con mayor frecuencia factores de riesgo cardiovascular, cumplían con mayor frecuencia los criterios de complejidad del procedimiento y tenían mayor riesgo de resultados clínicos adversos que los pacientes no vulnerables.
- •
El ATR se asoció con una clara reducción del RR de los resultados primarios compuestos y de los resultados secundarios clave, como la mortalidad y los eventos hemorrágicos graves, tanto en los PV como en los pacientes no vulnerables, en comparación con el ATF. Sin embargo, dado que la tasa de eventos fue mucho mayor en los PV, estos pacientes presentaron mayor reducción del riesgo absoluto con ATF que el grupo de pacientes no vulnerables.
- •
La seguridad y la eficacia comparadas de la bivalirudina y la HNF en PV y pacientes no vulnerables estuvieron en concordancia, con mayores beneficios absolutos relacionados con la bivalirudina en el primer grupo que en el segundo.
Los pacientes con SCA que presentan vulnerabilidad hemodinámica o eléctrica son frecuentes en la práctica diaria y corren mayor riesgo de morbilidad y mortalidad. La guía de práctica clínica de la Sociedad Europea de Cardiología subraya que los pacientes con SCA de alto riesgo e IC aguda, shock cardiogénico o PCEH obtienen el mayor beneficio cuando se aceleran todos los pasos del protocolo asistencial1,2. Sin embargo, no existe ninguna recomendación específica sobre el lugar de acceso preferible o la combinación de tratamiento antitrombótico para la angiografía o la ICP si está clínicamente indicado. Esto refleja la escasez de datos aleatorizados sobre esta población de pacientes con SCA de alto riesgo sometidos a tratamiento invasivo.
El ATR se prefiere de forma generalizada al ATF en pacientes con SCA en la guía de práctica clínica europea, pero no en la de ACC/AHA. En los PV con inestabilidad hemodinámica o eléctrica, el ATF se utiliza con mayor frecuencia, ya que la presión arterial sistólica baja y media dificulta el acceso a la arteria radial, la intervención coronaria suele ser más compleja y la necesidad de dispositivos de asistencia hemodinámica simultáneos es más frecuente. La clase Killip avanzada se ha identificado repetidamente entre las principales causas de ineficacia del ATR12–14. Sin embargo, en los últimos años, la experiencia y las nuevas técnicas han facilitado su uso. Un gran estudio del NCDR CathPCI Registry con 692.433 pacientes con infarto de miocardio con elevación del segmento ST a quienes se practicó una ICP primaria analizó las tendencias temporales del ATR, que aumentaron del 2% en 2009 al 23% en 2015, con una variación geográfica considerable15. La edad, el sexo, el shock cardiogénico, la parada cardiaca, los operadores que realizaban la práctica antes de 2012 y las instituciones sin filiación académica se asociaron con tasas más bajas de ATR15. De los 7.231 pacientes con clase Killip avanzada en la base de datos de la British Cardiovascular Intervention Society, se utilizó el ATF en 5.354 y el ATR en 1.877 pacientes. El ATR se asoció de manera independiente con menores mortalidad a 30 días, MACE hospitalarios y hemorragia grave16. En el presente estudio, se constató que el ATR continuó asociado con claros beneficios en los PV en comparación con los no vulnerables, con un mayor efecto del tratamiento, en términos absolutos, en el primer grupo. Una interpretación razonable de los resultados de este estudio es que no parece que el uso del ATR esté asociado con desventajas específicas en los PV, quienes corren mayores riesgos absolutos y obtienen mayor reducción del riesgo absoluto de esta intervención. Por lo tanto, nuestra observación respalda el uso del ATR como acceso predeterminado en todos los pacientes con SCA sometidos a tratamiento invasivo. En el análisis de subgrupos, los efectos del ATR y el ATF se mantuvieron constantes en todas las covariables preespecificadas, con la notable excepción de la proporción central de la ICP por ATR. Los grupos de PV y pacientes no vulnerables asignados al ATR en centros con la mayor proporción de ICP por ATR presentaron una reducción clínicamente considerable de los resultados de MACE o NACE en comparación con los asignados al ATF. En cambio, en los centros con una proporción baja o media de ICP por ATR, este aparentemente se asoció con beneficios algo inferiores en los pacientes no vulnerables o incluso con un riesgo ligeramente mayor, especialmente en casos de MACE, en los PV. Los resultados actuales deben interpretarse teniendo en cuenta que los operadores que participaron en el MATRIX tuvieron que recibir una formación adecuada tanto en ATR como en ATF. Esta consideración tiene importantes implicaciones clínicas17, lo que refuerza la noción de que, especialmente en los PV sometidos a tratamiento invasivo, el ATR debería ser el predeterminado solo si lo realizan operadores radiales habituales. En cambio, los centros/operadores menos expertos podrían ampliar aún más su formación seleccionando el ATR para pacientes menos vulnerables.
Tipos de antitrombina en pacientes con vulnerabilidad hemodinámica o eléctricaLos datos que comparan la bivalirudina con la HNF en pacientes con SCA e IC o PCEH son escasos18. Algunas pruebas indican que la IC crónica, independientemente de la ateroesclerosis y el SCA, se asocia con altas concentraciones de trombina que causan una formación más rápida de coágulos de fibrina resistentes y compactos. Por lo tanto, la bivalirudina podría ser aún más beneficiosa en estos pacientes4,5. En el EUROMAX, no hubo interacción significativa en el resultado primario entre los pacientes con clase Killip I y aquellos en clase II-IV, pero este último grupo era pequeño (77 y 69 en los grupos de bivalirudina y heparina respectivamente)19. En el HEAT-PPCI, el resultado primario fue claro en toda la estratificación según el deterioro de la función del ventrículo izquierdo (definido por una fracción de eyección del ventrículo izquierdo <55%)20. Pinto et al.5 presentaron un análisis de la base de datos del Hospital Premier que compara el uso de bivalirudina y heparina en más de 116.000 pacientes con IC congestiva sometidos a ICP. La mortalidad hospitalaria, que era el objetivo primario del estudio, fue menor con bivalirudina en monoterapia (2,3%) que con heparina en monoterapia (4,8%). En un análisis con emparejamiento por puntuación de propensión, el uso de bivalirudina se asoció con menor mortalidad que el de heparina. El tratamiento con bivalirudina también se asoció con tasas inferiores de hemorragia o transfusión, así como con hospitalizaciones más cortas5.
En el ensayo MATRIX, la bivalirudina no logró reducir de manera considerable los resultados primarios compuestos en comparación con la HNF, pero se asoció con tasas inferiores de hemorragia grave y mortalidad general, independientemente del uso de iGPIIb/IIIa en el grupo de comparación7,21. En el análisis actual, se observó que los PV mostraron mayores beneficios absolutos con bivalirudina que con HNF respecto a ambos resultados primarios compuestos, lo que probablemente refleje las tasas de eventos más altas observadas en estos pacientes. Las tendencias a favor de la bivalirudina en los PV en las pruebas de interacción de mortalidad general, mortalidad cardiovascular o hemorragia grave podrían indicar que un inhibidor directo de la trombina en lugar de un inhibidor indirecto podría ser particularmente beneficioso en esta población específica. A pesar de una tendencia hacia mayor índice de infarto de miocardio, la importante reducción de la mortalidad general y cardiovascular con bivalirudina observada en los PV podría atribuirse al mayor beneficio obtenido por estos pacientes en hemorragia grave y, en parte, a la tendencia a tasas más bajas de ictus en comparación con el grupo de pacientes no vulnerables. Sin embargo, nuestros análisis no son concluyentes y, en el mejor de los casos, generan hipótesis. Los análisis de subgrupos mostraron que la administración previa de HNF, pero no de ticagrelor o prasugrel, podría optimizar aún más los resultados en MACE o NACE en comparación con la administración de HNF a los PV, lo que no concuerda con la observación correspondiente en el grupo de pacientes no vulnerables. La noción de que la captación de inhibidores orales del P2Y12 aún más nuevos se retrasa particularmente en los PV22 puede ofrecer una posible explicación farmacodinámica a nuestros resultados actuales, que refuerza por completo el mensaje de que las estrategias parenterales (es decir, cangrelor o perfusión corta de iGPIIb/IIIa o prolongada de bivalirudina a dosis de ICP completa)22–24 podrían tener mayor prioridad que los agentes antiagregantes plaquetarios orales en los PV.
LimitacionesEste es un análisis a posteriori del ensayo MATRIX, que no se elaboró para analizar los efectos de las estrategias de tratamiento experimental en el subgrupo de PV. Nuestros resultados deben interpretarse en el contexto de errores no controlados de tipo I y tipo II, y considerarse como generadores de hipótesis. No se ajustaron las comparaciones múltiples, lo que aumentó el riesgo de error de tipo I. El estudio MATRIX no excluyó a los pacientes en función de la clase Killip avanzada o una PCEH en la presentación. Sin embargo, aún se desconoce si esta categoría de pacientes en alto riesgo se incluyó a continuación en el estudio y en qué medida. El requisito del consentimiento informado por escrito antes de la participación del paciente obviamente sesgó la inclusión de pacientes conscientes y colaboradores, a quienes deberían aplicarse nuestros resultados. Aun así, la proporción de PV (11,1%) se compara favorablemente con muchos otros estudios anteriores de SCA, que los excluyeron casi por completo.
Nuestra definición de PV no se preespecificó y abarca una población de pacientes heterogénea, y se incluyó en el momento de la ICP solo a unos pocos pacientes con shock cardiogénico manifiesto (clase Killip IV).
CONCLUSIONESEn pacientes con SCA sometidos a tratamiento invasivo, los efectos del ATR o el ATF y de la bivalirudina o la heparina no fraccionada fueron claros en pacientes con o sin vulnerabilidad hemodinámica o eléctrica. Las tasas de eventos absolutos fueron mayores en los PV y tanto el ATR como la bivalirudina se asociaron con mayor reducción del riesgo absoluto de los resultados finales isquémicos y hemorrágicos en este subconjunto de pacientes en comparación con el ATF o la HNF respectivamente.
FINANCIACIÓNLa Società Italiana di Cardiologia Invasiva (GISE), una organización sin ánimo de lucro que recibió subvenciones de Medicines Company y Terumo, patrocinó el ensayo. El análisis actual no recibió ninguna financiación directa o indirecta. El patrocinador y las empresas no tuvieron ningún papel en el diseño del estudio, la recopilación de datos, el seguimiento de datos, el análisis, la interpretación o la redacción del artículo.
CONFLICTO DE INTERESESM. Sunnåker está vinculado a CTU Bern, Universidad de Berna, que no acepta honorarios o pagos por consultoría de acuerdo con su política de personal. Los conflictos de intereses de CTU Bern se pueden encontrar en el sitio web de la Universidad. P. Vranckx ha recibido honorarios de consultoría de AstraZeneca y Medicines Company durante el estudio; honorarios por conferencias o de consultoría de Bayer, Health Care, Terumo y Daiichi-Sankyo al margen del trabajo presentado. S. Leonardi ha recibido honorarios de consultoría de AstraZeneca, Chiesi y Medicines Company durante el estudio y al margen del trabajo presentado. S. Windecker ha firmado contratos de investigación con la institución de Abbott, Amgen, Boston Scientific, Biotronik, Medtronic, Edwards Lifesciences, St. Jude y Terumo. M. Valgimigli ha recibido subvenciones de Medicines Company y Terumo durante la realización del estudio; subvenciones y honorarios personales de AstraZeneca, honorarios personales y apoyo no financiero de Medicines Company, honorarios personales de Terumo, St. Jude Vascular, Alvimedica, Abbott Vascular y Correvio, al margen del trabajo presentado.
Los demás autores no tienen conflictos de intereses.
- –
Cuando se compara el ATF con el ATR, este presenta varias ventajas y actualmente es el acceso recomendado para pacientes con SCA sometidos a ICP.
- –
Han surgido dudas sobre el uso del ATR especialmente en pacientes con vulnerabilidad (PV) hemodinámica (clase Killip avanzada) o eléctrica (supervivientes a PCEH), en quienes el ATF aún podría continuar siendo preferible y más rápido para establecer un diagnóstico y ofrecer un tratamiento oportuno.
- –
Tampoco se sabe cuál es el tratamiento antitrombótico óptimo para estos pacientes.
- –
En este gran ensayo aleatorizado contemporáneo, los PV (el 9,6% con IC aguda, el 2,0% con PCEH y el 0,5% con ambas afecciones) tenían con mayor frecuencia factores de riesgo cardiovascular, cumplían con mayor frecuencia los criterios de complejidad del procedimiento y tenían mayor riesgo de resultados clínicos adversos que los pacientes no vulnerables.
- –
El ATR se asoció con una clara reducción del RR de los resultados primarios compuestos y los resultados secundarios clave, como la mortalidad y los eventos hemorrágicos graves, tanto en los PV como en los pacientes no vulnerables, en comparación con el ATF. Sin embargo, dado que la tasa de eventos fue mucho mayor en los PV, estos pacientes obtuvieron mayor reducción del riesgo absoluto con el ATF.
- –
La seguridad y la eficacia comparadas de la bivalirudina y la HNF en los PV y los no vulnerables resultaron concordantes, con mayores beneficios absolutos relacionados con la bivalirudina en el primer grupo que en el segundo.