Los pacientes con estenosis aórtica presentan remodelado del ventrículo izquierdo (VI) y fibrosis miocárdica de sustitución (FMS). Se desconoce si sST2 se asocia con la FMS medida por resonancia magnética y con el sexo.
MétodosSe incluyó a 79 pacientes consecutivos (73,0 [68,0-78,0] años; 61% varones) con estenosis aórtica grave aislada tratados con sustitución valvular. Se identificaron y cuantificaron la FMS mediante realce tardío post-gadolinio (RTG) y se valoró el sST2 sérico.
ResultadosLa FMS se asoció con sST2 elevado, hipertrofia y dilatación del VI y menor fracción de eyección del VI. Todos los pacientes con disfunción del VI tenían FMS. sST2 ≥ 28,2 ng/ml se asoció con FMS y mayor hipertrofia del VI. La masa de RTG se correlacionó con el remodelado del VI y sST2. Los niveles de sST2 fueron mayores en pacientes con fibrosis intramiocárdica frente a subendocárdica. El análisis multivariante evidenció que solo la fracción de eyección y sST2 se asociaban con la FMS. Los varones presentaron mayores niveles de FMS y sST2. En varones la FMS correlacionó con mayor dilatación e hipertrofia ventricular, y con la masa de RTG.
ConclusionesEl sST2 es un factor independiente de FMS en la estenosisi aórtica grave aislada. sST2 ≥ 28,2 ng/ml predice la FMS y se relaciona con mayor hipertrofia del VI. La expresión de sST2 y asociaciones clínicas deben ser sexo-específicas.
Palabras clave
La estenosis aórtica (EA) es un tipo importante de cardiopatía valvular1. Por un proceso complejo en el que intervienen la hipertrofia del ventrículo izquierdo (VI) y la fibrosis miocárdica progresiva, la EA causa insuficiencia cardiaca (IC) y la muerte en un periodo de 5 años tras el diagnóstico de EA grave2. La fibrosis miocárdica de sustitución (FMS) consiste en el depósito de colágeno tras la apoptosis o necrosis de cardiomiocitos. En la EA, la resonancia magnética cardiaca (RMC) es un método no invasivo arraigado para cuantificar la FMS con secuencias de realce tardío de gadolinio (RTG) en el miocardio3. La FMS se relaciona con remodelado del VI4 y morbilidad y mortalidad elevadas2,5,6. Parece que la fisiopatología de la EA es dependiente del sexo7–9. Comprender las diferencias sexuales en la FMS de los pacientes con EA podría ser de ayuda para identificar objetivos terapéuticos específicos.
El gen del receptor de tipo 1 de la interleucina 1 (IL1RL1) pertenece a la familia de receptores de la interleucina 1 (IL-1) y codifica principalmente 2 isoformas del ST2: un receptor transmembrana (ST2L) y una forma soluble (sST2) que actúa como receptor señuelo de la IL-3310. La expresión de sST2 está aumentada en el miocardio y el suero de los pacientes con EA11,12. Curiosamente, el sST2 induce la activación de los fibroblastos cardiacos humanos y la síntesis de moléculas de colágeno, profibróticas y proinflamatorias13,14. En los pacientes con EA, la concentración de sST2 se relaciona con síntomas y evolución de la IC15,16. Además, la concentración de sST2 podría ser un marcador de la disfunción del VI en la EA17. Según datos recientes, el uso de valores umbral de sST2 específicos del sexo mejoraría el diagnóstico y aumentaría su valor pronóstico cardiovascular18,19. El objetivo es investigar si podría utilizarse la concentración de sST2 para identificar la FMS en un subgrupo aislado de pacientes con EA grave y si la concentración de sST2 está relacionada con el sexo.
MÉTODOSA continuación se hace una breve descripción de los métodos. Para más información, hay una versión ampliada de los materiales y los métodos en el apartado «Métodos» del material adicional.
Población de pacientesEn este estudio transversal, retrospectivo, observacional y descriptivo se incluyó a pacientes con EA grave aislada remitidos al Hospital Universitario de Navarra para someterse a una sustitución de válvula aórtica (VA) entre junio de 2013 y febrero de 2015. Se diagnosticó EA siguiendo las recomendaciones de la Sociedad Europea de Cardiología20. Se recogió el suero 24h antes de la intervención quirúrgica y se conservó a –80°C hasta los análisis por lotes. Se evaluó concomitancia de enfermedad coronaria (EC). Se obtuvo el consentimiento informado. Se acordó el protocolo del estudio con las recomendaciones éticas de la Declaración de Helsinki de 1975 y lo aprobó el comité de investigación con humanos de nuestra institución (Comité Ético de Experimentación Clínica, Gobierno de Navarra, Departamento de Salud; número de comité de ética: 2015/26).
EcocardiografíaSe hizo la ecocardiografía transtorácica con un ecógrafo consola VIVID7 3,5MHz (ecógrafo GE) o un IE-33 (Phillips Healthcare), de acuerdo con las recomendaciones actuales. Se evaluaron los gradientes transaórticos de presión máxima y media y el área de la VA mediante ecuación de continuidad.
Resonancia magnética cardiacaLos estudios de RMC se hicieron con un aparato de resonancia de 1,5 T (Avanto). Se utilizaron secuencias de precesión libre en estado estacionario para evaluar las dimensiones, la masa y la función del VI y el área de la VA. Se adquirieron las imágenes de RTG 10-15min tras la inyección intravenosa de contraste de gadolinio (Dotarem, 0,1 mmol/kg de peso corporal). Se adquirieron imágenes de gradiente eco con recuperación de inversión para detectar áreas de RTG. Se optimizaron los tiempos de retraso en la inversión para anular el miocardio normal. Se utilizaron imágenes de cinerradiografía (precesión libre en el estado estacionario) para evaluar el volumen, la masa y la función del VI. Se contornearon manualmente los bordes endocárdico y epicárdico del VI con el software ARGUS (Siemens Medical Solutions). Para determinar las velocidades del flujo, se evaluó la gravedad de la EA con planimetría derivada de la RMC del área de la VA y secuencias de contraste de fase.
Se calculó la masa del RTG de manera semiautomática con el software QMass MR7. La fibrosis intramiocárdica (difusa o focal que incluyera la unión interventricular) y subendocárdica y la fibrosis difusa generalizada de los anillos mitral y aórtico se consideraron patológicas.
Concentración de sST2Se cuantificó la concentración de sST2 circulante con un enzimoinmunoanálisis disponible en el mercado (Presage, Critical Diagnostics) y siguiendo las instrucciones del fabricante.
Análisis estadísticosLas variables categóricas se expresan como porcentajes y se compararon con la prueba de la χ2 o la prueba exacta de Fisher, según conviniera. Se evaluaron las variables continuas con la prueba de la t de Student con datos independientes y el análisis unidireccional de la varianza si la distribución era normal. En caso contrario, se utilizaron la prueba de la U de Mann-Whitney o la prueba de Kruskal-Wallis. Se hicieron pruebas a posteriori según conviniera. Se calcularon los coeficientes de correlación de Pearson o Spearman. Se recurrió al diseño de modelos de regresión lineal para mostrar los marcadores clínicos y biológicos útiles para estratificar/identificar a los pacientes con FMS. Se utilizó el software GraphPad Prism 9,0, versión SPSS 28,0.1.0 o el paquete estadístico R, v. 3,6.
Declaración de disponibilidad de datosLos datos que respaldan los resultados de este estudio se hallan disponibles previa solicitud razonada al autor para correspondencia.
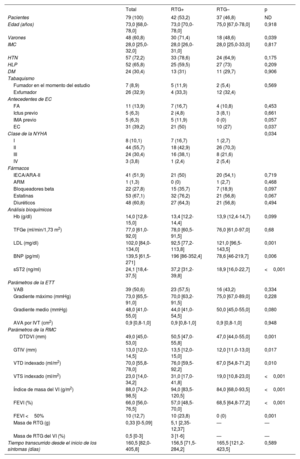
RESULTADOSCaracterísticas clínicas y de laboratorio de la cohorte del estudioEste estudio transversal, retrospectivo, observacional y descriptivo incluyó a 79 pacientes consecutivos (el 60,8% varones; mediana de edad, 73,0 [68,0-78,0] años) con EA grave. En la tabla 1 se muestran las características basales y demográficas de la cohorte. A partir de los datos publicados previamente sobre el ST2 sérico en pacientes con EA a los que va a practicarse una sustitución de la válvula21, se calculó que la magnitud del efecto era 0,625.
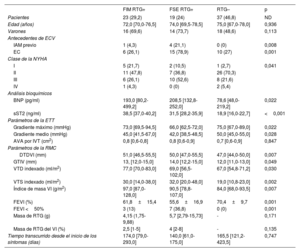
Características de la cohorte demográficas y basales, como evaluación focal de la fibrosis miocárdica de sustitución mediante imágenes de resonancia magnética cardiaca con realce tardío de gadolinio
| Total | RTG+ | RTG– | p | |
|---|---|---|---|---|
| Pacientes | 79 (100) | 42 (53,2) | 37 (46,8) | ND |
| Edad (años) | 73,0 [68,0-78,0] | 73,0 [70,0-78,0] | 75,0 [67,0-78,0] | 0,918 |
| Varones | 48 (60,8) | 30 (71,4) | 18 (48,6) | 0,039 |
| IMC | 28,0 [25,0-32,0] | 28,0 [26,0-31,0] | 28,0 [25,0-33,0] | 0,817 |
| HTN | 57 (72,2) | 33 (78,6) | 24 (64,9) | 0,175 |
| HLP | 52 (65,8) | 25 (59,5) | 27 (73) | 0,209 |
| DM | 24 (30,4) | 13 (31) | 11 (29,7) | 0,906 |
| Tabaquismo | ||||
| Fumador en el momento del estudio | 7 (8,9) | 5 (11,9) | 2 (5,4) | 0,569 |
| Exfumador | 26 (32,9) | 4 (33,3) | 12 (32,4) | |
| Antecedentes de EC | ||||
| FA | 11 (13,9) | 7 (16,7) | 4 (10,8) | 0,453 |
| Ictus previo | 5 (6,3) | 2 (4,8) | 3 (8,1) | 0,661 |
| IMA previo | 5 (6,3) | 5 (11,9) | 0 (0) | 0,057 |
| EC | 31 (39,2) | 21 (50) | 10 (27) | 0,037 |
| Clase de la NYHA | 0,034 | |||
| I | 8 (10,1) | 7 (16,7) | 1 (2,7) | |
| II | 44 (55,7) | 18 (42,9) | 26 (70,3) | |
| III | 24 (30,4) | 16 (38,1) | 8 (21,6) | |
| IV | 3 (3,8) | 1 (2,4) | 2 (5,4) | |
| Fármacos | ||||
| IECA/ARA-II | 41 (51,9) | 21 (50) | 20 (54,1) | 0,719 |
| ARM | 1 (1,3) | 0 (0) | 1 (2,7) | 0,468 |
| Bloqueadores beta | 22 (27,8) | 15 (35,7) | 7 (18,9) | 0,097 |
| Estatinas | 53 (67,1) | 32 (76,2) | 21 (56,8) | 0,067 |
| Diuréticos | 48 (60,8) | 27 (64,3) | 21 (56,8) | 0,494 |
| Análisis bioquímicos | ||||
| Hb (g/dl) | 14,0 [12,8-15,0] | 13,4 [12,2-14,4] | 13,9 (12,4-14,7) | 0,099 |
| TFGe (ml/min/1,73 m2) | 77,0 [61,0-92,0] | 78,0 [60,5-91,5] | 76,0 [61,0-97,0] | 0,68 |
| LDL (mg/dl) | 102,0 [84,0-134,0] | 92,5 [77,2-113,8] | 121,0 [96,5-143,5] | 0,001 |
| BNP (pg/ml) | 139,5 [61,5-271] | 196 [86-352,4] | 78,6 [46-219,7] | 0,006 |
| sST2 (ng/ml) | 24,1 [18,4-37,5] | 37,2 [31,2-39,8] | 18,9 [16,0-22,7] | <0,001 |
| Parámetros de la ETT | ||||
| VAB | 39 (50,6) | 23 (57,5) | 16 (43,2) | 0,334 |
| Gradiente máximo (mmHg) | 73,0 [65,5-91,0] | 70,0 [63,2-91,5] | 75,0 [67,0-89,0] | 0,228 |
| Gradiente medio (mmHg) | 48,0 [41,0-55,0] | 44,0 [41,0-54,5] | 50,0 [45,0-55,0] | 0,080 |
| AVA por IVT (cm2) | 0,9 [0,8-1,0] | 0,9 [0,8-1,0] | 0,9 [0,8-1,0] | 0,948 |
| Parámetros de la RMC | ||||
| DTDVI (mm) | 49,0 [45,0-53,0] | 50,5 [47,0-55,8] | 47,0 [44,0-55,0] | 0,001 |
| GTIV (mm) | 13,0 [12,0-14,5] | 13,5 [12,0-15,0] | 12,0 [11,0-13,0] | 0,017 |
| VTD indexado (ml/m2) | 70,0 [55,8-78,0] | 76,0 [59,5-92,2] | 67,0 [54,8-71,2] | 0,010 |
| VTS indexado (ml/m2) | 23,0 [14,0-34,2] | 31,0 [17,0-41,8] | 19,0 [10,8-23,0] | <0,001 |
| Índice de masa del VI (g/m2) | 88,0 [74,2-98,5] | 94,0 [83,5-120,5] | 84,0 [68,0-93,5] | <0,001 |
| FEVI (%) | 66,0 [56,0-76,5] | 57,0 [48,5-70,0] | 68,5 [64,8-77,2] | <0,001 |
| FEVI <50% | 10 (12,7) | 10 (23,8) | 0 (0) | 0,001 |
| Masa de RTG (g) | 0,33 [0-5,09] | 5,1 [2,35-12,37] | — | — |
| Masa de RTG del VI (%) | 0,5 [0-3] | 3 [1-6] | — | — |
| Tiempo transcurrido desde el inicio de los síntomas (días) | 160,5 [82,0-405,8] | 156,5 [71,5-284,2] | 165,5 [121,2-423,5] | 0,589 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; AVA por IVT: área de la válvula aórtica por ecuación de continuidad mediante integral velocidad-tiempo; BNP: propéptido natriurético cerebral; DM: diabetes mellitus; DTDVI: diámetro telediastólico del VI; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GTIV: grosor del tabique interventricular; Hb: hemoglobina; HLP: hiperlipemia; HTN: hipertensión; IAM: infarto agudo de miocardio; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; ND: no disponible; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; sST2: ST2 soluble; TFGe: tasa de filtrado glomerular estimada; VAB: válvula aórtica bicúspide; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los análisis univariantes se hicieron para comparar las características basales y demográficas de los pacientes clasificados como RTG+ y RTG−.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Para validar el tamaño de la muestra y la potencia estadística de la cohorte, se calculó la magnitud del efecto de la f de Cohen (f2=0,39 y α=0,05). La potencia estadística de la muestra fue > 90%.
La fibrosis miocárdica de sustitución se relacionó con mayores remodelado y disfunción del VISe clasificó a los pacientes como RTG positivos o negativos (tabla 1). Se compararon todas las variables registradas en la tabla 1 entre los grupos de RTG con pruebas de la χ2 para las variables categóricas y con pruebas para datos univariantes independientes como la t de Student o la U de Mann-Whitney para las variables continuas. Es importante destacar que se detectó FMS del VI en el 53,2% de los pacientes y que esta fue más probable en los varones (el 71,4 frente al 48,6%; p=0,039). La EC prevaleció entre los pacientes RTG positivos (el 50 frente al 27%; p=0,037). Los pacientes RTG positivos presentaron más dilatación del VI y aumento de la masa del VI y menor fracción de eyección, tal como demostraron los parámetros de la RMC: diámetro telediastólico del VI (p=0,001), grosor del tabique interventricular (p=0,017), volumen telediastólico indexado (VTDI) (p=0,01), volumen telesistólico indexado (VTSI) (p<0,001), masa indexada del VI (p=0,001) y fracción de eyección del VI (FEVI) (p <0,001), todos independientemente del grado de estenosis. Solo los pacientes RTG positivos (23,8%; p=0,001) tenían una FEVI <50%.
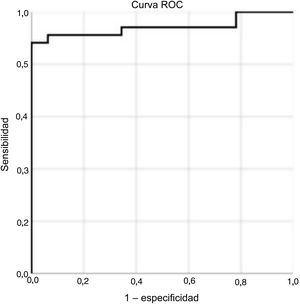
La concentración de sST2 circulante predijo la FMS en los pacientes con EA graveLa concentración de sST2 fue mayor en los pacientes con FMS que en los que no la sufrían —37,2 (31,2-39,8) frente a 18,9 (16,0-22,7); p <0,001—. En el análisis de la curva de eficacia diagnóstica (curva ROC) y el estadístico de Youden, el umbral de sST2 para la identificación de pacientes con FMS fue ≥ 28,2 ng/ml (sensibilidad del 88%, especificidad del 100%; área bajo la curva [AUC] = 0,942; p <0,001) (figura 1). Los pacientes con sST2 ≥ 28,2 presentaron mayor hipertrofia del VI que aquellos con sST2 <28,2 (grosor del tabique interventricular, p=0,022; masa indexada del VI, p=0,01) (tabla 1 del material adicional). Cabe destacar que cifras de sST2 ≥ 28,2 solo se observaron en pacientes con RTG positivos.
Curva de eficacia diagnóstica (curva ROC) y valor umbral para la sustitución mediante sST2 circulante para el diagnóstico de sustitución mediante FMS en pacientes con EA grave. Área bajo la curva (AUC) para la sustitución mediante sST2, 0,942 (sensibilidad del 88%, especificidad del 100%; p <0,001).
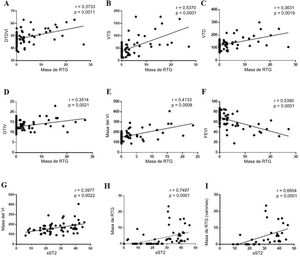
La masa de RTG del VI tiene correlación positiva con los parámetros de la RMC que indican una mayor dilatación del VI (diámetro telediastólico del VI, r=0,3733, p=0,001; VTS, r=0,5370, p=0,002; VTD, r=0,3631, p <0,001) (figura 2A-C) e hipertrofia (grosor del tabique interventricular, r=0,3514, p=0,002; masa del VI, r=0,4133, p=0,001) (figura 2D,E) y con una FEVI considerablemente reducida (r=−0,5390, p <0,001) (figura 2F). La concentración de sST2 circulante se relacionó con aumento de la masa del VI (r=0,3977, p=0,002) (figura 2G). Es importante destacar que la masa de RTG del VI se correlacionó claramente con la concentración de sST2 circulante (r=0,7497, p <0,001) (figura 2H).
Correlación entre la masa de realce tardío de gadolinio y los parámetros de la resonancia magnética cardiaca y la concentración de sST2 circulante. La masa de RTG se relacionó con marcadores de dilatación del VI (A-C), hipertrofia del VI (D y E) y disfunción del VI (F). El sST2 circulante se relacionó con masa del VI (G), masa de RTG (H) y masa de RTG solo en los varones (I) en el estudio de grupos separados por sexo. DTDVI: diámetro telediastólico del ventrículo izquierdo; GTIV: grosor del tabique interventricular; RTG: realce tardío de gadolinio; sST2: ST2 soluble; VI: ventrículo izquierdo; VTS: volumen telesistólico.
Se investigaron los distintos perfiles de la FMS, la fibrosis intramiocárdica y la fibrosis subendocárdica. En la tabla 2 se muestran las comparaciones multivariantes entre los 3 grupos y los análisis a posteriori correspondientes, en la tabla 2 del material adicional. Tal como se muestra en la tabla 1, 42 pacientes (53,2%) presentaban FMS: 23 (54,8%) de estos mostraban fibrosis intramiocárdica y 19 (42,4%), fibrosis subendocárdica (tabla 2). La concomitancia de EC y haber sufrido antes un infarto de miocardio fueron más frecuentes en los pacientes con fibrosis subendocárdica que en aquellos con fibrosis intramiocárdica (respectivamente, el 78,9 frente al 27,0%, p=0,001; el 21,1 frente al 4,3%, p=0,008). Se observó concordancia entre los segmentos enfermos de las arterias coronarias y las zonas de fibrosis miocárdica en 14 de los 15 pacientes con fibrosis subendocárdica, EC y RTG positivos (el 73,7% de todos los pacientes con fibrosis subendocárdica). En 1 paciente con EC (5,26%), la fibrosis subendocárdica no se relacionó con la arteria coronaria enferma y 4 pacientes con fibrosis subendocárdica no habían padecido EC con anterioridad.
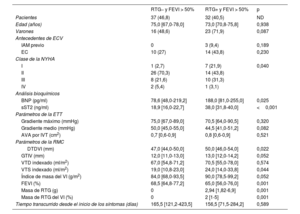
Comparación multivariante de las características de los pacientes agrupados según la presencia localizada de fibrosis miocárdica de sustitución y sus características
| FIM RTG+ | FSE RTG+ | RTG– | p | |
|---|---|---|---|---|
| Pacientes | 23 (29,2) | 19 (24) | 37 (46,8) | ND |
| Edad (años) | 72,0 [70,0-76,5] | 74,0 [69,5-78,5] | 75,0 [67,0-78,0] | 0,936 |
| Varones | 16 (69,6) | 14 (73,7) | 18 (48,6) | 0,113 |
| Antecedentes de ECV | ||||
| IAM previo | 1 (4,3) | 4 (21,1) | 0 (0) | 0,008 |
| EC | 6 (26,1) | 15 (78,9) | 10 (27) | 0,001 |
| Clase de la NYHA | ||||
| I | 5 (21,7) | 2 (10,5) | 1 (2,7) | 0,041 |
| II | 11 (47,8) | 7 (36,8) | 26 (70,3) | |
| III | 6 (26,1) | 10 (52,6) | 8 (21,6) | |
| IV | 1 (4,3) | 0 (0) | 2 (5,4) | |
| Análisis bioquímicos | ||||
| BNP (pg/ml) | 193,0 [80,2-499,2] | 208,5 [132,8-252,0] | 78,6 [48,0-219,2] | 0,022 |
| sST2 (ng/ml) | 38,5 [37,0-40,2] | 31,5 [28,2-35,9] | 18,9 [16,0-22,7] | <0,001 |
| Parámetros de la ETT | ||||
| Gradiente máximo (mmHg) | 73,0 [69,5-94,5] | 66,0 [62,5-72,0] | 75,0 [67,0-89,0] | 0,022 |
| Gradiente medio (mmHg) | 45,0 [41,5-67,0] | 42,0 [38,5-48,5] | 50,0 [45,0-55,0] | 0,028 |
| AVA por IVT (cm2) | 0,8 [0,6-0,8] | 0,8 [0,6-0,9] | 0,7 [0,6-0,9] | 0,847 |
| Parámetros de la RMC | ||||
| DTDVI (mm) | 51,0 [46,5-55,5] | 50,0 [47,0-55,5] | 47,0 [44,0-50,0] | 0,007 |
| GTIV (mm) | 13, [12,0-15,0] | 14,0 [12,2-15,0] | 12,0 [11,0-13,0] | 0,049 |
| VTD indexado (ml/m2) | 77,0 [70,0-83,0] | 69,0 [56,5-102,0] | 67,0 [54,8-71,2] | 0,030 |
| VTS indexado (ml/m2) | 30,0 [14,0-38,0] | 32,0 [20,0-48,0] | 19,0 [10,8-23,0] | 0,002 |
| Índice de masa VI (g/m2) | 97,0 [87,0-128,0] | 90,5 [78,8-107,0] | 84,0 [68,0-93,5] | 0,007 |
| FEVI (%) | 61,8±15,4 | 55,6±16,9 | 70,4±9,7 | 0,001 |
| FEVI <50% | 3 (13) | 7 (36,8) | 0 (0) | 0,001 |
| Masa de RTG (g) | 4,15 (1,75-9,88) | 5,7 [2,79-15,73] | - | 0,171 |
| Masa de RTG del VI (%) | 2,5 [1-5] | 4 [2-8] | - | 0,135 |
| Tiempo transcurrido desde el inicio de los síntomas (días) | 174,0 [79,0-293,0] | 140,0 [61,0-175,0] | 165,5 [121,2-423,5] | 0,747 |
AVA por IVT: área de la válvula aórtica por ecuación de continuidad mediante integral velocidad-tiempo; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del VI; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; FIM: fibrosis intramiocárdica; FSE: fibrosis subendocárdica; GTIV: grosor del tabique interventricular; IAM: infarto agudo de miocardio; ND: no disponible; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; sST2: ST2 soluble; VI: ventrículo izquierdo; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En conjunto, los pacientes con fibrosis subendocárdica RTG positivos presentaron mayor dilatación del VI y peor FEVI (incluso <50%) (diámetro telediastólico del VI, 50,0 [47,0-55,5] frente a 47,0 [44,0-50,0], p=0,019; VTD indexado, 69,0 [56,5-102,0] frente a 67,0 [54,8-71,2], p=0,037; VTS indexado, 32,0 [20,0-48,0] frente a 19,0 [10,8-23,0], p=0,001; FEVI, 55,6 ± 16,9 frente a 70,4 ± 9,7%, p=0,001), mientras que los pacientes con fibrosis intramiocárdica tendieron a sufrir más hipertrofia del VI, tal como muestra la masa indexada del VI (g/m2): 97,0 [87,0-128,0] frente a 84,0 [68,0-93,5] (p=0,004).
La concentración de sST2 fue mayor en los pacientes con fibrosis intramiocárdica que en aquellos con fibrosis subendocárdica (38,5 [37,0-40,2] frente a 31,5 [28,2-35,9], p=0,006). No obstante, no se observaron diferencias en la masa de RTG entre la fibrosis intramiocárdica y la fibrosis subendocárdica.
La FEVI y la concentración de sST2 se relacionaron de forma independiente con FMS en los pacientes con EA con FEVI conservada (> 50%)Solo se constató disfunción del VI en los pacientes con FMS (tabla 2). Se diferenciaron 2 grupos de pacientes con EA grave y FEVI conservada (> 50%): a) sin fibrosis (RTG–) y b) con fibrosis (RTG+) (tabla 3). En los pacientes con RTG+ se observó una tendencia al aumento de la hipertrofia del VI (grosor del tabique interventricular, p=0,052; masa indexada del VI, p=0,052; masa de RTG, p=0,001; masa de RTG del VI, p=0,001) y dilatación significativa (diámetro telediastólico del VI, p=0,022; VTS indexado, p=0,044). Esto simultáneamente al empeoramiento de la función del VI (la FEVI en RTG– frente a RTG+ fue 68,5% [64,8-77,2] frente a 65,0% [56,0-76,0], p=0,001). Cabe destacar que la concentración de péptido natriurético cerebral (BNP) fue considerablemente mayor con fibrosis que sin ella (188 [79,5-283,5] frente a 78,6 [46-219]; p=0,025). Sorprendentemente, la concentración de sST2 fue significativamente mayor en los pacientes con FEVI > 50% y fibrosis concomitante que en los que no sufrían fibrosis (38,0 [31,8-40,0] frente a 18,9 [16,0-22,7]; p<0,001) (tabla 1).
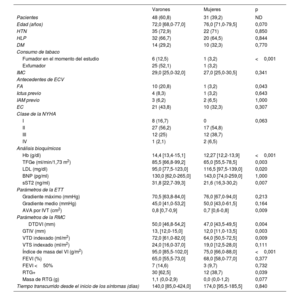
Comparaciones univariantes de las características de la cohorte según la presencia de fibrosis miocárdica de sustitución en los pacientes con FEVI conservada (> 50%)
| RTG− y FEVI > 50% | RTG+ y FEVI > 50% | p | |
|---|---|---|---|
| Pacientes | 37 (46,8) | 32 (40,5) | ND |
| Edad (años) | 75,0 [67,0-78,0] | 73,0 [70,8-75,8] | 0,938 |
| Varones | 16 (48,6) | 23 (71,9) | 0,087 |
| Antecedentes de ECV | |||
| IAM previo | 0 | 3 (9,4) | 0,189 |
| EC | 10 (27) | 14 (43,8) | 0,230 |
| Clase de la NYHA | |||
| I | 1 (2,7) | 7 (21,9) | 0,040 |
| II | 26 (70,3) | 14 (43,8) | |
| III | 8 (21,6) | 10 (31,3) | |
| IV | 2 (5,4) | 1 (3,1) | |
| Análisis bioquímicos | |||
| BNP (pg/ml) | 78,6 [48,0-219,2] | 188,0 [81,0-255,0] | 0,025 |
| sST2 (ng/ml) | 18,9 [16,0-22,7] | 38,0 [31,8-40,0] | <0,001 |
| Parámetros de la ETT | |||
| Gradiente máximo (mmHg) | 75,0 [67,0-89,0] | 70,5 [64,0-90,5] | 0,320 |
| Gradiente medio (mmHg) | 50,0 [45,0-55,0] | 44,5 [41,0-51,2] | 0,082 |
| AVA por IVT (cm2) | 0,7 [0,6-0,9] | 0,8 [0,6-0,9] | 0,521 |
| Parámetros de la RMC | |||
| DTDVI (mm) | 47,0 [44,0-50,0] | 50,0 [46,0-54,0] | 0,022 |
| GTIV (mm) | 12,0 [11,0-13,0] | 13,0 [12,0-14,2] | 0,052 |
| VTD indexado (ml/m2) | 67,0 [54,8-71,2] | 70,5 [55,0-78,0] | 0,574 |
| VTS indexado (ml/m2) | 19,0 [10,8-23,0] | 24,0 [14,0-33,8] | 0,044 |
| Índice de masa del VI (g/m2) | 84,0 [68,0-93,5] | 90,0 [78,5-99,2] | 0,052 |
| FEVI (%) | 68,5 [64,8-77,2] | 65,0 [56,0-76,0] | 0,001 |
| Masa de RTG (g) | 0 | 2,94 [1,82-6,9] | 0,001 |
| Masa de RTG del VI (%) | 0 | 2 [1-5] | 0,001 |
| Tiempo transcurrido desde el inicio de los síntomas (días) | 165,5 [121,2-423,5] | 156,5 [71,5-284,2] | 0,589 |
AVA por IVT: área de la válvula aórtica por ecuación de continuidad mediante integral velocidad-tiempo; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del VI; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección del ventrículo izquierdo; GTIV: grosor del tabique interventricular; IAM: infarto agudo de miocardio; ND: no disponible; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; sST2: ST2 soluble; VI: ventrículo izquierdo; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
El modelo de regresión lineal multivariante con selección retrógrada reveló que la FEVI y la concentración de sST2 se relacionaban independientemente con la carga de FMS (tabla 4). Cuanto más baja la FEVI, mayor la carga de FMS y viceversa. Por cada aumento del 1% en la FEVI, la FMS disminuía en 0,22 unidades. Es curioso que, independientemente de la FEVI, la concentración de sST2 se mantuvo asociada a la FMS: 1 ng/ml de sST2 se relacionaba con un aumento de 0,17 unidades de fibrosis. La distribución de residuales del modelo fue aproximadamente normal, pero con un aumento de la varianza. Así pues, para confirmar aún más la significación de las relaciones observadas, la dirección y la magnitud relativa, se aplicaron las transformaciones de Yeo-Johnson a la variable dependiente (FMS) tras calcular el valor lambda (–0,75) por el método de la probabilidad máxima22. La modelización de la relación entre la variable dependiente transformada (FMS) y las variables independientes (sST2 y FEVI) reveló que no había diferencias con respecto del modelo de regresión lineal multivariante original (tabla 3 del material adicional). Por último, se comprobaron las hipótesis de regresión lineal con el paquete gvlma (Global Validation of Linear Models Assumptions) en R23. Puesto que la fibrosis miocárdica puede deberse a la EA o la EC, se volvió a analizar los datos mediante regresión lineal multivariante y se excluyó a los pacientes que habían sufrido infarto de miocardio y EC (tabla 4 del material adicional). Estos resultados coinciden con el modelo original (tabla 4). Por último, se analizó la validez interna de los resultados mediante muestreo con reposición, tal como se especifica en los métodos. Los resultados se muestran en la tabla 5 del material adicional y confirman la solidez estadística de los análisis.
Modelo de regresión lineal multivariante con selección regresiva por pasos
| Estimador estadístico | IC95% | |
|---|---|---|
| Intersección | 13,33 | (7,013-19,66) |
| sST2 | 0,17 | (0,06-0,27) |
| FEVI | –0,22 | (–0,30 a 0,14) |
FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%.
La fibrosis como variable dependiente y el sST2 y la FEVI como variables independientes.
Se ha propuesto la existencia de diferencias patológicas relacionadas con el sexo subyacentes al fenotipo de la EA. Así pues, además se agrupó la cohorte del estudio por sexos (tabla 5). Se estudiaron las diferencias entre sexos para los parámetros cuantitativos registrados con los análisis univariantes. Fumar y tener antecedentes de fibrilación auricular fueron variables considerablemente distintas entre uno y otro sexo (p <0,001 y p=0,043 respectivamente). Tal y como se esperaba, el área de la VA era mayor en los varones que en las mujeres (p=0,009). No obstante, los gradientes (gradiente máximo, p=0,213; gradiente medio, p=0,164; FEVI, p=0,377) no difirieron entre los sexos.
Análisis univariantes de las diferencias sexuales en las características basales y demográficas de la cohorte
| Varones | Mujeres | p | |
|---|---|---|---|
| Pacientes | 48 (60,8) | 31 (39,2) | ND |
| Edad (años) | 72,0 [68,0-77,0] | 76,0 [71,0-79,5] | 0,070 |
| HTN | 35 (72,9) | 22 (71) | 0,850 |
| HLP | 32 (66,7) | 20 (64,5) | 0,844 |
| DM | 14 (29,2) | 10 (32,3) | 0,770 |
| Consumo de tabaco | |||
| Fumador en el momento del estudio | 6 (12,5) | 1 (3,2) | <0,001 |
| Exfumador | 25 (52,1) | 1 (3,2) | |
| IMC | 29,0 [25,0-32,0] | 27,0 [25,0-30,5] | 0,341 |
| Antecedentes de ECV | |||
| FA | 10 (20,8) | 1 (3,2) | 0,043 |
| Ictus previo | 4 (8,3) | 1 (3,2) | 0,643 |
| IAM previo | 3 (6,2) | 2 (6,5) | 1,000 |
| EC | 21 (43,8) | 10 (32,3) | 0,307 |
| Clase de la NYHA | |||
| I | 8 (16,7) | 0 | 0,063 |
| II | 27 (56,2) | 17 (54,8) | |
| III | 12 (25) | 12 (38,7) | |
| IV | 1 (2,1) | 2 (6,5) | |
| Análisis bioquímicos | |||
| Hb (g/dl) | 14,4 [13,4-15,1] | 12,27 [12,2-13,9] | <0,001 |
| TFGe (ml/min/1,73 m2) | 85,5 [66,8-99,2] | 65,0 [55,5-78,5] | 0,003 |
| LDL (mg/dl) | 95,0 [77,5-123,0] | 116,5 [97,5-139,0] | 0,020 |
| BNP (pg/ml) | 130,0 [62,0-265,0] | 143,0 [74,0-259,0] | 1,000 |
| sST2 (ng/ml) | 31,8 [22,7-39,3] | 21,6 (16,3-30,2) | 0,007 |
| Parámetros de la ETT | |||
| Gradiente máximo (mmHg) | 70,5 [63,8-84,0] | 76,0 [67,0-94,0] | 0,213 |
| Gradiente medio (mmHg) | 45,0 [41,0-53,2] | 50,0 [43,0-61,5] | 0,164 |
| AVA por IVT (cm2) | 0,8 [0,7-0,9] | 0,7 [0,6-0,8] | 0,009 |
| Parámetros de la RMC | |||
| DTDVI (mm) | 50,0 [46,8-54,2] | 47,0 [43,5-49,5] | 0,004 |
| GTIV (mm) | 13, [12,0-15,0] | 12,0 [11,0-13,5] | 0,003 |
| VTD indexado (ml/m2) | 72,0 [61,0-82,0] | 64,0 [50,5-72,5] | 0,009 |
| VTS indexado (ml/m2) | 24,0 [16,0-37,0] | 19,0 [12,5-28,0] | 0,111 |
| Índice de masa del VI (g/m2) | 95,0 [85,5-102,0] | 75,0 [66,0-88,0] | <0,001 |
| FEVI (%) | 65,0 [55,5-73,0] | 68,0 [58,0-77,0] | 0,377 |
| FEVI <50% | 7 (14,6) | 3 (9,7) | 0,732 |
| RTG+ | 30 [62,5] | 12 (38,7) | 0,039 |
| Masa de RTG (g) | 1,1 (0,0-2,9) | 0,0 (0,0-1,2) | 0,077 |
| Tiempo transcurrido desde el inicio de los síntomas (días) | 140,0 [85,0-424,0] | 174,0 [95,5-185,5] | 0,840 |
AVA por IVT: área de la válvula aórtica por ecuación de continuidad mediante integral velocidad-tiempo; BNP: péptido natriurético cerebral; DM: diabetes mellitus; DTDVI: diámetro telediastólico del VI; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GTIV: grosor del tabique interventricular; Hb: hemoglobina; HLP: hiperlipemia; HTN: hipertensión; IAM: infarto agudo de miocardio; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; ND: no disponible; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; sST2: ST2 soluble; TFGe: tasa de filtrado glomerular estimada; VAB: válvula aórtica bicúspide; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Los parámetros de la RMC revelaron mayores hipertrofia y dilatación del VI en los varones que en las mujeres, junto con un aumento de la prevalencia de la FMS global (el 62,5 frente al 38,7%; p=0,039). Cabe destacar que la concentración de sST2 profibrótico circulante fue considerablemente mayor en los varones que en las mujeres (31,8 [22,7-39,3] frente a 21,6 [16,3-30,2]; p=0,007).
Se observaron diferencias relacionadas con el sexo en comparación con el impacto de la FMS en los pacientes RTG positivos y RTG negativos dentro de cada grupo (tabla 6). En los varones, la FMS se relacionó con dilatación (diámetro telediastólico del VI, 53,0 [47,5-56,8] frente a 47,5 [44,5-51,0], p=0,009; VTS indexado, 31,5 [23,0-46,5] frente a 19,0 [11,0-23,0], p=0,002) y disfunción del VI (FEVI, 57,0% [48,5-67,0] frente a 71,0% [66,0-82,0]; p=0,006) y estos resultados no se observaron en las mujeres RTG positivas comparadas con las RTG negativas.
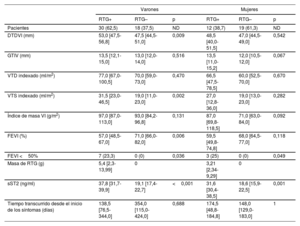
Diferencias sexuales analizadas mediante comparaciones univariantes dentro de cada grupo en la resonancia magnética cardiaca y los parámetros bioquímicos según la presencia de fibrosis miocárdica de sustitución
| Varones | Mujeres | |||||
|---|---|---|---|---|---|---|
| RTG+ | RTG– | p | RTG+ | RTG– | p | |
| Pacientes | 30 (62,5) | 18 (37,5) | ND | 12 (38,7) | 19 (61,3) | ND |
| DTDVI (mm) | 53,0 [47,5-56,8] | 47,5 [44,5-51,0] | 0,009 | 48,5 [40,0-51,5] | 47,0 [44,5-49,0] | 0,542 |
| GTIV (mm) | 13,5 [12,1-15,0] | 13,0 [12,0-14,0] | 0,516 | 13,5 [11,0-15,2] | 12,0 [10,5-12,0] | 0,067 |
| VTD indexado (ml/m2) | 77,0 [67,0-100,5] | 70,0 [59,0-73,0] | 0,470 | 66,5 [47,5-78,5] | 60,0 [52,5-70,0] | 0,670 |
| VTS indexado (ml/m2) | 31,5 [23,0-46,5] | 19,0 [11,0-23,0] | 0,002 | 27,0 [12,8-36,0] | 19,0 [13,0-23,0] | 0,282 |
| Índice de masa VI (g/m2) | 97,0 [87,0-113,0] | 93,0 [84,2-96,8] | 0,131 | 87,0 [69,8-118,5] | 71,0 [63,0-84,0] | 0,092 |
| FEVI (%) | 57,0 [48,5-67,0] | 71,0 [66,0-82,0] | 0,006 | 59,5 [49,8-74,8] | 68,0 [64,5-77,0] | 0,118 |
| FEVI <50% | 7 (23,3) | 0 (0) | 0,036 | 3 (25) | 0 (0) | 0,049 |
| Masa de RTG (g) | 5,4 [2,3-13,99] | 0 | 3,21 [2,34-9,29] | 0 | ||
| sST2 (ng/ml) | 37,8 [31,7-39,9] | 19,1 [17,4-22,7] | <0,001 | 31,6 [30,4-38,5] | 18,6 [15,9-22,5] | 0,001 |
| Tiempo transcurrido desde el inicio de los síntomas (días) | 138,5 [76,5-344,0] | 354,0 [115,0-424,0] | 0,688 | 174,5 [48,8-184,8] | 148,0 [129,0-183,0] | 1 |
DTDVI: diámetro telediastólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; GTIV: grosor del tabique interventricular; ND: no disponible; RTG: realce tardío de gadolinio; sST2: ST2 soluble; VI: ventrículo izquierdo; VTD: volumen telediastólico; VTS: volumen telesistólico.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
La FMS se relacionó con una alta concentración de sST2 independientemente del sexo (tabla 6). No obstante, el sST2 se correlacionó con la masa del RTG (r=0,6604, p <0,001) (figura 2I) solo en los varones.
DISCUSIÓNEn este estudio, la concentración de sST2 se relacionó con la FMS evaluada mediante RMC en los pacientes con EA. Un valor de sST2 ≥ 28,2 ng/ml podría ayudar a estratificar o identificar a los pacientes con FMS, hipertrofia del VI y mayor probabilidad de sufrir disfunción del VI a pesar de un grado de EA parecido al de los pacientes con un valor de sST2 <28,2 ng/ml. Es importante destacar que el sST2 fue un factor independiente para la FMS con un aumento de la fibrosis de 0,17 unidades cada 1 ng de sST2/ml. En conjunto, los resultados refuerzan la idea de que el sST2 podría ser un marcador útil de la FMS y, por extensión, de la masa de RTG del VI en los pacientes con EA. Por último, se observa que, con similar gravedad de la EA, la FMS y la concentración de sST2 fueron mayores en los varones que en las mujeres.
La expresión de sST2 es inducida por sobrecarga mecánica en los cardiomiocitos24. Además, la concentración de sST2 en la válvula aórtica de los pacientes con estenosis está aumentada frente a la de aquellos con insuficiencia de la válvula aórtica25. Además, la concentración de sST2 circulante aumenta en respuesta a la sobrecarga de presión en los pacientes con EA11. La concentración de sST2 > 29,0 ng/ml se relacionó de forma independiente con una evolución desfavorable tras el implante percutáneo de válvula aórtica y podría utilizarse para estimar la mortalidad acumulada a 1 año16. Asimismo, el valor umbral de sST2 ≥ 28,2 ng/ml permite identificar a los pacientes con FMS, un factor predictor independiente de mortalidad validado en los pacientes con EA6. La FMS es un factor importante implicado en el desarrollo de la EA26. Cabe destacar que, para el mismo grado de EA, el sST2 se relacionó con la carga de hipertrofia del VI, claramente asociada con la FMS. Esto coincide con estudios previos en los que se constata relación entre una respuesta hipertrófica avanzada y la presencia de FMS27.
No puede excluirse la posibilidad de que otros parámetros influyan en el grado y el tipo de fibrosis miocárdica y se requieren más estudios con cohortes más grandes. Aunque la EC podría ser una de las causas principales de fibrosis subendocárdica, al parecer no es la única. Los análisis multivariantes en pacientes con FEVI conservada revelaron que solo la FEVI y la concentración de sST2 son los factores independientes de la FMS que probablemente causen las anomalías estructurales y funcionales observadas en la EA avanzada independientemente de la concomitancia de EC o de haber sufrido ya un infarto de miocardio. Los análisis de muestreo con reposición adicionales confirmaron la solidez del modelo. Además, no se observó ninguna diferencia de edad entre los pacientes RTG positivos y los negativos, lo que descarta un mayor deterioro en función de la edad como causa de la FMS del VI.
Con frecuencia se ha pasado por alto el sexo femenino, y un número cada vez mayor de publicaciones demuestran la necesidad clínica de identificar biomarcadores y dianas terapéuticas. Nuestros datos coinciden con los de otros estudios que demuestran que los varones presentan más FMS que las mujeres con una EA de la misma gravedad8,28. Por consiguiente, en los varones fue mayor la concentración de sST2. Al contrario, en una publicación reciente, los varones presentaron un menor grado de fibrosis difusa y FMS que las mujeres en todo el espectro de gravedades de la EA9. Estas discrepancias podrían deberse a los criterios de inclusión de los pacientes con EA. Mientras que en los estudios previos y en este se incluyó a pacientes con EA grave, el estudio de Tastet et al.9 también incluyó a pacientes con EA leve (el 34% varones y el 46% mujeres), moderada (el 30% varones y el 24% mujeres) y grave (el 36% varones y el 30% mujeres). Podría suponerse que la FMS altere de manera sustancial la anatomía y la función del VI solo en los varones con EA. No obstante, no puede ignorarse el efecto del reducido tamaño de la muestra. Se requerirán más estudios para aclarar el posible impacto clínico dependiente del sexo de la FMS en la EA. Conforme a los resultados de este estudio, que constata mayor concentración de sST2 en los varones, se ha propuesto que el sexo es un determinante importante de la concentración de sST229. La concentración de sST2 es mayor en los varones que en las mujeres de la misma edad. Aunque se desconocen los mecanismos subyacentes, en el Framingham Heart Study se constató que la concentración de sST2 puede verse influida por los estrógenos29. Las organizaciones internacionales como los National Institutes of Health recomiendan firmemente incluir el sexo como variable biológica. Aunque son preliminares, los datos del presente estudio muestran posibles diferencias sexuales en la expresión de sST2 y la FMS e indican que el desarrollo de medios pronósticos y diagnósticos para ambos sexos es todavía un campo por investigar.
Para los pacientes con EA grave, se recomienda la sustitución programada de la válvula en el momento de inicio de los síntomas o la disfunción del VI (FEVI <50%). Cabe destacar que esto último se conoce normalmente como marcador de mal pronóstico30. Implementar una evaluación de la FMS en los pacientes con EA grave con FEVI > 50% podría ayudar a identificar a un grupo de pacientes con peor remodelado ventricular que precede a la aparición de disfunción del VI. Cifras de sST2 ≥ 28,2 ng/ml solo se encontraron en pacientes RTG positivos. Curiosamente, los análisis de regresión lineal multivariantes, con o sin datos previos de transformación, revelaron que el sST2 es un factor independiente de FMS en los pacientes con EA y FEVI conservada, con o sin cardiopatía isquémica concomitante. Es importante destacar que la FMS aumentó en 0,17 unidades cada 1 ng de sST2/ml.
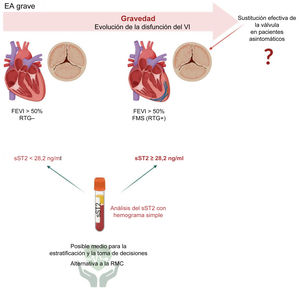
El tratamiento de los pacientes asintomáticos con EA grave supone un reto. No está clara la prevalencia real de la EA grave asintomática, y una proporción significativa de los pacientes siguen sin diagnóstico hasta que se encuentran en una fase avanzada, cuando las ventajas a largo plazo de la sustitución de la válvula son inciertas. El seguimiento de los pacientes asintomáticos con FEVI conservada que puedan contraer disfunción del VI podría facilitarse cuantificando la concentración de sST2 circulante. Además, los pacientes con EA aislada para quienes no es adecuada una RMC (p. ej., contraindicaciones a la RMC, como sufrir claustrofobia, ser portador de marcapasos y desfibrilador o una tasa de filtrado glomerular estimada <30ml/min) podrían beneficiarse de la cuantificación de sST2. Tal como se ilustra gráficamente en la figura 3, los pacientes asintomáticos con EA grave, FEVI > 50% y FMS podrían beneficiarse de una sustitución temprana de la válvula, lo cual podría identificarse mediante imágenes de RMC o análisis de la concentración de sST2 circulante durante las visitas de seguimiento31.
Figura central. Una simple cuantificación del sST2 en muestras séricas puede ayudar a identificar/estratificar a los pacientes con FMS y EA grave asintomática (sST2 ≥ 28,2 ng/ml) cuyas dilatación e hipertrofia del VI son más avanzadas que en los pacientes con EA grave asintomática sin fibrosis. Los pacientes con EA grave asintomática, FMS y sST2 ≥ 28,2 ng/ml podrían beneficiarse de una intervención temprana de sustitución de la válvula aórtica. Creado con BioRender.com. EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; FMS: fibrosis miocárdica de sustitución; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; sST2: ST2 soluble; VI: ventrículo izquierdo.
Este estudio tiene algunas limitaciones. En primer lugar, no se pudo reunir suficientes pruebas sobre las relaciones causales debido a las limitaciones inherentes al diseño experimental transversal del estudio. Segundo, según publicaciones previas, se confirma que el tamaño aparentemente reducido de la muestra del estudio es adecuado y tiene una potencia estadística superior al 90%. No obstante, esto es una limitación para estudiar la expresión dependiente del sexo de sST2 y su relación con los parámetros de la RMC y la FMS. Tercero, la cohorte del estudio representa una población real de pacientes consecutivos con EA grave aislada. Sin embargo, es muy probable que el sesgo de selección se deba a los criterios de exclusión. Por ejemplo, excluir la insuficiencia de la válvula aórtica o la enfermedad concomitante entre moderada y grave de la válvula mitral, que son muy prevalentes en la EA degenerativa, puede haber aumentado el porcentaje de pacientes con válvula aórtica bicúspide. Otros criterios de exclusión tales como la contraindicación para RMC podrían no interferir de manera significativa con la validez externa de los resultados, ya que en la práctica clínica a estos pacientes no se les sometería a ninguna cuantificación de la FMS mediante RMC. Al contrario, los pacientes con EA aislada o que tengan contraindicada la RMC se beneficiarían claramente de la evaluación de sST2 circulante. Por último, aunque se confirmaron estadísticamente el tamaño adecuado de la muestra y la validez interna del modelo, no puede descartarse la posibilidad de que algún criterio de exclusión haya influido en la prevalencia inusual de válvula aórtica bicúspide en la cohorte, y ello podría amenazar la validez externa de los resultados. Se requerirán estudios de repetición con series más grandes para evaluar las diferencias sexuales, validar la causalidad de las relaciones reportadas y eludir el efecto del gran número de válvulas aórticas bicúspides en la cohorte.
CONCLUSIONESLos datos de nuestro estudio aportan pruebas de que el sST2 está elevado en los pacientes con FMS y que es un factor independiente relacionado con la FMS en los pacientes con FEVI conservada, independientemente de la concomitancia de cardiopatía isquémica. El valor de sST2 ≥ 28,2 ng/ml se relacionó con FMS y mayor hipertrofia del VI. Por consiguiente, la concentración de sST2 circulante por encima de 28,2 ng/ml ayudaría a identificar a los pacientes con FMS. Nuestros resultados podrían ser una herramienta clínica útil. Son necesarios más estudios que evalúen la concordancia y la fiabilidad del sST2 circulante y la FMS. Se requieren estudios adicionales relacionados con el sexo y prospectivos.
FINANCIACIÓNEsta investigación fue financiada por: Contrato Miguel Servet CP13/00221 del Instituto de Salud Carlos III-FEDER, Fondo de Investigaciones Sanitarias [PI18/01875; PI21/00280; G°Na01/21]. L. Matilla tiene un contrato Predoctoral de Formación en Investigación en Salud (PFIS) (FI19/00302), E. Jover (CD19/00251) tiene una beca posdoctoral Sara Borrell, E. Martín-Núñez tiene una beca posdoctoral Margarita Salas (ULL-MS-P14) y M. Garaikoetxea tiene un contrato de la Fundación Miguel Servet.
CONTRIBUCIÓN DE LOS AUTORESV. Arrieta y E. Jover contribuyeron por igual a este artículo. Idea: N. López-Andrés. Metodología: V. Arrieta, A. Navarro, V. Álvarez, A. García-Peña, A. Gainza, A. Fernández-Celis y R. Sádaba. Análisis formal y tratamiento de los datos: V. Arrieta, A. Navarro, V. Álvarez, A. García-Peña, A. Gainza, A. Fernández-Celis, E. Jover, N. López-Andrés y R. Sádaba. Investigación: V. Arrieta, M. Garaikoetxea, E. Martín-Núñez, A. Navarro, L. Matilla, E. Jover, N. López-Andrés y A. Gainza. Redacción del artículo original: V. Arrieta, E. Jover y N. López-Andrés. Redacción, revisión y edición: V. Arrieta, E. Jover, A. García-Peña, R. Sádaba, V. Álvarez, A. Navarro y N. López-Andrés. Visualización: V. Arrieta y E. Jover. Supervisión: N. López-Andrés. Administración del proyecto: N. López-Andrés. Adquisición de financiación: N. López-Andrés.
CONFLICTO DE INTERESESNinguno.
- –
La FMS se relaciona con remodelado del VI y mal pronóstico en la EA.
- –
La RMC con análisis de RTG es un método no invasivo bien establecido para cuantificar la FMS.
- –
Las diferencias relacionadas con el sexo subyacen a la patogénesis y los fenotipos de la EA.
- –
El marcador de fibrosis sST2 se relaciona con inicio de los síntomas, concretamente IC, y la evolución en la EA.
- –
Igual que en el caso del RTG positivo, un umbral de sST2 sérico > 28,2 ng/ml predice FMS y remodelado del VI.
- –
Se observó un valor de sST2 más alto en los pacientes con FMS, en concreto con fibrosis intramiocárdica y mayor hipertrofia del VI.
- –
En los pacientes con FEVI conservada (> 50%), el sST2 es un predictor independiente de FMS pese a la concomitancia de cardiopatía isquémica.
- –
Tanto la FMS demostrada mediante RTG positivo como la concentración de sST2 son mayores en los varones que en las mujeres, pero solo se relaciona con hipertrofia y disfunción del VI en los varones.