Los fármacos antiarrítmicos con selectividad auricular actúan de forma preferente modificando determinadas características electrofisiológicas de las aurículas y minimizando el riesgo arritmogénico en los ventrículos. Se ha demostrado que la ranolazina, un fármaco utilizado para el tratamiento de la angina estable, bloquea muy selectivamente los canales de sodio de la aurícula y, en concreto, su corriente rápida (IKr). El bloqueo de IKr también interviene con las dosis usadas habitualmente, y es posible el bloqueo multicanal. Ambos efectos consiguen reducir, experimentalmente in vitro e in vivo, las características que precipitan y mantienen determinadas arritmias, especialmente la fibrilación auricular. Asimismo se ha señalado, por el bloqueo de INaL en el ventrículo, una reducción de arritmias ventriculares en distintos modelos con prolongación de la repolarización y susceptibilidad a la aparición de taquicardias ventriculares helicoidales. A pesar de eso, la evidencia clínica para su uso en arritmias auriculares y ventriculares es aún escasa y basada solamente en un subestudio y en su uso en casos aislados, por lo que son precisos estudios aleatorizados y controlados a mayor escala y diseñados a este fin.
Palabras clave
dispersión transmural de la repolarización.
potencial de acción.
posdespolarizaciones precoces.
posdespolarizaciones tardías.
síndrome de QT largo.
torsades de pointes.
Las arritmias auriculares y ventriculares constituyen uno de los retos más frecuentes en el ámbito clínico de la cardiología. Los fármacos antiarrítmicos son la alternativa más ampliamente utilizada en su tratamiento, pero su uso está limitado por una eficacia relativamente baja y una tasa elevada de efectos secundarios.
El desarrollo de nuevas técnicas permite complementar a los fármacos en determinados pacientes en los que han fracasado. La ablación con radiofrecuencia surge como opción terapéutica útil ante arritmias ventriculares y auriculares, como la fibrilación auricular1, 2. El uso de desfibriladores automáticos implantables aumenta la supervivencia en pacientes con un elevado riesgo de arritmias2.
Por otro lado, los efectos secundarios son otra gran frontera de los fármacos antiarrítmicos. El retraso de la conducción causado por los antiarrítmicos de clase I, la prolongación del intervalo QT de la clase III o el efecto inotrópico negativo de la clase IV contraindican su uso en la mayoría de los pacientes con cardiopatía estructural. Únicamente los bloqueadores beta consiguen reducir la mortalidad en pacientes con insuficiencia cardiaca3. La amiodarona, por sus características derivadas del bloqueo de múltiples canales, es segura en pacientes con cardiopatía estructural que padecen fibrilación auricular o arritmias ventriculares, pero sus numerosos efectos secundarios sistémicos reducen la gama de pacientes que pueden tomarla. La dronedarona, un análogo de la amiodarona, carece de muchos de sus efectos sistémicos, pero el aumento de mortalidad en pacientes con insuficiencia cardiaca descompensada4 y su eficacia inferior a la amiodarona deben aún establecerse de forma definitiva5.
Recientemente, se ha acuñado el concepto de selectividad auricular para designar nuevos fármacos antiarrítmicos que actúan de forma exclusiva o con elevada especificidad en el tejido auricular, con lo que se minimizan los riesgos en el ventrículo6. La ranolazina, un fármaco inicialmente diseñado y probado como antiisquémico y aprobado para el tratamiento de la angina estable7, dispone de características electrofisiológicas que lo encuadran en ese grupo. En el presente artículo se revisa la evidencia experimental y clínica disponible, en cuanto a mecanismos de acción, eficacia y seguridad, que justifican el estudio de la ranolazina como antiarrítmico.
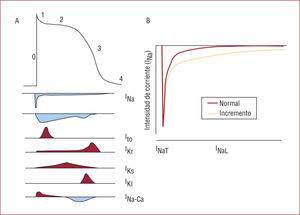
MECANISMO DE ACCIÓNCanales iónicosLas células excitables, en estado de reposo, muestran un potencial negativo en el interior de la célula de alrededor de −80 mV como consecuencia de la desigual distribución de cargas iónicas a ambos lados de la membrana. El potencial de acción (PAcc) es la unidad básica de la transmisión del estímulo eléctrico en las células miocárdicas, y se representa como la variación del potencial transmembrana en función del tiempo (fig. 1A). El cambio temporal del potencial transmembrana se origina por la presencia de corrientes iónicas; el balance entre las corrientes despolarizantes —entrada de iones positivos al interior de la célula— y repolarizantes —salida de iones positivos al exterior— durante el PAcc determina su morfología y su duración, así como la refractariedad de los miocitos. Estas características se pueden modificar mediante los fármacos antiarrítmicos inhibiendo o potenciando las citadas corrientes.
A: esquema del potencial de acción miocárdico, con la representación de las principales corrientes iónicas que lo configuran y las fases del potencial de acción. Las corrientes iónicas y sus iones se representan como Iión. El potencial de acción (PAcc) se inicia por la apertura de los canales de sodio que generan una corriente rápida de corta duración, despolarizando la célula. Posteriormente, una corriente transitoria (Ito) permite la entrada de potasio e inicia la repolarización. La corriente de calcio ICaL y la corriente lenta de sodio INaL, por un lado, y las corrientes de potasio IKs e IKr configuran la fase de meseta del PAcc y la posterior recuperación del potencial de reposo. B: la corriente de sodio tiene dos componentes, uno rápido, causante de la despolarización rápida del miocito, y una lenta que participa en el mantenimiento de la fase de meseta del PAcc. En la figura se representa la evolución de la intensidad de la corriente en función del tiempo.
El inicio del PAcc está determinado por la rápida apertura de los canales de sodio, que originan una corriente pico o rápida de sodio que despolariza los miocitos. La cinética de la apertura de estos canales determina la pendiente de la fase 0 del PAcc y ésta, la velocidad de conducción del estímulo en el miocardio8. En pocos milisegundos, la mayoría de los canales se cierran, y sólo una pequeña porción se mantiene abierta o se reabre inmediatamente, originando un segundo componente de corriente de sodio. Éste recibe el nombre de corriente lenta de sodio (INaL), que es un 0,5-1% de la intensidad de la corriente pico (fig. 1B). La INaL se encuentra activa durante la fase meseta del PAcc, momento en que la corriente neta a través de la membrana es prácticamente nula. En estas circunstancias, la INaL actúa como modulador de la duración del PAcc y, a pesar de su pequeña magnitud, los cambios en la intensidad de la INaL pueden alterar su duración. Este hecho es más importante en ciertas cardiopatías en que el incremento de la INaL prolonga el PAcc y resulta en un mayor riesgo de arritmias.
La prolongación de la repolarización que a menudo se encuentra en los pacientes con insuficiencia cardiaca tiene su origen tanto en un incremento de corrientes despolarizantes como en una reducción de las repolarizantes. Efectivamente, en modelos animales y en pacientes con insuficiencia cardiaca, se ha descrito un aumento de la INAL9, 10, como un descenso en diversas corrientes de potasio (especialmente Iks Ito e IKI)11,12.
De forma similar, la hipoxia incrementa la intensidad de INaL13 por un mecanismo mediado por peróxido de hidrógeno14 y carnitinas de cadena larga15, entre otros. Este incremento de sodio intracelular, en el que también participa un INa_Ca incrementado, justifica el hallazgo de una prolongación del intervalo QT en pacientes con isquemia activa16.
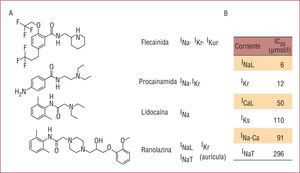
Bases celulares. Mecanismos de acción de la ranolazinaA pesar de sintetizarse inicialmente como antianginoso por un mecanismo inhibidor del metabolismo de los ácidos grasos, estudios posteriores demostraron que a las dosis habitualmente administradas la ranolazina actúa inhibiendo la INaL7. De forma consecuente con este hallazgo, la estructura de la ranolazina es similar a otros antiarrítmicos de clase I (fig. 2) y comparte su mismo sitio de unión específico en el canal de sodio17.
A nivel electrofisiológico, la ranolazina se comporta como un bloqueador multicanal. Su característica diferencial más significativa es la selectividad auricular, específicamente en el bloqueo de la corriente rápida de sodio, lo que limita los efectos arritmogénicos en el ventrículo. Las diferencias biofísicas entre los canales de sodio de las aurículas y los ventrículos, así como las características cinéticas de unión al receptor de ranolazina18, justifican el efecto selectivo auricular y un efecto residual en los miocitos ventriculares19, 20. Consecuentemente, la ranolazina modifica en la aurícula los parámetros electrofisiológicos esperables de un bloqueador de los canales de sodio, reduce la velocidad de conducción y prolonga el periodo refractario más allá del PAcc (refractariedad pospotencial)19, 21, 22. En el ventrículo, estos parámetros no se modifican19, 22 o lo hacen mínimamente23.
La ranolazina también inhibe el segundo componente de la corriente de sodio, INaL; a diferencia de la corriente rápida, la capacidad inhibidora en el ventrículo es intensa, de manera que la inhibición de INaL es de 9 a 40 veces más potente que la de la crecorriente rápida de sodio (INa)17, 24, 25.
A las concentraciones terapéuticas alcanzadas en la práctica clínica (2–10 μmol/l), la ranolazina inhibe de forma significativa la IKr y menos intensamente, la ICaL. Por el contrario, la inhibición del INa-Ca y la IKs se produce únicamente a concentraciones de ranolazina muy superiores a las terapéuticas, y no se ha documentado efecto en las IKI e Ito (fig. 2B)20, 25.
Mecanismos antiarrítmicosMediante la inhibición de las distintas corrientes iónicas, la ranolazina ejerce como antiarrítmico suprimiendo la actividad desencadenada, reduciendo la dispersión transmural de la repolarización (DTR) y prolongando el periodo refractario.
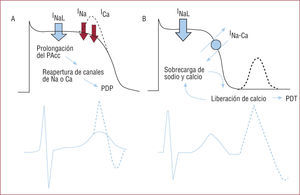
Posdespolarizaciones precoces y tardíasLas posdespolarizaciones precoces (PDP) y tardías (PDT) son un mecanismo de inicio de las arritmias auriculares y ventriculares que originan una extrasístole. Las PDP se originan durante las fases 2 o 3 del PAcc como consecuencia de una repolarización prolongada. Las PDT aparecen durante la fase 4 y se forman como resultado de una sobrecarga diastólica de calcio (fig. 3).
Mecanismo de formación de posdespolarización precoz (PDP) y tardía (PDT). A: la prolongación de la repolarización del potencial de acción origina PDP mediante la reapertura de canales de sodio o calcio que han recuperado la excitabilidad. B: la sobrecarga de calcio durante la diástole.
Un incremento de la INaL prolonga la repolarización y facilita la aparición de PDP, especialmente en las zonas donde el potencial de acción es más prolongado, usualmente las fibras de Purkinje26. Además, en los miocitos auriculares la sobrecarga de sodio es capaz de originar PDT27. Consecuentemente, los fármacos con capacidad para inhibir la INaL —como la ranolazina— reducen o suprimen la aparición de PDP28 y PDT27 y reducen la incidencia de arritmias iniciadas por actividad desencadenada.
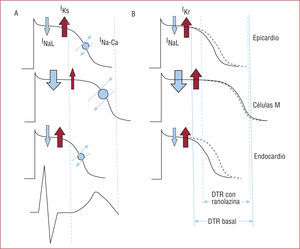
Dispersión transmural de la repolarizaciónEl PAcc varía de morfología y duración en el espesor del miocardio ventricular. El PAcc es más prolongado en las fibras de Purkinje que en los miocitos epicárdicos y endocárdicos; los miocitos medioventriculares o células M tienen características intermedias entre las fibras de Purkinje y las capas endoepicárdicas. Estas diferencias tienen su base en la desigual densidad de corrientes iónicas en las respectivas capas de miocitos. Las células M muestran, en comparación con los miocitos endocárdicos y epicárdicos, menor intensidad de la IKs, mayor intensidad de la INaL y una INa-Ca incrementada29. Así, en condiciones normales, la duración de la repolarización es heterogénea y hay refractariedad en el espesor miocárdico, característica denominada DTR, que es el origen de la onda T del ECG (fig. 4A).
La respuesta de las distintas capas de miocitos a cambios fisiológicos o patológicos o la exposición a fármacos o tóxicos también es desigual. En general, el bloqueo de la IKr o el incremento de la INaL prolongan el PAcc de manera mucho más marcada en las fibras de Purkinje que en los miocitos endocárdicos o epicárdicos. Consecuentemente, la DTR se incrementa en el espesor del miocardio30, lo que supone un mayor riesgo de arritmias por la posibilidad de que se produzcan bloqueos funcionales de la conducción y se facilite la aparición de taquicardias ventriculares polimorfas31.
El efecto de la ranolazina en la duración del PAcc depende del balance entre la inhibición de la INaL y la IKr. En los miocitos endocárdicos y epicárdicos ventriculares, el bloqueo de la IKr supera en importancia al de la INaL, y el resultado neto es una prolongación del potencial de acción. Por el contrario, en las fibras de Purkinje, la INaL es de mayor magnitud y su bloqueo tiene mayor repercusión y se acorta el PAcc. Las células M se comportan según un patrón intermedio y responden a la ranolazina con cambios mínimos en la duración del PAcc (fig. 4B). En general, la ranolazina prolonga ligeramente la repolarización, con tendencia a homogeneizarla y reducir la DTR25.
Prolongación del periodo refractarioLa reentrada es un mecanismo común en la aparición y la persistencia de distintas arritmias como la fibrilación auricular o ciertas taquicardias ventriculares. En general, una baja velocidad de conducción miocárdica y un periodo refractario corto tienden a mantener el circuito32. Los fármacos que prolongan el periodo refractario tienen la capacidad de desestabilizar los circuitos de reentrada y facilitar la reversión.
La ranolazina prolonga el periodo refractario mediante el bloqueo de la IKr y la INa. El bloqueo de la IKr prolonga la duración del PAcc y la refractariedad del miocito. Los bloqueadores de los canales de sodio característicamente generan refractariedad pospotencial, lo que fundamenta su uso en la fibrilación auricular19, 21, 33.
EFICACIA ANTIARRÍTMICA: DE LA FIBRILACIÓN AURICULAR A TAQUICARDIAS VENTRICULARESEfecto antiarrítmico en la aurículaLa capacidad antiarrítmica de la ranolazina en las taquicardias supraventriculares, y específicamente en la fibrilación auricular, se basa en su capacidad de actuar contra los factores iniciadores (actividad desencadenada) y el sustrato que la mantiene (prolongación de la refractariedad de los miocitos).
La extrasistolia auricular repetitiva, especialmente cuando se inicia en las venas pulmonares, es un mecanismo desencadenante habitual de fibrilación auricular, e incluso puede ser su única causa34. Estas extrasístoles pueden originarse por PDT y PDP en las venas pulmonares35, 36. En miocitos auriculares, la ranolazina inhibe su formación y suprime específicamente la aparición de PDP y PDT en preparaciones experimentales de venas pulmonares21, basalmente o durante la estimulación vagal o adrenérgica, con efecto sinérgico con el uso de amiodarona37.
El efecto antiarrítmico de la ranolazina se ha probado en distintos modelos animales in vivo en que la fibrilación auricular es fácilmente inducible. En modelos de fibrilación auricular vagal, inducida por acetilcolina intravenosa o en infusión intrapericárdica, así como en modelos de isquemia auricular, la ranolazina redujo la inducibilidad, y en los que se indujo fibrilación auricular, ésta fue de menor duración19, 22, 23.
Evidencia clínicaLos datos que avalan la eficacia y la seguridad de la ranolazina en la fibrilación auricular actualmente son escasos y provienen de subestudios y series cortas (tabla 1). El mayor nivel de evidencia proviene de un subanálisis del estudio MERLIN-TIMI 36, en el que se testó el efecto de la ranolazina en pacientes ingresados por síndrome coronario agudo. El objetivo primario, compuesto por muerte e isquemia, no difirió entre ambos grupos38. Los pacientes incluidos en el estudio fueron monitorizados durante 7 días con un Holter; los aleatorizados a ranolazina tuvieron menor incidencia de arritmias supraventriculares que los asignados a placebo (el 44,7 frente al 55%; p<0,001), con tendencia a la reducción de los episodios de fibrilación auricular (el 1,7 frente al 2,4%; p=0,08)39.
Estudios clínicos y casos publicados del efecto antiarrítmico de la ranolazina
| Estudio | Descripción |
| Efecto auricular | |
| Subestudio MERLIN-TIMI 3639 | Reducción de taquicardias supraventriculares (el 44,7 frente al 55%; p<0,001) en pacientes ingresados por sídrome coronario agudo sin elevación del ST |
| Murdock et al40 | Mantenimiento de ritmo sinusal en pacientes con fibrilación auricular paroxística refractaria |
| Murdock et al41 | Cardioversión de fibrilación auricular en el 72% de los pacientes con fibrilación auricular paroxística de evolución<6 h |
| Efecto ventricular | |
| Subestudio TIMI-3639 | Reducción de taquicardias ventriculares no sostenidas en pacientes ingresados por sídrome coronario agudo sin elevación del ST (> 8 latidos en el 5,3 frente al 8,2%; p<0,001) |
| Murdock et al45 | Tratamiento con ranolazina de un episodio de tormenta arrítmica |
| Kaliebe et al69 | Tratamiento de un paciente con taquicardia ventricular no sostenida sintomática |
| Moss et al59 | Acortamiento agudo del intervalo QTc en pacientes con síndrome del QT largo de tipo 3 |
Más allá de ese subestudio, únicamente se han publicado dos series cortas de pacientes con fibrilación auricular a los que se administró ranolazina. En una serie de 7 pacientes con fibrilación auricular (sin cardiopatía 6 de ellos) resistente a otros fármacos antiarrítmicos y con recidivas muy frecuentes, la ranolazina mantuvo en ritmo sinusal a 4 pacientes tras un seguimiento superior a los 4 meses40. El mismo grupo observó un efecto beneficioso de la ranolazina oral en la cardioversión de fibrilación auricular de corta duración. La administración de 2.000 mg de ranolazina a 18 pacientes con fibrilación auricular de menos de 48 h de duración revirtió a ritmo sinusal a 13 de ellos (72%) antes de 6 h. No se detectaron arritmias ventriculares ni otros efectos secundarios significativos41. A pesar de que los datos ofrecidos sugieren un efecto antiarrítmico en la prevención y la reversión de la fibrilación auricular, hay que interpretarlos con cautela. La reversión espontánea de la fibrilación auricular de corta duración es frecuente, por lo que la falta de un grupo control, asignación aleatoria y enmascaramiento en la valoración de los objetivos, así como el reducido tamaño muestral, destacan la necesidad de estudios clínicos prospectivos diseñados específicamente para evaluar el beneficio de la ranolazina en la fibrilación auricular.
Efecto antiarrítmico en el ventrículoEn el ventrículo, la ranolazina ejerce su efecto a través del bloqueo de la INaL y la IKr; suprime las PDP, prolonga el periodo refractario y reduce la DTR.
Cardiopatía estructuralExperimentalmente, se ha descrito un efecto antiarrítmico de la ranolazina en distintas cardiopatías, especialmente las que presentan una INaL incrementada. En un modelo de isquemia y reperfusión en rata, la ranolazina redujo la incidencia de episodios arrítmicos espontáneos y la duración de la taquicardia o la fibrilación ventricular de una forma dependiente de la concentración42. En miocitos obtenidos de corazones miocardiopáticos, en los que el PAcc estaba prolongado, la exposición a ranolazina acortó la duración del PAcc y suprimió la aparición espontánea de PDP24, 43.
El efecto modulador y el beneficio de actuar en la INaL se han demostrado también en modelos en que, a pesar de una prolongación del PAcc, esa corriente estaba reducida. De forma muy significativa, en un modelo de hipertrofia cardiaca y bloqueo auriculoventricular con elevada carga arrítmica en forma de taquicardias ventriculares polimórficas, la ranolazina consiguió reducir la extrasistolia ventricular espontánea y la incidencia de TdP44. De forma concordante, el grado de inhibición requerido para modificar las características electrofisiológicas en esos miocitos fue superior al de otros modelos44.
Eficacia clínicaLa seguridad y la eficacia de la ranolazina en la prevención de arritmias ventriculares fueron evaluadas en los pacientes ingresados por síndrome coronario agudo incluidos en el estudio MERLINTIMI 3639. En los pacientes asignados a ranolazina, se observó menor incidencia de taquicardia ventricular de más de ocho latidos que en el grupo placebo (el 5,3 contra el 8,3%; p<0,001). Por el contrario, no se hallaron diferencias significativas en las taquicardias ventriculares monomorfas sostenidas (el 0,13 contra el 0,22%; p=0,37) ni en taquicardias ventriculares polimórficas (el 0,32 contra el 0,22%; p=0,4). Aunque es posible que la menor incidencia de taquicardias ventriculares no sostenidas sea consecuencia de la reducción de la isquemia por ranolazina, no se encontraron diferencias en el beneficio obtenido entre los pacientes con isquemia persistente y los pacientes sin ella39. La ranolazina se utilizó en un paciente con miocardiopatía dilatada enólica y tormenta arrítmica que no había respondido a tratamiento con amiodarona, consiguiendo el control del cuadro45.
SÍNDROME DE QT LARGOEl intervalo QT puede prolongarse en el contexto de distintas cardiopatías, bien de forma primaria como consecuencia de enfermedades congénitas determinadas genéticamente (síndrome de QT largo [SQTL] congénito), bien por exposición a fármacos y tóxicos (SQTL adquirido). El papel de la ranolazina en estas situaciones ha sido valorado en estudios experimentales.
SQTL adquirido farmacológico. Interacción farmacodinámicaLos fármacos antiarrítmicos, especialmente los de las clases III y IA (quinidina, procainamida), por su efecto de bloqueo de las corrientes repolarizantes, prolongan el intervalo QTc46. La prolongación de la repolarización no es específica de los fármacos antiarrítmicos, sino que numerosos fármacos no considerados antiarrítmicos presentan como efecto colateral el bloqueo de una corriente repolarizante, en especial la IKr46. La exposición a estos fármacos, en determinadas personas con predisposición genética o que reciben otro fármaco que prolonga la repolarización, puede alargar el intervalo QT de forma exagerada y desencadenar taquicardia en TdP, lo que se denomina SQTL adquirido46.
El uso de ranolazina en estas circunstancias es motivo de preocupación, ya que prolonga el intervalo QT. A pesar de esto, los datos experimentales disponibles reflejan que, en esta situación, la modulación de la INaL supera al bloqueo de la IKr. En modelos in vivo e in vitro de SQTL adquirido, la adición de ranolazina redujo o suprimió la carga arrítmica20,47,48.
Eficacia clínicaLos resultados experimentales no han sido probados en un entorno clínico. Así, la administración de ranolazina está contraindicada en pacientes que estén tomando antiarrítmicos de las clases I o III distintos de amiodarona, y debe administrarse con precaución en pacientes con un intervalo QT prolongado o cuando se prescribe conjuntamente con otros fármacos que prolonguen el intervalo QT49.
SQTL congénitoEl SQTL congénito es un conjunto de enfermedades genéticas caracterizadas por prolongación del intervalo QT, taquicardias ventriculares tipo TdP y riesgo de muerte súbita en la mayoría de los casos. Fisicopatológicamente, el SQTL congénito es resultado de la disfunción de las corrientes iónicas, que concluyen en una prolongación de la repolarización. El efecto de distintos fármacos se ha probado en modelos animales con fármacos o mediante transgénicos.
Por su base fisiopatológica, la correlación más directa con la ranolazina se establece con la prolongación de la repolarización por un incremento de la INaL característico del SQTL tipo 3, causado por una mutación en el canal de sodio que incrementa INaL50. La ranolazina consiguió inhibir in vitro la INaL en dos modelos con mutaciones causantes de SQTL tipo 3 localizadas en puntos alejados del canal de sodio17, 51. Por otro lado, el uso de toxinas como ATXII ha permitido simular el incremento de la INaL característico del SQTL tipo 3 en múltiples situaciones y modelos experimentales y demostrar la eficacia de la ranolazina en el acortamiento del PAcc y de la actividad arrítmica27, 28.
Sin embargo, al igual que en la variante adquirida, la capacidad de la INaL para modular la duración del PAcc se extiende a las alteraciones causadas por otras corrientes iónicas. La prolongación de la repolarización mediante fármacos inhibidores de la IKr se ha utilizado como modelo experimental de SQTL tipo 2. Los bloqueadores de los canales de sodio consiguen mejorar el sustrato arritmogénico en este modelo52, y la ranolazina acorta la duración del PAcc y reduce la actividad desencadenada por el D-sotalol, clofilio, dofetilida o E-40 3 1 20 2 5 44 48.
El SQTL tipo 8 se produce por un incremento en la corriente lenta del calcio (ICaL), que prolonga la meseta del PAcc, especialmente en las células medioventriculares, e induce la aparición de PDT. El bloqueo con ranolazina de la INaL y la ICaL consiguió inhibir las PDT, corrigió la prolongación del PAcc y redujo la DTR, con lo que disminuyó la incidencia de arritmias ventriculares, en un modelo animal53.
Eficacia clínicaLos bloqueadores de los canales de sodio como la flecainida y la mexiletina se han estudiado como tratamiento específico para los pacientes con LQTS tipo 3, y se ha demostrado un acortamiento del intervalo QT54-56 y una reducción de la DTR57. En clínica, algunos bloqueadores de los canales de sodio también han sido útiles en pacientes con SQTL de tipos 1 y 257, 58.
Hasta el momento, la ranolazina se ha usado únicamente de forma aislada en pacientes con SQTL congénito, sin seguimiento a largo plazo. En un estudio con 5 pacientes con SQTL tipo 3 en los que se había documentado una mutación específica del canal de sodio (AKPQ), la administración aguda intravenosa de ranolazina acortó el intervalo QT en una media de 26 ms (QTc de 548±53 a 526±53 ms; p<0,05). Un efecto rebote no significativo en la duración del intervalo QT después de la infusión y, paradójicamente, unos índices electrocardiográficos (distancia entre el pico y el final de la onda T) que indican mayor DTR exigen estudios adicionales y ponen en duda la eficacia clínica. Durante la administración de ranolazina no se objetivaron eventos arrítmicos59. Además, sólo se incluyó en el estudio a pacientes con la mutación AKPQ y estos hallazgos podrían no ser aplicables a todos los pacientes con SQTL tipo 3. Efectivamente, la eficacia de los fármacos antiarrítmicos en los SQTL congénitos puede diferir según la mutación específica del canal de sodio56.
SEGURIDAD: ¿PROLONGA EL INTERVALO QT, INCREMENTA EL RIESGO ARRÍTMICO?El principal riesgo de la mayoría de los fármacos antiarrítmicos reside en su potencial efecto proarritmogénico.
El uso de fármacos bloqueadores de los canales del sodio ha sido proscrito en los pacientes con cardiopatía estructural, puesto que reducen la velocidad de conducción y favorecen el bloqueo unidireccional, la formación de reentradas y la aparición de taquicardias ventriculares8, con lo que se incrementa la mortalidad60. La ranolazina, por su bloqueo selectivo auricular de la INa, no modifica o reduce mínimamente la velocidad de conducción en el ventrículo, por lo que no es esperable la inducción de arritmias ventriculares típica de los fármacos antiarrítmicos de clase I.
El riesgo de taquicardia ventricular tipo TdP es especialmente marcado en los antiarrítmicos de clase III. El marcador más comúnmente utilizado para la estratificación del riesgo arritmogénico es la medición del intervalo QT61. En los estudios clínicos realizados, la administración de ranolazina se asoció a una prolongación significativa del intervalo QTc entre 2,3 y 8 ms en distintas poblaciones de pacientes con cardiopatía isquémica; menos de un 1% de los pacientes suspendieron el tratamiento con ranolazina como consecuencia de la prolongación del QT38, 62. Sin embargo, el poder de estratificación del intervalo QT es bajo. Efectivamente, otros factores influyen de forma decisiva en el origen de taquicardias ventriculares y justifican la falta de correlación entre el intervalo QT y el riesgo de arritmias61:
- –
La DTR actúa como sustrato para la formación de taquicardias ventriculares helicoidales. Como ya se ha descrito, la ranolazina reduce la DTR25.
- –
La generación de actividad desencadenada actúa como factor precipitante. La ranolazina reduce la aparición de actividad desencadenada en distintos contextos y modelos animales20, 47, 48.
- –
La dependencia inversa de la frecuencia —es decir, la prolongación del potencial de acción y, por lo tanto, la DTR y la generación de PDP— aumenta excesivamente a medida que se reduce la frecuencia cardiaca. Este efecto contribuye a una mayor prolongación del QT durante episodios de bradicardia e incrementa muy marcadamente el riesgo de taquicardias helicoidales. Clásicamente, los fármacos del grupo III responden a este esquema de acción61. Por el contrario, la ranolazina20, 25 y la amiodarona63 no poseen esta característica y la duración del PAcc se mantiene relativamente independiente de la frecuencia cardiaca.
Estas características justifican el bajo potencial arritmogénico de la ranolazina. No se han publicado casos de efecto proarritmogénico atribuido a la ranolazina. Además, en el estudio MERLIN, en el que más de 3.000 pacientes con cardiopatía isquémica activa recibieron ranolazina, no se incrementó la incidencia de taquicardias helicoidales e incluso se redujeron las taquicardias ventriculares no sostenidas39.
¿QUÉ APORTA LA RANOLAZINA AL ARSENAL TERAPÉUTICO ACTUAL?La ranolazina comparte mecanismos de acción y características farmacológicas con otros antiarrítmicos de las clases I y III. Sin embargo, presenta peculiaridades que la desmarcan de ambos grupos y ofrece opciones terapéuticas distintivas.
La capacidad de bloquear la INaL con una mayor selectividad que la INa es característica también de otros fármacos de la clase I, como la lidocaína64, la flecainida65 y la amiodarona66. Entre todos los fármacos con capacidad de bloquear la INaL, la ranolazina actúa con la mayor selectividad.
La lidocaína y la mexiletina presentan un efecto bloqueador de la INa relativamente puro. Los demás fármacos de la clase I y la ranolazina actúan también en corrientes repolarizantes de potasio, hecho que explica su mayor eficacia antiarrítmica en comparación con la lidocaína y la mexiletina67.
El bloqueo de la IKr, característico de la mayoría de los fármacos antiarrítmicos de la clase III, participa de forma significativa en la actividad de la ranolazina. Sin embargo, el bloqueador selectivo de la IKr dofetilida incrementa la DTR y es arritmogénico. La ranolazina, al igual que la amiodarona, bloquea tanto los canales repolarizantes de potasio como la INaL, lo que les atribuye un perfil de seguridad parecido. Sin embargo, los efectos secundarios sistémicos de la amiodarona no se han descrito con la ranolazina.
Cualitativamente, la ranolazina puede incluirse entre los nuevos fármacos antiarrítmicos selectivos de la aurícula. Entre ellos, el vernakalant se encuentra en un estado avanzado de desarrollo y estudio clínico. Éste es, al igual que la ranolazina, un fármaco bloqueador multicanal que tiene una potente selectividad auricular en el bloqueo de la INa y bloquea la INaL en el ventrículo, además de la IKur, la Ito y la IKr26. El vernakalant se ha probado por vía intravenosa en varios ensayos clínicos aleatorizados para la conversión de fibrilación auricular, y ha demostrado eficacia y seguridad especialmente en la fibrilación auricular de corta duración6. Al igual que la ranolazina, el vernakalant también acorta la duración del PAcc y la aparición de PDP en un modelo de INaL incrementada por ATXII68.
CONCLUSIONESLa ranolazina es un fármaco incluido en la nueva generación de fármacos antiarrítmicos selectivos de la aurícula, con efectos mediados por la INa y la IKr en la aurícula y la INaL y la IKr en el ventrículo. Estudios experimentales le atribuyen efectos beneficiosos en el tratamiento de la fibrilación auricular, las taquicardias ventriculares y el SQTL congénito o adquirido. Sin embargo, actualmente la evidencia clínica de eficacia es escasa y deriva únicamente de un subestudio, series cortas y casos aislados, por lo que su uso generalizado en pacientes con arritmias no está justificado. Se precisan, pues, estudios aleatorizados y controlados a gran escala para confirmar los esperanzadores resultados hallados hasta el momento.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.


 PAcc) se inicia por la apertura de los canales de sodio que generan una corriente rápida de corta duración, despolarizando la célula. Posteriormente, una corriente transitoria (Ito) permite la entrada de potasio e inicia la repolarización. La corriente de calcio ICaL y la corriente lenta de sodio INaL, por un lado, y las corrientes de potasio IKs e IKr configuran la fase de meseta del
PAcc) se inicia por la apertura de los canales de sodio que generan una corriente rápida de corta duración, despolarizando la célula. Posteriormente, una corriente transitoria (Ito) permite la entrada de potasio e inicia la repolarización. La corriente de calcio ICaL y la corriente lenta de sodio INaL, por un lado, y las corrientes de potasio IKs e IKr configuran la fase de meseta del 
 PDP) y tardía (
PDP) y tardía ( DTR: dispersión transmural de la repolarización.' title='Esquema del potencial de acción en condiciones normales (A) y después de la exposición a ranolazina (B).
DTR: dispersión transmural de la repolarización.' title='Esquema del potencial de acción en condiciones normales (A) y después de la exposición a ranolazina (B).