La proteína C reactiva, un reactante de fase aguda que participa en la respuesta inmunitaria innata, ha emergido como un biomarcador pronóstico de eventos cardiovasculares en sujetos supuestamente saludables y de la recurrencia de eventos en pacientes con enfermedad arterial coronaria establecida. Su posible utilidad no sólo en el pronóstico, sino también como blanco terapéutico, ha influido en que este sea el marcador inflamatorio más extensamente evaluado desde hace más de 10 años. En este artículo se exponen aspectos sobre la relación de la proteína C reactiva con la enfermedad arterial coronaria. Se tratan las intervenciones sobre el estilo de vida y farmacológicas, particularmente estatinas, relacionadas con una posible reducción de las concentraciones de este biomarcador y que han contribuido a que en la actualidad se considere a la proteína C reactiva como un indicador potencial de la respuesta a la terapia dirigida a la prevención primaria y secundaria de la enfermedad arterial coronaria.
Palabras clave:
enfermedad arterial coronaria.
infarto agudo de miocardio.
proteína C reactiva.
síndrome coronario agudo.
En los últimos años, la intervención sobre los factores de riesgo clásicos —dislipemia, hipertensión arterial, hábito de fumar, diabetes mellitus (DM) y obesidad— ha sido la piedra angular en la prevención primaria y secundaria de diferentes síndromes isquémicos como la angina estable crónica, la angina inestable, el infarto agudo del miocardio (IAM) y la muerte súbita1. Sin embargo, en la práctica clínica aún existen limitaciones en la identificación del riesgo cardiovascular, particularmente en los pacientes de riesgo intermedio, si sólo se tiene en cuenta los factores de riesgo clásicos1-3.
El reconocimiento de la inflamación como mecanismo central en la aterotrombosis ha incentivado las investigaciones para identificar marcadores que faciliten la detección de la activación inflamatoria subyacente con el propósito de mejorar la estratificación del riesgo cardiovascular4,5. Estudios recientes con proteínas de fase aguda, citocinas y moléculas de adhesión, entre otros, señalan que ciertos biomarcadores podrían añadir información pronóstica a la aportada por los factores de riesgo tradicionales, el más estudiado de los cuales es la proteína C reactiva (PCR), un reactante de fase aguda que participa en la respuesta inmunitaria innata, con características analíticas favorables a su utilización en este contexto1,3-6.
La posible utilidad de la PCR no sólo en el pronóstico, sino como diana terapéutica, ha contribuido a que sea el marcador inflamatorio más extensamente evaluado desde hace más de 10 años, sin que haya consenso en aspectos relacionados con su aplicación clínica4,7-10.
En este artículo se consideran aspectos concernientes a la relación de la PCR con la enfermedad arterial coronaria (EAC), las intervenciones sobre el estilo de vida y con fármacos asociadas con reducción de las concentraciones de este biomarcador que han contribuido a que en la actualidad la PCR se considere como un indicador potencial de la respuesta a la terapia dirigida a la prevención primaria y secundaria de la EAC.
PROTEÍNA C REACTIVA Y ENFERMEDAD ARTERIAL CORONARIALa PCR es una molécula pentraxínica estable, producida en el hígado en respuesta a la interleucina 6 y otras citocinas, aunque estudios recientes informan que también la producen los adipocitos e in situ en las placas de ateroma11-13.
En las últimas décadas, la PCR ha sido objeto de numerosos estudios relacionados con las enfermedades cardiovasculares, en particular con la EAC, debido a sus propiedades como biomarcador de la inflamación de bajo grado presente en el proceso aterotrombótico6. A su empleo con estos fines han contribuido sus características biológicas como biomarcador y la disponibilidad de métodos de alta sensibilidad, que detectan concentraciones séricas mínimas de PCR6,11,14. De ahí que en la literatura científica se le denomine PCR de alta sensibilidad.
Concentraciones elevadas de PCR se han relacionado con la presencia de DM, tabaquismo, hipertensión arterial, dislipemia y obesidad, en una relación que parece ser lineal15. Las concentraciones de PCR están inversamente relacionadas con factores potencialmente protectores de la EAC, como el colesterol unido a las lipoproteínas de alta densidad (cHDL), apolipoproteína A1 y estilos de vida saludables11,15,16.
Los primeros hallazgos de la relación entre la PCR y la EAC se publicaron en 1954, con la descripción del aumento de concentraciones de PCR como respuesta al IAM17. Sin embargo, el interés actual en este biomarcador se debe a que, desde la década de los noventa, diversos estudios han demostrado el valor pronóstico independiente de la PCR en la prevención primaria y secundaria de la EAC15,18-20.
Las cifras elevadas de PCR se asocian con un incremento en el riesgo de IAM y muerte cardiaca en individuos aparentemente sanos6,15. Se han establecido unos valores séricos de PCR < 1, 1–3 y > 3mg/l como representativos de riesgo cardiovascular bajo, intermedio y alto, respectivamente, lo que puede añadir información a la aportada por los factores de riesgo clásicos, particularmente en individuos con riesgo intermedio6. En la actualidad se reconoce que los sujetos que presentan crónicamente PCR > 10mg/l no son falsos positivos, sino que tienen un riesgo vascular elevado, ya que la inflamación de varios orígenes puede ser patogénica para el endotelio vascular21. El score de riesgo de Reynolds incorpora a los factores de riesgo clásicos las concentraciones de PCR y la historia familiar de IAM antes de los 60 años22. Sin embargo, algunos investigadores no consideran que la PCR aporte información adicional en la predicción de riesgo en la práctica clínica23.
Valores elevados de PCR se han asociado con un riesgo alto de eventos coronarios en pacientes con EAC estable y son predictores de peor evolución en pacientes con síndrome coronario agudo (SCA)6,19,20. Se ha reconocido que la adición de la PCR a la evaluación del riesgo a corto plazo podría ofrecer información adicional en la estratificación de los pacientes con SCA20. Sin embargo, otros estudios no indican esta relación y se plantea que se requiere confirmar su utilidad en la práctica clínica24,25.
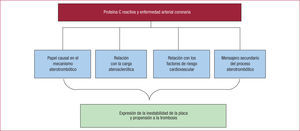
RELACIÓN ENTRE PROTEÍNA C REACTIVA Y ENFERMEDAD ARTERIAL CORONARIAAún no se ha definido en qué se basa la relación pronóstica de la PCR con la EAC. En la figura 1 se presentan los posibles factores que explicarían esta relación. Hay evidencia experimental que apunta a que la PCR no es un «espectador inocente», sino que participa en la formación, la progresión, la inestabilidad y la rotura de la placa aterosclerótica mediante diferentes mecanismos proinflamatorios13. No obstante, según otros investigadores, las evidencias disponibles no permiten afirmar que la PCR, por sí misma, tenga un papel causal en el proceso aterotrombótico26. La disponibilidad de un fármaco que actúe específicamente contra la PCR podría ofrecer nuevas evidencias acerca de su papel en este proceso. Pepys et al27 informaron de que la administración de un inhibidor específico de la PCR, 1,6- bis(fosfocolina)-hexano, en ratas limitó la extensión del infarto, pero hasta el presente no hay ensayos clínicos con este tipo de fármacos.
La PCR también puede ser la expresión de una enfermedad aterosclerótica más extensa y grave. Sin embargo, las concentraciones parecen tener poca relación con la carga aterosclerótica evaluada mediante la detección de calcio coronario o por angiografía coronaria, tema que es motivo de controversias28-30. Es posible que la PCR sólo sea un mensajero secundario de la inflamación de bajo grado, teniendo en cuenta que la secreción tisular —incluido el tejido adiposo— de citocinas incrementa su concentración, en relación con el desarrollo de aterosclerosis12.
La relación de la PCR con la predicción de riesgo podría vincularse a los factores de riesgo cardiovascular con reconocido efecto proinflamatorio asociados a valores elevados de este biomarcador9,10,15. Libby et al10 señalan que la PCR puede reflejar el estado inflamatorio en su conjunto, expresando aspectos difíciles de medir directamente, como el estilo de vida o la hiperactividad de las células inflamatorias determinada genéticamente, que no están incluidos en la mayoría de los modelos de predicción de riesgo y pueden exacerbar la aterosclerosis.
Valores elevados de PCR se relacionan con mayor cantidad de núcleo necrótico en las placas coronarias evaluadas por ultrasonido intravascular, incluso en pacientes con EAC estable31. Se ha observado relación entre cifras elevadas de PCR y presencia de placas blandas evaluadas mediante angiografía coronaria por tomografía axial computarizada de 64 cortes32. Estos resultados indican que la concentración de PCR se relaciona con la inestabilidad, la ulceración y la propensión a la trombosis de la placa aterosclerótica, como expresión de la activación del estado inflamatorio presente en el árbol coronario31,32.
Por otra parte, la atención recibida por la PCR en la literatura científica también está dada porque es un blanco potencial para intervenciones terapéuticas dirigidas a prevenir la enfermedad coronaria aterosclerótica.
PROTEÍNA C REACTIVA E INTERVENCIONES TERAPÉUTICASIntervenciones sobre estilos de vidaSe ha señalado que la cardioprotección relacionada con las intervenciones para modificar estilos de vida puede atribuirse en parte a su efecto en el estado inflamatorio16. Estudios prospectivos indican que estas intervenciones reducen la concentración de PCR (tabla 1).
Principales intervenciones cardioprotectoras que pueden reducir las concentraciones de proteína C reactiva
| Modificaciones en estilo de vida | Farmacológicas |
| Abandono del tabaquismo | Antiagregantes plaquetarios: ácido acetilsalicílico |
| Patrones dietéticos cardiosaludables | Inhibidores del SRA: IECA/ARA-II |
| Pérdida de peso | Hipoglucemiantes: metformina, insulina |
| Actividad física sistemática y entrenamiento con ejercicios | Hipolipemiantes: estatinas |
ARA-II: antagonistas de los receptores de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; SRA: sistema renina-angiotensina.
La activación del proceso inflamatorio parece ser uno de los mecanismos por los que el hábito de fumar incrementa el riesgo cardiovascular33. Los fumadores tienen altas concentraciones de PCR15,33,34, que pueden disminuir ligeramente después del abandono del tabaquismo; pero se requieren entre 10 y 20 años para que se igualen a las de aquellos que nunca han fumado34,35. Existe relación entre cantidad de cigarrillos consumidos y concentración de PCR, independientemente del tiempo transcurrido sin fumar33-35. Estos hallazgos permiten considerar que la determinación de la PCR no parece ser útil como indicador temprano del efecto beneficioso del cese del tabaquismo. No obstante, podría servir como indicador que contribuya a estimular la abstinencia a largo plazo.
Patrones dietéticos, pérdida de peso y ejercicio físicoLos patrones dietéticos habituales parecen modular la respuesta inflamatoria de bajo grado, por lo que una alimentación adecuada contribuiría a reducir la incidencia de EAC por esta vía16,36.
Las poblaciones que consumen dietas cardiosaludables suelen tener menores concentraciones de PCR, según el estudio Multi-Ethnic Study of Atherosclerosis (MESA)37 y el Nurses' Health Study38, al comparar patrones dietéticos prudentes con el patrón occidental en individuos sanos. Sin embargo, en el Women's Health Initiative Observational Study, realizado con mujeres posmenopáusicas, no se encontró asociación entre concentraciones de PCR y mayor consumo de fibra dietética39.
En estudios de intervención con alimentos específicos, las concentraciones de PCR se redujeron utilizando dieta baja en grasa, té negro o vino tinto36. El consumo a largo plazo de la dieta mediterránea se ha relacionado con la reducción del riesgo cardiovascular y de las concentraciones de PCR, por lo que se la puede considerar una dieta antiinflamatoria36.
Por otra parte, la pérdida de peso es un elemento en que se centran las intervenciones para prevenir el riesgo cardiovascular. El tejido adiposo está involucrado directamente en la regulación de citocinas proinflamatorias que inducen la producción de PCR12. La modulación de la inflamación podría ser un mecanismo por el cual la pérdida de peso reduce el riesgo de enfermedad cardiovascular12,40. El grado de adiposidad y la distribución de la grasa corporal constituyen una importante fuente de variación de las concentraciones de PCR en la población general12,40. En mujeres obesas intervenidas mediante restricción calórica sin modificación de la actividad física, las concentraciones de PCR se redujeron en un 32% después de la pérdida de peso41. En diabéticos obesos, la pérdida de peso debida a dieta y ejercicios redujo las concentraciones basales de PCR en un 43,3%42. Por ello, la pérdida de peso podría ser una estrategia no farmacológica efectiva para disminuir las concentraciones de PCR40.
El ejercicio es efectivo para reducir la disfunción endotelial y la inflamación de la pared vascular y se asocia con concentraciones bajas de PCR16,43,44. La pérdida de peso concurrente con ejercicios, y no el ejercicio per se, puede ser la causa de la reducción de las concentraciones de PCR, según estudios con sujetos sanos45,46.
En pacientes con EAC, bajo régimen de rehabilitación cardiovascular, las concentraciones de PCR se redujeron en un 41% con ejercicios, independientemente de la pérdida de peso y el tratamiento con estatinas47. Sin embargo, es difícil precisar qué elementos son los que causan la reducción de PCR, porque estos programas incluyen consejos dietéticos y manejo integral de los factores de riesgo. Las características de los sujetos incluidos y las diferencias en el tiempo y la intensidad del entrenamiento pueden ser causa de las contradicciones encontradas entre estudios43,44. La mayoría de los estudios que muestran disminución de la PCR con entrenamiento físico mantienen los ejercicios 12 semanas como mínimo43,44,47. Actualmente no hay consenso respecto a si la asociación entre actividad física y concentraciones de PCR es independiente de la reducción en la adiposidad.
A pesar de la disminución de las concentraciones de PCR mediante estrategias dirigidas a modificar estilos de vida, se requieren estudios que evalúen si estos efectos se traducen en una reducción del riesgo cardiovascular.
Proteína C reactiva e intervenciones farmacológicasSe ha informado de que las intervenciones farmacológicas cardioprotectoras pueden tener un efecto antiinflamatorio y disminuyen las concentraciones de PCR48-50 (tabla 1).
Ácido acetilsalicílicoEn individuos sanos o pacientes con EAC, las concentraciones de PCR pueden disminuir con el tratamiento con ácido acetilsalicílico (AA)48,51,52. En el Physician Health Study51, un estudio con varones supuestamente sanos, el AA (325mg en días alternos) redujo el riesgo cardiovascular. La mayor reducción se observó en quienes presentaban concentraciones elevadas de PCR51. En un ensayo aleatorizado a doble ciego, en pacientes con angina estable y concentraciones de PCR > 3mg/l, el AA (300mg/día) disminuyó la PCR en un 29%52. Sin embargo, existen diferencias en cuanto al efecto de dosis bajas de AA en las concentraciones de PCR48,53.
La resistencia al AA, un fenómeno multifactorial, se da con mayor frecuencia en pacientes con SCA complicados con neumonía, inflamación persistente (enfermedades autoinmunitarias), DM e hipertensión arterial54. Parece haber una asociación entre concentraciones de PCR y la resistencia al AA que sufren algunos pacientes54. La evaluación de las concentraciones de PCR podría ser de utilidad para monitorizar el tratamiento con este fármaco.
Fármacos antidiabéticosLa DM suele asociarse con concentraciones elevadas de PCR15. Los fármacos antidiabéticos pueden modular la inflamación, evidenciada por el descenso en las concentraciones de PCR48,49,55,56. La metformina redujo las concentraciones de PCR un 30% en diabéticos tipo 255, y en pacientes con SCA la insulina disminuyó las concentraciones de PCR un 40%56. Sin embargo, en el estudio The Lantus for C-reactive Protein Reduction in Early Treatment of Type 2 Diabetes (LANCET)57, el tratamiento con insulina o metformina, comparado con placebo, no redujo las concentraciones de PCR a pesar de la mejoría del control glucémico. No obstante, las concentraciones de PCR se redujeron en todos los grupos, lo que se atribuye a que se incluyó a todos los pacientes en un régimen dietético y cambios de estilo de vida57.
Inhibidores del sistema renina-angiotensinaSe reconocen las propiedades proinflamatorias de la angiotensina II4. Los inhibidores de la enzima de conversión de la angiotensina (IECA) y los antagonistas de los receptores de la angiotensina II (ARA-II) podrían modular la respuesta inmunitaria y atenuar la inflamación, lo que contribuye a sus efectos cardioprotectores48,58,59. El estudio Valsartan-Managing blood pressure Aggressively and evaluating Reductions in hsCRP (Val-MARC)59 incluyó a pacientes hipertensos tratados con valsartán o con valsartán/hidroclorotiazida 6 semanas. Los pacientes tratados con valsartán sólo redujeron las concentraciones de PCR, independientemente del control de la presión arterial, pero no así los que recibieron diurético59. Se observaron efectos similares en la PCR con olmesartán y telmisartán58,60. Hay datos de que los IECA (captopril, ramipril y fosinopril) reducen las concentraciones de PCR incluso en pacientes con DM tipo 248,60. No obstante, otros estudios no han indicado una reducción de las concentraciones de PCR mediante el tratamiento con IECA o ARA-II48,58,61.
EstatinasLos inhibidores de la enzima hidroximetilglutaril-coenzima A reductasa (estatinas) tienen efectos inmunomoduladores y reducen las concentraciones de PCR9,48-50,62,63. Se considera que el beneficio asociado con esta terapia se relaciona en parte con la disminución de las concentraciones de PCR9,63.
Un análisis post-hoc del ensayo Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS-TexCAPS)62 mostró que, en prevención primaria, el tratamiento de 1 año con lovastatina, comparada con placebo, redujo el riesgo coronario en los grupos con concentraciones basales elevadas de LDL y también en el grupo con concentraciones elevadas de PCR y bajas de LDL, lo que indica que las estatinas podrían ser eficaces en presencia de inflamación sistémica, aun en ausencia de hiperlipemia62.
El ensayo Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin (JUPITER)63, un estudio con sujetos sin enfermedad cardiovascular asignados aleatoriamente a tratamiento con rosuvastatina o placebo, demostró que, en individuos con LDL < 130mg/dl y concentraciones de PCR > 2mg/l, el tratamiento con rosuvastatina disminuyó la incidencia de eventos cardiovasculares. Estos hallazgos han permitido considerar que individuos para los que no es adecuado el tratamiento con estatinas podrían beneficiarse de estas considerando las concentraciones de PCR7,9,10. En este estudio, el tratamiento con rosuvastatina redujo las concentraciones de LDL por debajo de 55mg/dl63, de manera que el efecto en la incidencia de eventos podría deberse a la disminución en las concentraciones de LDL, lo que, asociado a la ausencia de un grupo control con bajos valores de PCR, contribuye a que la aplicación de estos resultados en la práctica clínica aún sea tema de debate8-10,64.
En los ensayos Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction (PROVE IT-TIMI 22)65 y Aggrastat to Zocor (A-to-Z)66, realizados en pacientes con SCA tratados con estatinas, la supervivencia libre de eventos cardiovasculares fue mayor en el grupo en que se redujeron tanto las concentraciones de LDL como las de PCR65. El estudio Reversing Atherosclerosis with Aggressive Lipid Lowering (REVERSAL)67, realizado en pacientes con EAC asignados aleatoriamente a recibir tratamiento moderado o intenso con estatinas, reveló que la menor progresión en las lesiones ateroscleróticas (detectada por ultrasonido intravascular a los 18 meses) ocurrió en los pacientes con mayor reducción concurrente de las concentraciones de LDL y PCR. La regresión del ateroma sólo se evidenció en los pacientes con mayor reducción en las concentraciones de PCR67. Por lo tanto, en prevención secundaria, monitorizar la PCR, junto con la LDL, maximizaría los beneficios del tratamiento con estatinas.
Con base en estos datos, se ha propuesto a la PCR como un predictor de la respuesta clínica a la terapia con estatinas, ya que sus beneficios podrían relacionarse con sus efectos antiinflamatorios4,7,9,10,50. Considerando que la adherencia a las intervenciones terapéuticas para reducir el riesgo cardiovascular depende, en parte, de la percepción del riesgo de enfermar, la adición de la PCR a la evaluación del perfil lipídico también podría constituir una herramienta útil para estos fines.
Se requieren ensayos clínicos que demuestren que las intervenciones dirigidas a modular la respuesta inflamatoria conducen a una reducción de los eventos cardiovasculares. Actualmente se realizan ensayos clínicos con estos propósitos68,69.
CONCLUSIONESNumerosos estudios han concluido que las intervenciones farmacológicas y en el estilo de vida dirigidas a la prevención cardiovascular disminuyen las concentraciones de PCR. Sin embargo, aún no hay evidencia definitiva que sustente que la disminución de las concentraciones de PCR conduzca a una reducción en el riesgo cardiovascular. Hasta que se defina si la PCR es una diana terapéutica, se podría utilizarla como un indicador del fenómeno que subyace a las manifestaciones clínicas, en el que la fluctuación de sus concentraciones en respuesta a intervenciones terapéuticas cardioprotectoras es una expresión de la modulación del proceso inflamatorio vinculada a la aterotrombosis.
CONFLICTO DE INTERESESNinguno.