Palabras clave
INTRODUCCION
Cada vez con mayor frecuencia, la anastomosis cavopulmonar superior o Glenn bidireccional (GB) es el procedimiento quirúrgico paliativo elegido para tratar a pacientes portadores de cardiopatías congénitas complejas. El espectro de los defectos subsidiarios de ser tratados con esta técnica no sólo se circunscribe a las cardiopatías con fisiología de corazón univentricular, sino también a aquellas en las que la corrección biventricular se hace imposible1-3. La técnica, entendida actualmente como paso intermedio, es la preferida en la estrategia terapéutica destinada a una paliación más definitiva, como es la derivación de la totalidad de la circulación venosa sistémica hacia el territorio vascular pulmonar: la derivación cavopulmonar total (DCPT)4-6.
Desde el punto de vista hemodinámico, la ventaja más importante del GB es la reducción de la sobrecarga de volumen ventricular, aspecto que, según algunos autores, contribuye de modo fundamental a preservar la función ventricular7, aunque hay que decir que este hecho se cumple sólo en los casos en los que el GB queda como única fuente de flujo sanguíneo al territorio vascular pulmonar. Otros beneficios se derivan de la mejoría de los valores de saturación sistémica de oxígeno y de la simplificación del procedimiento quirúrgico a la hora de proceder a la DCPT7,8. En este sentido, en los últimos años diversos centros prefieren realizar el GB precozmente como primera y única paliación, o poco tiempo después de una fístula sistémico-pulmonar o de un cerclaje de la arteria pulmonar. De este modo se evita, además, la distorsión anatómica que las cirugías paliativas previas al GB provocan con elevada frecuencia en el árbol vascular pulmonar9-11. Permanece en discusión la edad ideal a la que se debe realizar el GB o el intervalo aconsejable entre el GB y la DCPT10.
La morbimortalidad de las cardiopatías congénitas con corrección univentricular aún no es despreciable a pesar de la introducción del GB como procedimiento intermedio y de la sencillez de la técnica. Entre otras, la disfunción ventricular, la resistencia vascular pulmonar elevada, la insuficiencia de las válvulas auriculoventriculares, las fístulas arteriovenosas pulmonares, la estenosis de la anastomosis, la trombosis y la infección son las causas que mantienen una mortalidad global en el 8-15%5,12-17. Por otra parte, algo más del 10% de los enfermos son reintervenidos quirúrgicamente durante la evolución debido a la presencia de un flujo pulmonar inadecuado (ya sea por exceso o por defecto), a un mal funcionamiento de la anastomosis (estenosis, resistencia pulmonar elevada), o a la necesidad de reparar estenosis en las arterias pulmonares15,18.
El propósito de este trabajo es exponer nuestra experiencia, analizando los factores que pudieron influir en la evolución de estos enfermos, y especialmente en la mortalidad y en la necesidad de reintervención quirúrgica.
PACIENTES Y MÉTODO
Datos generales y diagnósticos
El estudio incluye los 100 enfermos a los que se realizó esta operación desde el 1 de diciembre de 1990 hasta el 1 de junio del año 2000. La edad media en el momento de efectuarse la intervención fue de 4,5 ± 3,6 años (rango: 24 días a 15,7 años), con 14 casos por debajo del año de vida y 4 menores de 3 meses. El peso medio fue de 16,5 ± 9,8 kg (rango: 2,6 a 67 kg), con 26 casos por debajo de los 10 kg. La relación varón/mujer fue de 1,18.
La población estudiada estaba compuesta por los enfermos con anatomía cardíaca con conexión univentricular, y aquellos con anatomía biventricular pero con defectos complejos que hicieron inviable la cirugía correctora con dos ventrículos. Quedaron excluidos del estudio los casos con:
1. Ramas pulmonares no confluentes a los que se practicó un Glenn clásico o unidireccional, excepto que su confluencia se estableciera en el momento del GB.
2. Continuidad vena cava inferior-vena ácigos-vena cava superior, ya que la realización del GB supuso la derivación total de la sangre venosa sistémica hacia el circuito pulmonar.
3. Reparación tipo medio ventrículo.
En la tabla 1 se recogen los distintos diagnósticos anatómicos y las anomalías asociadas significativas de los enfermos que componen la población estudiada. De modo sindrómico, la presentación fisiopatológica del 28% de los casos fue de flujo pulmonar aumentado, mientras que en el 72% existió algún grado de protección pulmonar en forma de atresia, estenosis valvular o subvalvular pulmonar. Entendemos como anomalías asociadas significativas aquellas con potencial influencia en el resultado del GB, ya sea por la necesidad de su corrección durante el GB, o porque ocasionan una alteración significativa en la hemodinámica.
Cirugía paliativa previa (CPP)
En 17 pacientes, el GB supuso la primera intervención quirúrgica. En los otros 83 enfermos fue preciso realizar algún tipo de operación quirúrgica antes del GB (tabla 2). En 13 casos, esta CPP fue realizada en otro hospital.
Estudio hemodinámico y angiográfico
Antes del GB se efectuó cateterismo cardíaco a 95 enfermos. En 91 casos se registraron las presiones sistólica y media de la arteria pulmonar (PSAP y PMAP, respectivamente) en mmHg, y en cuatro se consideró la presión en la vena pulmonar enclavada media como sucedáneo de la PMAP. También se obtuvo la saturación sistémica de oxígeno (SatAo) en 85 enfermos, la relación de flujo pulmonar y sistémico (FP/FS) en 61, y la resistencia arteriolar pulmonar (Rpa) en 54. Asimismo, se examinaron con detalle las angiografías realizadas para visualizar el árbol vascular pulmonar, detectando y valorando así la presencia de estenosis en las ramas de la arteria pulmonar.
Cirugía (GB)
En 88 casos, la anastomosis se efectuó entre la vena cava superior derecha y la arteria pulmonar derecha; en tres se realizó entre la vena cava superior izquierda y la arteria pulmonar izquierda, y en nueve la anastomosis se llevó a cabo de modo bilateral en un mismo acto quirúrgico, ante la existencia de un doble sistema de cava superior. Las vías de abordaje fueron la esternotomía media en 93 casos y la toracotomía derecha en siete. En 97 niños, el GB se realizó con la ayuda de circulación extracorpórea, cuya duración fue de 56,4 ± 31 min (rango, 19-135 min), y en 22 pacientes fue necesario el clampaje aórtico, con un tiempo de isquemia miocárdica de 45 ± 26 min (rango, 5-83 min).
En la tabla 2 se describen otros procedimientos simultáneos (uno o varios en cada caso) que fue preciso realizar en 31 pacientes durante el GB.
Repercusión de la cirugía previa al GB sobre las ramas pulmonares
En 36 niños, el 43,4% de los 83 enfermos con CPP, y en directa relación con la misma, se apreció estenosis de una o ambas ramas de la arteria pulmonar en el cateterismo previo al GB. En otros 6 casos se presentaron estenosis nativas de cualquiera de las ramas pulmonares principales. Se efectuaron dos estudios:
1. Se compararon entre sí los diferentes grupos de CPP con objeto de conocer su repercusión sobre la anatomía vascular pulmonar.
2. Se analizaron los casos en los que dichas lesiones precisaron ser corregidas durante el GB y se estudió en especial la repercusión de dicha actuación sobre el tiempo de cirugía extracorpórea (CEC) y de clampaje aórtico (CLAO). De los 36 casos en que se evidenció estenosis de una o ambas ramas pulmonares, en 16 (tres nativas y 13 en relación con la CPP) fue preciso actuar sobre la lesión vascular en el mismo acto operatorio, ya fuera mediante parche de ampliación (n = 12; ocho sobre la rama derecha y cuatro sobre la izquierda), efectuando en un caso una angioplastia en la rama izquierda, o mediante la implantación de un stent (n = 3, todos en la rama izquierda). Este grupo de 16 casos se comparó con el resto de enfermos no portadores de estenosis, aunque con dos excepciones: un caso con ramas pulmonares no confluentes en el que se estableció su continuidad durante el GB, y los casos (n = 15) en los que, además del GB, se practicó Blalock-Hanlon, resección subaórtica, ligadura de ductus o implantación de un marcapasos, procedimientos adicionales que, al incrementar el tiempo quirúrgico, originarían un sesgo de enmascaramiento importante a la hora de realizar la comparación estadística.
Después del GB, 8 niños precisaron ser sometidos a cateterismo intervencionista para efectuar angioplastia en la rama pulmonar derecha (n = 5, dos de ellos con reconstrucción intraoperatoria) o en ambas ramas (n = 2), o bien para implantar un stent en la rama izquierda. El cateterismo se efectuó entre los 9 meses y los 5 años después de la intervención.
Flujo pulmonar adicional (FPA)
En 78 casos se dejó, o se creó, un FPA en el momento de realizarse el GB. En estos enfermos, el flujo pulmonar tras la intervención quedó constituido como sigue (además de la sangre proveniente de la vena cava superior):
En 37 casos se dejó una estenosis pulmonar nativa, nueve de ellos con una o 2 fístulas sistémico-pulmonares previas al GB, que se mantuvieron.
En 22 casos se dejó un cerclaje de la arteria pulmonar previo.
En 15 casos (todos con atresia pulmonar) se dejaron fístulas sistémico-pulmonares previas: nueve Blalock-Taussig izquierdo, tres derecho y otros 3 casos de forma bilateral.
En 4 casos (todos también con atresia pulmonar) se efectuó, en el momento del GB, una fístula tronco-tronco (2 casos) o una reconexión ventrículo derecho-arteria pulmonar (2 casos).
En los 22 casos restantes, el GB quedó como única fuente de aporte sanguíneo a ambos pulmones.
Seguimiento
El seguimiento medio tras el GB fue de 3,5 ± 2,9 años, con un máximo de 8 años. Este período se consideró finalizado con el fallecimiento del enfermo, con la última revisión o con la realización de la DCPT de forma electiva (en 2 casos se realiza DCPT no electiva como solución a una mala situación clínica, considerándose en ambos como reintervención post-GB). De todos los enfermos se conocen datos de los últimos 8 meses. En cada revisión clínica se efectuó, en todos los casos, examen radiográfico, electrocardiograma y ecocardiograma.
Durante la evolución posquirúrgica, 8 enfermos precisaron de algún procedimiento de cateterismo terapéutico que se indicó ante la evidencia de una incorrecta situación hemodinámica (3 implantes de coils en la vena ácigos, 3 casos con diversos grados de estenosis en el GB resueltas con la colocación de dos stents y efectuando una angioplastia, un cierre de una fístula de Blalock-Taussig izquierda con coil, y un caso en el que se embolizaron unas colaterales bronquiales); en tres de ellos, el intervencionismo formó parte de un cateterismo programado como paso previo a la DCPT.
En el momento del cierre de este estudio se ha realizado cateterismo cardíaco post-GB en 48 casos y se ha completado la DCPT en 27 de ellos.
Grupos de enfermos
Grupo A. Resultado no satisfactorio por mortalidad o por reintervención quirúrgica durante el seguimiento (n = 15)
Forman este grupo los enfermos que fallecieron durante la evolución, con o sin relación con la cirugía de GB (n = 8), y los pacientes en los que fue preciso efectuar uno o más procedimientos quirúrgicos para corregir alguna anomalía anatómica o hemodinámica que impedía de forma fundamental la correcta evolución del caso (n = 7).
Grupo B. Resultado satisfactorio (n = 85)
Pertenecen a este grupo los pacientes supervivientes en quienes no fue preciso practicar procedimiento quirúrgico alguno durante la evolución.
Un enfermo falleció después de precisar reintervención quirúrgica tras el GB. A efectos estadísticos sólo se cuenta como enfermo fallecido, aunque sus datos aparezcan descritos en las tablas correspondientes a los fallecidos y también a los reintervenidos.
Análisis estadístico
En la tabla 3 se enumeran las diferentes variables independientes continuas y categóricas usadas para evaluar su impacto sobre la evolución postoperatoria del GB, utilizando como variable dependiente, según fuera apropiado, la mortalidad, la necesidad de reintervención quirúrgica, o ambas conjuntamente. Hemos considerado que el flujo pulmonar era excesivo (FPE) después del GB en los casos que han requerido una reintervención para reducir el flujo pulmonar o en aquellos que han cursado con saturación de O2 transcutánea (SatO2) > 90% a las 48 h del GB. Las variables continuas se expresan como media ± desviación estándar, y rango.
Un primer análisis crudo consistió en comparar 3 grupos de enfermos de diferente evolución clínica (los fallecidos, los que precisaron reintervención y los de evolución satisfactoria) mediante el test de Kruskal-Wallis con la correspondiente corrección de Bonferroni. Según los resultados de este procesamiento, a los que se añade el potencial defecto debido al reducido número de casos en cada uno de los dos primeros grupos, se planteó la unión de los mismos, resultando finalmente un grupo A, compuesto de 15 enfermos, con evolución no satisfactoria, para su comparación con el grupo B de 85 enfermos con buena evolución. A efectos comparativos, entre los dos grupos finales, A y B, se compararon las variables continuas mediante el test de Wilcoxon para variables no apareadas, construyéndose para las variables categorizadas las tablas de contingencia correspondientes. Las variables cualitativas expresadas en su valor relativo porcentual se compararon mediante el test de la *2, test de Fisher o prueba binomial según fuera necesario.
A continuación, se realizó un punto de corte en las variables continuas hemodinámicas (PSAP y PMAP) con el criterio estadístico de fijar dicha categorización según su mayor nivel de significación.
Por último, se efectuó regresión logística no condicional uni y multivariante utilizando el logaritmo del cociente de máxima verosimilitud como estadístico para la comparación de variables. Se comprobó la colinealidad entre la PSAP y la PMAP, a partir de la cual sólo es utilizada esta última en todas las comparaciones múltiples. Para obtener el modelo multivariante, se utilizó una estrategia «hacia atrás» incluyendo en el modelo inicial aquellas variables que en los procesamientos estadísticos previos se asociaron con el resultado clínico.
Al tratarse de un estudio retrospectivo, y no disponer de la totalidad de los valores de las diferentes variables hemodinámicas previas al GB, se seleccionó un subgrupo de 48 niños en quienes sí se obtuvieron la totalidad de dichos valores, comparándose los pertenecientes al grupo A (n = 8; 3 fallecidos y 5 reintervenidos), con los pertenecientes al grupo B (n = 40). Como paso previo al procesamiento estadístico se confirmó que esta muestra específica era representativa del universo total.
La supervivencia precoz y tardía se evaluó mediante la prueba de Kaplan-Meyer. Esta misma prueba se utilizó para observar la tasa de enfermos con evolución satisfactoria (libres de cualquier procedimiento quirúrgico para corregir el estado postoperatorio inicial). El intervalo de confianza se fijó al 95%.
Para todos los procedimientos efectuados se consideró la significación estadística cuando p < 0,05.
RESULTADOS
Estancia hospitalaria
La estancia promedio en la unidad de cuidados intensivos (UCI) fue de 6,2 ± 9,5 días, con un rango comprendido entre 1 y 60 días (¾ 5 días en 74 casos). El tiempo total de hospitalización (HOSP), incluyendo los cuidados intensivos, fue de 14,4 ± 17,2 días, con un rango de 1 a 96 días (¾ 10 días en 63 casos). En 17 niños se observaron complicaciones importantes en el postoperatorio inmediato: signos de bajo gasto cardíaco e insuficiencia cardíaca congestiva en 10 enfermos, infección o sepsis en siete, arritmias en cinco, derrame pleural en cinco, parálisis frénica en cuatro (tres precisaron plicatura diafragmática), complicaciones pulmonares como neumotórax o atelectasia importante en 3 casos, mediastinitis en un caso y necesidad de traqueostomía en otro caso.
Mortalidad
La mortalidad de nuestra serie estuvo compuesta por 8 enfermos (8%). No se detectaron diferencias en cuanto a la edad o el peso en el momento de la intervención, ni tampoco en el diagnóstico clínico. Los principales factores asociados al fallecimiento en estos enfermos fueron el FPE (2 casos con salida pulmonar permeable y uno con fístula sistémico-pulmonar), y la presencia de anomalías asociadas (2 resecciones subaórticas por estenosis del foramen ventrículo-cameral y un caso con insuficiencia mitral severa). Se produjeron 5 fallecimientos en las primeras 24 h del postoperatorio con cuadros clínicos de bajo gasto cardíaco y cianosis; dos de ellos con presión pulmonar elevada. Los otros 3 niños fallecieron más allá de los 30 días siguientes a la intervención: un caso que murió a los 10 meses del GB con insuficiencia cardíaca congestiva refractaria al tratamiento tras realizar un recerclaje de la arteria pulmonar 3 meses después del GB, otro que falleció con daño cerebral muy importante tras realizar un GB contralateral urgente 30 días después de la primera intervención, y otro que lo hizo por causa desconocida, a los 40 días del GB, habiendo presentado unos datos hemodinámicos favorables y un postoperatorio sin complicaciones.
Reintervención quirúrgica
En 8 pacientes fue necesario reintervenir durante la evolución. Tampoco se detectaron diferencias llamativas en cuanto a edad, peso o diagnóstico. Asimismo, los principales factores relacionados con la reintervención fueron el FPE (3 casos con cerclaje de la arteria pulmonar y uno con fístula sistémico-pulmonar) y la presencia de anomalías asociadas (3 estenosis subaórticas y un caso de drenaje venoso pulmonar anómalo parcial). La reoperación tuvo lugar entre los 2 días y 3 años después del GB (media 4,5 meses). La insuficiencia cardíaca era severa en 5 casos (en tres se cerró la arteria pulmonar, en otro se desmontó el GB y en otro se efectuó con éxito el segundo tiempo de DCPT a los 3 meses del GB); y la cianosis era muy importante en los otros 3 enfermos (en un caso se amplió la anastomosis VCS-APD ante la evidencia de estenosis de la misma, en otro se realizó un Mustard con la vena cava inferior, y en otro se efectuó el segundo tiempo de DCPT a los 10 días del GB, falleciendo el enfermo).
Resultado satisfactorio
El grupo lo constituyen 85 enfermos, de los cuales 66 tenían FPA, existiendo FPE (por SatO2 > 90% a las 48 h del GB) únicamente en seis de ellos. Asimismo, 5 enfermos tenían anomalías asociadas significativas (estenosis subaórtica, insuficiencia mitral moderada, agenesia de válvula pulmonar y 2 casos de drenaje venoso pulmonar anómalo). En los 85 enfermos de este grupo, la SatAo preoperatoria fue de 86 ± 5% (rango, 67-98). A la salida del quirófano y 48 h más tarde, los valores fueron de 87 ± 8% (rango, 74-96) y 88 ± 6% (rango, 72-98; n = 60), respectivamente. Estos datos no pusieron de manifiesto diferencias significativas entre sí.
Análisis de supervivencia y tasa de enfermos con resultado satisfactorio
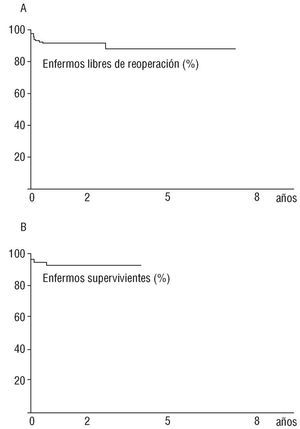
La supervivencia alcanzó el 95% (IC del 95%, 90-99) en el postoperatorio inmediato, el 93% a los 3 meses (IC del 95%, 88-98), y el 91,8% más allá del año de realizado el GB (IC del 95%, 86-97). Cuando se analiza la tasa de enfermos libres de precisar reintervención, se alcanza el 97% en el postoperatorio inmediato (IC del 95%, 94-100), el 92% a los 3 meses (IC del 95%, 87-98), y el 90% a los 3 años (IC del 95%, 83-97) (fig. 1).
Fig. 1. Curva actuarial de supervivencia (abajo), y de enfermos libres de reoperación (arriba).
Análisis de los 3 grupos iniciales de evolución clínica
No se encontraron diferencias entre los 3 grupos en lo referente a las siguientes variables continuas: edad, peso, SatAo, FP/FS, Rpa, CLAO y UVI. Tampoco se detectaron diferencias cuando se compararon las variables categóricas. Sin embargo, sí se hallaron diferencias cuando se compararon los valores medios de la PSAP (26, 26 y 20 mmHg, respectivamente; p < 0,018), de la PMAP (20, 18 y 14 mmHg, respectivamente; p < 0,008), del CEC (79, 54 y 56 min, respectivamente; p < 0,048) y de la hospitalización (7, 44 y 15 días, respectivamente; p < 0,0004) entre los 3 grupos. Debido al reducido número de casos de los dos primeros grupos (fallecidos y reintervenidos), la información derivada de estas comparaciones debe tomarse con cautela. Para paliar este déficit, se decidió unirlos con el objeto de realizar las comparaciones estadísticas.
Análisis de los dos grupos finales de evolución: A con resultado no satisfactorio, y B con resultado satisfactorio
No se encontraron diferencias significativas cuando se compararon la edad, peso, SatAo, Rpa, CLAO, UCI y HOSP, presencia de estenosis de ramas pulmonares, cerclaje de la arteria pulmonar previo a la intervención y existencia o no de FPA tras el GB. Sin embargo, sí fueron diferentes los valores de la PSAP (p < 0,009) y de la PMAP (p < 0,002) y existió una tendencia en lo que se refiere al CEC (p < 0,07) y el FP/FS (p < 0,06). Los valores de estas últimas 4 variables fueron siempre menores en el grupo B (tabla 4).
El análisis de tablas de contingencia, al explorar el punto de corte óptimo para categorizar la PMAP, reflejó que existe una asociación con la evolución cuando la misma oscila entre 15 y 20 mmHg; sin embargo, la mayor significación se obtuvo cuando el valor de corte es ¾ 17 mmHg (*2 = 9,1; p < 0,002) (tabla 5).
La aplicación de la prueba binomial puso en evidencia que la edad por debajo del año en el momento del GB, el FPE, el doble Glenn, las anomalías asociadas y las arritmias, se asocian con el resultado entre los dos grupos de análisis (tabla 6).
En los 48 enfermos con todos los datos hemodinámicos importantes completos (PMAP, PSAP, Rpa, SatAo, FP/FS) se compararon los pertenecientes a cada grupo de estudio. Los valores correspondientes al grupo A fueron siempre mayores que los correspondientes al grupo B. La PMAP y la SatAo fueron las variables con significación estadística (tabla 7).
Regresión logística no condicional
En el modelo univariante, la PMAP y la PSAP (tanto continuas como categorizadas) se asociaron con cada una de las variables dependientes analizadas (mortalidad, reintervención, o ambas conjuntamente). Otras variables (FP/FS, CEC, UVI y HOSP) demostraron una asociación variable según la comparación efectuada. La CEC sólo puso de manifiesto una fuerte tendencia cuando se evaluó con relación a la mortalidad (tabla 8). En los modelos multivariantes avanzados con estrategia «hacia atrás» sólo se mantuvo la PMAP cuando la variable dependiente fue la mortalidad (OR = 0,85; IC del 95%, 0,74-0,97; p < 0,015).
Repercusión de la CPP en la anatomía vascular pulmonar
En nuestra serie, la presencia de estenosis en una o ambas ramas de la arteria pulmonar no ha influido en la mortalidad precoz o tardía, o en la necesidad de reintervención quirúrgica. Sin embargo, ha constituido la primera causa de indicación de cateterismo intervencionista terapéutico tras el GB.
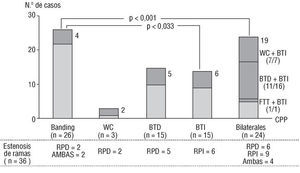
Al efectuar el análisis de los grupos de CPP (26 casos con cerclaje de la arteria pulmonar y 57 casos con fístula sistémico-pulmonar uni o bilateral), en relación con el número de estenosis de rama que provocaron (n = 36), resultó significativamente menor el número de lesiones que originó la realización de un cerclaje de la arteria pulmonar que el que provocó la implantación de 2 fístulas (una a cada rama) (p < 0,001), o una fístula solitaria a la rama izquierda (p < 0,03). Claramente, el Watterston-Cooley (WC) es la fístula que más se asocia con estenosis de rama (6 estenosis de rama derecha de 10 WC implantados, ya fueran solitarios o en combinación con una fístula a la rama pulmonar izquierda) (fig. 2).
Fig. 2. Repercusión que las distintas cirugías paliativas previas al GB tuvieron sobre las ramas pulmonares.
Cuando se compararon los 16 enfermos que precisaron reconstrucción de alguna o ambas ramas pulmonares con los 68 en los que no fue necesario hacerlo se observó:
1. La presencia de estenosis de arterias pulmonares antes de efectuarse el GB no influyó significativamente en la mortalidad, reintervención quirúrgica o ambos aspectos combinados, tanto aplicando una regresión logística no condicional como efectuando las tablas de contingencia correspondientes (tabla 6).
2. Se constató que los enfermos que precisaron reconstrucción de alguna o ambas ramas requirieron un mayor tiempo de CEC que aquellos en los que no fue preciso hacerlo (82 frente a 52 min, respectivamente, p < 0,0005).
3. El 43% de los enfermos que precisaron reparar una o ambas ramas pulmonares tuvieron necesidad de CLAO, mientras que esta técnica fue tan sólo precisa en el 11% de los que no tuvieron necesidad de dicha reparación (p < 0,009). El tiempo consumido en el CLAO no fue diferente en ambas poblaciones.
4. No se encontraron diferencias significativas entre ambos grupos, respecto del tiempo transcurrido entre la CPP y el GB (4,2 y 5,3 años, respectivamente), y de la edad a la que se realizó el GB (4,9 y 5,8 años, respectivamente).
DISCUSIÓN
La anastomosis entre la vena cava superior y la arteria pulmonar derecha fue descrita por primera vez en 195819. El procedimiento fue abandonado durante los años setenta al aparecer la operación de Fontan aplicada a los casos de atresia tricúspide, y ampliada después a un extenso grupo de cardiopatías con imposibilidad de corrección biventricular. Mas tarde se retomó la técnica, esta vez como bidireccional, confirmándose como un excelente método paliativo en aquellos casos con fisiología de corazón univentricular20. En los últimos años se utiliza como paso quirúrgico intermedio en los enfermos candidatos a una corrección tipo Fontan. Ésta es la estrategia quirúrgica que se lleva a cabo en la mayoría de los centros, incluido el nuestro.
Mortalidad y necesidad de reintervención
A pesar de que el GB es una técnica quirúrgica sencilla, la morbimortalidad no es despreciable debido a múltiples variables, como la anatomía y hemodinámica de la lesión, la presencia de lesiones asociadas y la dificultad que supone lograr dejar un FP adecuado tras la intervención. Nuestra mortalidad, tanto la precoz (6%) como la tardía (2%), así como la tasa de reintervenciones en el seguimiento (8%), se sitúan dentro de los rangos publicados por otros autores5,12-18.
El principal objetivo de este estudio fue definir los factores asociados con la mortalidad y/o con la necesidad de reintervención. Dichos factores se exponen en la tabla 9.
Presión de la arteria pulmonar
Es un parámetro directo, no calculado, de fácil adquisición durante el cateterismo en la gran mayoría de los enfermos, y esencial para establecer la indicación operatoria.
Presión media de la arteria pulmonar
Su valor es de obligatoria determinación durante el estudio hemodinámico previo al GB, ya que en buena medida refleja la resistencia vascular del pulmón. Cuando ello no es posible de forma directa, consideramos que la presión de enclavamiento en la vena pulmonar es de suficiente fiabilidad. Hemos demostrado su fuerte asociación con el resultado del GB y creemos que es el primer parámetro a tener en cuenta en el momento de la indicación operatoria. Aunque en nuestra serie la significación estadística se mantiene entre 15 y 19 mmHg, el punto de corte a partir del cual se aprecia un descenso de su valor predictivo se sitúa en los 17 mmHg. En este estudio hemos encontrado un 23% de casos con valores superiores (tres de ellos con más de 20 mmHg) que logran sobrevivir sin necesidad de reintervención quirúrgica. Aunque se han descrito casos de GB realizado con éxito en lactantes muy pequeños con PMAP muy elevada21, creemos, en consonancia con otros autores, que se debe asumir un riesgo operatorio progresivamente mayor a partir de 17 mmHg de PMAP5,22,23. En los casos con más de 20 mmHg deben tenerse en cuenta otros factores, como el FP y la Rpa, a la hora de contraindicar la realización del GB.
Presión sistólica de la arteria pulmonar
Aunque su valor guarda un cierto paralelismo con la PMAP, no atrayendo por ello el suficiente interés en otras series, hemos constatado que es un factor determinante para el resultado operatorio. Desde el punto de vista fisiopatológico refleja la pulsatilidad del árbol vascular pulmonar, en especial en aquellas condiciones con permeabilidad de la válvula pulmonar, con o sin cerclaje previo. En nuestra serie, su valor predictivo puede ser consecuencia del numeroso grupo de niños con FPA. De todos modos, en los casos con PSAP mayor de 26 mmHg deberían valorarse otros factores (FP y Rpa) antes de contraindicar la realización del GB.
Resistencias pulmonares. Relación flujo pulmonar/flujo sistémico. Saturación de O2
¿Deben rechazarse de forma absoluta para efectuar GB los casos con presión pulmonar elevada (PMAP > 20 mmHg y PSAP > 26 mmHg)? Como ya se ha comentado, en estos enfermos es preciso valorar otros parámetros, ya que están descritos casos (y algunos de ellos tenemos en nuestro estudio) con buen resultado y presiones elevadas debidas a hiperaflujo pulmonar. Pero la obtención de los valores correspondientes a Rpa y FP/FS no está exenta de dificultad. Ambos son parámetros calculados a partir de otros cuya determinación es a veces difícil, o cuyo valor es asumido, generando así una cierta inexactitud en los cálculos. Por otra parte, la determinación de la SatAo, elemento básico para efectuar dichos cálculos, debe hacerse en condiciones de sedación, de anestesia y de oxigenoterapia estándar y homogéneas, no siempre presentes en todos los pacientes. Estas dificultades tienen un claro ejemplo en niños con múltiples fuentes de FP, o en aquellos en los que el FP proviene exclusivamente de una fístula sistémico-pulmonar; en estas condiciones es obligatorio extraer la muestra sanguínea para la determinación de la saturación lo más lejos posible del afluente sistémico.
Diversos autores demuestran que una SatAo baja o una Rpa elevada (como variable continua o categorizada en > 3 U/m2) en el cateterismo previo al GB son claros factores asociados a mortalidad14,19,23. Otros aprecian que una Rpa elevada influye de forma negativa en la SatO2 post-GB24. Contrariamente a estas observaciones, nuestra experiencia demuestra que valores altos de FP/FS antes del GB aumentan el riesgo de muerte y/o reintervención y, específicamente en el grupo de 48 niños con parámetros hemodinámicos completos, unos valores elevados de SatAo y FP/FS se constituyen en factor determinante, con significación estadística, de mortalidad y de reoperación. Si bien estos datos pueden parecer un contrasentido, ya que el mejor resultado del GB debería asociarse con Rpa baja, FP (y FP/FS) elevado, y SatO2 post-GB alta, esto no ha sido siempre así en nuestra serie, debido a que en la mayoría de los casos en los que se daban estas circunstancias no se eliminó el FPA, aumentando así de forma exagerada el FP (FPE) y apareciendo competencias de flujo indeseables que deterioraron la hemodinamia del enfermo.
En definitiva, aunque las dificultades en la recogida de datos señaladas en el párrafo anterior, y el limitado número de casos en los que disponemos de los parámetros hemodinámicos al completo, provocan que este estudio no proporcione conclusiones definitivas respecto a qué valores de Rpa, FP/FS o SatAo determinan un buen resultado, especialmente en los casos con presión pulmonar elevada, sí podemos ofrecer unos datos orientativos que nos parecen de interés:
De 14 niños con FP/FS >= 2,5, se dejó FPA en 10, falleciendo o siendo reintervenidos cuatro.
De 12 niños con Rpa ¾ 0,5, se dejó FPA en ocho, falleciendo y/o precisando reoperación tres.
De 26 niños con SatO2 post-GB >= 90%, se dejó FPA en 13, falleciendo o siendo reintervenidos cuatro de ellos.
Flujo pulmonar adicional/flujo pulmonar excesivo
En este estudio no hemos logrado definir unos criterios firmes para decidir dejar, crear, o abolir el flujo pulsátil adicional al GB en el momento de la intervención. Este FPA se decide dejar en muchas ocasiones en el mismo quirófano ante una situación de hipoxemia o de hipotensión grave y sostenida. Además, en muchas ocasiones es harto difícil ajustar la «cantidad» de FPA que necesita un determinado caso sin que exista competencia ni signos de hiperaflujo pulmonar tras el GB6,17,24. Varias publicaciones defienden mantener este FPA tras el GB enfatizando sus ventajas:
Mantiene o mejora la oxigenación tisular.
Disminuye la Rpa, quizá por un efecto denominado angiogénesis26.
Evita las fístulas arteriovenosas pulmonares (asegura el aporte de «factor hepático» desde el sistema venoso del hígado a los pulmones)27.
Es más satisfactorio tanto desde el punto de vista clínico, tanto para el cardiólogo como para los padres del enfermo, al observarse una mejoría llamativa e inmediata de la SatO2.
Es más confortable y seguro para el propio cirujano evitar desaturaciones graves durante la intervención5.
Otros autores, por el contrario, abogan por la supresión del FPA argumentando no sólo que su permanencia se asocia con la mortalidad y/o reintervención después del GB, sino también que la PMAP elevada (> 13-15 mmHg) que provoca limita la longevidad del sistema circulatorio una vez completada la univentricularización total13,15,17,20. Además, sostienen que la DCPT tiene más riesgo operatorio y un resultado menos satisfactorio a medio-largo plazo en los niños con FPA respecto de los que sólo tienen el GB. Algunas de las consideraciones a favor de suprimir el FPA tras el GB serían:
Evita el aumento de la presión pulmonar y del flujo competitivo, causas de cianosis, edema en esclavina y derrames pleurales21,26.
Preserva la función ventricular al disminuir la sobrecarga de volumen.
Durante mucho tiempo, nuestro objetivo prioritario ha sido mantener o mejorar la SatO2 de estos enfermos, dejando las fuentes adicionales de flujo pulmonar intactas, con la perspectiva de que fueran haciéndose más pequeñas con la edad. Los resultados del presente trabajo no ponen de manifiesto una diferencia significativa al comparar la evolución en los casos en los que se dejó FPA (78 casos, de los cuales un 15% falleció o precisó reintervención), respecto de los que sólo tuvieron el GB como única fuente de flujo pulmonar (22 casos, con un 13% perteneciente al grupo A). Pero lo que sí hemos observado en nuestros enfermos es que, en muchos de ellos, ese flujo adicional se ha revelado como excesivo (FPE) durante la evolución postoperatoria inmediata o tardía. En nuestra serie, el FPE ha sido un factor determinante de la mortalidad y de la reintervención quirúrgica, siendo causa de fallecimiento o reoperación en 6 niños (tres de los 8 fallecidos y tres de los 8 reintervenidos), y en dos de los 10 que precisaron cateterismo intervencionista durante la evolución. Atendiendo a estos datos, en la última parte de nuestra experiencia hemos tendido a suprimir todas las fuentes de FPA, teniendo presente que para llevar a cabo esta política puede ser preciso:
1. Determinar en el cateterismo previo y en el mismo quirófano la viabilidad de esta supresión mediante oclusiones temporales de las fuentes de flujo pulmonar, con monitorización continua de la SatO2. El valor de esta estrategia está aún por determinar, especialmente cuando el afluente sistémico es el único aporte de sangre al pulmón.
2. Asumir que en las 48-72 h siguientes al GB, la SatO2 se recupera hasta valores sólo levemente inferiores a los observados en los niños con FPE12,18 (es por completo permisible una SatO2 incluso menor a 75% si no existe acidosis metabólica). Una SatO2 elevada en el postoperatorio es un factor de mal pronóstico.
Anomalías asociadas significativas
Es otro de los aspectos importantes en nuestra experiencia, ya que aparece como factor de riesgo de muerte y reintervención. En varias publicaciones21,22,24,27 se destaca que la presencia de estas u otras anomalías constituyen en sí un factor de riesgo importante para realizar una intervención tipo Fontan, por lo que se prefiere disminuir su impacto negativo realizando el GB como paso intermedio. Aun así, en nuestra serie, determinadas lesiones se asocian con el resultado de la intervención:
La insuficiencia mitral. Se suele corregir al tiempo que el GB sólo en grados severos y, en especial, cuando se asocia a defecto del septo atrioventricular o a heterotaxia. Algunos autores describen una disminución en su intensidad tras la disminución de la sobrecarga de volumen ventricular que representa el GB27.
La estenosis subaórtica. Suele estar presente en patologías con FPE y sobrecarga de volumen ventricular. Además, ocasiona aumento de la disfunción diastólica ventricular por hipertrofia miocárdica. Por otra parte, durante su corrección prolonga la cirugía extracorpórea, exige clampaje aórtico para su corrección y provoca en algunos casos la aparición de bloqueo auriculoventricular completo con la necesidad de implantar un marcapasos. Tenemos en nuestro estudio 3 casos de corazón univentricular con vasos en transposición, estenosis subaórtica y cerclaje de la arteria pulmonar, en los que hubo que ampliar el foramen ventrículo-cameral durante el GB. En uno de ellos, con bloqueo auriculoventricular de segundo grado como evolución natural de su ventrículo único, se colocó marcapasos durante el GB. En otro, con ampliación de la región subaórtica, bloqueo auriculoventricular completo y marcapasos antes del GB se recambió el generador durante la intervención. El otro enfermo tuvo una evolución satisfactoria. Existe además otro enfermo con ventrículo único y sin estenosis subaórtica en el que se implantó marcapasos durante el GB por bloqueo auriculoventricular completo.
Otras anomalías. La agenesia de la válvula pulmonar o el drenaje venoso pulmonar anómalo ocasionan importantes alteraciones anatómicas y fisiológicas, tanto cardíacas como pulmonares, ensombreciendo el pronóstico, sobre todo en el momento de la intervención14.
Tiempo de cirugía extracorpórea
En nuestra experiencia, es un factor determinante de mortalidad, debido probablemente a la presencia de anomalías asociadas que precisan corrección intraoperatoria compleja y al efecto pernicioso (generalmente transitorio) de la propia circulación extracorpórea. En efecto, algunos autores han observado mejores resultados (mejor SatO2 inmediata) en los casos operados sin circulación extracorpórea22. Sin embargo, ésta es inevitable en presencia de anomalías asociadas que requieran corrección intracardíaca. Para neutralizar los efectos nocivos28 que la circulación extracorpórea provoca (edema miocárdico y pulmonar, elevación de forma transitoria de la presión diastólica pulmonar y de la Rpa) se ha considerado el uso de la ultrafiltración como técnica intraoperatoria que ayudaría a disminuir la tasa y duración del derrame pleural y el tiempo de estancia hospitalaria29. En nuestro estudio, el número de casos operados sin CEC ha sido escaso y no podemos extraer conclusiones definitivas.
Otros aspectos perioperatorios
El cerclaje de la arteria pulmonar previo al GB
No ha resultado factor de riesgo, pero es más frecuente en los niños pertenecientes al grupo A. Hay que tener presente que esta técnica se realiza en situaciones de hiperaflujo pulmonar y que se asocia o puede provocar estenosis subaórtica30.
La vía de abordaje
No incide en sí misma en el resultado del GB. La esternotomía es la vía más habitual, proporciona mayor seguridad en el manejo de la CEC y hace posible el control de todas las fuentes de flujo pulmonar. La toracotomía derecha tiene la ventaja de no crear adherencias que dificulten futuras intervenciones, y puede estar indicada si no son precisas otras técnicas adicionales o no se contempla la eliminación de fuentes de flujo pulmonar centrales o en el hemitórax izquierdo22.
La técnica con doble Glenn
Se puede efectuar ante la presencia de un doble sistema de vena cava superior. En nuestra serie aparece como factor determinante en la evolución de estos enfermos, probablemente por coincidir con casos con una mayor complejidad anatómica. De hecho, tres de los 4 niños fallecidos o reintervenidos a los que se practicó doble Glenn tenían anomalías asociadas significativas; y, por otra parte, el doble sistema de vena cava superior se suele asociar a heterotaxia, y ésta es un reconocido factor asociado con la mortalidad18,23.
Tiempo de estancia en cuidados intensivos y hospitalización
Son más bien consecuencias, y no factores determinantes de la evolución. Son variables con escaso impacto estadístico, ya que, por ejemplo, cinco de los 8 pacientes que fallecieron lo hicieron en las primeras 24 h del postoperatorio; esto contrasta con aquellos que se reintervienen y que, por tanto, prolongan ambas estancias.
Arritmias
Su aparición durante el postoperatorio no es frecuente y puede tratarse muchas veces de la expresión de una mala hemodinámica previa. En todo caso, contribuye al mal resultado y nuestra experiencia se asocia con mortalidad y con necesidad de reintervención quirúrgica. Pueden ser debidas al daño del nodo sinusal o de su arteria, a las técnicas previas o asociadas al GB, como el Blalock-Hanlon, la resección subaórtica (bloqueo auriculoventricular completo) o a técnicas de Hemi-Fontan12.
Estenosis de ramas de la arteria pulmonar
Como en otros estudios, la aparición de estenosis en las ramas pulmonares tras cirugía paliativa previa al GB ha sido en nuestra experiencia un hecho frecuente, aunque carente de asociación con la mortalidad y la necesidad de reintervención quirúrgica5,30. No obstante, en los casos en que fue precisa su reparación durante el GB hemos observado un mayor tiempo de CEC y una mayor necesidad de clampar la aorta. La presencia de estas estenosis ha sido la causa más frecuente de indicación de cateterismo intervencionista tras el GB. ¿Cómo puede evitarse la aparición de estas lesiones?:
1. GB precoz, evitando cualquier fístula sistémico-pulmonar o, al menos, una segunda paliación y, sobre todo, el Watterston-Cooley, que en nuestra serie genera el mayor número de estenosis.
2. En los casos sin protección pulmonar nativa, la indicación del cerclaje de la arteria pulmonar durante el período neonatal es poco menos que inevitable. Pero sería de desear que el tiempo entre la misma y el GB fuera el menor posible. Esto dependerá de cómo se «controle» la presión pulmonar. En no pocos casos será preciso cerrar totalmente la arteria pulmonar en el momento del GB.
Edad y peso en el momento del GB
Varias publicaciones demuestran que, en niños menores de 6 meses, el GB puede efectuarse con mínima morbimortalidad, aunque con postoperatorios algo más complicados y con SatO2 temporalmente muy bajas8,9,11,12,31. Como variables continuas, la edad y el peso no fueron en nuestra serie factores determinantes de mortalidad y/o reintervención, aunque claramente los pacientes fallecidos y/o reintervenidos tuvieron menor edad y peso en el momento del GB que los que sobrevivieron sin necesidad de ser reoperados. Sólo categorizando estas variables tuvieron significación estadística: la edad ¾ 12 meses y el peso ¾ 10 kg fueron significativamente más frecuentes en el grupo con peor resultado.
Aunque de forma especulativa, y en consonancia con otros autores23,32, somos de la opinión que el GB realizado en edades tempranas tiene varias ventajas, y también algunos inconvenientes. Entre las primeras:
1. En las cardiopatías con isquemia pulmonar evita la cirugía paliativa, disminuyendo así el impacto negativo que la misma tiene sobre la evolución (hipertensión pulmonar, estenosis de ramas pulmonares) del GB.
2. En los niños más pequeños, la sangre de la vena cava superior puede ser una excelente fuente de flujo pulmonar y de aumento de SatO2; esto se debe a que en esta etapa de la vida la vena cava superior transporta una mayor cantidad de sangre que la inferior.
3. Disminuye de manera precoz la sobrecarga de volumen ventricular.
4. Reduce el número de operaciones, apareciendo más aceptable la estrategia quirúrgica, tanto para la familia como para el propio paciente.
5. Permite corregir lesiones asociadas importantes antes de la DCPT.
Como desventajas, se podrían destacar las siguientes:
1. Saturaciones más bajas en el postoperatorio inmediato.
2. Aunque existen varias opiniones al respecto33, parece existir un escaso crecimiento de las arterias pulmonares después del GB a partir de los 2 años de implantada la anastomosis. Tras la intervención, el FP/FS sin FPA oscila alrededor de 0,5, tal vez insuficiente para un correcto crecimiento de las ramas pulmonares.
3. Mayor riesgo de mal resultado, hecho objetivado en nuestra estadística y que puede estar también influido por una mayor asociación de anomalías significativas o por el mayor tono muscular vascular pulmonar transitorio y fisiológico que aparece en esta edad.
En resumen, nuestro grupo, en la fase final de la serie que presentamos, y de forma progresiva, tiende actualmente a realizar el GB de forma precoz, a ser posible sin cirugía extracorpórea, evitando así en lo posible la fístula sistémico-pulmonar previa y sus efectos nocivos secundarios sobre el árbol vascular pulmonar.
Hallazgos angiohemodinámicos después del GB
Serán el objetivo de un próximo trabajo. Hay que señalar, de todos modos, que no hemos encontrado en nuestra serie ningún caso con fístulas arteriovenosas. Estos hallazgos podrían estar en relación con la gran cantidad de enfermos con flujo pulmonar pulsátil adicional34. En 2 casos se comprobó una circulación fina pulmonar, sin que se llegara a visualizar una imagen reticular sugerente y ni mucho menos una vena pulmonar. Sin embargo, sí hemos constatado una gran variedad de circulación colateral venosa, de escape, desde vena cava superior, en ocasiones incluso sin alteración hemodinámica acompañante, que como se ha comentado antes, fue motivo de indicación de un cateterismo intervencionista terapéutico.
CONCLUSIONES
1. La presión arterial pulmonar media y sistólica, son factores esenciales y determinantes de la mortalidad y/o reintervención en el resultado del Glenn bidireccional.
2. El flujo pulmonar adicional ha sido con frecuencia excesivo, y como tal, factor de riesgo importante de mortalidad y de reoperación.
3. Son también factores de riesgo la complejidad anatómica representada por la presencia de anomalías asociadas significativas, la intervención con doble Glenn y la aparición de arritmias en el postoperatorio.
4. Las estenosis en las ramas de la arteria pulmonar como consecuencia de la cirugía previa al Glenn bidireccional no son factores de riesgo en sí mismas, pero prolongan significativamente el tiempo de cirugía extracorpórea, y exigen con mayor frecuencia clampaje aórtico durante la operación.
5. La edad y el peso en el momento del Glenn bidireccional sólo tienen impacto estadístico si son menores de un año y 10 kg, respectivamente.
Correspondencia: Dr. L. Fernández Pineda. Servicio de Cardiología Pediátrica. Hospital Ramón y Cajal. Ctra. de Colmenar, km. 9,100. 28034 Madrid. Correo electrónico: lfernandezp@hrc.insalud.es Recibido el 13 de septiembre de 2000. Aceptado para su publicación el 15 de marzo de 2001.