Palabras clave
INTRODUCCIÓN
El infarto agudo de miocardio (IAM) es un síndrome caracterizado por la disrupción aguda del flujo coronario. Éste se debe a la combinación de la rotura de una placa aterosclerótica presente en el endotelio, secundaria a diferentes causas, y a la formación de trombo que ocluye el vaso. Hay otros factores interrrelacionados, como la trombólisis espontánea, la vasoconstricción, la presencia de circulación colateral, etc., que también desempeñan un importante papel en el desarrollo de este síndrome. La extensión de la necrosis miocárdica que finalmente se producirá dependerá tanto de los mecanismos endógenos como, sobre todo, del tratamiento instaurado1. En esta puesta al día revisaremos los conceptos actuales sobre revascularización percutánea del IAM.
ACTP PRIMARIA. ACTP FACILITADA (CON O SIN TRASLADO A OTRO CENTRO)
Comparación con trombólisis
La angioplastia coronaria transluminal percutánea (ACTP) se introdujo como una estrategia de reperfusión a mediados de la década de los ochenta. La ACTP primaria (en el contexto de un IAM) fue descrita por Meyer et al2 y Hartzler et al3 en 1982-1983. Ésta demostró ser superior a la terapia trombolítica en cuanto a restauración temprana y completa del flujo coronario4, con una baja incidencia de isquemia recurrente, reinfarto, accidente cerebrovascular (ACV) y muerte5-7. En el estudio STAT8 se comparó la ACTP primaria con la trombólisis (TBL). En el primer grupo se redujo el parámetro de valoración primario (muerte, reinfarto o ACV) de forma significativa (p < 0,001). En un estudio realizado en nuestro centro en la década de los noventa en el que se comparaba la ACTP primaria con la trombólisis con t-PA acelerada en pacientes con IAM anterior se observaron beneficios significativos en la mortalidad, la isquemia residual, la disminución de la rotura cardíaca y el ACV9. Este beneficio se mantenía a los 4 años en pacientes > 65 años. Weaver et al10 analizaron los resultados de los primeros 10 estudios aleatorizados en los que se comparaba la angioplastia primaria con la trombólisis en un metaanálisis que demostró menores tasas de mortalidad, reinfarto y ACV en los pacientes tratados con ACTP primaria10. Zijlstra11 hizo una revisión de 6.478 pacientes aleatorizados para recibir ACTP primaria frente a TBL. En el primer grupo, la mortalidad fue del 5,5% y en el segundo del 7,8% (p < 0,001). Keeley et al12 presentaron una revisión de todos los estudios en los que se comparaba la ACTP con la trombólisis en el IAM, con un total de 7.739 pacientes. Los pacientes tratados con ACTP tuvieron menor mortalidad (p = 0,0002), reinfarto no fatal (p < 0,0001) y menor número de eventos adversos. Estos resultados eran mejores a corto plazo y en el seguimiento, e independientes del trombolítico utilizado. En el grupo TBL, el sangrado fue significativamente mayor que en los pacientes tratados con ACTP (p < 0,0001). El grupo NHMRC presentó los resultados de diferentes estudios sobre el seguimiento durante 6 meses de pacientes en los que se comparaba la ACTP primaria con la trombólisis13. La mortalidad a los 30 días para el grupo ACTP fue del 4,3% y para el grupo TBL del 6,9% (p = 0,004). A los 6 meses, la diferencia continuaba siendo significativa (p = 0,04).
Relación de retraso y efectividad del tratamiento
El tratamiento de reperfusión debe ser lo más temprano posible: «time is muscle» (el tiempo es músculo). El dilema que surge entre el retraso en la instauración del tratamiento y la efectividad de éste influirá en la elección de la mejor estrategia terapéutica en cada caso.
Zijlstra et al14 evaluaron la evolución de los pacientes de acuerdo con el tiempo hasta la institución del tratamiento. Estudiaron a 2.635 pacientes incluidos en 10 estudios aleatorizados para recibir ACTP primaria frente a trombólisis. El tiempo medio desde la aleatorización hasta el tratamiento fue de 69 min para la ACTP y 22 min para TBL. Dividieron a los pacientes en 3 grupos según fueran aleatorizados < 2 h desde el comienzo del dolor, entre 2 y 4 h y > 4 h. Los pacientes tratados con ACTP tuvieron una menor incidencia de eventos adversos mayores, independientemente del tiempo trascurrido desde el comienzo del dolor hasta el momento de la aleatorización. Al aumentar el tiempo trascurrido se incrementaba el número de eventos en el grupo de trombólisis, pero no en el de ACTP. En el estudio PAMI 215, la mortalidad fue menor en los pacientes tratados antes de las 2 h, pero fue independiente del tiempo transcurrido después de éstas. Aunque también podemos hablar de la «hora de oro» en la ACTP16, pues se preservaría mejor la función ventricular17, la influencia del retraso es mayor en la TBL: la eficacia del tratamiento trombolítico es menor y el beneficio relativo de la ACTP es aún mayor pasada la primera hora. Brodie et al17 evaluaron la importancia del tiempo de reperfusión en la supervivencia a los 30 días y en la fracción de eyección del ventrículo izquierdo (FEVI). Los 1.352 pacientes analizados fueron divididos en 2 grupos según el comienzo del dolor: mayor o menor de 2 h antes del tratamiento. En el primer grupo, la mortalidad precoz fue menor (p = 0,04). En los pacientes tratados > 2 h, la mortalidad a los 30 días y la tardía fueron independientes del tiempo de retraso. Brodie et al analizaron el tiempo de reperfusión de pacientes incluidos en el estudio Stent PAMI18. Dividieron a los pacientes según el tiempo de aleatorización: < 2 h del comienzo del dolor, entre 2 y 4 h, entre 4 y 6 h y > 6 h. Los pacientes del primer grupo tenían tendencia a presentar mayor número de infartos anteriores. No hubo diferencias en la mortalidad a 1 y 6 meses, en la nueva revascularización del vaso tratado (TLR) por isquemia o en ACV discapacitante. A los 6 meses hubo mayor número de reinfartos en el grupo de presentación tardía. Se obtuvo en igual proporción un flujo TIMI 3 en todos los grupos. Sin embargo, la FEVI fue mayor en los tratados antes de 2 h. La reoclusión fue mayor en el grupo revascularizado tardíamente, sin que en ello influyera el uso de stent. Se ha comprobado que con la ACTP primaria se consigue una mayor proporción de flujo TIMI 3, se reduce la mortalidad debida a complicaciones mecánicas y disminuyen las complicaciones hemorrágicas. El mayor beneficio obtenido con la ACTP primaria en comparación con la trombólisis se deriva en parte de la mayor influencia del retraso en la trombólisis.
Evaluación de riesgo en la ACTP
Addala et al19 presentaron un índice de riesgo de mortalidad en pacientes con IAM tratados con ACTP. La mortalidad total fue del 3,1%. En el estudio se mostró un score con una fuerte asociación con la mortalidad hospitalaria, al mes y a los 6 meses. Ésta se incrementaba 33 veces si el score era ≥ 9 (p < 0,0001). La edad > 75 años fue el predictor de mayor peso en este score, con una puntuación de 7. Lo más importante de este estudio es que define a un grupo de pacientes en los que el tratamiento debe ser más agresivo. Como se ha mencionado, la ACTP primaria con balón fue segura y más eficaz que la trombólisis. Sin embargo, en el seguimiento angiográfico se observó reoclusión del vaso tratado en un 10-15% y reestenosis en un 35-40% de los casos20. La presencia de disección residual o de estenosis > 30% fueron los predictores más importantes de isquemia recurrente y de reoclusión del vaso tratado21.
¿Angioplastia con balón o stent coronario?
Las limitaciones de la ACTP con balón en la angioplastia primaria llevaron a que algunos investigadores introdujeran el stent en el arsenal terapéutico del IAM. En un principio se consideró que el infarto era una contraindicación para la implantación de stent debido al riesgo teórico de oclusión al implantarlo en estas lesiones de elevado contenido trombótico22. Sin embargo, la obtención con el stent de un mayor diámetro luminal y la resolución de la disección residual (factores predisponentes para isquemia y reoclusión arterial)23 podría facilitar la resolución del trombo residual por los mecanismos endógenos de la fibrinólisis. Numerosos estudios y registros publicados demostraron la seguridad y eficacia del stent durante la ACTP primaria.
Stone et al24 presentaron los resultados del estudio PAMI Stent Pilot, en el que se evalúa la seguridad del stent en el IAM. Los pacientes tuvieron una baja incidencia de muerte hospitalaria (0,8%), reinfarto (1,7%) e isquemia recurrente (3,8%). En una publicación posterior se presentó el seguimiento a los 7 meses del estudio25 con datos de 236 pacientes. La mortalidad fue de 1,7%, el reinfarto de 2,1% y la TLR de 11,1%. La reestenosis angiográfica fue de 27,5%. El número de stents y el diámetro de referencia del vaso fueron determinantes de TLR. Grines et al26 publicaron un trabajo en el que comparaban ACTP con y sin stent. Incluyeron a un total de 900 pacientes. Consiguieron un mayor diámetro luminal mínimo (DLM) en el grupo tratado con stent (p < 0,001). A los 6 meses, los pacientes del grupo stent tuvieron menor incidencia de angina (p = 0,02) reestenosis y TLR (p < 0,001) guiada por isquemia. También fue significativamente menor el objetivo combinado de muerte, reinfarto, ictus y TLR. Sin embargo, en el grupo tratado con stent se observó una tendencia hacia una mayor mortalidad a los 12 meses, aunque no llegó a ser significativa. Esto coincidió con un menor grado de TIMI 3 en el grupo stent, lo que es probable que fuera debido a la embolización distal del trombo previamente fragmentado por la predilatación con balón. En otro estudio, el STENTIM 1, se demostró la seguridad del stent en el IAM27.
En el estudio PASTA28 se demostró que la ACTP primaria con stent en pacientes seleccionados conseguía una baja incidencia de eventos cardíacos mayores durante los primeros 12 meses y menor tasa de reestenosis en comparación con el balón.
Otros estudios adicionales contribuyeron a demostrar la seguridad y eficacia del stent en el tratamiento del IAM, como el realizado en nuestro centro29, el estudio STENTIM 230 y el FRESCO31. El CADILLAC32 da un paso adelante y añade el inhibidor de la glucoproteína IIb/IIIa, para comparar ACTP con stent (Multilink) frente a balón, en pacientes que reciben o no abciximab. Se incluyó a 2.082 pacientes divididos en: ACTP primaria (n = 515), ACTP primaria con abciximab (n = 529), stent (n = 513) y stent con abciximab (n = 525). El objetivo primario fue el combinado de muerte, reinfarto, ictus o revascularización guiada por isquemia a los 6 meses. No hubo diferencias significativas en el objetivo primario entre los 2 grupos de angioplastia primaria. Tampoco hubo diferencias entre los 2 grupos de stent. En cambio, se observaron diferencias significativas en el objetivo combinado a los 6 meses entre ACTP primaria y el grupo stent a expensas de una menor revascularización del vaso tratado con stent, sin diferencias en mortalidad o el ACV. La aparente ausencia de beneficio relativo del abciximab asociado al stent a los 6 meses es sin duda debida al gran peso relativo del stent en la reducción de la reestenosis, el componente más poderoso del objetivo combinado. En el análisis de los resultados a los 30 días se demostró el beneficio del abciximab33.
En el registro ULTIMA34 se analizaron los resultados de un subgrupo de 40 pacientes con IAM por afección del tronco de la coronaria izquierda tratados con stent. Actualmente se acepta que en la revascularización percutánea del vaso causante del IAM, se utilice el stent como patrón de referencia. Sin embargo, se produce una disminución del flujo TIMI 3 y una incidencia de embolización distal en el 15% de los pacientes. Se ha considerado que una forma de disminuir la embolización distal podría ser la colocación de un stent directo (figs. 1 y 2) sin predilatación con balón. Loubeyre et al35 presentaron un trabajo en el que compararon el stent directo con la predilatación en 206 pacientes con IAM. Los del primer grupo tuvieron una menor incidencia de flujo lento-no reflujo (p = 0,01) con mejor resolución del segmento ST (p = 0,01), sin diferencias en la mortalidad o la estancia hospitalaria. Otros autores también han constatado buenos resultados con el stent directo36,37. La ausencia de predilatación disminuye la fragmentación de la placa y la embolización distal, lo que preserva la microcirculación con la consiguiente disminución del fenómeno de no reflujo y la mejor reperfusión miocárdica. Actualmente se cree que en lesiones con imagen angiográfica de gran contenido trombótico, en pacientes jóvenes, ante la sospecha de lesiones blandas y en los casos en que no se utilicen dispositivos de aspiración de trombo es aconsejable realizar una ACTP primaria con la colocación de un stent directo. En caso de que haya lesiones calcificadas o cuando se sospeche que no se lograría una adecuada expansión del stent, es preferible realizar predilatación.
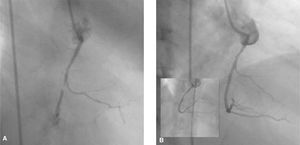
Fig. 1. A) Se observa la imagen de la arteria coronaria derecha con estenosis suboclusiva en su tercio medio. B) Resultado final después de implantar un stent directo.
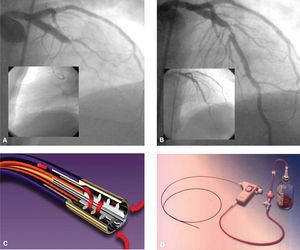
Fig. 2. A) Oclusión completa de la arteria descendente anterior en su tercio medio. En el recuadro pequeño se observa el paso del X-Sizer a través de la oclusión. B) Resultado posterior a la trombectomía. En el recuadro pequeño se aprecia el resultado final después de implantar el stent. C y D) Catéter y dispositivo del sistema X-Sizer.
Resultado de la reperfusión mecánica en contextos clínicos específicos
En los pacientes diabéticos con IAM, los resultados son peores que en los no diabéticos. Stuckey et al38, en un subanálisis del estudio CADILLAC, demostraron que el uso de abciximab no mejora los resultados de estos pacientes. Sin embargo, hubo diferencias significativas en el grupo tratado con stent en comparación con el tratado con balón. Harjai et al39 demostraron que los pacientes diabéticos tuvieron mayor proporción de enfermedad de múltiples vasos, pero tenían mejor flujo TIMI 3 en el momento del ingreso. La mortalidad hospitalaria fue de 4,6%, frente a 2,6% en pacientes no diabéticos (p = 0,005). Durante el seguimiento, la diferencia en la mortalidad frente a los no diabéticos era significativa (p < 0,0001). La mayor mortalidad en los diabéticos se debe a que tienen infartos más grandes, con mayor afección de la FEVI e incidencia de insuficiencia renal.
Hay un gran debate acerca del alcance de la revascularización percutánea en pacientes con lesiones de múltiples vasos en el contexto del IAM. Pellizzon et al40 compararon 2 grupos de pacientes: con revascularización sólo de la arteria causante del infarto o conjuntamente con otros vasos. No hubo diferencias en cuanto a las tasas de reinfarto y revascularización al cabo de 1 año. Sin embargo, se produjo una mayor mortalidad en el grupo con revascularización de otros vasos (p = 0,029), con una tendencia no significativa hacia un aumento de la mortalidad cardíaca. En las guías de la AHA/ACC41 no se recomienda la realización de ACT P a otras arterias en caso de lesiones de múltiples vasos en el IAM. Sin embargo, con las mejoras actuales en los materiales, en pacientes en los que debe asegurarse un adecuado flujo colateral o en los que las lesiones de otros vasos hacen prever que no se incrementará la dificultad del procedimiento, algunos autores realizan la revascularización de otros vasos en el mismo procedimiento, con lo que disminuyen la morbilidad, la estancia hospitalaria y el coste.
Creca del 3-5% de los injertos venosos aortocoronarios falla cada año trascurrido desde la intervención, y el 3% de los pacientes con cirugía previa desarrolla infarto42. Stone et al43 realizaron un análisis de 58 pacientes del estudio PAMI 2 con IAM y cirugía de revascularización miocárdica previa. En el 55% de los casos, la arteria causante del infarto era un injerto aortocoronario. En comparación con la revascularización de las arterias nativas, los injertos tuvieron menor proporción de flujo TIMI 3, con mayor presencia de trombo. Los pacientes con cirugía previa tuvieron mayor mortalidad hospitalaria con respecto a los no operados, especialmente si el vaso tratado era un injerto44. La anatomía del injerto y la gran cantidad de material trombótico son 2 factores que afectan al resultado del procedimiento en estos pacientes.
¿Están indicados los stents farmacoactivos?
Con la aparición de los stents farmacoactivos (DES) se ha logrado disminuir la incidencia de reestenosis45-47. Su aplicación en el IAM todavía está en estudio, ya que se teme que puedan aumentar la incidencia de trombosis aguda/subaguda del stent. Saia et al48 presentaron una serie consecutiva de pacientes en la que demostraba su seguridad con una incidencia de reestenosis angiográfica del 0%. Lemos et al49 presentaron un trabajo sobre los beneficios a corto y largo plazo de los DES en 369 pacientes, y los compararon con stents convencionales. Los pacientes del segundo grupo recibieron en mayor proporción inhibidores de la glucoproteína IIb/IIIa. No hubo diferencias entre grupos en la apertura del vaso, el tamaño del infarto (marcadores enzimáticos) y los eventos a corto plazo. Tampoco hubo diferencias en la trombosis del stent. En la evolución (10 meses), los pacientes que recibieron DES tuvieron una menor incidencia de eventos combinados (p = 0,02), debida fundamentalmente a una reducción en el riesgo de reintervención (p = 0,01). En el análisis multivariable, el DES fue el único predictor independiente de disminución del evento combinado (p = 0,03). Estos resultados todavía deben ser confirmados en estudios aleatorizados.
Flujo epicárdico y reperfusión miocárdica
Tradicionalmente, el buen resultado de la angioplastia primaria se ha asociado con la obtención de un flujo epicárdico normal (TIMI 3) en la arteria causante del infarto de forma precoz y sostenida50,51. Con posterioridad se ha observado que no sólo bastaba con la apertura del vaso epicárdico, sino que, además de obtener un flujo TIMI 3, debía lograrse una adecuada perfusión miocárdica. Aparecieron trabajos en los que se evaluaban la perfusión miocárdica52, con ecografía de contraste53, la gammagrafía54 y la resonancia magnética55, y se demostró que, a pesar de conseguir flujo TIMI 3, no siempre se lograba una adecuada reperfusión tisular. Dibra et al56 presentan el análisis de la perfusión miocárdica (TMP), en que comparan a los pacientes con TMP 2/3 frente a 0/1. Los del primer grupo tuvieron infartos más pequeños (p = 0,001), con una tendencia hacia una menor mortalidad al año. Los pacientes tratados con stent tuvieron una mayor proporción de TMP 2/3 que los tratados con trombólisis (p = 0,001).
Van't Hof et al57 introducen el término de myocardial blush (MB), un método angiográfico para describir la efectividad de la perfusión miocárdica que la validan comparándola con la resolución del segmento ST en el electrocradiograma (ECG). En su trabajo encontraron una relación inversa entre el MB y el tiempo de isquemia, el tamaño del infarto y la FEVI. El MB se asociaba con aumento de mortalidad según disminuía el grado de perfusión.
Stone et al58 evaluaron la importancia de la perfusión miocárdica. En 173 pacientes con IAM, obtuvieron flujo TIMI 3 en 94,2%. Sin embargo, de éstos, el MB fue normal en el 29,4% y en ningún caso de pacientes con flujo < TIMI 2. En los pacientes con flujo TIMI 3, la mortalidad fue del 6,8% en pacientes con blush normal, del 13,2% en los que tenían grado 2 y del 18,3% en pacientes con grados 0-1 (p = 0,004). Se obtuvo un score miocárdico de grado 3 en el 15% de los infartos en los que la arteria relacionada era la descendente anterior, en el 25,8% la circunfleja y en 45,2% la coronaria derecha (p = 0,0003).
Otro elemento de gran valor para evaluar reperfusión es la resolución de la elevación del segmento ST en el ECG posterior al cateterismo. La persistencia de un segmento ST elevado después de la recanalización refleja la presencia de una lesión transmural sostenida y se correlaciona con alteración de la reperfusion y afección de la microcirculación, con mayor extensión del daño miocárdico57. Claeys et al estudiaron el valor pronóstico de la resolución del segmento ST poscateterismo en 91 pacientes con IAM59. En el 36% de los casos, el segmento ST persistía elevado después de la revascularización percutánea. Estos pacientes desarrollaron infartos más extensos y tuvieron peor pronóstico: mayor mortalidad cardíaca (p = 0,01) y otros eventos adversos (p < 0,005). Se podría considerar que los pacientes de más edad tendrían una mayor afección del endotelio y, por tanto, un mayor daño de isquemia/reperfusión en la microcirculación. La lesión de isquemia/reperfusión provoca la liberación de factores vasodilatadores e hipotensión arterial60. El desarrollo de lesión de reperfusión se relaciona con un aumento del daño microvascular y las arritmias e incluso con muerte súbita y perpetuación del estado trombótico. En la microvasculatura habría una mayor exposición a factores procoagulantes, inhibición del sistema fibrinolítico y agregación plaquetaria, en parte debida a la reducción del óxido nítrico, todo lo cual provocaría oclusión microvascular61,62. Esta afección del flujo produce el fenómeno de no reflujo, o flujo lento, descrito por primera vez en humanos por Ito et al63.
Matetzky et al64 evaluaron la persistencia del segmento ST elevado en 117 pacientes. En el 24% no se resolvió el segmento ST y en ellos la FEVI fue peor en el alta (p < 0,01). También tuvieron mayor mortalidad e insuficiencia cardíaca a largo plazo (p = 0,004). Los pacientes con no reflujo tienen un mayor riesgo de infarto y muerte. Los mecanismos causantes serían: vasoconstricción arterial, pérdida de la autorregulación capilar, embolización distal, afección microvascular, edema tisular, aumento de los mediadores inflamatorios, alteración endotelial o aumento de los receptores de vasoconstrictores, como Ag-II. El no reflujo afecta al 10-20% de los pacientes tratados por un IAM65. En relación con su tratamiento, se han empleado diversos fármacos, como verapamilo, adenosina y últimamente con los mejores resultados, nitroprusiato sódico.
MANEJO DEL TROMBO
Trombectomía y dispositivos de protección distal
El trombo asociado a la lesión es un hallazgo angiográfico común y que conlleva dificultades para conseguir una adecuada perfusión miocárdica. La formación del trombo sobre la placa rota y la posterior oclusión de la arteria es la forma de inicio de la mayoría de los infartos de miocardio. A pesar de los importantes avances en el desarrollo de agentes antiplaquetarios y antitrombóticos, la persistencia de remanentes de trombo en las lesiones está fuertemente asociada con un alto riesgo de embolización distal y el fenómeno de no refujo, lo que conlleva resultados angiográficos y clínicos peores. Los abordajes mecánicos que se han desarrollado incluyen catéteres de aspiración del trombo, reolíticos, lisis por ultrasonido, dispositivos de protección distal y trombectomía mecánica66.
X-Sizer
El dispositivo de trombectomía helicoidal X-Sizer (EV3, Mineapolis, Minnesota) (figs. 2 C y D) ha sido eficaz en el tratamiento de los síndromes coronarios agudos (SCA) con y sin elevación del segmento ST, en las trombosis de stent coronario y en los injertos de vena safena. Moreno et al67 describen su experiencia inicial en 4 pacientes con IAM a los que se realizó una extracción intracoronaria de trombo. En la experiencia más extensa de varios centros españoles e italianos se obtuvieron la misma seguridad y eficacia en un grupo amplio de pacientes con IAM. Brueck et al68 comunicaron un caso con estenosis de injerto aortocoronario al cual se le realizó trombectomía de rescate después de la implantación de 2 stents por oclusión de la arteria nativa, con éxito y sin complicaciones; este hecho sugiere que el sistema X-Sizer es capaz de recuperar los restos trombóticos después de la macroembolización del injerto de vena safena, incluida la arteria coronaria nativa. Kwok et al69 evaluaron los primeros resultados angiográficos en humanos que experimentaron trombectomía intracoronaria con el sistema X-Sizer, en 14 pacientes. El diámetro medio de estenosis se redujo del 89,3% a una estenosis residual final del 14,4%. No se produjo ningún episodio de perforación, espasmo coronario distal, cierre abrupto o flujo lento/no reflujo. En el estudio X-TRACT70 se comparó a pacientes con SCA cuya lesión causante estaba localizada en arterias nativas o injertos aortocoronarios. No se observaron diferencias en el objetivo primario (infarto periprocedimiento), pero los pacientes en los que se utilizó X-Sizer tuvieron una menor incidencia de infartos grandes periprocedimiento, especialmente aquellos en los que la lesión tratada estaba localizada en las arterias nativas.
Beran et al71 compararon prospectivamente el ICP convencional y con el uso previo del X-Sizer en 65 pacientes con características clínicas similares, de los que 49 tenían IAM. Se concluyó que en los SCA con sospecha de trombo, el tratamiento previo con el X-Sizer mejora el flujo epicárdico y acelera la resolución del segmento ST en comparación con el ICP convencional.
Napodano et al72 evaluaron los efectos de la trombectomía mecánica con el X-Sizer en la reperfusión del miocardio durante la angioplastia primaria en 92 pacientes con evidencia angiográfica de trombo intraluminal, quienes fueron aleatorizados para trombectomía intracoronaria seguida de stent o una estrategia convencional de stent. La reperfusión del miocardio fue valorada por el MB y la resolución del segmento ST. El flujo TIMI 3 posprocedimiento fue similar en ambos grupos. Se observó un MB 3 en 71,7% de los pacientes del grupo de trombectomía y en el 36,9% de los del grupo de estrategia convencional (p = 0,006). La resolución del segmento ST > 50% ocurrió con más frecuencia en pacientes con trombectomía.
En el estudio XAMINE se comparan los resultados de 200 pacientes aleatorizados en 14 centros europeos para recibir tratamiento con X-Sizer o terapia convencional de la arteria causante del infarto, con evidencia clara de trombo y flujo TIMI 0-1 en la coronariogra-fía inicial. El objetivo primario fue la magnitud de la resolución del segmento ST posprocedimiento, y fue significativamente mejor en el grupo tratado con X-Sizer. La trombectomía también fue más eficaz para reducir la incidencia de embolización distal y de flujo lento/no reflujo73.
AngioJet
El AngioJet (POSSIS Medical, Inc., Minneapolis, Minnesota) (fig. 3) ha sido empleado en algunas series de pacientes con IAM. En un estudio con 115 pacientes con IAM tratados con el dispositivo AngioJet se obtuvo una tasa de éxito del 92%; sin embargo, se produjo embolización distal en el 12%, no reflujo sostenido en el 5% y perforación coronaria en el 3%74.
Fig. 3. Consola y catéteres de la trombectomía reolítica (AngioJet).
Nakagawa et al75 estudiaron la eficacia y seguridad del AngioJet en 31 pacientes con IAM y seguimiento angiográfico a los 3 y 6 meses. El procedimiento se realizó con éxito en 29 pacientes (94%). No hubo eventos mayores intrahospitalarios ni durante el seguimiento.
Recientemente se han presentado los resultados de un estudio aleatorizado multicéntrico realizado en Estados Unidos en el que se comparaba la trombectomía reolítica con AngioJet con el intervencionismo coronario convencional en pacientes con IAM y elevación del segmento ST. El AngioJet fue incapaz de reducir el tamaño del infarto respecto al intervencionismo convencional y de mejorar la resolución del segmento ST. La utilización de trombectomía reolítica con AngioJet aumentó la incidencia de complicaciones, incluida la mortalidad, en comparación con la terapia intervencionista convencional. En resumen, el AngioJet fue menos seguro y eficaz que el intervencionismo convencional76.
Dispositivos de protección distal
PercuSurge
En varios ensayos multicéntricos, el uso del PercuSurge ha sido efectivo para la reducción de la incidencia de embolización distal en el tratamiento de injertos safenos aortocoronarios77,78 (fig. 4).
Fig. 4. PercuSurge. Protección distal utilizada en el estudio EMERALD.
Belli et al79 evaluaron el uso del PercuSurge asociado con inhibidores de la glucoproteína IIb/IIIa en 8 pacientes con IAM y obtuvieron un éxito en el procedimiento del 88%, sin complicaciones periprocedimiento. Wu et al80 evaluaron los resultados angiográficos a 6 meses y la perfusión del sitio distal a la obstrucción del balón en pacientes con IAM. Se trató a 74 pacientes con dispositivo PercuSurge. Se concluyó que el PercuSurge durante la ICP en el contexto del IAM conlleva una tasa alta inmediata de flujo TIMI 3 en los vasos epicárdicos y la conservación de la integridad de la microcirculación.
En el estudio EMERALD, Stone et al81 incluyeron a 501 pacientes con IAM en los que se ralizó una angioplastia primaria o de rescate con y sin el dispositivo de protección distal PercuSurge. En este estudio aleatorizado y multicéntrico, el PercuSurge no fue más eficaz que el intervencionismo convencional para la resolución del segmento ST y el flujo microvascular; tampoco fue más seguro y no fue capaz de reducir la mortalidad y los eventos totales
Filter Wire
Otro de los dispositivos de protección distal es el Filter Wire (FW) (figs. 5 y 6). Algunos pequeños estudios observacionales muestran su eficacia en la angioplastia de injertos de vena safena77,82,83. Stone et al84 realizaron un estudio aleatorizado en 651 pacientes con 682 lesiones de injertos de vena safena tratadas con angioplastia y FW o Guard Wire. Los resultados en cuanto a éxito de los procedimientos, flujo epicárdico periprocedimiento, complicaciones angiográficas y eventos mayores inmediatos o a 30 días fueron similares. Limbruno et al85 evaluaron la seguridad y eficacia del FW como terapia adjunta a la angioplastia primaria en 53 pacientes con IAM, y la compararon con un grupo control tratado con angioplastia primaria convencional. El FW se asoció con un alto grado de MB 3 y una resolución temprana del segmento ST. Se precisaría un estudio aleatorizado amplio en el que se compararan los resultados de la angioplastia primaria con y sin protección distal con el FW para determinar el verdadero papel de este dispositivo.
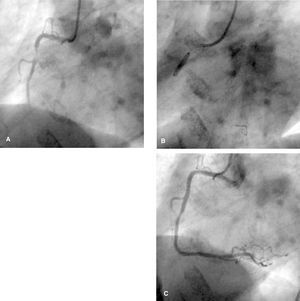
Fig. 5. A) Placa con gran contenido trombótico en la arteria coronaria derecha. B) Implantación de un stent mediante un dispositivo de protección distal Filter Wire. C) Resultado final, sin imagen de embolización distal.
Fig. 6. Filter Wire. Filtro de protección distal.
TÉCNICAS ESPECIALES
Hipotermia circulatoria
La hipótesis de la posible reducción del tamaño del infarto producido por la hipotermia circulatoria ha sido comprobada por Dixon et al86 en el estudio COOL-MI, en el que comparaban a pacientes con angioplastia primaria convencional con otros a los que, además de la angioplastia primaria, se les producía una hipotermia circulatoria. Los eventos adversos fueron similares en los 2 grupos. El estudio tampoco sirvió para hallar diferencias en el objetivo primario del estudio (tamaño del infarto), aunque en el subgrupo de infarto anterior, el tamaño del infarto fue menor en los pacientes en los que se logró llegar al grado de hipotermia profunda. Un problema encontrado es la difícil tolerancia de los pacientes. El futuro papel de esta técnica está por determinar, pero será preciso encontrar una forma que la haga más cómoda y buscar los subgrupos de pacientes en los que la hipotermia pueda marcar diferencias clínicas significativas: grandes infartos, presentación tardía, disfunción ventricular previa, etc.
Hiperoxigenación
Otra técnica empleada87 en pacientes con IAM para tratar de disminuir el tamaño del infarto consiste en la administración de sangre hiperoxigenada (PO2 = 600) en la arteria causante del infarto inmediatamente proximal a la obstrucción, después de realizada la angioplastia y de forma continua durante 90 min. Los resultados esperanzadores de un pequeño estudio observacional no fueron refrendados por un estudio aleatorizado en el que la hiperoxigenación no fue capaz de disminuir el tamaño del infarto ni la incidencia de eventos adversos, aunque la hiperoxigenación produjo una disminución del tamaño del infarto en los pacientes con < 6 h de evolución de los síntomas.
PREVENCIÓN DE DAÑO POR REPERFUSIÓN
Una de las preocupaciones que todavía suscita la repercusión mecánica es la prevención del daño por reperfusión. Se han propuesto diferentes teorías para explicarlo y, a su vez, se ha considerado que se podían utilizar diversas estrategias terapéuticas para prevenirlo. Entre las estrategias terapéuticas propuestas estarían la administración de fluosol, magnesio, trimetazidina, cylexina, adenosina, anti-CD18, eniporida, etc. Uno de los últimos fármacos propuestos como eficaces para prevenir el daño por repercusión es el pexelizumab que, a través de la inhibición del complemento C5, reduciría el daño miocárdico. Granger et al88 probaron la seguridad y eficacia del pexelizumab en el estudio COMMA, en el que de forma aleatorizada se probó su efecto en 814 pacientes. Si bien no hubo diferencias significativas en el objetivo primario, que era el tamaño del infarto, sí las hubo en la tasa de mortalidad a los 6 meses a favor de los pacientes tratados con pexelizumab. Este efecto será probado en un grupo más amplio de pacientes (> 3.500) en el estudio APEX-AMI, que ya ha comenzado el período de inclusión.
CENTROS DE ANGIOPLASTIA PRIMARIA
En muchos países, debido a descentralización y agilización de los sistemas de salud, hay una carencia de centros con experiencia en la realización de ACTP primaria e incluso hospitales sin servicio de hemodinámica o cirugía que pudieran solucionar las complicaciones de la revascularización percutánea. Por esto, algunos autores y guías preconizan la utilización de terapia trombolítica en los pacientes que lleguen a estos centros, con la revascularización percutánea o quirúrgica diferida cuando sea necesario. A partir de esto, algunos autores se plantearon la creación de centros con experiencia en hemodinámica (carentes de servicio de cirugía) o el traslado a centros con mayor experiencia.
En el estudio C-PORT89 se evaluó la ACTP en centros sin cirugía y se comparó la revascularización con la terapia lítica. En el primer caso, los resultados fueron significativamente mejores. En el NRMI90 se comparó la revascularización en centros con y sin cirugía cardíaca. La mortalidad fue independiente del retraso desde el comienzo de los síntomas y la recepción hospitalaria, en un rango de < 2 a > 12 h. La mortalidad, sin embargo, estuvo ligada al tiempo puerta-balón, con un incremento significativo de la mortalidad cuando éste excedía las 2 h. Por ello, algunos autores consideran que la demora en el traslado a otro centro aumentaría la mortalidad91.
En el PAMI No SOS Study92, Wharton et al comparan a los pacientes que ingresan con IAM y se les realiza ACTP en centros sin cirugía cardíaca con los que son trasladados a centros que sí cuentan con ella. El tiempo medio dolor-balón fue de 201 min. No hubo muertes durante el traslado. Se utilizaron más bloqueadores beta, abciximab y stents en el grupo no trasladado (p = s). Este último obtuvo un flujo TIMI 3 final mayor (p = 0,004). No hubo diferencias significativas en tiempo de estancia hospitalaria. Tampoco hubo diferencias significativas en el objetivo primario a los 30 días. Sin embargo, la mortalidad fue mayor en el grupo trasladado (p = 0,043), aunque después de ajustar según las características basales, estas diferencias no se mantuvieron. No hubo diferencias al año en las tasas de reinfarto, ACV o en el objetivo combinado. La ACTP primaria en centros sin cirugía puede ser realizada de forma segura, con similares resultados. Las guías de AHA/ACC93 recomiendan la realización de la revascularización en centros sin cirugía, pero con cardiólogos intervencionistas de probada experiencia (> 75 casos/año).
La apertura del vaso y la evolución a largo plazo no necesariamente están relacionadas con el tiempo de ACTP18,94. Grines et al95 analizaron los resultados del Air PAMI Study, donde se comparaba la trombólisis en el hospital de ingreso frente al traslado a otro centro para la ACTP. El estudio termina prematuramente con 138 pacientes. No hubo muertes o necesidad de reanimación durante el traslado. El tiempo de estancia hospitalaria fue significativamente menor en los pacientes tratados con ACTP. A los 30 días no hubo diferencias significativas en el objetivo primario. Sin embargo, en el análisis multivariable, el traslado para la realización de una ACTP fue un predictor independiente de reducción del objetivo primario (p = 0,028).
El estudio PRAGUE 196 fue diseñado para comparar 3 estrategias en pacientes con IAM < 6 h: a) trombólisis en el hospital; b) trombólisis y traslado para ACTP facilitada, y c) transporte a un centro para ACTP sin tratamiento previo. En el estudio se incluyó a 300 pacientes. No hubo complicaciones durante el traslado en el tercer grupo. El objetivo primario de muerte, reinfarto y ACV a los 30 días fue menor en el tercer grupo (8%) en comparación con el segundo (15%) y el primero (23%; p < 0,02). La incidencia de reinfarto se redujo de manera significativa en el tercer grupo comparado con los otros dos (p < 0,03). La mortalidad se redujo del 14% en el primer grupo al 7% en el tercero aunque, por el tamaño de la muestra, la diferencia no fue significativa. En los primeros 2 grupos los resultados fueron similares. En el estudio PRAGUE 2, Widimsky et al97 evaluaron a 850 pacientes con IAM y compararon el traslado a un centro con hemodinámica frente a la trombólisis en el hospital de recepción. Se incluyó a pacientes con < 12 h del comienzo de síntomas y < 120 km de distancia del laboratorio de hemodinámica. El estudio finalizó prematuramente debido al exceso de mortalidad en el grupo tratado con trombólisis después de 3 h (aumento de 2,5 veces comparado con el grupo de angioplastia). En el grupo de ACTP únicamente hubo un 1,2% de complicaciones durante el traslado. En cuanto al tiempo de hospitalización, fue menor en el grupo de angioplastia (p < 0,05). La mortalidad a los 30 días fue del 6,8% para la angioplastia y del 10% para la trombólisis (p = 0,12). El objetivo combinado fue menor en el grupo de ACTP (p < 0,003), con un mayor número de ACV en el grupo de trombólisis (p = 0,03).
En el estudio DANAMI 298 se comparó el tratamiento trombolítico in situ con el traslado a otro centro para la realización de ACTP. Se suspendió prematuramente por los beneficios que demostró la ACTP. El tiempo medio desde el comienzo de los síntomas hasta la aleatorización fue de 135 min. No hubo muertes durante el traslado. Se consiguió un 75% de reducción en el riesgo relativo de reinfarto (p = 0,0003) y reducción del MACE a los 30 días (p = 0,02) en el grupo de ACTP. La diferencia fue significativa con independencia de la localización del infarto, tanto en los de cara inferior como anterior. El beneficio de la angioplastia se observó en los diferentes grupos según se separó por horas desde el inicio de síntomas hasta la realización de la ACTP, y se mantuvo a pesar del tiempo de tratamiento (incluso en los > 4 h). Estos estudios demuestran que el traslado de los pacientes en el contexto de un IAM a centros que cuenten con hemodinámica obtiene mejores resultados, un menor número de eventos y un mejor pronóstico a largo plazo que la realización de trombólisis en el hospital de ingreso.
Zijsltra et al11 realizaron un metaanálisis de los estudios aleatorizados que comparaban el traslado a otro centro para ACTP frente a la trombólisis en el centro de ingreso. La mortalidad fue del 6,8% en el grupo trasladado para ACTP frente al 9,6% en el traslado con trombólisis en el centro de ingreso (p = 0,01). Keeley et al realizan un metaanálisis similar12. A pesar de la demora en el traslado, la ACTP primaria reduce de manera significativa el reinfarto no fatal, el ACV y el resto de eventos adversos.
El término angioplastia facilitada se refiere al uso de terapia farmacológica para lograr la reperfusión antes de llegar al laboratorio de hemodinámica. El objetivo es lograr un mayor número de pacientes con la arteria causante del infarto abierta al llegar al hospital de referencia y preservar la función ventricular con la esperanza de no incrementar las complicaciones. Aunque en términos absolutos angioplastia facilitada incluiría cualquier tratamiento farmacológico, el término se asocia con el tratamiento con inhibidores de la glucoproteína IIb/IIIa asociados a la mitad de dosis del fármaco trombolítico. Stone et al99 analizaron la importancia del flujo TIMI 3 al llegar al laboratorio a partir de los pacientes incluidos en los estudios PAMI. Incluyeron a 2.507 pacientes, de los cuales el 16% tenía flujo TIMI 3 en la coronariografía inicial. A estos pacientes los compararon con los que tenían un grado de flujo TIMI menor. En los primeros, la FEVI era mayor (57 frente a 53%; p = 0,003) y eran menos propensos a desarrollar insuficiencia cardíaca (p = 0,009). Hubo diferencias en la mortalidad a los 6 meses (p = 0,009). Estos resultados apuntarían hacia la conveniencia de la ACTP facilitada. En el estudio HEAP100 no se encontraron beneficios con el uso de altas dosis de heparina como pretratamiento de la angioplastia. En el estudio PACT101 se comparan, en 606 pacientes con IAM, el tratamiento fibrinolítico frente a placebo (ACTP en ambos grupos). El 61% de los pacientes del primer grupo tenía la arteria abierta al llegar al laboratorio (el 33% con flujo TIMI 3) frente al 34% del segundo grupo (p = 0,001). Sin embargo, no hubo diferencias en la obtención de flujo TIMI 3 final. O'Neill et al102 compararon la ACTP primaria frente a la facilitada (previa infusión de estreptocinasa). El flujo TIMI 2-3 fue similar en ambos grupos (92 frente a 98%). Durante el seguimiento hubo una tendencia hacia una mejor FEVI en el segundo grupo. Sin embargo, en estos pacientes se observó un aumento importante de las hemorragias con necesidad de transfusión (39%). Igualmente, en el estudio ECSG103 no hubo aumento del beneficio con la ACTP facilitada, mientras que se produjo un aumento del riesgo de eventos. En el estudio SWIFT104 se obtuvieron resultados similares. Bonnefoy et al105, en el estudio CAPTIM, compararon el tratamiento con fibrinólisis prehospitalaria (n = 419) frente a la ACTP primaria (n = 421). No hubo diferencias significativas entre los grupos en el objetivo combinado (el 8,2 frente al 6,2%) de muerte, reinfarto no fatal e ictus. Tampoco hubo diferencias en la mortalidad.
En el estudio GRACIA 1106 se compararon 2 estrategias postinfarto tratado con trombólisis: a) invasiva: coronariografía sistemática y revascularización (si procede), b) coronariografía derivada de la documentación no invasiva de isquemia. El estudio demuestra la superioridad de la coronariografía sistemática postinfarto tratado con fibrinólisis, pero no aporta más luz acerca de la comparación de la angioplastia primaria y la facilitada. En el estudio GRACIA 2107 se compara la ACTP primaria con stent frente a la ACTP facilitada en 212 pacientes con IAM < 12 h. El tamaño de muestra no era suficiente para encontrar diferencias en resultados clínicos. En este estudio no hubo diferencias entre las 2 estrategias en el tamaño del infarto (medido por marcadores biológicos) ni en la FEVI a las 6 semanas. Tampoco hubo diferencias significativas en el índice de motilidad parietal a las 6 semanas. A la espera de resultados de estudios aleatorizados más amplios, hoy día se puede afirmar que la ACTP facilitada no aporta beneficio frente al traslado y el tratamiento de revascularización sin fibrinólisis previa. Las guías de la AHA/ACC41 establecen como una recomendación de clase IIb la realización de una ACTP facilitada en los pacientes de alto riesgo en los se va a retrasar la realización de ACTP y hay bajo riesgo de complicaciones por sangrado.
GUÍAS TERAPÉUTICAS DE LAS SOCIEDADES CIENTÍFICAS
Las guías de la Sociedad Europea de Cardiología108 establecen como una recomendación de clase I (nivel de evidencia A) el tratamiento del IAM con ACTP si se instituye en < 90 min desde el contacto con el médico o centro en el que es admitido y se realiza en centros con probada experiencia.
Las guías de la AHA/ACC41 establecen como una recomendación de clase I la realización de la ACTP antes de los 90 min del diagnóstico del infarto en IAM < 12 h y que se lleva a cabo en centros con probada experiencia. En el caso de que los síntomas tengan una evolución < 3 h, se recomienda la ACTP en caso de que el procedimiento se realice en < 1 h del diagnóstico. Si el paciente llega con > 3 h de comenzado los síntomas, se recomienda la ACTP como tratamiento de elección. También se recomienda la ACTP cuando desarrolle insuficiencia cardíaca o edema pulmonar con una evolución del cuadro < 12 h. Cuando el IAM es > 12 h se recomienda realizar ACTP en caso de desarrollo de insuficiencia cardíaca, inestabilidad eléctrica o hemodinámica, o en caso de que los síntomas isquémicos persistan.
Las guías de Práctica Clínica de la Sociedad Española de Cardiología109 establecen como indicación de clase I de angioplastia primaria para pacientes con «IAM < 12 h desde el comienzo de los síntomas hasta que ingresen en un hospital con instalaciones y probada experiencia en angioplastia, especialmente en infartos extensos, con inestabilidad hemodinámica o contraindicación para tratamiento trombolítico. Pacientes < 75 años, en shock cardiogénico y dentro de las primeras 6 h de instalación del cuadro. Son indicación de clase IIa «los que con infartos extensos y contraindicación para tratamiento trombolítico, ingresaran en un hospital sin instalaciones de angioplastia y cuyo traslado permita la realización de la angioplastia dentro de las primeras 6 h del inicio de los síntomas. Pacientes con infartos extensos o con inestabilidad hemodinámica que ingresaran en un centro de similares características y cuyo traslado e intervención no suponga un retraso > 120 min». Es indicación de clase III en pacientes con «infartos no extensos que ingresaran en un hospital sin instalaciones de angioplastia».
ACTP DE RESCATE/CONTRAINDICACIÓN DE TROMBÓLISIS
La ACTP de rescate es la apertura mecánica del vaso después de haber fallado la trombólisis. Ross et al110 no encontraron diferencias significativas entre la ACTP de rescate y la primaria en cuanto a la mortalidad o la reestenosis. En el estudio RESCUE111 se evaluó a 151 pacientes con IAM de cara anterior tratados con trombólisis con control angiográfico a las 6-8 h de comenzado el dolor, cuya imagen de flujo era TIMI 0-1. Se excluyeron los casos de shock cardiogénico. Los pacientes fueron divididos en 2 grupos según se realizara angioplastia (n = 78) o tratamiento conservador (n = 73). La fracción de eyección postesfuerzo mejoró significativamente en los que recibieron angioplastia (p = 0,04). No hubo diferencias en la mortalidad total, aunque sí en la insuficiencia cardíaca severa (p = 0,05). El beneficio de la repermeabilización mecánica con angioplastia postrombólisis fallida sería independiente de la preservación del miocardio y estaría relacionada con una mejor remodelación, una menor incidencia de insuficiencia cardíaca, una mayor estabilidad eléctrica y un probable desarrollo posterior de circulación colateral.
Hong et al112 presentaron un trabajo con 31 pacientes a los que se realizó ACTP de rescate y los compararon con pacientes con ACTP primaria. En el primer grupo hubo mayor tendencia hacia la hipotensión arterial (p = 0,021), por lo que más pacientes ingresaron en el laboratorio en shock cardiogénico. No hubo diferencias en la supervivencia al mes, a los 6 y a los 12 meses.
Las guías de la Sociedad Europea de Cardiología108 establecen como una recomendación de clase IIa (nivel de evidencia B) la realización de ACTP de rescate cuando falla la trombólisis o cuando ésta está contraindicada.
ACTP EN LA ANGINA POSTINFARTO
Se define como angina postinfarto (APIAM) la que aparece entre las 24 h y los 30 días posteriores al infarto agudo. Es un claro marcador de mal pronóstico y se asocia con una mayor mortalidad113,114. El tratamiento trombolítico no ha reducido la incidencia de APIAM115.
En el estudio GUSTO I, un 20% de los pacientes presentó APIAM. El riesgo de reinfarto antes de los 30 días se incrementó en los que presentaron alteraciones electrocardiográficas que acompañaban a la angina, si bien la mortalidad aumentó solamente en los que tenían alteraciones hemodinámicas116.
En el estudio GISSI-3 APPI117 se demostró que la revascularización miocárdica en estos pacientes reduce la incidencia de eventos posteriores. En el registro GRACE118 se observó una reducción significativa de la mortalidad en los pacientes revascularizados.
Las guías de la AHA/ACC recomiendan la terapia invasiva sólo si hay evidencia de isquemia después de la trombólisis efectiva. En los pacientes estables es una indicación de clase III41.
SHOCK CARDIOGÉNICO
La incidencia estimada de shock cardiogénico en pacientes con IAM es aproximadamente del 7-10%119,120. Es una causa importante de muerte en el seno del IAM121-123. El shock cardiogénico se relaciona de manera directa con el tamaño del infarto124,125. Una pérdida del 40% del miocardio del ventrículo izquierdo termina irremediablemente en shock cardiogénico126,127. El cuadro puede ser producto de un gran IAM, un reinfarto en el mismo territorio o un infarto pequeño en un paciente con disfunción ventricular previa. Las complicaciones mecánicas del infarto, como rotura de un músculo papilar, defectos septales ventriculares o rotura de la pared libre del ventrículo izquierdo, son también causas de shock cardiogénico126,127. Es importante instaurar medidas urgentes de soporte hemodinámico125. Sin embargo, el único tratamiento beneficioso de este cuadro es la revascularización miocárdica precoz. En el GUSTO 1120, el éxito de la ACTP en casos de shock se asoció con la disminución de la mortalidad a los 30 días. En el registro ULTIMA, el 15% de los pacientes ingresó con IAM o shock cardiogénico. La mortalidad intrahospitalaria en estos casos fue del 69%26.
En el estudio SHOCK122 se compararon dos estrategias de tratamiento en 320 pacientes con shock cardiogénico: revascularización frente a tratamiento médico. No hubo reducción significativa de la mortalidad a los 30 días en la revascularización, pero sí a los 6 meses. En los pacientes < 75 años hubo una reducción absoluta de la mortalidad del 15% a los 30 días y del 20% a los 6 meses. Sin embargo, en los pacientes > 75años, la mortalidad se incrementó un 22% en los revascularizados respecto a los que recibieron tratamiento médico.
En el registro SHOCK128, la mortalidad hospitalaria disminuyó del 71% en 1992 al 60% en 1997. En los pacientes revascularizados en el registro, la mortalidad hospitalaria era del 50% en 1992 y del 38,5% en 1997. En un trabajo de Moreno et al129, en los pacientes que ingresaron en shock cardiogénico, la supervivencia mejoró del 36,4% antes de 1994 al 76,5% en 1997. Sanborn et al130 demostraron que la FEVI, el flujo TIMI previo, el número de vasos con enfermedad y el vaso causante se relacionaban de forma significativa con la supervivencia a 1 año en pacientes con shock cardiogénico. Zeymer et al131 presentaron los resultados del registro ALKK, en el que evaluaron los predictores de mortalidad en 1.333 pacientes con IAM complicado con shock cardiogénico tratados en 80 centros de Alemania. En el análisis multivariable, la afección de la descendente anterior, la enfermedad de 3 vasos, el flujo TIMI < 3 posterior al cateterismo, la edad y el retraso en la instauración del tratamiento fueron predictores independientes de mortalidad.
En el registro GRACE se evaluaron los resultados del tratamiento con stent en el shock cardiogénico132. La mortalidad hospitalaria total fue de 59%. Ésta fue menor en los que recibieron revascularización que en los que recibieron terapia conservadora (45 frente a 69%; p < 0,001). En el análisis multivariable, la presentación con shock y la revascularización con stent fueron los dos predictores de supervivencia hospitalaria. En 2 registros pequeños se observaron igualmente los beneficios del stent respecto a la ACTP con balón en pacientes con shock cardiogénico133,134.
Las guías de la Sociedad Europea de Cardiología108 establecen como una recomendación de clase I (nivel de evidencia C) la revascularización y el uso del balón de contrapulsación (BIAC) del IAM complicado con shock cardiogénico. Las guías de la AHA/ACC41 recomiendan como clase I la ACTP en pacientes < 75 años con IAM que desarrollen shock cardiogénico antes de las 36 h tras el ingreso y la revascularización en las 18 h del diagnóstico del cuadro. Cuando el paciente es > 75 años, la realización de ACTP es una recomendación de clase IIa.
El BIAC es teóricamente beneficioso en pacientes con alto riesgo, ya que aumenta el gasto cardíaco, reduce el consumo de oxígeno e incrementa el flujo coronario135. De todos modos, en los pacientes muy comprometidos, el aumento del gasto cardíaco que produce es modesto (Vranckx P, Serruys PW. Comunicación personal. PCR, 2004). Las indicaciones actuales en pacientes con IAM se extienden a los que presentan rotura septal e insuficiencia mitral136, angina postinfarto, arritmias ventriculares graves137 e insuficiencia ventricular progresiva138. En pacientes con IAM puede mantener y mejorar los parámetros hemodinámicos mientras se recupera el ventrículo izquierdo139, disminuye la incidencia de isquemia recurrente140 y la incidencia de reoclusión de la arteria relacionada con el infarto141. Stone et al142 realizaron un registro con pacientes consecutivos con IAM entre los años 1996 y 2001 e incluyeron a 5.495 pacientes. Tuvieron un 2,7% de complicaciones mayores relacionadas con el uso del balón (isquemia de miembro severa, sangrado severo o muerte). La muerte se atribuyó directamente al balón en 3 pacientes (0,05%). Las guías de la AHA/ACC41 incluyen como indicación de clase I el uso del BIAC en el IAM como medida estabilizadora en casos de shock cardiogénico, insuficiencia mitral aguda o perforación septal en el seno de un IAM y como medida estabilizadora para realizar la revascularización miocárdica; arritmias ventriculares recurrentes e intratables, acompañadas de inestabilidad hemodinámica; y en el caso de angina postinfarto refractarias al tratamiento convencional.
Dispositivos de soporte ventricular
Los dispositivos de soporte ventricular temporales permiten al corazón lesionado recuperarse manteniendo una perfusión tisular óptima y disminuyendo la carga del ventrículo. De esta manera, se elimina un factor que afecta de forma negativa a la evolución de los pacientes. La descarga mecánica del miocardio durante la isquemia y la reperfusión disminuye la carga de trabajo y el consumo miocárdico de oxígeno, lo que aumenta el beneficio, ya que el tamaño del infarto se ha relacionado con el grado de disminución de la carga del ventrículo izquierdo. Hay poca experiencia, pero con buenos resultados observacionales en pacientes en shock con disfunción ventricular muy grave (Vranckx P, Serruys PW. Comunicación personal. PCR, 2004).
AGRADECIMIENTOS
Agradecemos a los Dres. Luis García-Nielsen y José Pinto su importante ayuda en la preparación de este manuscrito.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. E. García.
Hospital Universitario Gregorio Marañón. Hemodinámica y Cardiología Intervencionista.
Dr. Esquerdo, 46. 28007 Madrid. España.
Correo electrónico: ejgarcia@retemail.es