El paciente con fibrilación auricular y enfermedad coronaria combina a menudo altos riesgos isquémico y hemorrágico. En el contexto de la anticoagulación oral, el clopidogrel es el inhibidor del P2Y12 con mejor perfil de seguridad y, aunque recomendado para los pacientes con síndrome coronario agudo, el pretratamiento antes de un procedimiento invasivo continúa siendo objeto de debate. Para los pacientes electivos que van a someterse a una intervención coronaria, no se recomienda la terapia puente con heparina periprocedimiento, dado que esta estrategia se ha relacionado con una mayor incidencia de eventos adversos. El acceso radial debería ser de elección en la mayoría de los casos, siempre que la situación hemodinámica y la anatomía coronaria lo permitan. Aunque la evidencia es aún escasa, se recomienda administrar dosis bajas de heparina no fraccionada durante el procedimiento.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Actualización en el tratamiento de los pacientes con fibrilación auricular sometidos a intervención coronaria», que ha sido patrocinado por Boehringer Ingelheim.
Palabras clave:
Aproximadamente, un 20-30% de los pacientes diagnosticados de fibrilación auricular (FA) sufrirán enfermedad coronaria (EC) a lo largo de su vida1. En las últimas décadas se ha producido un incremento de la prevalencia de esta arritmia relacionado con el envejecimiento de la población, y actualmente se presenta en más del 12% de los pacientes sometidos a intervención coronaria percutánea (ICP)2. Además, la presencia de FA en pacientes con EC se ha relacionado con un peor pronóstico2. Desde el punto de vista clínico, el tratamiento antitrombótico de este tipo de pacientes a menudo plantea cuestiones difíciles. En este artículo se revisa la evidencia actual sobre el tratamiento antitrombótico antes y durante la ICP en pacientes con FA.
Fármacos Antiagregantes PlaquetariosÁcido acetilsalicílicoEl ácido acetilsalicílico (AAS) bloquea de modo irreversible la síntesis de tromboxano A2. Antes de que se generalizara el uso de las tienopiridinas, con este fármaco en monoterapia se demostró, en comparación con placebo, una reducción de la tasa de eventos adversos cardiovasculares mayores (MACE) (infarto, ictus y muerte cardiovascular) en pacientes con EC, incluidos aquellos con FA3. Actualmente se recomienda una dosis de carga de 150-300 mg por vía oral antes de una ICP, así como para los pacientes con síndrome coronario agudo (SCA) con independencia de la estrategia de tratamiento4. La dosis de mantenimiento recomendada es de 70-100 mg/día, y no se ha demostrado beneficio alguno con la administración de dosis mayores5.
Inhibidores del receptor P2Y12Existen 4 moléculas que se unen al receptor plaquetario P2Y12 e inhiben la agregación plaquetaria mediada por adenosina difosfato (tabla 1).
Características farmacocinéticas y dosis recomendadas de los inhibidores del receptor P2Y12
| Fármaco | Inhibición del receptor P2Y12 | Via de administración | Metabolismo hepático | Dosis de carga, dosis de mantenimiento | Inicio del efecto | Retraso hasta cirugía |
|---|---|---|---|---|---|---|
| Clopidogrel | Irreversible | Oral | Sí (profármaco) | 300-600 mg, 75 mg/24 h | 2-6 h | 5 días |
| Prasugrel | Irreversible | Oral | Sí (profármaco) | 60 mg, 10 mg/24 h | 30 min-4 h | 7 días |
| Ticagrelor | Reversible | Oral | No (acción directa) | 180 mg, 90 mg/12 h | 30 min-2 h | 5 días |
| Cangrelor | Reversible | Intravenosa | No (acción directa) | 30 μg/kg, 4 μg/kg/min | 2 min | 2 h |
Tras un primer paso de metabolización hepática, menos del 20% se transforma en una forma activa que inhibe irreversiblemente el receptor P2Y126. Existe una gran variabilidad individual en la respuesta al fármaco, lo que da lugar a un porcentaje no despreciable de pacientes (5-44%) con elevada reactividad plaquetaria residual, y se ha descrito una mayor incidencia de eventos en ellos7. Se ha demostrado que agregar el clopidogrel al tratamiento con AAS reduce la incidencia de MACE en pacientes con SCA o sometidos a ICP electiva8,9.
PrasugrelSe trata de una tienopiridina de tercera generación que se une de manera irreversible al receptor P2Y12. A pesar de su metabolismo hepático, presenta una respuesta antiplaquetaria más homogénea que el clopidogrel10. El estudio TRITON-TIMI 38, con más de 13.000 pacientes con SCA sometidos a ICP, demostró que la administración del prasugrel disminuye en un 19% la incidencia de MACE11. Asimismo se observó una reducción significativa en las tasas de infarto, revascularización urgente del vaso diana y trombosis del stent, con un mayor beneficio en el subgrupo de pacientes diabéticos. Sin embargo, esta reducción de la incidencia de eventos isquémicos se produjo a expensas de un aumento significativo de la tasa de hemorragias mayores o mortales. Se identificó a los pacientes con accidente cerebrovascular previo como un subgrupo en el que el tratamiento con prasugrel se asocia con peores resultados, por lo cual tiene contraindicado su uso. Por otra parte, no se evidenció ningún beneficio en los pacientes de edad ≥ 75 años o con un peso < 60 kg, por lo que no se recomienda su uso en estos pacientes.
TicagrelorA diferencia de los 2 anteriores, no es un profármaco y se une de manera reversible al receptor P2Y12. En el estudio PLATO, con más de 18.000 pacientes con SCA, se demostró una reducción en la tasa de MACE del 16% frente al clopidogrel, a expensas de una menor incidencia de infarto y muerte cardiovascular12. Además, se objetivó una disminución de la mortalidad total y las trombosis del stent favorable al ticagrelor. Estos beneficios fueron independientes de la estrategia seguida, invasiva o no. No hubo diferencias significativas en la incidencia de ictus o hemorragia mayor, aunque sí una mayor tasa de hemorragias graves no relacionadas con cirugía de revascularización coronaria en el grupo de ticagrelor.
En los últimos años algunos estudios han comparado el tratamiento con ticagrelor y prasugrel. El ensayo PRAGUE 18 analizó la incidencia de muerte, reinfarto, ictus, hemorragia mayor o revascularización urgente en pacientes con SCA con elevación del segmento ST (SCACEST), pero se detuvo prematuramente por futilidad13. Un metanálisis reciente que incluyó datos de 4 estudios clínicos aleatorizados tampoco encontró diferencias en MACE, trombosis del stent o hemorragias mayores entre ambos tratamientos14.
CangrelorEs el único administrado por vía intravenosa, inhibe de modo reversible el receptor P2Y12 y destaca por su rápido inicio y fin de acción6. Un metanálisis de los principales 3 ensayos clínicos realizados hasta el momento, que incluyeron a pacientes tanto con SCA como con EC estable, concluyó que, en comparación con el clopidogrel, el tratamiento con cangrelor al inicio de la ICP se asocia con una reducción del 19% del compuesto de muerte, infarto, isquemia periprocedimiento y trombosis del stent, pero a expensas de un aumento significativo del número de eventos hemorrágicos15. La última guía de revascularización miocárdica le otorga un nivel de recomendación IIb para pacientes sin pretratamiento con inhibidores del receptor P2Y12 que se someten a ICP4.
Inhibidores de la glucoproteína IIb/IIIaActualmente se comercializan 3 inhibidores de la glucoproteína IIb/IIIa: eptifibatida, tirofibán y abciximab. Estos fármacos inhiben la unión del fibrinógeno a la forma activada del receptor plaquetario IIb/IIIa e impiden la adhesión plaquetaria. Su administración es por vía intravenosa y su uso solo se considera en el contexto del SCA y la ICP. Los resultados de los estudios clínicos son controvertidos y no respaldan un uso sistemático. En un metanálisis de pacientes con SCACEST sometidos a ICP primaria que incluye 16 estudios aleatorizados, no se demostró una reducción en la tasa de muerte o reinfarto a 30 días, y se objetivó un aumento significativo del riesgo de hemorragia mayor. En el análisis de subgrupos, los pacientes con mayor riesgo isquémico sí obtenían beneficio en la mortalidad16. Actualmente se recomienda su uso como estrategia de rescate en ICP complicada por fenómeno de no-reflow o alta carga de trombo4. Por el contrario, se deben evitar en pacientes con anticoagulación oral.
Pretratamiento con Inhibidores del Receptor P2Y12Cardiopatía isquémica estable (coronariografía electiva)Un subestudio del ensayo CREDO, en el que se incluyó a pacientes con angina estable, angina inestable o infarto reciente, concluyó que el pretratamiento con 300 mg de clopidogrel entre 3 y 24 h antes de la ICP electiva no se asociaba con una reducción del compuesto combinado de infarto, muerte o revascularización urgente frente al placebo9. El estudio ARMYDA-5 PRELOAD comparó el pretratamiento con 600 mg de clopidogrel 4-8 h antes del procedimiento en pacientes a los que se practicaba una coronariografía electiva con el tratamiento tras conocer la anatomía coronaria antes de la ICP, y no encontró diferencias significativas en la tasa de eventos isquémicos17. Por último, en otro estudio aleatorizado en pacientes con angina estable, tampoco se objetivaron diferencias significativas en cuanto a eventos isquémicos periprocedimiento por el pretratamiento con clopidogrel durante la angiografía coronaria en caso de necesidad de ICP frente al tratamiento sistemático con dosis de carga 6 h antes del procedimiento. Esta última estrategia se asoció con un mayor número de hemorragias menores18.
Con base en estos datos, la guía europea de revascularización miocárdica recomienda el tratamiento con clopidogrel una vez conocida la anatomía coronaria para los pacientes con cardiopatía isquémica estable4. No existen estudios que analicen el pretratamiento con prasugrel o ticagrelor en este contexto, y su uso solo debería considerarse en el momento de la ICP para pacientes con muy alto riesgo (enfermedad del tronco común, antecedentes de trombosis del stent, etc.)4.
Síndrome coronario agudo (coronariografía urgente o emergente)En el contexto del SCA, la reactividad plaquetaria está incrementada y el pretratamiento con inhibidores del P2Y12 podría, al menos en teoría, tener beneficios en la incidencia de eventos trombóticos. Sin embargo, esta estrategia presenta también potenciales desventajas, como un aumento del riesgo hemorrágico o de la estancia hospitalaria de pacientes que terminan sometidos a revascularización quirúrgica19.
En el estudio PLATO, cerca de la mitad de los pacientes reclutados tenían SCA sin elevación del segmento ST (SCASEST) y la administración de ticagrelor más de 3 h antes de la ICP mostró superioridad en cuanto a la reducción de eventos trombóticos12. El estudio ATLANTIC comparó el pretratamiento con ticagrelor durante el traslado en ambulancia frente a su administración en el momento de la ICP en pacientes con SCACEST20. No se objetivaron diferencias en la tasa de reperfusión coronaria preprocedimiento ni en el objetivo combinado de eventos isquémicos, si bien el pretratamiento se relacionó de manera significativa con una menor incidencia de trombosis del stent. Estudios observacionales posteriores no han demostrado beneficio en la reducción del compuesto de mortalidad por cualquier causa, infarto o trombosis del stent en los pacientes con SCACEST pretratados con ticagrelor21.
En cuanto al pretratamiento con prasugrel, en el estudio ACCOAST se aleatorizó a más de 4.000 pacientes con SCASEST a una dosis de carga de 30 mg previa a la coronariografía, completando con otros 30 mg si la ICP estaba indicada, o a recibir una dosis de 60 mg durante la ICP, una vez conocida la anatomía coronaria19. No hubo diferencias significativas en el objetivo principal del estudio, pero sí se incrementó notablemente la incidencia de hemorragias mayores en el grupo de pretratamiento, lo que hizo que el estudio se interrumpiera precozmente.
A pesar de estos datos, la guía más reciente de la Sociedad Europea de Cardiología recomienda considerar el pretratamiento con ticagrelor (o clopidogrel en caso de que este fármaco no esté disponible o esté contraindicado) tan pronto como se diagnostique SCASEST a los pacientes que se va a tratar de manera invasiva (grado de recomendación IIa)4. La indicación de prasugrel en este contexto quedaría limitada a pacientes con anatomía coronaria conocida que van a someterse a ICP4. En cuanto a los pacientes con SCACEST, se recomienda el uso sistemático de ticagrelor o prasugrel (de elección frente a clopidogrel) antes de la ICP.
Pretratamiento para Pacientes con Anticoagulación Oral CrónicaCada vez se someten a ICP más pacientes con anticoagulación oral, ya sea con antagonistas de la vitamina K (AVK) o con anticoagulantes orales de acción directa (ACOD). Actualmente el clopidogrel es el único inhibidor del receptor P2Y12 que se recomienda para pacientes con indicación de tratamiento combinado4. En este sentido, el estudio WOEST, en el que se incluyó a cerca de 600 pacientes con AVK sometidos a ICP, la combinación de clopidogrel con warfarina fue superior al tratamiento triple con AAS y clopidogrel en cuanto a la incidencia de hemorragias y muerte por cualquier causa, sin un aumento significativo en la incidencia de eventos trombóticos22.
La utilización de ticagrelor y prasugrel en combinación con anticoagulantes orales es muy poco frecuente en la práctica clínica habitual, debido a un potencial mayor riesgo de eventos hemorrágicos y a la ausencia de evidencia. El registro TRANSLATE-ACS23 analizó los eventos hemorrágicos en pacientes sometidos a ICP en función del régimen antitrombótico establecido. La utilización de prasugrel como segundo antiagregante añadido a warfarina en cerca de 100 pacientes se relacionó con una mayor tasa de hemorragias frente al clopidogrel, aunque fundamentalmente a expensas de hemorragias menores que no requirieron hospitalización. En el ensayo RE-DUAL PCI se incluyó a más de 2.700 pacientes con EC sometidos a ICP y aleatorizados a tratamiento antitrombótico doble (clopidogrel o ticagrelor + dabigatrán 110 o 150 mg) y triple (clopidogrel o ticagrelor + AAS + warfarina). Los resultados de este estudio avalan también la utilización de clopidogrel en combinación con ACOD en este contexto24. Por el contrario, subestudios posteriores mostraron una mayor tasa de hemorragias con ticagrelor en los distintos esquemas de tratamiento frente al clopidogrel, aunque no afectaba al objetivo principal del estudio.
Anticoagulantes orales en prevención secundaria después de un síndrome coronario agudoCon el AAS se ha demostrado una disminución en la incidencia de MACE en prevención secundaria25. Sin embargo, el riesgo isquémico residual de los pacientes con EC establecida continúa siendo alto, especialmente durante el primer año. En los últimos años, varios estudios han analizado el papel potencial de los anticoagulantes orales en este contexto. En el caso de los AVK, su uso en pacientes con EC estable se asocia con una mayor reducción de eventos trombóticos frente al tratamiento antiagregante solo con AAS, a expensas, sin embargo, de un incremento de hasta 3 veces en el riesgo de hemorragia mayor26. Con la llegada de los ACOD, con un perfil de seguridad favorable frente a los AVK, han surgido nuevas alternativas de tratamiento. El estudio APPRAISSE 2 evaluó la utilidad del apixabán 5 mg/12 h frente a placebo añadido al tratamiento antiagregante estándar en más de 7.000 pacientes con SCA27. El estudio finalizó prematuramente por un exceso de hemorragias como sangrado intracraneal o mortal en el grupo experimental, sin una disminución significativa en la tasa de MACE, que era el objetivo principal del estudio. Paralelamente, el estudio ATLAS ACS-2 TIMI 51 aleatorizó a más de 15.000 pacientes que habían sufrido un SCA a recibir rivaroxabán 2,5 mg/12 h o 5 mg/12 h frente a placebo junto con el tratamiento antiagregante habitual (más del 90% con tratamiento doble)28. En este estudio, los 2 grupos asignados al tratamiento con ACOD se asociaron con una reducción significativa en MACE (dosis de 2,5 mg/12 h, hazard ratio [HR] = 0,84; intervalo de confianza del 95% [IC95%], 0,72-0,97; p = 0,02; 5 mg/12 h, HR = 0,85; IC95%, 0,73-0,98; p = 0,03). Además, la dosis más baja redujo el riesgo de muerte cardiovascular y la muerte por cualquier causa. Sin embargo, hubo casi 4 veces más riesgo de hemorragia mayor, incluida la hemorragia intracraneal, en los grupos asignados al rivaroxabán frente al tratamiento estándar. Más recientemente, en el estudio COMPASS se aleatorizó a más de 27.000 pacientes con EC estable o enfermedad vascular periférica a 3 brazos de tratamiento: rivaroxabán 2,5 mg/12 h más AAS 100 mg/24 h, rivaroxabán 5 mg/12 h o AAS 100 mg/24 h29. La estrategia de tratamiento con rivaroxabán a dosis bajas más AAS fue superior en la prevención de MACE frente al tratamiento con AAS solo (HR = 0,76; IC95%, 0,66-0,86; p < 0,001), además de asociarse de manera significativa con una disminución de la mortalidad total. No se objetivaron diferencias entre el uso del rivaroxabán en monoterapia o el tratamiento convencional con AAS. En cuanto al objetivo de seguridad, el número de hemorragias mayores fue significativamente mayor en los grupos asignados al rivaroxabán, si bien no hubo diferencias en cuanto a la tasa de hemorragia mortal, intracraneal o sintomática en órgano crítico, y se demostró un beneficio clínico neto favorable a la combinación de rivaroxabán a dosis bajas y AAS. Con base en estos datos, la guía europea de revascularización coronaria otorga la recomendación IIb a la adición de rivaroxabán 2,5 mg/12 h al tratamiento antiagregante plaquetario doble con AAS y clopidogrel como tratamiento de mantenimiento tras un SCA para pacientes sin indicación de anticoagulación crónica y con bajo riesgo hemorrágico y alto riesgo isquémico4.
Intervención coronaria percutánea en pacientes con anticoagulación crónicaAbordaje de la anticoagulación antes del procedimientoEl tratamiento anticoagulante para el paciente con FA e indicación de ICP depende principalmente del contexto clínico (angina estable o SCA), el tratamiento anticoagulante previo a la intervención (ACOD o AVK) y el acceso vascular durante la ICP (radial o femoral). Fuera del contexto de la ICP, la terapia puente con heparina (TPH) frente a un tratamiento ininterrumpido con AVK parece aumentar el riesgo hemorrágico sin afectar a la incidencia de eventos tromboembólicos en pacientes sometidos a procedimientos electivos de bajo riesgo de hemorragia30. Estos datos podrían ser aplicables a los pacientes con ICP por acceso radial, un procedimiento considerado de bajo riesgo hemorrágico según los últimos documentos de consenso31.
En un registro observacional con cerca de 1.000 pacientes a los que se practicó ICP tanto por EC estable como por SCA, no se observaron diferencias entre ambas estrategias en la incidencia de muerte, infarto, revascularización del vaso diana, trombosis del stent o ictus, con una tendencia no significativa a mayor riesgo de eventos hemorrágicos en el grupo de TPH32. En un subanálisis del estudio WOEST, el mantenimiento de la anticoagulación oral no se relacionó con una mayor tasa de MACE o eventos hemorrágicos periprocedimiento33. En la misma línea, en un metanálisis reciente de 8 estudios con más de 2.300 pacientes con AVK sometidos a coronariografía diagnóstica o ICP, se analizaron las diferencias en eventos cardiovasculares y cerebrovasculares mayores y hemorrágicos entre aquellos a los que se interrumpió el tratamiento, con o sin TPH, y aquellos a los que se mantuvo la anticoagulación oral34. Aunque en general no se observaron diferencias en la tasa de eventos entre interrumpir el tratamiento AVK o no, mantener la anticoagulación oral mostró un perfil favorable frente a interrumpirla más TPH, con una menor incidencia de eventos tanto trombóticos como hemorrágicos. Con base en estos hallazgos, se recomienda no interrumpir el tratamiento con AVK a los pacientes programados para ICP electiva por vía radial (especialmente aquellos con alto riesgo tromboembólico [CHA2DS2-VASc ≥ 2])35.
La evidencia en cuanto al tratamiento con ACOD en este contexto es mucho menor. Recientemente, en el estudio BRUISE CONTROL-2 no se observaron diferencias en la incidencia de eventos adversos entre mantener o interrumpir los ACOD en pacientes con alto riesgo tromboembólico sometidos al implante de un dispositivo de estimulación cardiaca36. En un documento de consenso reciente, se recomienda suspender los ACOD entre 12 y 24 h antes del procedimiento (entre 24 y 48 h antes para los pacientes con insuficiencia renal en tratamiento con dabigatrán) a los pacientes con indicación de ICP electiva por angina estable sin alto riesgo tromboembólico, y evitar la TPH35.
En el contexto del SCA, la estrategia puede diferir en función del momento del procedimiento. En pacientes con SCACEST o SCASEST de muy alto riesgo con indicación de ICP emergente, el procedimiento se realizará independientemente del tratamiento anticoagulante previo o de la hora de toma de la última dosis, y es preferible el acceso radial siempre que sea posible35,37,38. Para los pacientes con SCASEST sometidos a ICP durante el ingreso, se recomienda mantener el tratamiento con ACOD o AVK periprocedimiento35.
Manejo de la anticoagulación durante el procedimientoEl tratamiento de elección durante la ICP para pacientes sin tratamiento anticoagulante previo es la heparina no fraccionada4. En pacientes con anticoagulación oral, la evidencia del tratamiento con heparina intraprocedimiento es escasa y su uso podría conllevar un aumento del riesgo hemorrágico. En el contexto de la ICP electiva en pacientes en tratamiento ininterrumpido con AVK, se recomienda añadir una dosis baja de heparina no fraccionada durante el procedimiento, aunque podrían omitirla los pacientes con razón internacional normalizada (INR) > 2,535,39,40. Para los pacientes que reciben ACOD y los han suspendido antes del procedimiento, se recomienda el uso de la dosis estándar de heparina no fraccionada durante la ICP35.
Para los pacientes con SCASEST, está indicado el uso de fondaparinux o enoxaparina hasta el estudio invasivo y la eventual revascularización, ya que se ha demostrado que reduce la tasa de muerte o infarto38. El estudio OASIS-541 comparó el fondaparinux frente a la enoxaparina en este contexto, y se objetivó una disminución significativa de las hemorragias mayores en el primer grupo, sin diferencias en eventos isquémicos. En los pacientes pretratados con fondaparinux, se documentó una mayor incidencia de trombosis del catéter, motivo por el cual se recomienda administrar durante la ICP heparina a dosis cercanas a las de los pacientes no pretratados42. Por el contrario, para los pretratados con enoxaparina, se recomienda continuar con el mismo tratamiento durante la ICP43,44. En el estudio SYNERGY45, el pretratamiento con enoxaparina fue no inferior a la heparina no fraccionada en pacientes con SCASEST de alto riesgo en cuanto a la incidencia de muerte e infarto.
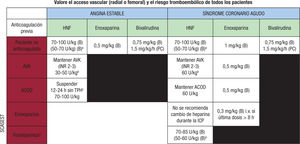
Por el contrario, es muy escasa la evidencia sobre el tratamiento periprocedimiento en pacientes que ingresan por SCA con tratamiento anticoagulante crónico. Para los pacientes con SCASEST, según la guía clínica vigente, se recomienda realizar la ICP sin interrumpir el tratamiento anticoagulante, ya sea con AVK o con ACOD. Un estudio observacional que incluyó a más de 400 pacientes en tratamiento crónico con warfarina documentó una menor incidencia no significativa de hemorragias, sin diferencias en la tasa de MACE, en los pacientes que no recibieron tratamiento con heparina durante el procedimiento46. Por otra parte, para los pacientes en tratamiento previo con ACOD, se recomienda el uso de dosis bajas de heparina no fraccionada o enoxaparina independientemente de cuándo se administró la última dosis del fármaco35,38. Esta recomendación se extiende a los pacientes con SCACEST, independientemente del tipo de tratamiento anticoagulante previo (AVK o ACOD) o la hora de la última dosis del fármaco35,37. En la figura 1 se muestra un esquema terapéutico del uso de anticoagulación durante el procedimiento para pacientes que ingresan tanto para ICP electiva como por SCA en función del tratamiento anticoagulante previo. En particular, es reseñable la disponibilidad de un agente específico de reversión del dabigatrán para los casos en que se haya continuado el tratamiento anticoagulante durante el procedimiento y haya aparecido una complicación.
Dosis de anticoagulación intraprocedimiento recomendadas según el contexto clínico: intervención coronaria percutánea electiva o síndrome coronario agudo, pacientes con o sin anticoagulación previa. ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; B: bolo; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; PC: perfusión continua; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TPH: terapia puente con heparina.
aEn caso de uso concomitante de inhibidores de la glucoproteína IIb/IIIa.
bSe podría omitir la administración de dosis de heparina añadida a los pacientes con INR > 2,5.
cExcepto tratamiento con dabigatrán en caso de filtrado glomerular < 50 ml/h: se suspende 24-48 h antes.
dNo está indicado para pacientes con fibrilación auricular.
El acceso radial se considera de elección en los procedimientos de ICP, especialmente en el contexto de SCA, donde se ha demostrado que reduce la incidencia de MACE, incluida la mortalidad, frente a la vía femoral47. Esta última es un factor independiente del riesgo de complicaciones vasculares en pacientes tratados con AVK48. En este contexto, el acceso radial presenta la ventaja de que permite llevar a cabo procedimientos electivos sin suspender la anticoagulación oral y evitando la TPH, que se ha relacionado con mayor incidencia de complicaciones.
Revascularización con stentEn los últimos años, la innovación en el diseño de los stents farmacoactivos (SFA) ha permitido reducir la incidencia de eventos isquémicos y mejorar su perfil de seguridad con regímenes de tratamiento antitrombótico cada vez más cortos. La disminución del tiempo de exposición a un segundo antiagregante resulta especialmente importante para los pacientes con mayor riesgo hemorrágico, como aquellos con indicación de anticoagulación crónica49. Actualmente la guía de revascularización coronaria aconseja la utilización de SFA como primera elección para cualquier procedimiento de ICP4. En este sentido, la última generación de SFA incorpora polímeros bioabsorbibles y, más recientemente, elimina el polímero como vehículo del fármaco inmunosupresor, lo que facilita una endotelización más temprana. En 2017 se publicaron los resultados del estudio LEADERS-FREE, en el que la revascularización con SFA sin polímero liberador de biolimus se asoció con una menor tasa de eventos (infarto, muerte cardiovascular y trombosis del stent) tras 1 mes de doble antiagregación frente al implante de stent convencional50. En este estudio se analizó a cerca de 2.500 pacientes con alto riesgo hemorrágico, y en torno a un tercio de los pacientes tenían FA y tomaban tratamiento triple al alta hospitalaria. Resultados similares se han comunicado con otras plataformas con polímero bioabsorbible51. Aunque las recomendaciones actuales de la duración del tratamiento antitrombótico tras la ICP se basan sobre todo en el tipo de evento índice (infarto o enfermedad estable) y en el balance individual entre los riesgos isquémico y hemorrágico, y no en el tipo de stent implantado, la utilización de SFA de última generación, con mejor perfil de seguridad y más evidencia en regímenes de tratamiento cortos, debería tenerse en consideración.
ConclusionesEl grupo de pacientes con FA sometidos a ICP supone en muchos casos un reto tanto para el cardiológico clínico como para el intervencionista, puesto que es frecuente la coexistencia de altos riesgos isquémicotrombótico y hemorrágico. Los cambios frecuentes de medicación durante el ingreso y la necesidad de un tratamiento combinado se han relacionado con una mayor incidencia de hemorragias, que empeoran el pronóstico de estos pacientes. El acceso radial, los regímenes cortos de tratamiento combinado y no interrumpir el tratamiento anticoagulante crónico en los procedimientos electivos deben contribuir a reducir los eventos hemorrágicos periprocedimiento.
Conflicto de InteresesNo se declara ninguno.
Información Sobre eL SuplementoEste artículo forma parte del suplemento titulado «Actualización en el tratamiento de los pacientes con fibrilación auricular sometidos a intervención coronaria», que ha sido patrocinado por Boehringer Ingelheim.