La hipercoagulabilidad y la tromboembolia son procesos derivados de la infección por el coronavirus 2 del síndrome respiratorio agudo grave y causan un alto grado de morbilidad y mortalidad relacionadas con la enfermedad coronavírica de 2019 (COVID-19). Este estudio pretende evaluar el efecto de los antiagregantes plaquetarios en la gravedad de la COVID-19 (riesgo de hospitalización y mortalidad), la susceptibilidad a la infección por el coronavirus 2 del síndrome respiratorio agudo grave y la progresión a COVID-19 grave.
MétodosSe realizó un estudio poblacional de casos y controles en una región del noroeste de España en 2020. En él participaron 3.060 sujetos con una prueba de reacción en cadena de la polimerasa positiva que fueron hospitalizados, 26.757 sujetos con una prueba de reacción en cadena de la polimerasa positiva que no fueron hospitalizados y 56.785 controles sanos.
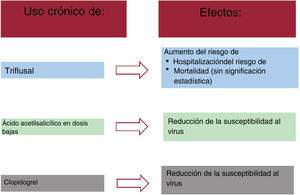
ResultadosParece que el triflusal se asoció con un aumento significativo del riesgo de infección (ORa=1,97; IC95%, 1,27-3,04) y la susceptibilidad a esta (ORa=1,45; IC95%, 1,07-1,96). Además, al parecer causa un aumento no significativo del riesgo de mortalidad (OR=2,23; IC95%, 0,89-5,55) y de progresión a estadios más graves de la enfermedad (OR=1,42; IC95%, 0,8-2,51). El ácido acetilsalicílico parece asociado con una disminución estadísticamente significativa de la susceptibilidad a la infección por el coronavirus 2 del síndrome respiratorio agudo grave (OR=0,92; IC95%, 0,86-0,98).
ConclusionesParece que el uso de triflusal causa un mayor riesgo de susceptibilidad a contraer COVID 19 y un riesgo aún mayor de hospitalización, mientras que los demás antiagregantes plaquetarios podrían estar asociados con una reducción del riesgo de los diversos resultados o no muestran efectos de riesgo. Estos hallazgos podrían respaldar que se reconsidere la prescripción de triflusal en situaciones de pandemia por COVID-19.
Palabras clave
Tras el estallido de la pandemia por la enfermedad coronavírica de 2019 (COVID-19), el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) ha provocado una crisis sanitaria grave con 762 millones de casos de COVID-19 y 6,84 millones de muertes a nivel mundial1. A pesar de los avances realizados en la contención del virus, la Organización Mundial de la Salud ha advertido de que continúa siendo una amenaza para la salud pública2.
La infección por el SARS-CoV-2 no solo provoca un síndrome respiratorio agudo3 sino que también da lugar a una disfunción endotelial y una activación de plaquetas y neutrófilos, lo cual induce un estado de hipercoagulación e inflamación4,5. Entre estos procesos, la endotelitis ha resultado ser el proceso principal en la patogenia de la enfermedad, así como el aumento de las concentraciones de dímero D, que es un indicador clave de la gravedad de la enfermedad6. Todo ello aumenta el riesgo de tromboembolia venosa y arterial, lo cual podría conducir a su vez a daños multiorgánicos, con un aumento del riesgo de mortalidad7–11.
Existe la hipótesis de que los pacientes a quienes se administra un tratamiento antiagregante plaquetario crónico podrían presentar una reducción de las complicaciones tromboembólicas específicas de la COVID-19. Es posible que esto se deba a la acción del sistema de trampas extracelulares de neutrófilos y a la inhibición de la formación de microtrombos secundarios a la propagación del virus12,13. En consecuencia, se ha propuesto un nuevo uso de los antiagregantes plaquetarios para el tratamiento de la COVID-19, igual que se ha hecho con otros tratamientos ya existentes14.
Varios estudios han analizado el papel de los antiagregantes plaquetarios en los pacientes con COVID-19 y los riesgos asociados a su uso. Sin embargo, en muchos de ellos esto se ha hecho solamente a nivel prehospitalario, cuando la medicación se administra en las fases iniciales de la enfermedad3,4,15,16. Algunos estudios han analizado el papel del empleo crónico de antiagregantes plaquetarios y el riesgo de mortalidad y la gravedad de la enfermedad, aunque con resultados poco uniformes9,17,18. Además, hasta donde se sabe, no hay ningún estudio que haya evaluado al mismo tiempo el papel del uso crónico de ácido acetilsalicílico, clopidogrel y triflusal en todos los procesos patológicos de la COVID-19. En consecuencia, los objetivos del presente estudio fueron evaluar la repercusión de un tratamiento preexistente a largo plazo con antiagregantes plaquetarios (triflusal, ácido acetilsalicílico y clopidogrel) en la gravedad (riesgo de hospitalización y mortalidad), la susceptibilidad a la infección y la progresión a COVID-19 grave.
MÉTODOSContextoEste estudio se llevó a cabo en Galicia, región del noroeste de España con una población de cerca de 3 millones de habitantes, casi todos ellos (98%) atendidos por el Sistema Nacional de Salud, que se financia en gran parte mediante impuestos. Aunque los pacientes deben pagar entre el 0 y el 60% del coste de los medicamentos, dependiendo de su renta, las visitas médicas son gratuitas. El Servizo Galego de Saúde (SERGAS), que forma parte del Servicio Nacional de Salud, lleva un registro electrónico de la historia clínica de todos los pacientes. Este registro incluye toda la información sobre la asistencia clínica prestada a los diferentes niveles del proceso de atención sanitaria, tanto en atención primaria como en los hospitales (pruebas diagnósticas, prescripción de medicamentos, códigos de la Clasificación Internacional de Atención Primaria, hospitalizaciones, etcétera).
Diseño del estudio y participantesSe llevó a cabo un estudio de casos y controles de base poblacional, utilizando un enfoque epidemiológico19. Este diseño se caracteriza por el uso de datos de una muestra representativa de todos los casos (en este estudio, con un muestreo exhaustivo) de una población definida e identificada de forma precisa (es decir, la población atendida por el Sistema de Salud de Galicia) y la compara con los datos de personas (controles) elegidos aleatoriamente de la misma población que la de los casos (estudios de casos y controles, de base poblacional). Según Rothman, este diseño se puede considerar la opción más deseable para un estudio de casos y controles20. El periodo de estudio fue el comprendido entre marzo y diciembre de 2020.
Para abordar los diversos objetivos del estudio, se llevaron a cabo 4 subestudios con el fin de analizar la asociación entre el consumo crónico de antiagregantes plaquetarios y: a) la gravedad de la COVID-19 (riesgo de hospitalización y mortalidad); b) susceptibilidad a la infección por SARS-CoV-2, y c) progresión a la COVID-19 grave.
Para estudiar la gravedad de la enfermedad en relación con el riesgo de hospitalización, los casos se definieron como pacientes ingresados en cualquier hospital del SERGAS por COVID-19 y confirmada con una prueba de reacción en cadena de la polimerasa (PCR), durante el periodo comprendido entre el estallido de la pandemia y el 31 de diciembre de 2020, ambos inclusive. El tiempo transcurrido entre la fecha de la prueba de PCR positiva y la hospitalización21 se limitó a un máximo de 10 días con objeto de excluir los posibles casos que pudieran haber sido ingresados por razones distintas de la infección por la COVID-19. Con la finalidad de mejorar la eficiencia del análisis del riesgo de hospitalización, los controles se seleccionaron aleatoriamente y se emparejaron con los casos según la edad, el sexo y el centro de atención primaria. Se seleccionaron hasta 20 controles por cada caso.
Para evaluar la gravedad de la enfermedad en relación con la mortalidad, los casos se definieron como cualquier persona que falleciera durante el ingreso hospitalario con una prueba de PCR positiva confirmada para COVID-19 en 2020. Los controles fueron las mismas personas que se utilizaron para evaluar el riesgo de hospitalización por la COVID-19.
Para evaluar la susceptibilidad, los casos se definieron como cualquier persona con un diagnóstico de COVID-19 confirmado por una prueba de PCR positiva (estando hospitalizada o no) durante el periodo del estudio21. Se utilizaron como controles a las mismas personas que se utilizaron para evaluar el riesgo de hospitalización, caracterizadas por la ausencia de antecedentes de una prueba de PCR positiva.
Para evaluar la progresión a COVID-19 grave, los casos se definieron como cualquier persona hospitalizada por la COVID-19 confirmada por una prueba de PCR positiva en 2020 (estando hospitalizada o no) y los controles fueron todos los pacientes con una prueba de PCR positiva para COVID-19 confirmada no hospitalizados en 2020. En este modelo, los casos no se emparejaron con los controles.
Aspectos éticosEl estudio fue aprobado por el Comité de Ética de Investigación de Galicia (referencia 2020/349), certificado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), y se llevó a cabo cumpliendo los principios de la Declaración de Helsinki y la legislación actual sobre investigación biomédica. El protocolo del estudio está registrado en el EU Electronic Register of Post-Authorisation Studies22. Se realizó una extracción automática de los datos y una anonimización para garantizar que los participantes incluidos no pudieran ser identificados y, por consiguiente, no fue necesario obtener su consentimiento informado.
Origen y obtención de los datosTodos los datos fueron extraídos de forma semiautomática por una empresa de servicios de tecnología de la información (IT) independiente a partir de los Sistemas de Información y Análisis Complejos (SIAC) utilizados por el SERGAS. El SIAC actúa como almacén de datos que guarda la información para la gestión de varios sistemas (dispensación de medicamentos, diagnósticos y hospitalizaciones, entre otros). Las series de datos generadas y analizadas durante el presente estudio no son de dominio público debido a las Restricciones de los Sistemas de Salud Pública Gallegos.
ExposiciónLas variables de exposición fueron los antiagregantes plaquetarios (código de ATC B01AC). Se incluyeron concretamente el clopidogrel (B01AC04), el ácido acetilsalicílico (B01AC06) y el triflusal (B01AC18). El uso de un tipo de antiagregante plaquetario no implica que el paciente no pueda utilizar otro tipo de antiagregante plaquetario. Se registraron los prescritos y dispensados a los casos y los controles a lo largo de todo el periodo de estudio, junto con el uso de cualquier otra medicación en los 6 meses previos a la fecha índice. La fecha índice se definió como el 10.° día antes de la fecha de la prueba de PCR positiva para los casos y el mismo día de la fecha índice para los casos emparejados del modelo de hospitalización para los controles.
Como covariables del estudio, se registraron los datos demográficos y antropométricos, las variables clínicas de la COVID-19 (si procedía) y la fecha de hospitalización, las comorbilidades (hipertensión, diabetes, enfermedad pulmonar obstructiva crónica, obesidad, cardiopatía isquémica, ictus, insuficiencia cardiaca, fibrilación auricular, insuficiencia renal crónica, cáncer, asma, tabaquismo actual) y la exposición a otros medicamentos (antihipertensivos, diuréticos, fármacos antiinflamatorios no esteroideos, hipolipemiantes, anticoagulantes y glucocorticoides) prescritos y dispensados a cada uno de los participantes. Se utilizó la polimedicación (número de medicaciones diferentes prescritas y dispensadas para enfermedades crónicas en los últimos 6 meses previos a la fecha índice) como indicador indirecto del grado de cronicidad en los pacientes23.
Análisis estadísticoPara realizar el análisis estadístico, se utilizaron modelos mixtos lineales generalizados24 con la función de vínculo binomial. El motivo del uso de estos modelos fue la estructura de los datos y sus muchas ventajas respecto a la regresión condicional24–26. La variable independiente utilizada para construir los modelos fue la dispensación de clopidogrel, ácido acetilsalicílico y triflusal frente a la ausencia de ella. Para la creación de los modelos, se consideraron los cuatro niveles siguientes: paciente; estratos de casos y controles (caso y control emparejado); centro de salud, y ola pandémica. Se utilizaron efectos aleatorios para evaluar el efecto de la ola de la pandemia y efectos aleatorios anidados para los pacientes, los estratos de casos y controles y el centro de salud. Se partió del supuesto de que el efecto de la exposición en la probabilidad de ser un caso (ajustado para las covariables) pudiera ser diferente en las distintas olas de la infección. Se aplicaron ajustes para las posibles variables causantes de confusión, incluidas las de edad, sexo, comorbilidades, tabaquismo y cada tratamiento farmacológico adicional. Los resultados se expresan en forma de valores de odds ratio ajustada (ORa) con sus correspondientes intervalos de confianza del 95% (IC95%). Se obtuvieron estimaciones ajustadas del efecto del tratamiento antiagregante plaquetario dispensado en comparación con la ausencia de todo tratamiento farmacológico antiagregante plaquetario. Los modelos se estimaron con el empleo de la función glmer del paquete informático R Ime427 (R Software versión 4.1.0).
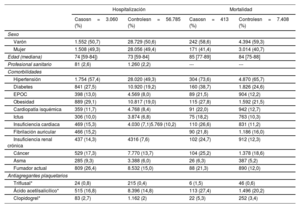
RESULTADOSSe obtuvieron datos de 86.602 participantes, de los cuales 3.060 fueron casos (participantes hospitalizados con una prueba de PCR positiva) y 413 de ellos fallecieron durante la hospitalización; y 26.757 fueron casos no hospitalizados. Hubo 56.785 participantes que no habían tenido una prueba de PCR positiva. En los pacientes tratados crónicamente con antiagregantes plaquetarios, el fármaco utilizado con más frecuencia fue el ácido acetilsalicílico. Las características demográficas y clínicas de los casos y los controles se presentan en la tabla 1 y la tabla 2.
Características demográficas y clínicas de la cohorte (gravedad: riesgo de hospitalización y mortalidad)
| Hospitalización | Mortalidad | |||
|---|---|---|---|---|
| Casosn=3.060 (%) | Controlesn=56.785 (%) | Casosn=413 (%) | Controlesn=7.408 (%) | |
| Sexo | ||||
| Varón | 1.552 (50,7) | 28.729 (50,6) | 242 (58,6) | 4.394 (59,3) |
| Mujer | 1.508 (49,3) | 28.056 (49,4) | 171 (41,4) | 3.014 (40,7) |
| Edad (mediana) | 74 [59-84]) | 73 [59-84] | 85 [77-89] | 84 [75-88] |
| Profesional sanitario | 81 (2,6) | 1.260 (2,2) | --- | --- |
| Comorbilidades | ||||
| Hipertensión | 1.754 (57,4) | 28.020 (49,3) | 304 (73,6) | 4.870 (65,7) |
| Diabetes | 841 (27,5) | 10.920 (19,2) | 160 (38,7) | 1.826 (24,6) |
| EPOC | 398 (13,0) | 4.569 (8,0) | 89 (21,5) | 904 (12,2) |
| Obesidad | 889 (29,1) | 10.817 (19,0) | 115 (27,8) | 1.592 (21,5) |
| Cardiopatía isquémica | 359 (11,7) | 4.768 (8,4) | 91 (22,0) | 942 (12,7) |
| Ictus | 306 (10,0) | 3.874 (6,8) | 75 (18,2) | 763 (10,3) |
| Insuficiencia cardiaca | 469 (15,3) | 4.030 (7,1)5.769 (10,2) | 110 (26,6) | 831 (11,2) |
| Fibrilación auricular | 466 (15,2) | 90 (21,8) | 1.186 (16,0) | |
| Insuficiencia renal crónica | 437 (14,3) | 4316 (7,6) | 102 (24,7) | 912 (12,3) |
| Cáncer | 529 (17,3) | 7.770 (13,7) | 104 (25,2) | 1.378 (18,6) |
| Asma | 285 (9,3) | 3.388 (6,0) | 26 (6,3) | 387 (5,2) |
| Fumador actual | 809 (26,4) | 8.532 (15,0) | 88 (21,3) | 890 (12,0) |
| Antiagregantes plaquetarios | ||||
| Triflusal* | 24 (0,8) | 215 (0,4) | 6 (1,5) | 46 (0,6) |
| Ácido acetilsalicílico* | 515 (16,8) | 8.396 (14,8) | 113 (27,4) | 1.496 (20,2) |
| Clopidogrel* | 83 (2,7) | 1.162 (2) | 22 (5,3) | 252 (3,4) |
EPOC, enfermedad pulmonar obstructiva crónica.
Los datos expresan n (%) o mediana [rango intercuartílico].
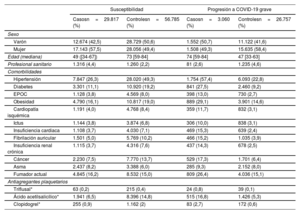
Características demográficas y clínicas de la cohorte (susceptibilidad y progresión a COVID-19 grave)
| Susceptibilidad | Progresión a COVID-19 grave | |||
|---|---|---|---|---|
| Casosn=29.817 (%) | Controlesn=56.785 (%) | Casosn=3.060 (%) | Controlesn=26.757 (%) | |
| Sexo | ||||
| Varón | 12.674 (42,5) | 28.729 (50,6) | 1.552 (50,7) | 11.122 (41,6) |
| Mujer | 17.143 (57,5) | 28.056 (49,4) | 1.508 (49,3) | 15.635 (58,4) |
| Edad (mediana) | 49 ([34-67]) | 73 [59-84] | 74 [59-84] | 47 [33-63] |
| Profesional sanitario | 1.316 (4,4) | 1.260 (2,2) | 81 (2,6) | 1.235 (4,6) |
| Comorbilidades | ||||
| Hipertensión | 7.847 (26,3) | 28.020 (49,3) | 1.754 (57,4) | 6.093 (22,8) |
| Diabetes | 3.301 (11,1) | 10.920 (19,2) | 841 (27,5) | 2.460 (9,2) |
| EPOC | 1.128 (3,8) | 4.569 (8,0) | 398 (13,0) | 730 (2,7) |
| Obesidad | 4.790 (16,1) | 10.817 (19,0) | 889 (29,1) | 3.901 (14,6) |
| Cardiopatía isquémica | 1.191 (4,0) | 4.768 (8,4) | 359 (11,7) | 832 (3,1) |
| Ictus | 1.144 (3,8) | 3.874 (6,8) | 306 (10,0) | 838 (3,1) |
| Insuficiencia cardiaca | 1.108 (3,7) | 4.030 (7,1) | 469 (15,3) | 639 (2,4) |
| Fibrilación auricular | 1.501 (5,0) | 5.769 (10,2) | 466 (15,2) | 1.035 (3,9) |
| Insuficiencia renal crónica | 1.115 (3,7) | 4.316 (7,6) | 437 (14,3) | 678 (2,5) |
| Cáncer | 2.230 (7,5) | 7.770 (13,7) | 529 (17,3) | 1.701 (6,4) |
| Asma | 2.437 (8,2) | 3.388 (6,0) | 285 (9,3) | 2.152 (8,0) |
| Fumador actual | 4.845 (16,2) | 8.532 (15,0) | 809 (26,4) | 4.036 (15,1) |
| Antiagregantes plaquetarios | ||||
| Triflusal* | 63 (0,2) | 215 (0,4) | 24 (0,8) | 39 (0,1) |
| Ácido acetilsalicílico* | 1.941 (6,5) | 8.396 (14,8) | 515 (16,8) | 1.426 (5,3) |
| Clopidogrel* | 255 (0,9) | 1.162 (2) | 83 (2,7) | 172 (0,6) |
EPOC, enfermedad pulmonar obstructiva crónica; COVID-19, enfermedad coronavírica de 2019.
Los datos expresan n (%) o mediana [rango intercuartílico].
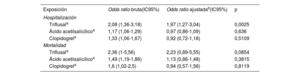
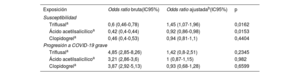
Para los fines del análisis, el estudio incluyó a 3.060 casos con una prueba de PCR positiva que habían sido hospitalizados. El grupo de control lo formaron 56.785 controles sin ninguna prueba de PCR positiva. Después del ajuste, el triflusal (OR=1,97; IC95%, 1,27-3,04) se asoció a un aumento del riesgo de hospitalización. En cambio, el uso de ácido acetilsalicílico (OR=0,97; IC95%, 0,86-1,09) y el de clopidogrel (OR=0,92; IC95%, 0,72-1,18) no mostraron ningún efecto de riesgo estadístico (tabla 3). Los resultados principales se presentan en la figura 1.
Riesgo de gravedad de la COVID-19, con necesidad de hospitalización, mortalidad y uso actual de antiagregantes plaquetarios
| Exposición | Odds ratio bruta(IC95%) | Odds ratio ajustadab(IC95%) | p |
|---|---|---|---|
| Hospitalización | |||
| Triflusala | 2,08 (1,36-3,18) | 1,97 (1,27-3,04) | 0,0025 |
| Ácido acetilsalicílicoa | 1,17 (1,06-1,29) | 0,97 (0,86-1,09) | 0,636 |
| Clopidogrela | 1,33 (1,06-1,67) | 0,92 (0,72-1,18) | 0,5109 |
| Mortalidad | |||
| Triflusala | 2,36 (1-5,56) | 2,23 (0,89-5,55) | 0,0854 |
| Ácido acetilsalicílicoa | 1,49 (1,19-1,86) | 1,13 (0,86-1,48) | 0,3815 |
| Clopidogrela | 1,6 (1,02-2,5) | 0,94 (0,57-1,56) | 0,8119 |
IC95%, intervalo de confianza del 95%.
El uso de un tipo de anticoagulante no descarta la posibilidad de que el mismo paciente pueda ser tratado con otro tipo de anticoagulante.
Ajustado respecto a: edad, sexo y comorbilidades: hipertensión, diabetes, EPOC (enfermedad pulmonar obstructiva crónica), obesidad, cardiopatía isquémica, ictus, insuficiencia cardiaca, fibrilación auricular, insuficiencia renal crónica, cáncer, asma, fumador actual y consumo actual de otros tratamientos farmacológicos (antihipertensivos, diuréticos, fármacos antiinflamatorios no esteroideos, hipolipemiantes, anticoagulantes y glucocorticoides). Se utilizó la polimedicación (número de medicaciones diferentes prescritas y dispensadas para enfermedades crónicas en los últimos 6 meses previos a la fecha índice) como indicador indirecto del grado de cronicidad en los pacientes.
Para los fines de este análisis, hubo 413 casos hospitalizados con una PCR positiva que fallecieron y 7.408 controles sin ninguna prueba de PCR positiva. No se observaron resultados significativos con ninguno de los fármacos antiagregantes plaquetarios, es decir, triflusal (OR=2,23; IC95%, 0,89-5,55), ácido acetilsalicílico (OR=1,13; IC95%, 0,86-1,48) y clopidogrel (OR=0,94; IC95%, 0,57-1,56) (tabla 3).
SusceptibilidadPara los fines de este análisis, hubo 29.817 casos con una prueba de PCR positiva (3.060 hospitalizados y 26.757 no hospitalizados) y 56.785 controles sin ninguna prueba de PCR positiva. Tras el ajuste, el triflusal aumentó el riesgo de infección por el virus (OR=1,45; IC95%, 1,07-1,96), mientras que el ácido acetilsalicílico (OR=0,92; IC95%, 0,86-0,98) parecía que reducía la susceptibilidad a la infección de COVID-19. El uso de clopidogrel (OR=0,94; IC95%, 0,81-1,1) no mostró efectos estadísticamente significativos sobre el riesgo (tabla 4).
Susceptibilidad a la COVID-19, riesgo de progresión a COVID-19 grave y uso actual de antiagregantes plaquetarios
| Exposición | Odds ratio bruta(IC95%) | Odds ratio ajustadab(IC95%) | p |
|---|---|---|---|
| Susceptibilidad | |||
| Triflusala | 0,6 (0,46-0,78) | 1,45 (1,07-1,96) | 0,0162 |
| Ácido acetilsalicílicoa | 0,42 (0,4-0,44) | 0,92 (0,86-0,98) | 0,0153 |
| Clopidogrela | 0,46 (0,4-0,53) | 0,94 (0,81-1,1) | 0,4404 |
| Progresión a COVID-19 grave | |||
| Triflusala | 4,85 (2,85-8,26) | 1,42 (0,8-2,51) | 0,2345 |
| Ácido acetilsalicílicoa | 3,21 (2,86-3,6) | 1 (0,87-1,15) | 0,982 |
| Clopidogrela | 3,87 (2,92-5,13) | 0,93 (0,68-1,28) | 0,6599 |
IC95%, intervalo de confianza del 95%; COVID-19, enfermedad coronavírica de 2019.
El uso de un tipo de anticoagulante no descarta la posibilidad de que el mismo paciente pueda ser tratado con otro tipo de anticoagulante.
Ajustado respecto a: edad, sexo y comorbilidades: hipertensión, diabetes, EPOC (enfermedad pulmonar obstructiva crónica), obesidad, cardiopatía isquémica, ictus, insuficiencia cardiaca, fibrilación auricular, insuficiencia renal crónica, cáncer, asma, fumador actual y consumo actual de otros tratamientos farmacológicos (antihipertensivos, diuréticos, fármacos antiinflamatorios no esteroideos, hipolipemiantes, anticoagulantes y glucocorticoides). Se utilizó la polimedicación (número de medicaciones diferentes prescritas y dispensadas para enfermedades crónicas en los últimos 6 meses previos a la fecha índice) como indicador indirecto del grado de cronicidad en los pacientes.
Para este análisis, hubo 3.060 casos con una prueba de PCR positiva que fueron hospitalizados y 26.757 controles con PCR que no fueron hospitalizados. Tras el ajuste, el uso de triflusal (OR=1,42; IC95%, 0,8-2,51), ácido acetilsalicílico (OR=1; IC95%, 0,87-1,15) o clopidogrel (OR=0,93; IC95%, 0,68-1,28) no mostró ningún efecto estadísticamente significativo sobre el riesgo (tabla 4).
DISCUSIÓNLos resultados de este estudio de casos y controles a gran escala, basados en datos de la práctica clínica real, al parecer indican que, mientras que el tratamiento crónico con ácido acetilsalicílico a dosis bajas (AAS-DB) o clopidogrel no aumenta el riesgo de hospitalización o de mortalidad por COVID-19, sí se asocia a una reducción de la susceptibilidad al virus. En cambio, el triflusal podría asociarse con un aumento en torno a dos veces del riesgo de hospitalización y mortalidad. En el caso de la mortalidad, este aumento no tuvo significación estadística. Así pues, estos resultados sugieren que, en las situaciones de pandemia de COVID-19, debe considerarse la posible conveniencia de evitar la prescripción de triflusal y reemplazarlo por clopidogrel o ácido acetilsalicílico.
En la bibliografía médica hay algunos estudios que han analizado la asociación entre el uso crónico de antiagregantes plaquetarios y la susceptibilidad al virus28,29, mientras que otros autores han examinado, por un lado, su asociación con la gravedad de la enfermedad y, por el otro, con el riesgo de mortalidad por la COVID-199,17,18. Sin embargo, hasta donde se sabe, este estudio es el primero en que se abordan todos estos parámetros al mismo tiempo.
Aunque el ácido acetilsalicílico y el triflusal son salicilatos que inhiben la ciclooxigenasa 1 (COX-1) y la ciclooxigenasa 2 (COX-2), el triflusal inhibe la COX-2 de forma más leve. Además, el triflusal inhibe también el AMPc y el GMPc30. Esto podría explicar que desempeñen un papel diferente en la gravedad de la COVID-19. El triflusal no ha sido autorizado por la Agencia Europea de Medicamentos ni por la Food and Drug Administration de Estados Unidos, pero está comercializado actualmente en 25 países31. La detección de los posibles riesgos asociados a su empleo crónico podría ser, pues, de gran importancia tanto desde la perspectiva clínica como desde el punto de vista de la salud pública. Aunque cabría especular con la posibilidad de que esta diferencia de efecto pudiera deberse al hecho de que las dosis recomendadas del triflusal como antiagregante plaquetario son mayores que las del ácido acetilsalicílico32,33, es posible que la diferencia no explicara una magnitud del efecto tan alta como la observada en el riesgo de hospitalización. De igual modo, esto no se explicaría por la existencia de un factor de confusión a causa de la indicación, ya que ambos fármacos tienen las mismas indicaciones terapéuticas32,33. Sin embargo, junto con su semejanza en la estructura química, es posible que nuestros resultados puedan explicarse también por un efecto pleiotrópico independiente debido al mecanismo de acción específico de ambos antiagregantes plaquetarios.
Parece que los resultados de este estudio indican que el uso crónico de AAS-DB o clopidogrel no tiene efectos significativos sobre el riesgo de hospitalización, mortalidad por la COVID-19 o progresión a estadios más graves de la enfermedad, de manera coherente con lo señalado en algunos estudios ya publicados9,17. Los datos de este estudio revelan también que el uso crónico de AAS-DB se asocia a una reducción de la susceptibilidad al virus (OR=0,92; IC95%, 0,86-0,98), observación esta que es coherente con lo indicado por otros estudios previos12,29. Por lo que respecta a la mortalidad, los resultados de estudios previos sobre el uso de AAS-DB a nivel prehospitalario no son homogéneos en lo relativo a su capacidad de reducir la mortalidad por la COVID-19: mientras que algunos estudios apuntan a un efecto protector, en otros no se han observado efectos significativos3,15. Sin embargo, es cierto que el uso crónico (incluso antes de la infección por el virus) no es el mismo que en el uso prehospitalario en el que el AAS-DB se administra una vez que el paciente ha sido diagnosticado de COVID-19 en los estadios iniciales.
En este estudio, el tratamiento crónico con triflusal se asoció a un aumento estadísticamente significativo del riesgo de hospitalización (OR=1,97; IC95%, 1,27-3,04) y a un aumento del riesgo de mortalidad sin significación estadística (OR=2,23; IC95%, 0,89-5,55). Soldevila et al.34 describieron un efecto similar para la mortalidad y observaron que el riesgo en los pacientes tratados con triflusal era el doble del existente en los pacientes tratados con ácido acetilsalicílico (el 60,0 frente al 28,4%). No se pudo encontrar ningún otro estudio sobre los efectos del triflusal, debido posiblemente al hecho de que su uso está menos extendido que el del ácido acetilsalicílico35. Sin embargo, su uso no es en modo alguno desdeñable, puesto que ha sido autorizado en muchos países31. La gran magnitud del efecto observada en la relación entre el triflusal y el riesgo de hospitalización, juntamente con la asociación no significativa con la mortalidad, podrían indicar la necesidad de buscar tratamientos alternativos en situaciones de pandemia.
Ventajas y limitacionesUno de los puntos fuertes más importantes de nuestro estudio es el gran tamaño de la muestra (más de 86.000 participantes), que se alcanzó mediante un método de muestreo exhaustivo, lo que nos permitió incluir a todos los casos con un diagnóstico de COVID-19 de Galicia en 2020.
Otro punto fuerte es el ajuste aplicado respecto a la presencia de variables causantes de confusión (datos sociodemográficos, comorbilidades y uso de otros fármacos). Esto permitió estimar con precisión la posible asociación entre el uso crónico de cada tipo de antiagregante plaquetario y el proceso de la enfermedad de la COVID-19.
Además, la medición de la variable de exposición se basó en datos correspondientes a fármacos que actualmente se dispensan en las farmacias, y no se basan en las prescripciones (como ocurre en otros estudios), lo cual reduce el riesgo de mala clasificación.
No obstante, no se puede descartar por completo la existencia de factores de confusión residuales derivados de variables del estudio no medidas o mal clasificadas, dado que no se dispuso de datos que permitieran medir la gravedad de las comorbilidades asociadas a una mayor gravedad de la COVID-19. Sin embargo, esto ocurre en todos los estudios de observación en los que puede disponerse de bases de datos secundarias.
Además, los controles no se emparejaron con casos equiparables en las cohortes utilizadas para el estudio de la susceptibilidad y la progresión a COVID-19 grave. No obstante, muchos autores señalan que esto no reduce en modo alguno la validez de los estudios, ya que la ausencia de emparejamiento por características equiparables podría deteriorar la eficiencia de un estudio, pero no aumenta el riesgo de sesgo20,23. Además, en 2020 las hospitalizaciones habrían sido proporcionales a los casos de COVID-19.
La falta de pruebas diagnósticas suficientes en los meses iniciales de la pandemia podría haber llevado al hecho de que algunos de los participantes con COVID-19 asintomática se hubieran asignado al grupo de control. De hecho, algunos participantes a los que no se realizó una prueba de PCR pueden haber tenido en realidad COVID-19, lo cual comportaría un error de clasificación en los resultados. Sin embargo, no existe razón alguna para creer que esta mala clasificación hubiera sido diferente según el grupo de exposición (triflusal, ácido acetilsalicílico y clopidogrel, sin ningún antiagregante plaquetario), por lo que las estimaciones del efecto no estarían sesgadas36. Asimismo, en estas pruebas no se detectaba la carga viral. Dado el bajo número de participantes tratados con triflusal, no se obtuvieron resultados concluyentes en el análisis de la relación dosis-respuesta. La base de datos que se utilizó en este estudio carecía de información sobre las indicaciones de los tratamientos prescritos, por lo que no pudimos aplicar un ajuste respecto a las posibles indicaciones. Por último, no se incluyó la raza como covariable. No obstante, en nuestra área geográfica, prácticamente la totalidad de la población es caucásica.
CONCLUSIONESLos resultados sugieren que ni el clopidogrel ni el AAS-DB se asocian a un aumento del riesgo de hospitalización o de mortalidad, y que el AAS-DB al parecer se asocia incluso a una disminución de la susceptibilidad. En cambio, el triflusal parece que se asocia a un aumento apreciable del riesgo de hospitalización y de mortalidad. Estos resultados indican que, aunque la retirada del tratamiento con los antiagregantes plaquetarios clopidogrel o AAS-DB no está justificada, la prescripción de triflusal en situaciones de pandemia de COVID-19 debiera reconsiderarse. Si estos resultados se reproducen con otras bases de datos y se replican en ensayos clínicos, podrían ser de interés en la prescripción de fármacos antiagregantes plaquetarios en las situaciones de pandemia.
FINANCIACIÓNEste trabajo contó con el apoyo del Instituto de Salud Carlos III a través del proyecto [COV20/00470] (cofinanciado por el Fondo Europeo de Desarrollo Regional, «Una manera de hacer Europa»).
CONSIDERACIONES ÉTICASEste estudio fue aprobado por el Comité de Ética de Investigación de Galicia (referencia 2020/349), certificado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), y se llevó a cabo cumpliendo los principios de la Declaración de Helsinki y la legislación actual sobre investigación biomédica. El protocolo del estudio está registrado en el EU Electronic Register of Post-Authorisation Studies y puede consultarse en https://www.encepp.eu/encepp/viewResource.htm?id=44588. Se realizó una extracción automática de los datos y una anonimización para garantizar que los participantes incluidos no pudieran ser identificados y, por consiguiente, no fue necesario obtener su consentimiento informado.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALEn la elaboración de este artículo no se ha utilizado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESA. Prieto-Campo diseñó el estudio y redactó el artículo. M. Zapata-Cachafeiro diseñó el estudio y redactó el artículo. M. Portela-Romero diseñó el estudio y revisó el artículo. M. Piñeiro-Lamas diseñó el estudio, analizó los datos y revisó el artículo. A. Figueiras diseñó el estudio, analizó los datos y revisó el artículo. A. Salgado-Barreira diseñó el estudio, analizó los datos y revisó el artículo. Todos los autores leyeron y aprobaron la versión final.
CONFLICTO DE INTERESESNinguno.
- -
El SARS-CoV-2da lugar a una disfunción endotelial y una activación de plaquetas y neutrófilos, lo cual induce un estado de hipercoagulación e inflamación.
- -
El SARS-CoV-2 aumenta el riesgo de tromboembolia venosa y arterial, lo cual podría conducir a su vez a daños multiorgánicos, con un aumento del riesgo de mortalidad.
- -
El AAS-DB y el clopidogrel no aumentaron el riesgo de hospitalización o de mortalidad por la COVID-19. Por el contrario, estos fármacos se asociaron a una reducción de la susceptibilidad al virus.
- -
El triflusal se asoció a un aumento a casi el doble del riesgo de hospitalización y de la mortalidad; en el caso de la mortalidad, este aumento no tuvo significación estadística.
Quisiéramos expresar nuestro agradecimiento a la Dirección General de Salud Pública del SERGAS por proporcionarnos los datos necesarios para llevar a cabo este estudio, a DXC Technology por su trabajo en la extracción de los datos del estudio y a Michael Benedict por la revisión y corrección del inglés.