La crioablación con balón de las venas pulmonares es una técnica novedosa que se ha demostrado útil para prevenir las recurrencias de la fibrilación auricular paroxística y persistente. Una de las complicaciones más relevantes del procedimiento es la parálisis del nervio frénico derecho. Se ha descrito recientemente la utilidad de la tomografía computarizada multidetector para localizar el recorrido de la arteria y el nervio frénico y predecir el riesgo de parálisis frénica durante la crioablación, según la distancia del paquete vasculonervioso frénico derecho al ostium de la vena pulmonar superior derecha. A 55 pacientes consecutivos con fibrilación auricular paroxística (media de edad 52±12 años) sometidos a crioablación con balón, se les realizó estudio previo con tomografía computarizada multidetector para medir el tamaño de las venas pulmonares. Se pudo identificar algún fragmento de la arteria pericardiofrénica derecha en 10 pacientes (20%), con una longitud media de 25 (7-68) mm.
Palabras clave
La crioablación con balón de las venas pulmonares (VP) es una técnica en expansión que parece tener resultados similares a la ablación con radiofrecuencia1, 2, 3 en la prevención de las recurrencias de la fibrilación auricular (FA) paroxística y persistente, con menor incidencia de complicaciones. Una de las complicaciones más relevantes del procedimiento es la parálisis del nervio frénico derecho (NFD). Se ha descrito recientemente la utilidad de la tomografía computarizada multidetector (TCMD) para situar el recorrido de la arteria y el NFD de manera sistemática y predecir el riesgo de ulterior parálisis frénica durante la crioablación en función de la distancia entre la arteria pericardiofrénica derecha (APFD) y el ostium de la vena pulmonar superior derecha (VPSD)4. El objetivo de este estudio es valorar la utilidad de la TCMD en la localización del NFD en pacientes que van a someterse a ablación de las VP.
MétodosAnalizamos retrospectivamente a los pacientes consecutivos sometidos a ablación con balón de las VP en los que se realizó previamente una TCMD para medir el tamaño estas. En todos los estudios se empleó un tomógrafo de 64 detectores (General Electric Medical Systems, Milwaukee, Estados Unidos). A los pacientes que presentaban una frecuencia cardiaca > 60 lpm, se les suministró vía intravenosa 2-10 mg de atenolol 5 min antes de la adquisición de las imágenes. La angiografía con TCMD se llevó a cabo con sincronización electrocardiográfica y tras la administración de contraste yodado no iónico (Ultravist 370) ajustado según peso.
Parámetros de la adquisiciónColimación 64×0,625 mm, 120 kV, 350-70 mA con modulación de dosis y máxima intensidad en un 40-80% del ciclo cardiaco; tiempo de rotación, 0,4s; pitch, 0,2-0,4 adaptado a frecuencia cardiaca, y campo de visión, 140-180 mm. Los estudios se realizaron en inspiración. Los datos se reconstruyeron en mesodiástole del ciclo cardiaco usando un algoritmo de sincronización retrospectiva con electrocardiograma. La dosis estimada de radiación fue de 12-20 mSv. Los datos se transfirieron a una estación de trabajo (General Electric Medical Systems) para su evaluación y posprocesado. Un cardiólogo y un radiólogo expertos en imagen cardiaca (más de 120 estudios al año de TCMD cardiaca) analizaron el recorrido de la APFD en cortes axiales, reconstrucciones maximun intensity projection y volume rendering tridimensional identificándola a nivel del ostium de la VPSD. Los resultados se expresan como arteria visible o no visible. Las variables se expresan como porcentaje o media±desviación estándar. Se determinó la concordancia entre observadores para la identificación de la APFD calculando el índice kappa. En caso de discordancia entre ambos observadores, se decidió por consenso. Las comparaciones de medias se realizaron con la prueba de la t de Student. Para todos los análisis se utilizó SPSS Statistics 15.0.
ResultadosSe incluyó a 55 pacientes: 39 varones (71%), con media de edad de 52±12 años, corazón estructuralmente normal y FA paroxística. Se pudo identificar la APFD en 10 casos (20%) (observador 1: 14 casos; observador 2: 10 casos; concordancia: κ=0,57). La arteria completa sólo se pudo identificar en 1 caso (Figura 1, Figura 2) y en el resto, sólo segmentos de dicha estructura (tamaño medio, 25 [7-68] mm) (Figura 3), aunque en todos ellos se pudo identificar su relación con el ostium de la VPSD (distancia media, 18,9 [3-26] mm). Se produjeron 3 casos de parálisis frénica derecha durante el procedimiento, y se pudo visualizar la APFD y medir su distancia al ostium de VPSD en 2 de ellos (3 y 13mm, respectivamente). Los pacientes cuya APFD se pudo visualizar mostraron tendencia a tener mayor índice de masa corporal (IMC) (29,29±3,35 en visible y 27,53±2,57 en no visible; p=0,06).
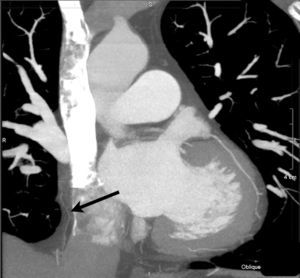
Figura 1. Reconstrucción maximun intensity projection coronal que muestra el recorrido de la arteria pericardiofrénica derecha a través de la grasa pericárdica.
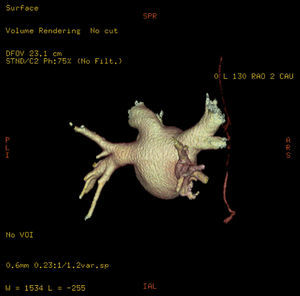
Figura 2. Reconstrucción tridimensional de volumen de la aurícula izquierda y las venas pulmonares, con visualización de la arteria pericardiofrénica derecha (vista oblicua posterior derecha).
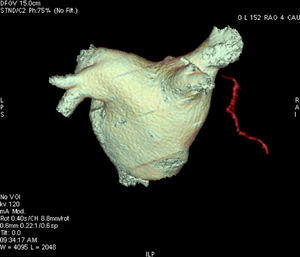
Figura 3. Reconstrucción tridimensional de volumen de la aurícula izquierda y las venas pulmonares, con visualización de un fragmento de la arteria pericardiofrénica derecha.
DiscusiónProbablemente la complicación más relevante de la ablación de VP es la parálisis diafragmática total o parcial, por lesión del nervio frénico, más frecuente durante el aislamiento con criobalón (4-10%)5, 6 que con radiofrecuencia (0,1-0,48%)7. Aunque generalmente es reversible (el 80% al año)7, 8, se han descrito casos muy sintomáticos9. El NFD discurre próximo a la VPSD y a la vena cava superior10, que son las estructuras cuya ablación es más probable que lesione el NFD8, aunque también se ha descrito durante la ablación de la VP inferior derecha2. La forma habitual de prevenir la lesión del NFD consiste en estimularlo desde la vena cava superior durante la aplicación en VP derechas y detener la aplicación de energía precozmente al detectar disminución o ausencia de contracción del diafragma2, 6. Se ha publicado recientemente un método para identificar a los pacientes con alto riesgo de parálisis frénica mediante el empleo de la TCMD-angiografía4. La arteria y la vena pericardiofrénicas y el nervio frénico discurren de forma paralela en un paquete vasculonervioso común, lo que permite localizar todas las estructuras identificando cualquiera de ellas. Aunque el nervio tiene la misma densidad radiológica que las estructuras adyacentes, realzando la APFD con el empleo de contraste, Matsumoto et al11 consiguen observarla con TCMD en un 47% de los pacientes. Horton et al4 emplearon esta técnica para identificar el paquete vasculonervioso del NFD y medir su distancia al ostium de la VPSD, y observaron que aquellos con mayor proximidad presentaron de manera significativa mayor incidencia de parálisis frénica, por lo que señalan que esta técnica podría identificar a los pacientes con una anatomía más vulnerable a dicha complicación durante la crioablación. En dicho estudio4, la identificación de la APFD se obtuvo usando los protocolos habituales para el estudio de las arterias coronarias. En nuestra serie, utilizando estos mismos protocolos hemos podido identificar el recorrido de la APFD en un bajo porcentaje de los pacientes, y sólo en un caso en su totalidad. La sensibilidad, por lo tanto, es inferior a la de Matsumoto et al11 (47%) y muy inferior al 100% indicado en la serie de Horton et al4. No encontramos una explicación obvia a estas diferencias, aunque el calibre submilimétrico de la arteria en el límite de la resolución espacial de la TCMD podría tener relación. Nuestros datos indican que un mayor IMC podría asociarse a mejor visualización, pero otros autores no observan esta posible relación11. La posible utilización de nitroglicerina para aumentar el calibre de las arterias antes de la adquisición de las imágenes, como se realiza en el protocolo de estudio de la enfermedad coronaria, tampoco se detalla en las series publicadas4, 11. En cualquier caso, la concordancia entre observadores para la identificación de la APFD parece pequeña, lo que demuestra la dificultad para identificar dicha estructura. Como conclusión, con la tecnología utilizada en este estudio y el método descrito empleado, la sensibilidad de la técnica para la detección de la APFD es baja, por lo que la utilidad para predecir la lesión frénica durante la crioablación parece muy escasa y no justifica por sí misma la elección de la TCMD como técnica preferente de imagen en estos pacientes, sobre todo si se tiene en cuenta la dosis de radiación a que se los somete y la posibilidad de utilizar la resonancia magnética como alternativa.
Conflicto de interesesNinguno.
Recibido 21 Noviembre 2010
Aceptado 10 Febrero 2011
Autor para correspondencia: Ctra. Madrid-Cartagena s/n, 30120 El Palmar, Murcia, España. jnieto1980@hotmail.com