La disfunción miocárdica, sistólica o diastólica, tanto del ventrículo derecho como del izquierdo, es un desenlace frecuente en numerosas anomalías cardiacas congénitas que a menudo son causa de insuficiencia cardiaca, arritmia y muerte. La fibrosis miocárdica, detectable con las actuales técnicas de diagnóstico por la imagen, probablemente participe en el deterioro gradual de la función miocárdica1. Esta función se ha investigado y se ha demostrado de manera muy convincente en pacientes con tetralogía de Fallot (TdF) y, en menor grado, pacientes con un ventrículo derecho (VD) sistémico, como en la transposición de las grandes arterias (TGA). Las pruebas obtenidas hasta ahora llevan a la convicción de que la participación de la fibrosis en la evolución natural de estas enfermedades es muy importante. Las herramientas de diagnóstico por la imagen para detectar y cuantificar la fibrosis permiten estudiar la evolución de los cambios miocárdicos a lo largo del tiempo, investigar qué factores influyen más en la fibrogénesis, establecer un pronóstico (identificar el riesgo de arritmia, los episodios de insuficiencia cardiaca congestiva) o incluso identificar un posible objetivo indirecto para los estudios de farmacoterapia. Este artículo revisa las pruebas actuales para la fibrosis centrándose en las 2 enfermedades antes mencionadas y sus correlaciones clínicas.
La mayoría de los diagnósticos por imagen de fibrosis miocárdica hoy se sirven de 2 técnicas muy habituales: la resonancia magnética cardiaca (RMC) y el contraste con gadolinio, por lo cual no se diagnostica por imagen a pacientes no aptos para la RMC o la administración de contraste. Ambas técnicas se basan en la idea que la fibrosis aumenta el espacio extracelular. Puesto que los medios de contraste a base de gadolinio son estrictamente extracelulares, su efecto será más visible cuando el espacio extracelular se agrande. El contraste acorta el T1, es decir, disminuye el tiempo necesario para que los protones que están girando vuelvan a alinearse con el eje de la magnetización longitudinal después de un pulso que invierte el eje de los protones que giran. Así, el tiempo T1 variará en las áreas densamente extracelulares, como las áreas fibrosadas, lo cual puede determinarse mediante imágenes.
En el realce tardío de gadolinio (RTG), al que también se hace referencia como realce retardado de gadolinio, las imágenes se obtienen aproximadamente a los 10-30min de la inyección del contraste de gadolinio. Las áreas densas del espacio miocárdico extracelular retienen más contraste que las áreas de miocardio normal, por lo que tendrán un tiempo T1 más corto y mayor intensidad de señal que el miocardio normal. Cuando son lo bastante grandes, estas áreas se detectan visualmente como una placa o cicatriz focal. Las áreas de mucha señal, o áreas «potenciadas», pueden perfilarse y cuantificarse, aunque este proceso es algo subjetivo. Sin embargo, es probable que muchos pacientes con cardiopatías congénitas tengan una fibrosis miocárdica más difusa, y puesto que el RTG es en gran medida un método muy dicotómico, puede ser menos efectivo para detectarla o cuantificarla2. En la fibrosis difusa, pueden utilizarse las técnicas de diagnóstico por la imagen para cuantificar los valores de T1 píxel a píxel. Al determinar el valor T1 de cada píxel en el miocardio antes y después de administrar el gadolinio, y después de representar gráficamente los cambios frente al valor de la acumulación de sangre, se calcula el volumen de distribución del gadolinio en el miocardio, que puede convertirse en una fracción de volumen extracelular (VEC)1. El VEC muestra fibrosis difusa en pacientes adultos con cardiopatía congénita con varias lesiones, y se relaciona con el tamaño y la función del ventrículo3. El VEC es sobre todo objetivo, pero requiere un contorneado cuidadoso para evitar la grasa extracelular o las trabeculaciones miocárdicas.
Ambas técnicas se han utilizado ampliamente en distintas enfermedades cardiacas y han mostrado repetidas veces la relación con otros marcadores de función cardiaca o estado clínico adversos. En la cardiopatía congénita, se han estudiado la TdF y la TGA con más detalle con estos métodos. Es importante identificar las diferencias entre estos métodos, ya que las diferencias en el grado de fibrosis dependen del método utilizado, como se comenta más adelante. Una diferencia clave es que el VEC cubre una muestra de miocardio más pequeña que el RTG. En consecuencia, el RTG es más sensible a la carga total de fibrosis, aunque requiere una mayor cantidad para detectarla visualmente.
FIBROSIS EN LA TETRALOGÍA DE FALLOTEn la TdF, el primer estudio que mostró RTG incluyó a 92 participantes4. Como era de esperar, el RTG se halló casi de manera universal en el tracto de salida del ventrículo derecho, en un parche transanular o cerca de este o en un parche de cierre de la comunicación interventricular. No obstante, también se observó RTG patológico del ventrículo izquierdo en el 13% de los participantes. El grado de RTG se relacionó con la edad, los síntomas, la arritmia previa, el péptido natriurético cerebral (BNP), la capacidad de ejercicio y el volumen y la función del VD. Desde entonces se han realizado varios estudios que, en conjunto, muestran diversos hallazgos alrededor de esta cuestión básica: más fibrosis asociada con hallazgos clínicos adversos (tabla 1). El RTG se ha demostrado tanto en el VD como en el VI, aunque la percepción es que el VD es el más afectado. La afección del VI confirma una vez más que en la TdF ambos ventrículos están afectados a través de varios mecanismos de acoplamiento.
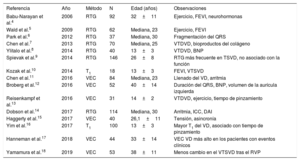
Estudios sobre fibrosis miocárdica en la tetralogía de Fallot
| Referencia | Año | Método | N | Edad (años) | Observaciones |
|---|---|---|---|---|---|
| Babu-Narayan et al.4 | 2006 | RTG | 92 | 32±11 | Ejercicio, FEVI, neurohormonas |
| Wald et al.5 | 2009 | RTG | 62 | Mediana, 23 | Ejercicio, FEVI |
| Park et al.6 | 2012 | RTG | 37 | Mediana, 30 | Fragmentación del QRS |
| Chen et al.7 | 2013 | RTG | 70 | Mediana, 25 | VTDVD, bioproductos del colágeno |
| Ylitalo et al.8 | 2014 | RTG | 40 | 13±3 | VTDVD, BNP |
| Spievak et al.9 | 2014 | RTG | 146 | 26±8 | RTG más frecuente en TSVD, no asociado con la función |
| Kozak et al.10 | 2014 | T1 | 18 | 13±3 | FEVI, VTSVD |
| Chen et al.11 | 2016 | VEC | 84 | Mediana, 23 | Llenado del VD, arritmia |
| Broberg et al.12 | 2016 | VEC | 52 | 40±14 | Duración del QRS, BNP, volumen de la aurícula izquierda |
| Reisenkampf et al.13 | 2016 | VEC | 31 | 14±2 | VTDVD, ejercicio, tiempo de pinzamiento |
| Dobson et al.14 | 2017 | RTG | 114 | Mediana, 30 | Arritmia, ICC, DAI |
| Haggerty et al.15 | 2017 | VEC | 40 | 26,1±11 | Tensión, asincronía |
| Yim et al.16 | 2017 | T1 | 100 | 13±3 | Mayor T1 del VD, asociado con tiempo de pinzamiento |
| Hanneman et al.17 | 2018 | VEC | 44 | 33±14 | VEC VD más alto en los pacientes con eventos clínicos |
| Yamamura et al.18 | 2019 | VEC | 53 | 38±11 | Menos cambio en el VTSVD tras el RVP |
BNP: péptido natriurético cerebral; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; ICC: insuficiencia cardiaca congestiva; RTG: realce tardío de gadolinio; RVP: reemplazo de válvula pulmonar; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho; VEC: volumen extracelular; VTDVD: volumen telediastólico del ventrículo derecho; VTSVD: volumen telesistólico del ventrículo derecho.
Salvo otra indicación, la edad se expresa en media±desviación estándar.
Estudios más recientes han incorporado el VEC en las técnicas de diagnóstico por la imagen para la detección de la fibrosis difusa, y en conjunto muestran hallazgos parecidos, pero con variación entre los estudios. Los investigadores del hospital infantil de Boston han mostrado aumento del VEC en el VD y el VI de 84 pacientes con TdF (media de edad, 24 años)11. En 11 de los participantes se halló un valor anómalo de VEC del VI. El VEC del VD era mayor en los pacientes con volumen de llenado del VD que en aquellos con presión de llenado del VD. Al mismo tiempo se publicó un estudio con 52 participantes mayores (media de edad, 40±14 años) y 22 controles, en el cual el VEC del VI era más alto en los pacientes que en los controles (el 28,2%±3,9% frente al 26,1%±2,0%; p=0,026)12. No se determinó el VEC del VD. Lo más importante, el VEC del VI aumentado se relacionó con una edad mayor, la edad en el momento de repararse la TdF, mayor concentración de la fracción aminnoterminal del propéptido natruirético cerebral (NT-proBNP), mayor duración del QRS, menor distancia en la prueba de los 6 min de marcha y mayor volumen en la aurícula izquierda. En otro estudio con pacientes más jóvenes (edad, 13,9±2,4 años), el tiempo T1 nativo (antes de la administración de contraste) y el VEC del VD se relacionaron con tiempos de pinzamiento aórtico y bypass más largos durante la reparación inicial, así como con la capacidad de ejercicio máximo13,16. En otro estudio con adultos, 40 pacientes de 26±11 años, se demostró que el VEC del VI se relaciona con asincronía del VI y tensión radial15.
Aunque estos estudios, que abarcan varias edades, varíen en algunos de sus hallazgos, cada uno contribuye a una nueva visión y muestra la participación de la fibrosis del VD y el VI en la evolución natural posterior a la reparación. Otra confirmación procede de los estudios que muestran que el desenlace clínico es peor en los pacientes con fibrosis demostrable. En un estudio con pacientes sometidos a reemplazo de la válvula pulmonar, el grado de reducción del tamaño del VD fue inferior en los que tenían fibrosis del VD18. En otro estudio con 52 participantes adultos, el objetivo de arritmia o insuficiencia cardiaca congestiva al cabo de 4 años fue más frecuente en aquellos con un valor más alto de VEC del VI12. Y en otro estudio más, con 44 pacientes adultos con un seguimiento medio de solo 8 meses, el VEC del VD se relacionó con el objetivo combinado de muerte, insuficiencia cardiaca congestiva o taquicardia ventricular17. El mensaje por lo general coherente de estos estudios es que la fibrosis tiene un impacto, si bien reducido, en el resultado.
TRANSPOSICIÓN DE LAS GRANDES ARTERIAS CON UN VENTRÍCULO DERECHO SISTÉMICOEn el VD sistémico de quienes tienen una TGA, también se ha demostrado la presencia de fibrosis con las técnicas de RTG y VEC. Los estudios existentes se resumen en la tabla 2, en la cual se muestra que la fibrosis miocárdica se relaciona con el deterioro clínico. Aquí merece la pena mencionar específicamente varios de estos estudios.
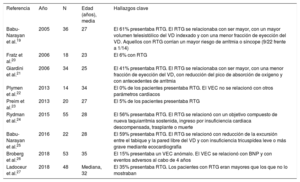
Compilación de los datos actuales relacionados con el realce tardío de gadolinio o la fracción de volumen extracelular en el ventrículo derecho sistémico
| Referencia | Año | N | Edad (años), media | Hallazgos clave |
|---|---|---|---|---|
| Babu-Narayan et al.19 | 2005 | 36 | 27 | El 61% presentaba RTG. El RTG se relacionaba con ser mayor, con un mayor volumen telesistólico del VD indexado y con una menor fracción de eyección del VD. Aquellos con RTG corrían un mayor riesgo de arritmia o síncope (9/22 frente a 1/14) |
| Fratz et al.20 | 2006 | 18 | 23 | El 6% con RTG |
| Giardini et al.21 | 2006 | 34 | 25 | El 41% presentaba RTG. El RTG se relacionaba con ser mayor, con una menor fracción de eyección del VD, con reducción del pico de absorción de oxígeno y con antecedentes de arritmia |
| Plymen et al.22 | 2013 | 14 | 34 | El 0% de los pacientes presentaba RTG. El VEC no se relacionó con otros parámetros cardiacos |
| Preim et al.23 | 2013 | 20 | 27 | El 5% de los pacientes presentaba RTG |
| Rydman et al.24 | 2015 | 55 | 28 | El 56% presentaba RTG. El RTG se relacionó con un objetivo compuesto de nueva taquiarritmia sostenida, ingreso por insuficiencia cardiaca descompensada, trasplante o muerte |
| Babu-Narayan et al.25 | 2016 | 22 | 28 | El 59% presentaba RTG. El RTG se relacionó con reducción de la excursión entre el tabique y la pared libre del VD y con insuficiencia tricuspídea leve o más grave mediante ecocardiografía |
| Broberg et al.26 | 2018 | 53 | 35 | El 15% presentaba un VEC anómalo. El VEC se relacionó con BNP y con eventos adversos al cabo de 4 años |
| Ladoceur et al.27 | 2018 | 48 | Mediana, 32 | El 35% presentaba RTG. Los pacientes con RTG eran mayores que los que no lo mostraban |
BNP: péptido natriurético cerebral; RTG: realce tardío de gadolinio; VD: ventrículo derecho; VEC: fracción de volumen extracelular.
El RTG ha demostrado fibrosis sistémica del VD en hasta el 61% de los participantes19. Los pacientes afectados son mayores y tienen peor función sistémica del VD que los pacientes no afectados. También presentan más arritmia y síncope, lo que añade credibilidad al RTG como marcador de la afección miocárdica19. En otros estudios se han notificado resultados y asociaciones parecidos21, incluso con tensión de la pared y con biomarcadores de colágeno27,28. Esta última asociación respalda de manera significativa la hipótesis de que el RTG refleja la fibrosis miocárdica verdadera antes que otras alteraciones como el edema miocárdico. La extensión del RTG se relaciona con asincronía, además de con una menor capacidad para hacer ejercicio y con arritmias previas, lo que implica que hay relación entre la fibrosis, el retraso electromecánico y los eventos clínicos25.
Como con la TdF, el conjunto de investigaciones disponibles indica claramente que la fibrosis miocárdica desempeña alguna función en la evolución natural de la insuficiencia sistémica del VD, aunque no todos los estudios muestran un predominio similar del RTG, y algunos no muestran ninguno20,22,23. Esta discrepancia reflejaría la naturaleza subjetiva del RTG, en especial entre las trabeculaciones densas. Por otro lado, la edad del paciente o las técnicas quirúrgicas pueden variar, lo que refleja la heterogeneidad inherente. Además, la mayor parte de los estudios se realizaron exclusivamente en la D-TGA y no en la TGA corregida congénitamente (cc-TGA).
Solo algunos estudios han investigado si detectar la fibrosis puede alterar el pronóstico. El mayor estudio incluyó a 55 pacientes, el 56% con RTG24. El RTG del VD se relacionó de manera independiente con un resultado adverso al cabo de 7,8 años (objetivo combinado de taquiarritmia sostenida, ingreso por insuficiencia cardiaca, trasplante o muerte). Asimismo, se ha observado una correlación clínico-patológica con un corazón explantado después del trasplante2. Aunque esto corrobora que la fibrosis actúa como intermediario importante en la disfunción cardiovascular y los eventos clínicos, aún hay dudas sobre si la presencia del RTG debe orientar el cuidado del paciente.
El primer estudio especializado de VEC en el VD sistémico se realizó en 14 pacientes con D-TGA después de la transposición congénitamente corregida con un método de contraste en equilibrio durante la infusión constante de gadolinio22. Curiosamente, no se observó RTG focal en ningún paciente. El VEC del tabique era mayor que en los controles, pero no se pudo determinar el VEC de la pared libre del VD. No había correlación entre el VEC y el volumen o la fracción de eyección del VD.
Un estudio prospectivo a mayor escala investigó a 53 pacientes (con ambas variedades de D-TGA y cc-TGA) y controles26. El VEC del VD fue anómalo en el 29% de ellos. Los pacientes con un VEC elevado no diferían de modo significativo de aquellos cuyo VEC era normal, y no hubo ninguna diferencia en el volumen del VD, la fracción de eyección del VD, la gravedad de la insuficiencia tricuspídea, los antecedentes de arritmia, la toma de medicamentos, los subproductos del colágeno circulante o la aldosterona, aunque la concentración del BNP fue mayor. Después de un seguimiento medio de 4,4 años, los pacientes con un VEC elevado sufrieron eventos de insuficiencia cardiaca con mayor frecuencia que los que no lo tenían elevado, a pesar de la ausencia de relación con otros signos clínicos de insuficiencia cardiaca. Aunque es poco aconsejable especular a partir de un estudio de pequeño tamaño, los resultados respaldan la hipótesis según la cual la fibrosis tiene una función importante en la aparición de la insuficiencia cardiaca clínica.
Hay que destacar algunas limitaciones del VEC. Es más difícil cuantificar el VEC del VD que el del VI. Se complica por la posible acumulación trabecular de contraste. La inclusión errónea de esta acumulación disminuye el valor T1 posterior al contraste y aumenta el VEC. Algunos estudios de RTG indican que la fibrosis es más frecuente que el VEC, cuando este debería ser más sensible. Esta diferencia paradójica se relacionaría en parte con el muestreo; las adquisiciones en T1 suelen limitarse solo a 1-3 planos del eje corto y no abarcan todo el ventrículo como hace el RTG. Además, puesto que el VEC es una medida continua, la fibrosis reducida seguiría resultando en un VEC «normal» a pesar de que el proceso fibrótico ya esté presente. Los límites del valor normal pueden diferir entre los laboratorios, y no se valida bien la varianza entre las mediciones a lo largo del tiempo. Tampoco está claro si las diferencias en la tensión se relacionan con la fibrosis.
El entusiasmo por el uso clínico generalizado del VEC se ha visto reducido porque el tratamiento clínico aún no dispone de resultados. Aunque la relación entre la fibrosis y la disfunción ventricular parece innegable, los tratamientos farmacológicos para atenuar la fibrosis no conducen necesariamente a la mejoría clínica, y el VEC no informa sobre el uso del desfibrilador automático implantable.
CONCLUSIONESUno de los principales objetivos de las técnicas de diagnóstico por la imagen en la cardiopatía congénita es evaluar la función y el volumen miocárdicos. No obstante, también hay que describir cualquier cambio importante en el miocardio que refleje cambios patológicos subyacentes en respuesta a la sobrecarga adversa. Esto incluye la presencia de fibrosis miocárdica. En la TdF y la TGA, los estudios con RTG y VEC representan en conjunto la fibrosis miocárdica como pieza clave del deterioro gradual de la función ventricular y los resultados clínicos adversos. Aunque las decisiones sobre el tratamiento basadas en algunas de estas aplicaciones nuevas siguen siendo empíricas, en teoría la detección de fibrosis sería un objetivo indirecto e importante para futuros estudios farmacológicos u orientaría en las decisiones futuras sobre las diversas opciones terapéuticas.
CONFLICTO DE INTERESESNinguno.